CARD9 基因敲除小鼠骨髓来源树突状细胞对阿萨希毛孢子菌临床株的免疫反应缺陷
2017-05-19吕雪莲王聪敏区敏仪杨蓉娅
巴 根,吕雪莲,王聪敏,丁 潇,区敏仪,祝 贺,杨蓉娅
CARD9 基因敲除小鼠骨髓来源树突状细胞对阿萨希毛孢子菌临床株的免疫反应缺陷
巴 根,吕雪莲,王聪敏,丁 潇,区敏仪,祝 贺,杨蓉娅

巴 根
目的初步探讨CARD9基因敲除小鼠骨髓来源树突状细胞(bone marrowderived dendritic cell, BMDC)对阿萨希毛孢子菌临床株(Trichosporon asahii, T.asahii)的免疫反应缺陷。方法体外培养野生型(wild type, WT)与CARD9基因敲除型(CARD9 knockout, CARD9-/-)小鼠BMDC并分别与热灭活的T.asahii进行共培养,比较两者对菌体的黏附吞噬能力、表面共刺激分子的激活、细胞因子的表达以及两种小鼠感染菌株后的生存率。结果共培养24 h后,WT与CARD9-/-小鼠BMDC对T.asahii的黏附吞噬情况比较未见明显差异;经T.asahii刺激的CARD9-/-小鼠BMDC的CD80、CD86激活情况以及白细胞介素(IL)-6、肿瘤坏死因子(TNF)-α表达水平均明显低于WT小鼠BMDC(P<0.05);感染T.asahii的CARD9-/-小鼠的生存率明显低于WT小鼠(P<0.05)。结论CARD9-/-小鼠BMDC对T.asahii的免疫反应缺陷主要体现在共刺激分子的激活以及促炎细胞因子的表达,但并未影响其对T.asahii的吞噬识别。
阿萨希毛孢子菌;基因,CARD9;树突状细胞
[J Pract Dermatol, 2017, 10(2):73-76]
阿萨希毛孢子菌(Trichosporon asahii, T.asahii)是毛孢子菌病(trichosporonosis)的主要致病菌,多引起免疫缺陷患者播散性感染[1]。本课题组在临床上发现了国内首例播散性阿萨希毛孢子菌病[2],患者无肿瘤及人免疫缺陷病毒(human immunodef ciency virus,HIV)感染等获得性免疫缺陷病史,长期抗真菌治疗疗效不理想。对该患者进行全外显子组测序分析显示其CARD9基因存在错义点突变进而造成了CARD9功能缺陷。CARD9即胱天蛋白酶募集域蛋白-9(caspase recruitment domain-containing protein 9,CARD9),是一种重要的接头蛋白,能够与B细胞淋巴瘤因子-10(BCL10)、胃肠黏膜相关淋巴组织-1(MALT1)结合形成CBM复合体,在抗真菌免疫反应中发挥重要的胞内信号传导作用,主要表达于巨噬细胞、中性粒细胞以及树突状细胞(dendritic cell, DC)[3]。而DC作为调动并调节宿主抗真菌免疫反应的关键,能够在病原真菌入侵时将菌体黏附吞噬,同时激活表面共刺激分子,并表达多种细胞因子,从而对其进行抗原提呈并诱导Th细胞(helper T cell)的分化,激活适应性免疫将其杀灭[4,5]。
本研究通过体外实验模拟DC对致病真菌的免疫识别过程,利用CARD9基因敲除型(CARD9 Knockout, CARD9-/-)小鼠CARD9功能缺陷的特点,分别将野生型(wild type,WT)与CARD9-/-小鼠骨髓来源树突状细胞(bone marrow-derived dendritic cell, BMDC)与分离自播散性阿萨希毛孢子菌病患者的T.asahii进行共培养,比较两者对菌体的黏附吞噬能力、表面共刺激分子的激活、细胞因子的表达以及两种小鼠感染菌株后的生存率,从微观和宏观角度初步探索CARD9基因敲除小鼠BMDC对T.asahii的免疫反应缺陷,为研究CARD9功能缺陷及播散性阿萨希毛孢子菌病患者的发病机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 仪器 IX73型倒置显微镜(日本Olympus公司)、普通光学显微镜(德国Leica公司)、LRH-150-MS型真菌培养箱(广东省医疗器械厂)、5810R冷冻离心机(德国Eppendorf公司)、3111型CO2培养箱(美国Thermo公司)、LSRFortessa型流式细胞仪(美国BD公司)。
1.1.2 试剂 胎牛血清(香港BIOCIO公司),RPMI-1640液体培养基(美国Gibco公司),磷酸盐缓冲液PBS(美国Hyclone公司),链霉素-青霉素(美国Gibco公司),重组小鼠GM-CSF、重组小鼠IL-4(美国PeProtech公司),APC标记的小鼠CD11c单抗、PE标记的小鼠CD80单抗、FITC标记的小鼠CD86单抗、小鼠Fc block(美国BD公司),4%多聚甲醛、红细胞裂解液(北京索莱宝生物科技有限公司),YPD干粉(北京奥博星生物技术有限公司),AimPlex小鼠Th1/Th2/Th17-16因子试剂盒(北京旷博生物技术股份有限公司)。
1.1.3 菌株 T.asahii分离自播散性阿萨希毛孢子菌病患者颈部皮损,通过基因测序并比对GenBank/ EMBL/DDBJ国际核酸序列数据库发现该菌株rRNA大亚基D1/D2区域碱基序列与阿萨希毛孢子菌标准株完全相同,证实为阿萨希毛孢子菌并保藏于陆军总医院皮肤科实验室(菌藏号:BM1403)。
1.1.4 实验动物 选取WT(C57BL/6)与CARD9-/-纯系小鼠,雄性,周龄6~8 w,体重18~20 g,由清华大学动物实验中心提供[许可证号:SCXK(京)2014-0007]。
1.2 方法
1.2.1 WT与CARD9-/-小鼠BMDC诱导培养 将WT与CARD9-/-小鼠颈椎脱臼处死,无菌取股骨及胫骨骨髓。加入红细胞裂解液去除红细胞,离心(1 500 r/min, 5 min)后弃上清。RPMI-1640培养基(含10%胎牛血清)悬浮细胞,以每孔2×106密度接种于6孔培养板,加入细胞因子GM-CSF(终浓度20 ng/ml)、IL-4(终浓度10 ng/ml),置于37℃、5% CO2的细胞培养箱中培养,隔日半量换液并补足细胞因子。培养至8 d时,各取1×104的WT与CARD9-/-小鼠悬浮细胞,流式细胞术检测其CD11c(小鼠BMDC的特异性标志)表达率分别为(96.37 ±0.92)%和(97.11±1.84)%,说明诱导培养成功。收获剩余悬浮及半悬浮细胞,并以相同浓度重新铺入6孔板中待用。
1.2.2 菌悬液配制 将冻存于-80℃甘油中的T.asahii复温后接种于20 ml液体YPD培养基中,35℃振荡培养18 h,增殖产生大量孢子。取10 ml热灭活(121℃,15 min)并离心(1 500 r/min, 5 min)弃掉YPD培养基,以无菌生理盐水配制浓度为1×107/ml的热灭活菌悬液;另10 ml直接离心(1 500 r/min, 5 min),弃掉YPD培养基并以无菌生理盐水配制相同浓度的成活T.asahii菌悬液待用。
1.2.3 BMDC对T.asahii的吞噬率测定 将圆形细胞粘附载玻片(直径1cm)置于24孔板中,以每孔1 ×105密度分别铺入WT与CARD9-/-小鼠BMDC,贴壁2 h后加入热灭活T.asahii菌悬液(细胞与菌体浓度比例为1:5)。置于37℃、5% CO2的细胞培养箱中共培养24 h后弃掉上清,PBS漂洗3次,4%多聚甲醛固定10~20 min后取出圆形盖玻片置于载玻片上。经瑞氏-姬姆萨染色后用倒置相差显微镜观察BMDC对T.asahii的吞噬现象,至少计数100个细胞,吞噬率=吞噬T.asahii的BMDC细胞个数/所计数的BMDC细胞总数×100%。
1.2.4 BMDC表面共刺激分子检测 将培养有WT与CARD9-/-小鼠BMDC的6孔板中分别加入热灭活T.asahii菌悬液(细胞与菌体浓度比例为1:5),以未加入菌悬液的WT与CARD9-/-小鼠BMDC作为对照组,置于37℃、5% CO2的细胞培养箱中共培养24 h。收集各组BMDC,调整单个待测样本细胞数至5× 105,以50 μl的Fc-block冰上孵育5 min,PBS洗涤1次。分别加入APC-CD11c、FITC-CD86与PE-CD80单抗各1 μl,4℃避光孵育30 min,用PBS洗涤1次,流式细胞仪上机检测。
1.2.5 BMDC产生细胞因子检测 收集上一步实验中各组上清液,采用AimPlex小鼠Th1/Th2/Th17-16因子试剂盒检测小鼠BMDC细胞因子IL-1β、白细胞介素(IL)-6、IL-23和肿瘤坏死因子(TNF)-α的产生水平,具体操作按照试剂盒说明书进行,每组设1个复孔。
1.2.6 感染小鼠生存率分析 分别取WT小鼠与CARD9-/-小鼠各3只(生存率分析要求样本含量为观察协变量的5~20倍。本实验的观察协变量仅有小鼠生存时间1项,样本含量为WT小鼠与CARD9-/-小鼠共6只,样本含量为观察协变量的6倍,符合统计学要求),采用1 ml注射器将成活T.asahii菌悬液经尾静脉对每只小鼠各接种0.1 ml。每日观察小鼠,连续观察16 d,记录小鼠生存情况。
1.3 统计学方法
应用GraphPad Prism5.0软件进行统计学分析及图表制作,实验数据以均数±标准差(±s)表示,采用单因素方差分析(oneway ANOVA)比较各组间均值,采用Log-rank检验比较小鼠生存率。P<0.05认为差异有统计学意义。
2 结果
2.1 BMDC形态及其对T.asahii的吞噬比较
经瑞氏-姬姆萨染色可见,培养至8 d时WT与CARD9-/-小鼠BMDC在光镜下分布较均匀,表面可见典型的树枝样突起,其形态比较未见明显差异(图1a)。与T.asahii共培养24 h后可见,WT与CARD9-/-小鼠BMDC对菌体均具有黏附吞噬作用,且两者吞噬形态相似(图1b),两组吞噬率比较差异无统计学意义(P>0.05,图1c)。
2.2 BMDC表面共刺激分子的活化比较
共培养24 h后,以CD11c阳性的细胞圈门检测各组BMDC表面共刺激分子表达情况。结果显示,未经T.asahii刺激的WT与CARD9-/-小鼠BMDC均低表达CD80与CD86,且差异无统计学意义(P>0.05);而经T.asahii刺激的WT与CARD9-/-小鼠BMDC的CD80与CD86表达水平均明显升高,但CARD9-/-小鼠BMDC的表达水平明显低于前者(P<0.05)(图2)。
2.3 BMDC各细胞因子的表达比较
共培养24 h后,未经T.asahii刺激的WT与CARD9-/-小鼠BMDC均低表达IL-6和TNF-α,且表达差异均无统计学意义(P均>0.05);而经T.asahii刺激的WT小鼠BMDC表达IL-6和TNF-α水平均明显高于CARD9-/-小鼠BMDC(P<0.05)(图3)。
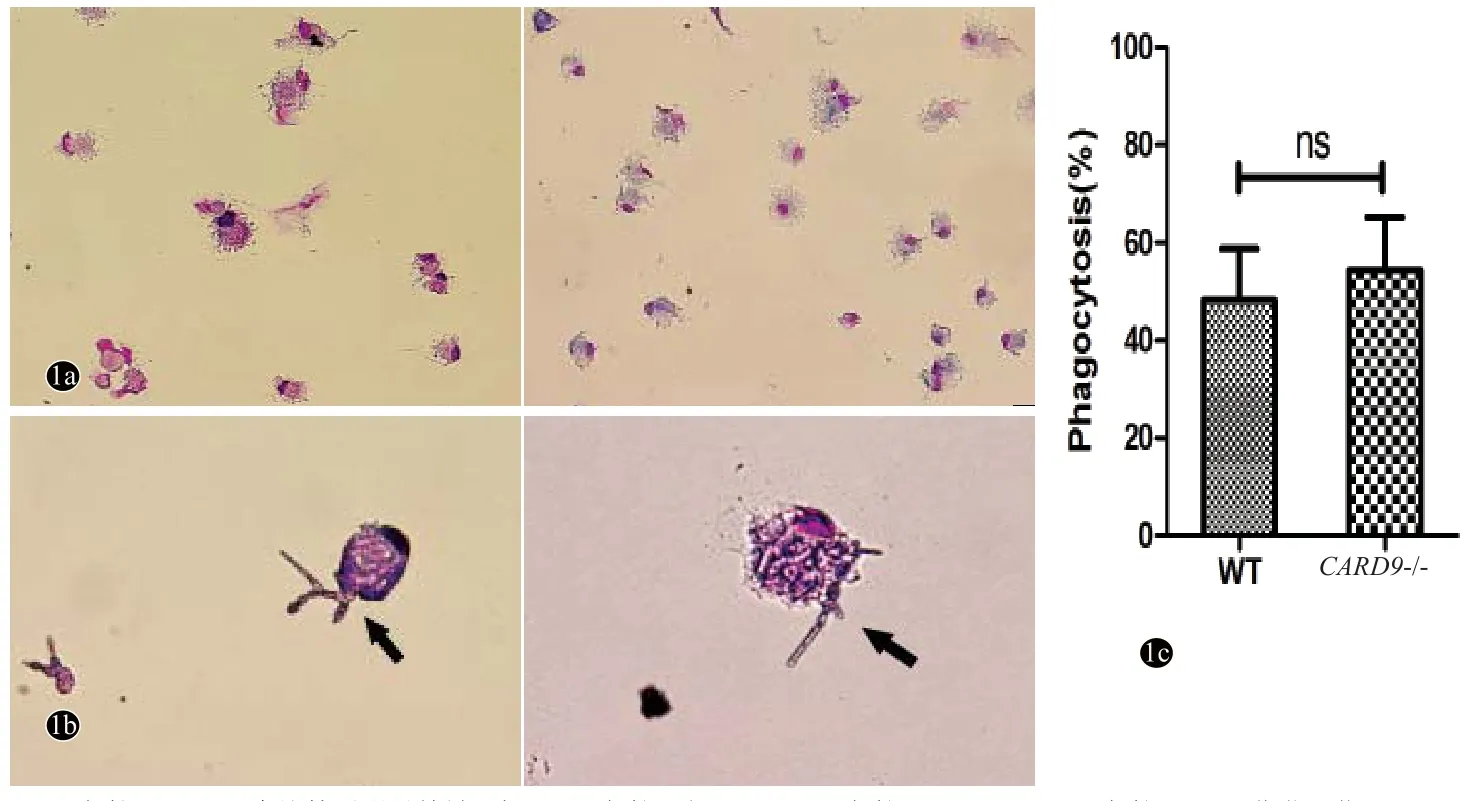
图1 WT与CARD9-/-小鼠BMDC及其对T.asahii吞噬功能的比较(HE染色)
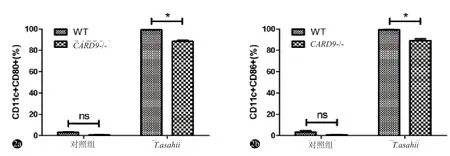
图2 对照组与T.asahii刺激组共刺激分子的表达比较
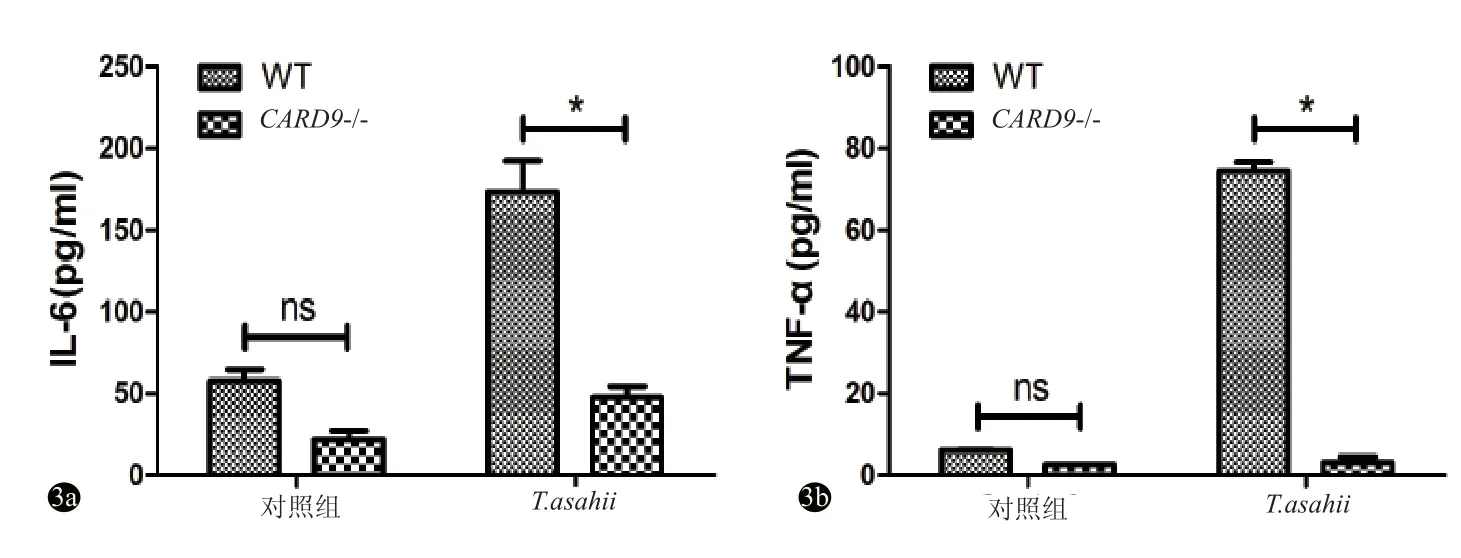
图3 对照组与T.asahii刺激组细胞因子表达比较
2.4 感染小鼠生存率比较
连续观察16 d,感染T.asahii的CARD9-/-小鼠全部死亡,分别于9 d死亡2只,11 d死亡1只;而感染T.asahii的WT小鼠则全部存活。Log-rank生存率分析提示两组小鼠生存率差异具有统计学意义(P<0.05)(图4)。
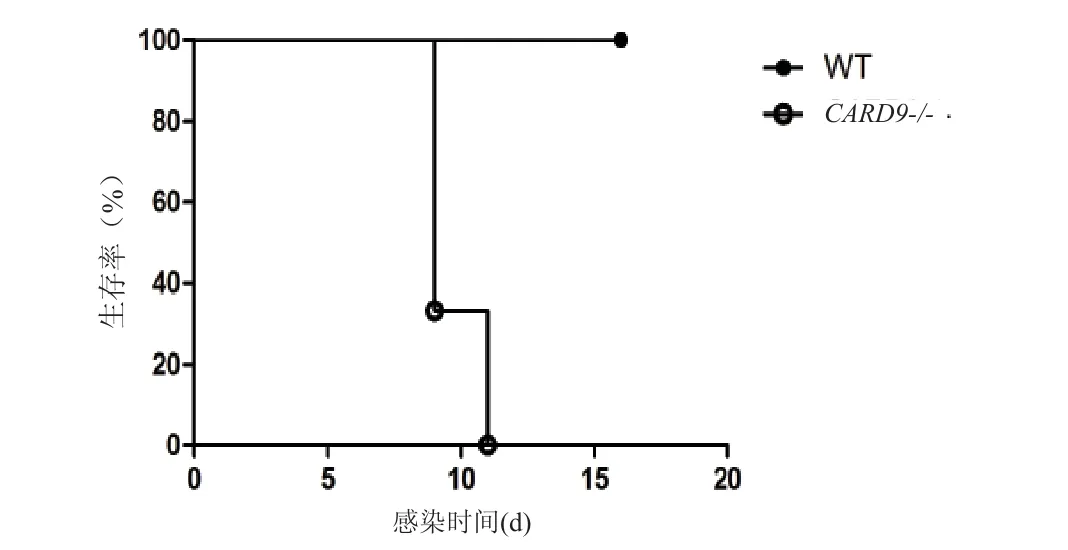
图4 感染小鼠生存率比较
3 讨论
新近研究显示,CARD9功能缺陷可以导致白念珠菌、疣状瓶霉、皮炎外瓶霉以及红色毛癣菌等多种真菌播散性感染[6-8]。而真菌感染后宿主免疫细胞对致病真菌反应的第一步就是将其吞噬,但这一功能信号在胞内的传递并不依赖于CARD9的介导[9,10]。本实验中可以看到WT与CARD9-/-小鼠BMDC对菌体均具有黏附吞噬作用,且两组吞噬率比较未见明显差异,说明CARD9功能缺陷同样并未影响BMDC对T.asahii的吞噬作用。
DC摄取致病真菌后便通过模式识别受体(pattern recognition receptor,PRR)对菌壁各种抗原成分进行识别,这其中dectin-1(DC-associated C-type lectin)受体能够识别真菌菌壁的重要抗原成分β-葡聚糖(β-glucan),其后在脾酪氨酸酶(spleen tyrosine kinase, Syk)作用下促使CARD9与BCL10、MALT1形成CBM复合体,激活转录因子NF-κB(nuclear factor kappa B)促进共刺激分子CD80和CD86的活化[10,11]。本实验以小鼠BMDC的特异性标志CD11c圈门,可以看到经T.asahii刺激的WT与CARD9-/-小鼠BMDC其共刺激分子表达水平均明显升高,但后者明显低于前者。这说明尽管两者均能够识别T.asahii,但CARD9功能缺陷影响了CBM复合体的形成,进而降低了共刺激分子的表达,从而阻碍了抗原提呈过程。
另外本实验中经T.asahii刺激的WT小鼠BMDC表达IL-6和TNF-α水平明显高于CARD9-/-小鼠,这其中TNF-α能够趋化中性粒细胞早期杀灭真菌;而IL-6则介导Th17细胞的分化,通过适应性免疫效应进一步清除真菌[12]。Th17细胞在宿主对抗真菌感染中具有重要作用,而多数文献[3,6-8,10]报道CARD9功能缺陷主要引起IL-6低表达进而影响了Th17细胞的分化,从而造成宿主对各种机会性致病真菌易感。本研究中动物实验显示感染T.asahii的CARD9-/-小鼠全部死亡,而WT小鼠则全部存活,两者生存率存在明显差异,从宏观角度证实了CARD9功能缺陷的确会导致宿主对T.asahii免疫功能下降。但由于CARD9在中性粒细胞及巨噬细胞中均有表达且同样影响二者抗真菌效应的发挥,与此同时Th1与Th2细胞也参与了适应性免疫反应过程,因此上述通路缺陷是否直接造成了宿主感染T.asahii还有待研究[6,12-13]。
综上所述,该研究初步表明,CARD9-/-小鼠BMDC对T.asahii的免疫反应缺陷主要影响共刺激分子的激活以及促炎细胞因子的表达,但并未影响其对T.asahii的吞噬识别。这也为研究CARD9功能缺陷及播散性阿萨希毛孢子菌病患者的发病机制奠定了基础。
[1] Cho O, Matsukura M, Sugita T. Molecular evidence that the opportunistic fungal pathogen Trichosporon asahii is part of the normal fungal microbiota of the human gut based on rRNA genotyping [J]. Int J Infect Dis, 2015, 39:87-88.
[2] Yang R, Ao J, Wang W, et al. Disseminated trichosporonosis in China [J]. Mycoses, 2003, 46(11-12):519-523.
[3] Roth S, Ruland J. Caspase recruitment domain-containing protein 9 signaling in innate immunity and inf ammation [J]. Trends Immunol, 2013, 34(6):243-250.
[4] Wang R, Wan Z, Li R. Th and Treg response induced by Aspergillus fumigatus pulsed dendritic cells in vitro [J]. Chin Med J (Engl), 2014, 127(20):3616-3622.
[5] Lass-Flörl C, Roilides E, Löff er J, et al. Minireview: host defence in invasive aspergillosis [J]. Mycoses, 2013, 56(4):403-413.
[6] Wu W, Zhang R, Wang X, et al. Impairment of immune response against dematiaceous fungi in Card9 knockout mice [J]. Mycopathologia, 2016, 181(9-10):631-642.
[7] Lanternier F, Barbati E, Meinzer U, et al. Inherited CARD9 def ciency in 2 unrelated patients with invasive Exophiala infection [J]. J Infect Dis, 2015, 211(8):1241-1250.
[8] Lanternier F, Pathan S, Vincent QB, et al. Deep dermatophytosis and inherited CARD9 def ciency [J]. N Engl J Med, 2013, 369(18): 1704-1714.
[9] Brown GD. Innate antifungal immunity: the key role of phagocytes [J]. Annu Rev Immunol, 2011, 29:1-21.
[10] Engelhardt KR, Grimbacher B. Mendelian traits causing susceptibility to mucocutaneous fungal infections in human subjects [J]. J Allergy Clin Immunol, 2012, 129(2):294-305.
[11] 祝贺, 吕雪莲, 杨蓉娅. Dectin-1与真菌β-葡聚糖介导的天然免疫[J]. 实用皮肤病学杂志, 2015, 8(4):277-279.
[12] Thakur R, Anand R, Tiwari S, et al. Cytokines induce effector T-helper cells during invasive aspergillosis; what we have learned about T-helper cells? [J]. Front Microbiol, 2015, 6:429.
[13] Liang P, Wang X, Wang R, et al. CARD9 deficiencies linked to impaired neutrophil functions against Phialophora verrucosa [J]. Mycopathologia, 2015, 179(5-6):347-357.
The impairment of immune response against Trichosporon asahii clinical isolate in CARD9 knockout murine bone marrow-derived dendritic cell
BA Gen,LV Xue-lian,WANG Cong-min,et al
Department of Dermatology, PLA Army General Hospital & Second Military Medical University, Beijing 100700, China
ObjectiveTo investigate the impairment of immune response against Trichosporon asahii(T.asahii) clinical isolate in CARD9 knockout murine bone marrow-derived dendritic cell(BMDC).MethodsAfter in vitro co-culture of BMDCs from wild type mice(WT) and CARD9 knockout mice(CARD9-/-) with heat-killed T.asahii, the phagocytotic ability, costimulatory molecules activation and cytokines production of BMDCs between WT and CARD9-/- were compared.ResultsCompared with the WT BMDC, the phagocytotic ability of CARD9-/- BMDC was not signif cantly impaired, but its activation of CD80 and CD86 and the production of IL-6 and TNF-α were significantly lower after co-cultured with T.asahii for 24h. After having been infected by T.asahii, the CARD9-/- mice showed remarkable lower survival rate than the WT mice.ConclusionCARD9-/- BMDC exhibited the defects in costimulatory molecules activation and inf ammatory cytokines production but not the phagocytotic ability against T.asahii.
Trichosporon asahii;Gege,CARD9;Dendritic cell
R756.9
A
1674-1293(2017)02-0073-04
2016-10-10
2017-01-18)
(本文编辑 祝贺)
10.11786/sypfbxzz.1674-1293.20170203
国家自然科学基金面上项目(81471928;81571972);全军医学科技青年培育项目(14QNP010)
100700 北京,陆军总医院(第二军医大学临床医学院)皮肤科(巴根,王聪敏,丁潇,区敏仪,祝贺,杨蓉娅);首都医科大学附属安贞医院皮肤科(吕雪莲)
巴根,在读硕士研究生,主要研究方向:阿萨希毛孢子菌与宿主天然免疫,E-mail: 1311571168@qq.com
杨蓉娅,E-mail: yangrya@sina.com
