牛病毒性腹泻病毒实时荧光定量RT-PCR检测方法的建立
2017-05-18岳丰雄徐宏军
黄 杰,岳丰雄,徐宏军
(成都天邦生物制品有限公司,四川成都 610100)
牛病毒性腹泻病毒实时荧光定量RT-PCR检测方法的建立
黄 杰,岳丰雄*,徐宏军
(成都天邦生物制品有限公司,四川成都 610100)
为了建立一种快速、特异、灵敏的检测牛病毒性腹泻病毒(BVDV)TaqMan实时荧光定量RT-PCR的方法,根据NCBI GenBank上已公布的BVDV、猪瘟病毒(CSFV)核酸序列进行比对,利用Oligo 6.71软件设计一对引物及一条探针,建立了检测BVDV的TaqMan实时荧光定量RT-PCR方法。通过对该方法的特异性、重复性及其敏感性进行相关试验,结果表明该方法检测出BVDV标准毒株Oregon C24V为阳性,猪圆环病毒2型、猪伪狂犬病病毒、猪传染性胃肠炎病毒、猪流行性腹泻病毒、猪繁殖与呼吸综合征病毒和CSFV的检测均为阴性。对BVDV标准毒株最低检测量达到10-2.5TCID50。该方法检测同一样品重复进行8次检测,结果均一致,表明方法的重复性较好。应用该方法对6批猪瘟疫苗专用血清进行BVDV检测,阳性率为16.7%;猪瘟弱毒苗中未检出BVDV。建立的BVDVTaqMan实时荧光定量RT-PCR方法为生产无BVDV污染的猪瘟苗提供了有力的保障。
牛病毒性腹泻病毒;实时荧光定量RT-PCR;猪瘟病毒;疫苗
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV),又称牛病毒性腹泻-黏膜病病毒(Bovine viral diarrhea-mucosal disease virus,BVD-MDV),属于黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的成员[1-3]。该病毒与猪瘟病毒(Classical swine fever virus,CSFV)、绵羊边界病毒(Border disease virus,BDV)及长颈鹿瘟病毒(Pestivirus of giraffe)同属[4-5]。BVDV主要感染牛,引发传染性牛病毒性腹泻病,主要临床症状为腹泻、黏膜糜烂溃疡,咳嗽及怀孕母牛流产或产出死胎和畸形胎,持续感染(PI)及免疫抑制等,给养牛业造成了重大的经济损失[6-7]。该病毒除感染牛外,还可以感染骆驼、山羊、绵羊、鹿、猪等[6,8]。研究表明BVDV能突破宿主特异性发生交叉感染[9],因此,猪瘟弱毒疫苗在生产中使用的牛血清、细胞、胰酶等材料中若含有BVDV病原,会导致疫苗污染,从而影响猪瘟疫苗的质量[10]。
国内外对猪瘟疫苗原材料中检测BVDV的方法主要有Vero传代细胞检测法、致细胞病变和红细胞吸附外源病毒检验法、荧光抗体检测法、RT-PCR法[11]和实时荧光定量RT-PCR法[12-14]。每种方法均具有其优缺点,本研究目的在于建立一种快速、特异、灵敏的检测牛病毒性腹泻病毒(BVDV)TaqMan实时荧光定量RT-PCR方法,为生产无BVDV污染的猪瘟弱毒疫苗提供技术支持。
1 材料与方法
1.1 材料
1.1.1 病毒 BVDV(Oregon C24V株)、猪圆环病毒2型(PCV2)、猪伪狂犬病病毒(PRV)、猪传染性胃肠炎病毒(TGEV)、猪流行性腹泻病毒(PEDV)、猪繁殖与呼吸综合征病毒(PRRSV)和CSFV(C株)毒株,均由成都天邦生物制品有限公司保存。
1.1.2 引物和探针设计与合成 根据GenBank中已公布的CSFV及BVDV核酸序列以及已发表的BVDV RT-PCR检测方法相关专利和文章,利用DNA Star软件进行序列分析,再利用Oligo 6.71设计一对引物及探针用于鉴定BVDV及CSFV病毒(见表1),其扩增目的片段大小为156 bp。引物由上海英骏公司合成,探针由ABI公司合成,引物及探针浓度稀释成10 μmol/L,置-20℃保存。
1.1.3 主要试剂 One Step PrimeScriptTMRT-PCR Kit (Perfect Real Time)购自宝生物工程(大连)有限公司;病毒RNA提取试剂盒、病毒DNA提取试剂盒购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 病毒模板的制备 按照病毒RNA提取试剂盒说明书提取BVDV、CSFV、TGEV、PEDV和PRRSV病毒的总RNA以及病毒DNA提取试剂盒说明书提取PRV和PCV2的总DNA,为后续检测提供模板。
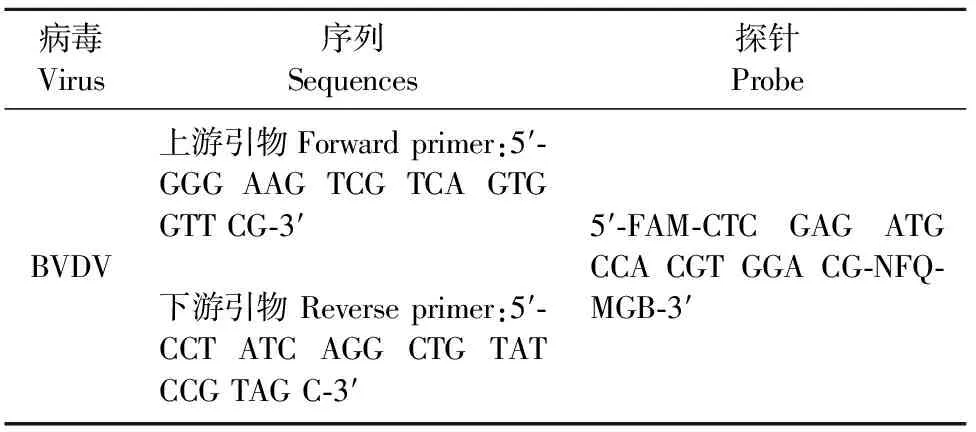
表1 引物及探针序列
1.2.2 RT-PCR最优反应体系 为了达到最优的BVDV RT-PCR检测结果,分别对其引物探针及浓度进行了优化,得到的最优条件如下:25 μL体系:2×One Step RT-PCR buffer 12.5 μL,TaKaRa ExTaqHS 0.5 μL,Prime Script RT Enzyme Mix 0.5 μL,上、下游引物1 μL(10 μmol/L),荧光探针1 μL(10 μmol/L),BVDV RNA模板5 μL,用去离子水补足25 μL。
1.2.3 RT-PCR最优反应程序 荧光定量检测在eppendorf realplex上进行,其反应程序为:42℃ 5 min;95℃ 10 s,95℃ 5 s,61.3℃ 30 s,反应进行40个循环,于61.3℃进行荧光信号采集。
1.2.4 特异性试验 将PCV2、PRV、TGEV、PEDV、PRRSV、BVDV、CSFV等病毒核酸应用已优化的方法进行相应的特异性试验。
1.2.5 重复性试验 根据已优化的反应条件,对同一样品提取BVDV RNA模板进行荧光定量RT-PCR检测。
1.2.6 敏感性试验 将BVDV种毒(105.5TCID50/mL)进行10倍比例的稀释,每个稀释度分别提取RNA核酸进行荧光定量RT-PCR检测。
1.2.7 方法的初步应用
1.2.7.1 疫苗及血清的检测 用建立的BVDV荧光定量RT-PCR方法检测猪瘟弱毒细胞苗15批,以及新生牛血清样品6批(3批国产,3批进口),Ct值在40以内的判为阳性结果,无Ct值判为阴性。
1.2.7.2 猪瘟疫苗成品与BVDV种毒混合检测 将猪瘟弱毒细胞苗成品与BVDV种毒按照不同比例混合,共计10个样(表2)。分别提取每个样品的RNA,用建立的方法检测,结果判定与1.2.7.1一致。

表2 猪瘟疫苗成品与BVDV不同比例的样品
“*”中的BVDV含量是指用DMEM将BVDV进行10倍倍比稀释后,10 μL中含有BVDV的量,“-”表示未添加该项目。
“*”The content of BVDV in 10 μL after BVDV was diluted by DMEM,“-”means not add.
2 结果
2.1 特异性检测结果
以PCV2、PRV、TGEV、PEDV、PRRSV的核酸为模板进行荧光定量RT-PCR,结果仅BVDV 核酸有荧光曲线扩增,结果见图1。对购自中国兽医药品监察所的CSFV种毒,自繁第F481代次种毒进行BVDV荧光定量RT-PCR检测,该样品重复提取4个样品进行,结果表明提供的CSFV种毒脾毒的核酸BVDV检测结果为阴性(图2)。综上所述,BVDV荧光定量RT-PCR检测方法对PCV2、PRV、PRRSV、TGEV、PEDV、CSFV的检测结果均为阴性。
2.2 重复性试验检测结果
同一模板重复进行8次荧光定量RT-PCR反应,结果表明所有的样品的Ct值介于25.94~26.54之间,最大Ct值相差0.6,表明检测样品结果的重复性较好,其荧光扩增曲线分别见图3、表3。

表3 重复性试验样品检测Ct值
2.3 敏感性试验结果
将BVDV种毒进行10倍稀释提取核酸进行荧光定量RT-PCR检测,其最低检测量达到10-2.5TCID50/mL(0.0 032 TCID50/mL),不同稀释度荧光定量曲线扩增图及检测Ct值分别见图4和表4。
2.4 方法的初步应用
2.4.1 疫苗及血清的检测 用建立的BVDV荧光定量RT-PCR方法检测猪瘟弱毒疫苗15批,以及牛血清样品6份,结果显示只有1批国产血清检测结果呈阳性(表5)。
2.4.2 分别提取每个混合样品的RNA,利用建立的BVDV荧光定量RT-PCR方法检测(表6)。
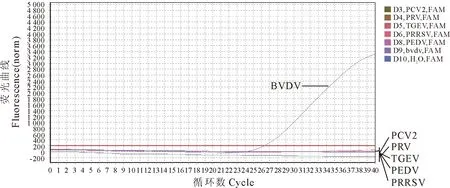
图1 BVDV荧光定量RT-PCR的特异性检测
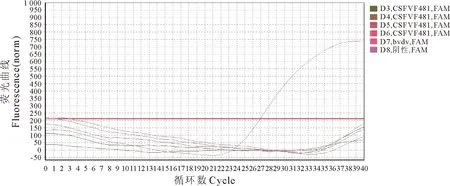
图2 CSFV荧光定量RT-PCR的特异性
图3 BVDV荧光定量RT-PCR的重复性检测

表4 敏感性试验不同稀释度检测结果
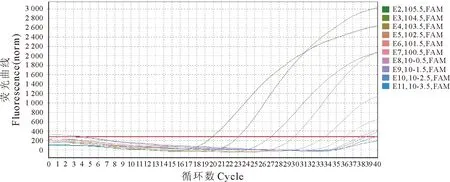
图4 BVDV荧光定量RT-PCR反应敏感性试验
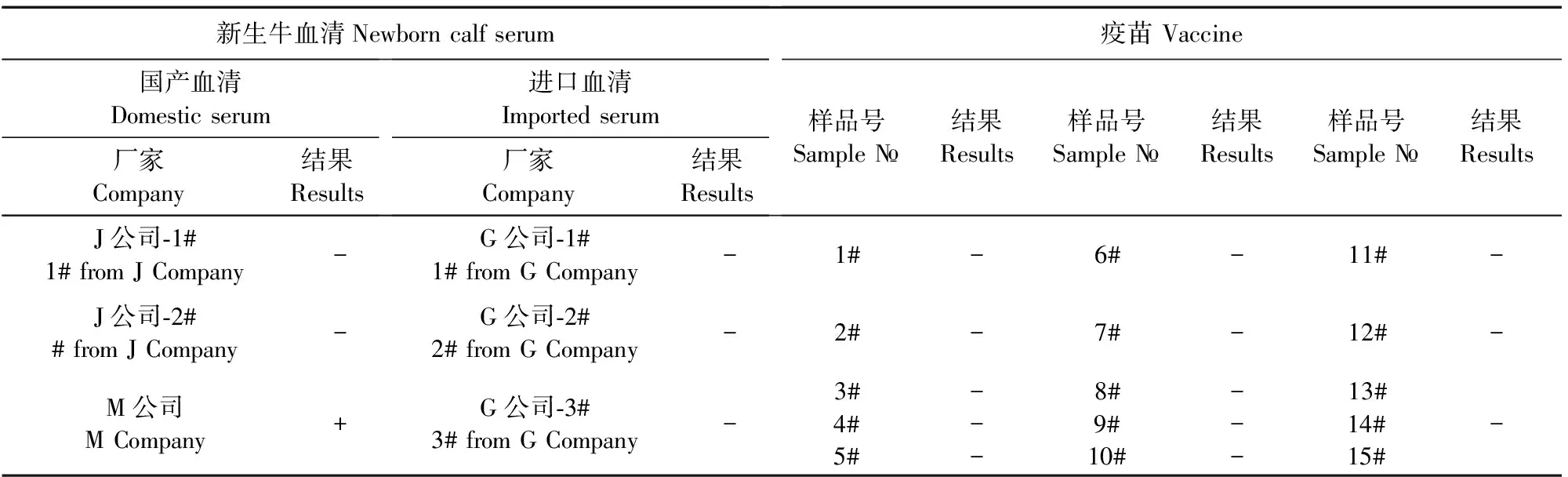
表5 新生牛血清及猪瘟弱毒疫苗中BVDV检测结果
注:“-”代表样品检测无Ct值;“+”代表样品检测的Ct值<40。
Note:“-”means no Ct value detected;“+”means Ct value<40.

表6 不同比例混合样品的BVDV检测结果
3 讨论
通过NCBI GenBank中公开的BVDV序列设计的一对引物及一条特异性探针,建立了一步法BVDVTaqMan实时荧光定量RT-PCR检测方法。通过对该方法进行特异性、重复性以及敏感性试验,结果表明该方法对PCV(DBN-SX07株)、PRV(Batha-K61株)、TGEV(疫苗株)、PEDV(疫苗株)、PRRSV(CH-1R株)、CSFV(C株)无特异性扩增。病毒的最低检测灵敏度可达到10-2.5TCID50。
BVDV常规检测方法存在费时、费力或者存在非特异性反应和敏感性低等缺点,不能为生产实际提供及时准确的检测结果。常规的RT-PCR检测方法的敏感性不如荧光定量RT-PCR[15]。实时荧光定量PCR方法分为两种,一种是非特异性荧光标记SYBR Green 染料法,该方法具有适用任何DNA模板且不必设计复杂的探针,然而具有容易与非特异性双链DNA结合,产生假阳性和对引物特异性要求较高等缺点。另一种是特异性荧光标记TaqMan探针法,具有对目标序列的高特异性,引物设计相对简单和重复性好等优点,同时具有只适合一个特定的目标和探针价格较高等缺点。检测BVDV的荧光定量PCR染料法和TaqMan探针法均有报道。研究表明荧光定量RT-PCR染料法的灵敏度比常规的RT-PCR高10倍[16],然而TaqMan探针法的灵敏度是常规RT-PCR的100倍。因此,TaqMan探针法较染料法的灵敏度高。本研究同样采用TaqMan探针法,具有较好的敏感性,对检测猪瘟疫苗中是否含有BVDV污染更加灵敏。
值得注意的是目前国内猪瘟弱毒疫苗受BVDV污染仍然存在,而使用污染BVDV的猪瘟疫苗会引起仔猪 BVDV 的先天性感染,从而表现出与猪瘟类似的症状与病变。本研究建立的 BVDVTaqMan实时荧光定量RT-PCR法对猪瘟疫苗专用血清及猪瘟弱毒疫苗中是否含有BVDV进行了检测,结果显示6批血清BVDV阳性率为16.7%,从而可以从源头上控制BVDV污染猪瘟疫苗,15批猪瘟疫苗中未检出BVDV。同时,本研究将猪瘟疫苗成品与BVDV种毒按照不同比例的混合,表6检测结果具有很好的线性关系,进一步说明了该方法的特异性、重复性及敏感性较好。因此,本文的建立BVDV快速检测方法,为生产无BVDV污染的猪瘟疫苗提供了有力的保障。
[1] Pringle C R.The universal system of virus taxonomy,updated to include the new proposals ratified by the International Committee on Taxonomy of Viruses during 1998[J].Arch Virol,1999,144:421-429.
[2] Wang W,Shi X,Tong Q,et al.A bovine viral diarrhea virus type 1a strain in China:isolation,identification,and experimental infection on calves [J].Virol J,2014,11:8.
[3] Aduriz G,Atxaerandio R,Cortabarria N.First detection of bovine viral diarrhea virus type 2 in cattle in Spain [J].Vet Rec Open,2015,2(1):e000110.
[4] Callens N,Brügger B,Bonnafous P,et al.Morphology and molecular composition of purified bovine viral diarrhea virus envelope [J].PLoS Pathog,2016,12(3):e1005476.
[5] Liu L H,Xia H Y,Belák S,et al.A TaqMan real-time RT-PCR assay for selective detection of atypical bovine pestiviruses in clinical samples and biological products [J].J Virol Meth,2008,154:82-85.
[6] Passler T,Riddell K P,Edmondson M A,et al.Experimental infection of pregnant goats with bovine viral diarrhea virus (BVDV)1 or 2[J].Vet Res,2014,45:38.
[7] Mao L,Li W,Yang L,et al.Primary surveys on molecular epidemiology of bovine viral diarrhea virus 1infecting goats in Jiangsu province,China[J].BMC Vet Res,2016,12(1):181.
[8] Passler T,Ditchkoff S S,Walz P H.Bovine viral diarrhea virus (BVDV) in white-tailed deer (Odocolieusvirginianus)[J].Front Microbiol,2016,7:945.
[9] Young N J,Thomas C J,Collins M E,et al.Real-time RT-PCR detection of bovine viral diarrhea virus in whole blood using an external RNA reference [J].J Virol Meth,2006,138 (1):218-222.
[10] Tao J,Liao J,Wang Y,et al.Bovine viral diarrhea virus (BVDV) infections in pigs [J].Vet Microbiol,2013,30:185-189.
[11] 李晶梅,刘 丹,薛 霜,等.猪瘟病毒和牛病毒性腹泻病毒双重RT-PCR鉴别检测方法的建立及应用[J].动物医学进展,2014,35(4):66-71.
[12] 范 晴,谢芝勋,刘加波,等.牛病毒性腹泻病毒实时荧光定量RT-PCR检测方法的建立[J].动物医学进展,2010,3(10):10-14.
[13] 韩猛立,黄 新,钟发刚,等.牛病毒性腹泻病毒SYBR Green Ⅰ实时定量RT-PCR检测方法的建立及应用[J].新疆农业科学,2014,51(2):333-339.
[14] 王 荣,李文文,王 妍,等.牛病毒性腹泻病毒实时荧光定量RT-PCR方法的建立及应用[J].中国畜牧兽医,2014,41(2):35-39.
[15] Deng M,Ji S,Fei W,et al.Prevalence study and genetic typing of bovine viral diarrhea virus (BVDV) in four bovine species in China[J].PLoS One,2015,10(4):e0121718.
[16] Zhang N,Liu Z W,Han Q Y,et al.Development of one-step SYBR Green real-timeRT-PCR for quantifying bovine viral diarrhea virus type-1 and its comparison with conventional RT-PCR[J].Virol J,2011,8:374.
Establishment Real-time Fluorescence Quantitative RT-PCR for Detection of Bovine Viral Diarrhea Virus
HUANG Jie,YUE Feng-xiong,XU Hong-jun
(ChengduTecbondBiologicalProductsCo.,Ltd,Chengdu,Sichuan,610100,China)
The aim of this study was to establish a rapid,specific and sensitiveTaqMan real-time fluorescence quantitative RT-PCR method for detection of bovine viral diarrhea virus (BVDV).A pair of primers and a probe were designed by using the Oligo 6.71 software to detect BVDV according to the nucleic acid sequence of BVDV and classical swine fever virus (CSFV) on NCBI GenBank so as to establish the method.The specificity,repeatability and sensitivity of the method were tested,the results showed that BVDV Oregon C24V strain was positive,while PCV2,PRV,TGEV,PEDV,PRRSV and CSFV test results were negative.To detect BVDV standard strains,the minimum detectable amount could reach 10-2.5TCID50.The method has good repeatability by testing the same sample repeated eight times.BVDV positive rate of the special serum of classical swine fever vaccine was 16.7%.However,BVDV positive rate of classical swine fever vaccine was not detected.Therefore,this new method provided a useful tool for free from contamination with BVDV of classical swine fever vaccine.
Bovine viral diarrhea virus; real-time fluorescent quantitative RT-PCR; Classical swine fever virus; vaccine
2016-09-19
黄 杰(1987-),男,四川遂宁人,硕士,主要从事兽用疫苗研究。*通讯作者
S852.653
A
1007-5038(2017)05-0059-05
