A型流感病毒PB1-F2蛋白与蛋白激酶R相互作用研究
2017-05-18于洪敏张茂林关振宏
于洪敏,金 新,2,张茂林,段 铭,关振宏*
(1.吉林大学人兽共患病教育部重点实验室 人兽共患病研究所,吉林长春 130062;2.吉林农业大学动物科学技术学院,吉林长春 130118)
研究论文
A型流感病毒PB1-F2蛋白与蛋白激酶R相互作用研究
于洪敏1,金 新1,2,张茂林1,段 铭1,关振宏1*
(1.吉林大学人兽共患病教育部重点实验室 人兽共患病研究所,吉林长春 130062;2.吉林农业大学动物科学技术学院,吉林长春 130118)
为研究A型流感病毒的重要毒力因子PB1-F2对蛋白激酶R (PKR)的调控机制,通过纯化GST-PB1-F2融合蛋白,利用GST pull-down试验证实了PB1-F2与PKR发生相互作用;采用免疫荧光试验进一步验证了二者的相互关系;实时荧光定量PCR表明PB1-F2能负调控PKR及IL-6的mRNA水平;采用siRNA干扰PKR基因的表达后,PB1-F2抑制IL-6的mRNA转录作用更显著。进一步运用蛋白免疫印迹方法检测了PB1-F2对PKR及其底物eIF-2α蛋白磷酸化水平的影响,显示过表达PB1-F2后,PKR及eIF-2α的磷酸化表达水平明显下调。本研究表明PB1-F2与PKR相互作用而抑制PKR磷酸化活化,并通过PKR调控IL-6的表达,为探索PB1-F2的未知生物学功能提供了重要信息。
A型流感病毒;PB1-F2;蛋白激酶R;蛋白磷酸化
流感病毒属于正黏病毒科,其中A型流感病毒(Influenza A virus,IAV)曾引起人类流感的大流行,导致全球5000万人死亡,而PB1-F2蛋白在这次大流行中起着关键性的作用[1]。研究发现,PB1-F2蛋白有多种功能,在病毒感染的过程中,PB1-F2主要定位在宿主细胞线粒体的内膜和外膜,可通过其羧基末端的线粒体靶向序列诱导免疫细胞的凋亡和组织损伤[2];PB1-F2还能与IAV的其他蛋白相互作用,例如PB1-F2通过其氨基端结构域与PB1相互作用,增强病毒RNA依赖的RNA聚合酶活性(viral RNA-dependent RNA polymerase,vRdRp)[3-4];PB1-F2已经被证实在病毒感染过程中能够诱导早期的炎症反应事件,增强免疫病理反应[5-6];有些研究还显示PB1-F2可拮抗IFN-β的产生,促进病毒复制[7-8]。PB1-F2对增强IAV的致病性至关重要,但是对其具体的分子机制还尚不清楚,有待进一步研究。
蛋白激酶R(PKR)是一种双链RNA依赖的丝/苏氨酸蛋白激酶,其含有两个不同功能的结构域,即氨基端双链RNA结合调节结构域和羧基端激酶催化结构域[9]。早期的研究发现PKR具有抑制病毒复制的功能,病毒在细胞内复制过程中产生的双链RNA与PKR的氨基端结合并激活PKR,活化的PKR促进IFN的产生及真核细胞起始转录因子(eIF-2α)的磷酸化,直接抑制蛋白的合成[10]。近年的研究发现,PKR还能够活化炎症小体,促进细胞分泌IL-1β、IL-18、HMGB1等细胞因子,参与炎症反应[11]。此外,PKR还参与多条信号通路诱导的细胞凋亡和自噬,例如PKR作为一种应激蛋白活化激酶,能够使MAPK信号通路中的JNK和p38活化,参与细胞凋亡的调控[12]。目前研究显示PKR在调控病毒复制、宿主炎症反应、细胞凋亡和自噬等过程中都发挥着重要作用,但是它与病毒蛋白相互作用的机制尚需深入研究。
本试验旨在研究PB1-F2蛋白对PKR作用的调控,深入理解和研究PB1-F2在宿主细胞内的分子作用机理及二者相互作用对病毒复制和炎症的影响,这不仅有助于揭示病毒的致病机制,还有利于发现新的药物靶标,为流感的防控奠定基础。
1 材料与方法
1.1 材料
1.1.1 细胞系、菌株及质粒 人胚胎肾细胞293T、人肺癌细胞A549、E.coliBL21感受态、pGBKT7-PB1(PB1基因来源于H5N1毒株)、pGEX-6p-1-PB1-F2(H5N1)、pcDNA3.0-Flag-PKR、pcDNA3.0-NS1等,均由本实验室保存。
1.1.2 主要试剂 胎牛血清、胰酶、RPMI 1640及DMEM培养基为Hyclone公司产品;PEI转染试剂为Promega公司产品;Lipofectamine®LTX转染试剂及Alexa Fluor 594荧光标记的IgG为Invitrogen公司产品;Trizol及反转录试剂盒为TaKaRa公司产品;荧光定量PCR试剂盒为Roche公司产品;p-PKR、eIF-2α、β-actin抗体为Cell Signaling Technology公司产品;HRP标记的羊抗鼠IgG及羊抗兔IgG为Santa Cruz公司产品;BCA法蛋白定量试剂盒及ECL化学发光显影液为Thermo公司产品。
1.2 方法
1.2.1 pGEX-6p-1-PB1-F2真核表达质粒的构建 参考GenBank上发表的H5N1亚型流感病毒 (序列号FJ864691.1) 的PB1-F2基因序列设计一对PCR扩增引物,上游引物(含有BamHⅠ酶切位点):5′-CGGGATCCATGGAACAGGGACAGGATAC-3′;下游引物(含有XhoⅠ酶切位点):5′-CCGCTCGAGTCAGCTTATCCACTCTTGTTTG-3′,以pGBKT7-PB1(H5N1)质粒为模板进行PCR 扩增,反应程序为:95 ℃ 预变性 5 min后,按以下参数进行35个循环:94 ℃ 30s,58 ℃ 30s,72 ℃ 1min;最后72 ℃延伸10 min。纯化的PCR扩增产物与pGEX-6p-1载体用BamHⅠ和XhoⅠ双酶切后进行连接,转化大肠埃希菌,进行PCR鉴定和酶切鉴定,对阳性质粒进行测序分析。
1.2.2 GST-PB1-F2融合蛋白的表达与纯化 将pGEX-6p-1或pGEX-6p-1-PB1-F2转化至E.coliBL21感受态细胞中,待长出单个菌落后,挑取单菌落置于Amp+抗性的 LB液体培养基中过夜培养;次日将上述菌液转接于LB液体培养基中,继续培养使其OD值为0.6~0.8。加入终浓度为1 mmol/L的IPTG,16℃诱导表达,收集菌体、超声,取上清与谷胱甘肽Sepharose 4B凝胶结合过夜;用PBS充分洗脱掉未结合的蛋白,沉淀物进行SDS-PAGE电泳分析。
1.2.3 GST pull-down 将293T细胞接种于10 cm皿中培养过夜,当细胞密度约为80%时,采用PEI转染试剂将pcDNA3.0-Flag-PKR质粒转染293T细胞中,48 h后收细胞、裂解、离心,取上清中的蛋白样品分别与纯化的GST或GST-PB1-F2融合蛋白于4℃翻转孵育结合3 h,洗涤琼脂糖珠3次,获得的沉淀物进行Western blot分析。
1.2.4 免疫荧光 将A549细胞接种于铺有爬片的12孔培养板中,采用Lipofectamine®LTX转染试剂转染pEGFP-PB1-F2和pcDNA3.0-Flag-PKR质粒,24 h后进行免疫荧光试验。一抗使用Flag标签抗体,二抗使用红色荧光标记的Alexa Fluor 594抗体,用DAPI染细胞核后,在共聚焦显微镜下观察。
1.2.5 实时荧光定量PCR (qPCR) 将A549细胞接种于6孔板中,按照剂量梯度转染PB1-F2质粒,24 h后收细胞;在PKR干扰试验中,细胞在转染质粒前,转染PKR的小干扰RNA(si-PKR),24 h后转染pEGFP或pEGFP-PB1-F2质粒,24 h后收细胞。将收集的细胞用Trizol法提取细胞总RNA,按照TaKaRa反转录试剂盒反转录成cDNA,反转录体系中各组的总RNA量保持一致。按照荧光定量PCR试剂盒的说明书检测各样品中mRNA的表达量,以β-actin基因为内参,计算各样品中mRNA的相对表达量,采用比较Ct值的“2-△△CT”的方法进行数据的分析处理。
1.2.6 免疫印迹分析 将A549细胞接种于6孔板中,按照上述转染方法分别转染pEGFP 2 μg、pEGFP-PB1-F2 1 μg、pEGFP-PB1-F2 2 μg或pcDNA3-NS1 1 μg,24 h后收细胞裂解、离心,取上清用BCA法测定蛋白浓度,各组取等量的蛋白样品进行Western blot分析,用p-PKR、p-eIF-2α等抗体检测蛋白的磷酸化表达水平。ECL化学曝光成像,利用Image J软件进行数据定量分析。
1.2.7 统计分析 采用SPSS 17.0 统计学软件进行统计分析,数据以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 GST-PB1-F2融合蛋白的表达与纯化
将pGEX-6p-1-PB1-F2质粒转化至E.coliBL21菌株中,大量诱导表达后用Glutathione Sepharose 4B亲和层析纯化融合蛋白。SDS-PAGE检测结果表明(图1),原核表达的GST-PB1-F2相对分子质量约为36 ku,与预测值相符。纯化的GST-PB1-F2蛋白将用于GST pull-down试验。
2.2 GST pull-down验证PB1-F2与PKR的相互作用
将pcDNA3.0-Flag-PKR质粒转染至293T细胞中,48 h后收细胞,细胞裂解后取上清与GST或GST-PB1-F2融合蛋白混合孵育3 h,多次洗涤沉淀物后,用Flag抗体进行Western blot分析(图2),PKR-Flag蛋白在293T细胞中大量表达,并能够与GST-PB1-F2融合蛋白结合,而阴性对照GST不能与PKR蛋白结合,证明PB1-F2与PKR在体外存在特异性相互作用。
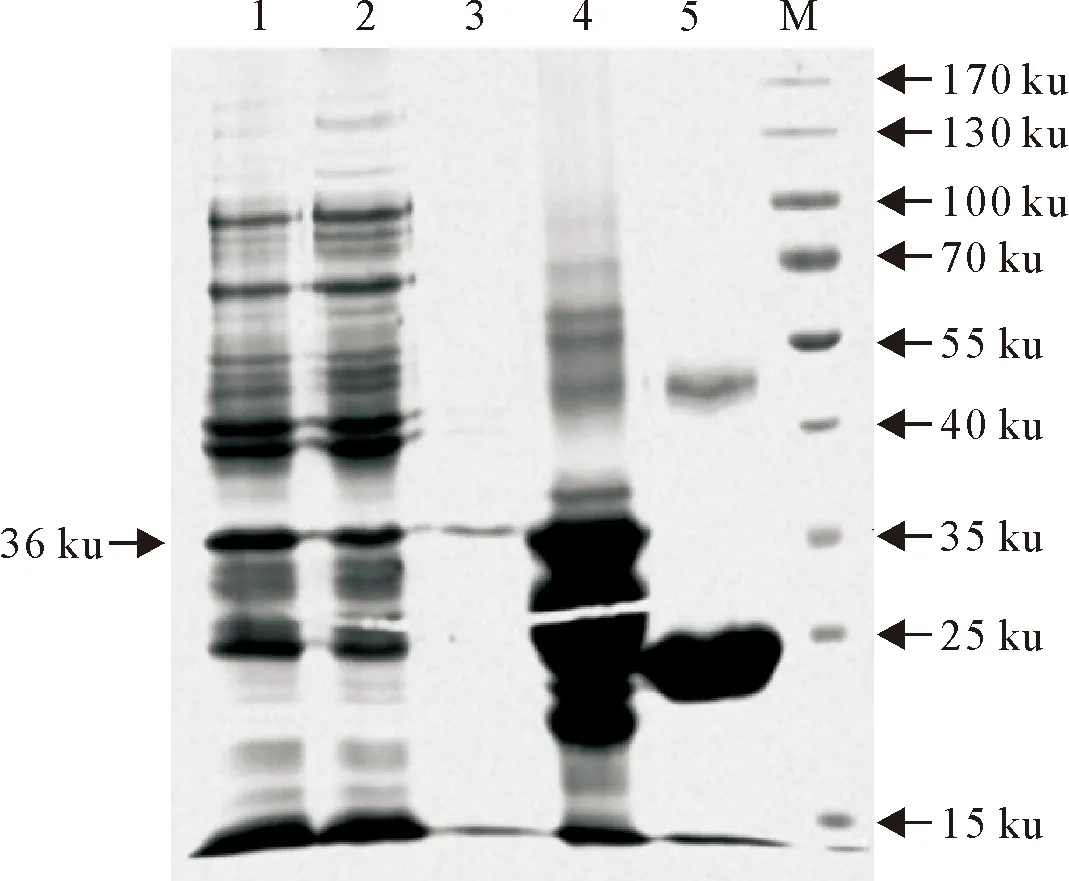
M.蛋白分子质量标准; 1.IPTG诱导的重组菌总蛋白; 2.IPTG诱导的重组菌上清; 3.诱导的重组菌沉淀; 4.纯化的GST-PB1-F2蛋白; 5.纯化的GST蛋白
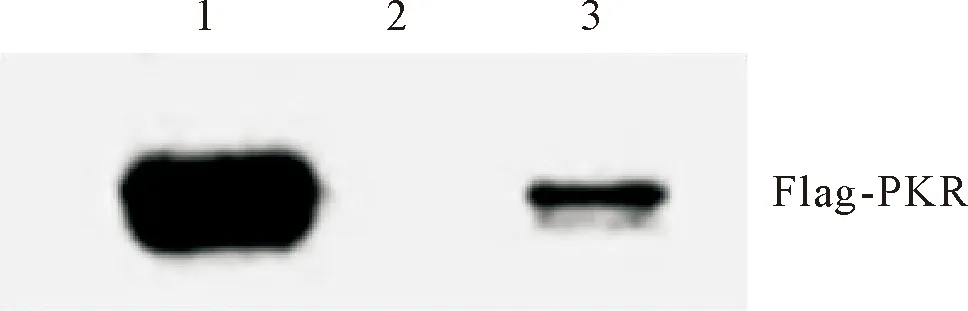
1.Flag-PKR 表达上清;2.GST蛋白+Flag-PKR;3.GST-PB1-F2蛋白+Flag-PKR
2.3 免疫荧光试验验证
将pEGFP-PB1-F2与pcDNA3.0-Flag-PKR质粒共转染A549细胞,进行免疫荧光试验,以抗Flag抗体为一抗,Alexa Fluor 594红色荧光标记的IgG为二抗,通过共聚焦显微镜观察结果(图3), PB1-F2蛋白为绿色荧光,Flag-PKR蛋白为红色荧光,二者在细胞浆中有明显的共定位,说明PB1-F2与PKR蛋白在A549细胞中存在相互作用。
2.4 荧光定量PCR检测结果
将PB1-F2质粒瞬时转染A549细胞后,提取细胞总RNA,反转录后用qPCR法检测PB1-F2对PKR及促炎症细胞因子IL-6的mRNA转录水平的影响(图4),过表达PB1-F2蛋白能够显著抑制PKR的mRNA转录,这种抑制作用呈现剂量依赖关系;细胞转染PKR siRNA(si-PKR)抑制PKR的表达后,PB1-F2下调促炎因子IL-6的mRNA表达作用更显著了,表明PB1-F2在一定程度上可能通过PKR调控IL-6的表达。

图3 免疫荧光试验分析PB1-F2与PKR的相互作用

图4 PB1-F2通过抑制PKR下调IL-6 mRNA 表达
2.5 PB1-F2抑制PKR的磷酸化
将A549细胞接种于6孔板中,分别转染pEGFP空载体、pEGFP-PB1-F2或pcDNA3-NS1质粒,转染24 h后,将各组细胞的等量蛋白样品进行Western blot检测(图5),过表达PB1-F2能够显著抑制PKR及eIF-2α的磷酸化水平,且这种抑制作用呈剂量依赖性。
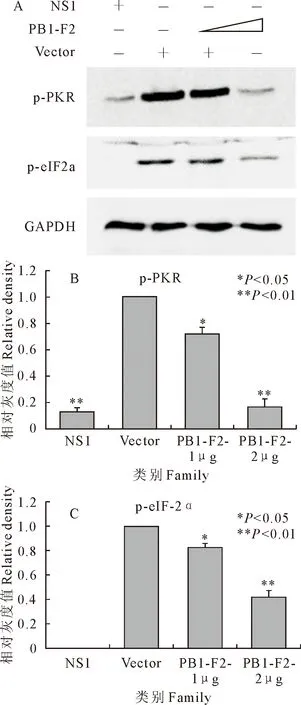
图5 PB1-F2抑制PKR及eIF-2α的磷酸化水平
3 讨论
PB1-F2是IAV的重要毒力因子,存在于多种流感病毒毒株中,它的存在及表达水平的高低与IAV的致死率有密切的联系,因为在禽流感病毒中PB1-F2基因的突变或缺失,病毒的毒力及致病性都发生明显的改变[13-15]。PKR作为宿主细胞内一种重要的蛋白激酶, 除了通过IFN和eIF-2α行使抗病毒功能之外,在STAT信号通路中,也与STAT1及STAT3相互作用构成其抗病毒通路的又一个重要分支[16];此外,PKR还可调控NF-κB信号通路,参与对细胞免疫应答、炎症反应、细胞凋亡等过程相关基因的转录调节。
为了逃避宿主的天然免疫应答,多种病毒编码的蛋白质都能够抑制PKR的活化,如人巨细胞病毒的m142/m143蛋白通过与PKR相互作用使其移位[17];裂谷热病毒编码的NSs蛋白利用蛋白酶体介导PKR降解[18];埃博拉病毒的VP35蛋白也能拮抗PKR,但具体机制尚不明确[19];流感病毒的NS1蛋白通过与dsRNA结合或直接与PKR结合阻止PKR的活化[20]。为了研究A型流感病毒的PB1-F2蛋白是否也能够与PKR相互作用,我们采用GST pull-down和免疫荧光试验均发现PB1-F2与PKR存在特异性相互作用;在A549细胞中过表达PB1-F2后,PKR的mRNA转录及蛋白磷酸化水平明显下调,说明PB1-F2能够抑制PKR活化,而且这种抑制作用呈剂量依赖性;采用si-PKR干扰PKR基因的表达后,PB1-F2负调控IL-6的mRNA表达作用更显著,说明PB1-F2可能在一定程度上通过PKR调控炎症细胞因子 IL-6的表达。我们还发现抑制PKR的表达后,PB1-F2能更显著地抑制NF-κB的转录活性,说明PB1-F2在一定程度上通过PKR负调控NF-κB信号通路。PB1-F2调控PKR信号通路是否与其调节炎症反应机制有关,还有待于进一步研究。本研究可为探索PB1-F2参与调控炎症反应及病毒复制的机制提供新的依据。
[1] Conenello G M,Pliese P.Influenza A virus PB1-F2:A small protein with a big punch[J].Cell Host Microbe,2007,2(4):208-209.
[2] Gibbs J S,Malide D,Homung F,et al.The influenza A virus PB1-F2 protein targets the inner mitochondrial membrane via a predicted basic amphipathic helix that disrupts mitochondrial function[J].Virology,2003,77(13):7214-7224.
[3] Kosik I,Krejnusova I,Bystricka M,et al.N-terminal region of the PB1-F2 protein is re sponsible for increased expression of influenza A viral protein PB1[J].Virology,2011,55(1):45-53.
[4] Mazur I,Anhlan D,Mitzner D,et al.The proapoptotic influenza A virus protein PB1-F2 regulates viral polymerase activity by interaction with the PB1 protein[J].Cell Microbiol,2008,10(5):1140-1152.
[5] Alymova I V,Green A M,van de Velde N,et al.Immunopathogenic and antibacterial effects of H3N2 influenza A virus PB1-F2 map to amino acid residues 62,75,79,and 82[J].J Virol,2011,85(23):12324-12333.
[6] McAuley J L,Tate M D,MacKenzie-Kludas C J,et al.Activation of the NLRP3 inflammasome by IAV virulence protein PB1-F2 contributes to severe pathophysiology and disease[J].PLoS Pathog,2013,9(5):e1003392.
[7] Dudek SE,Wixler L,Nordhoff C,et al.The influenza virus PB1-F2 protein has interferon antagonistic activity[J].Biol Chem,2011,392(12):1135-1144.
[8] Varga Z T,Grant A,Manicassamy B,et al.Influenza virus protein PB1-F2 inhibits the induction of type I interferon by binding to MAVS and decreasing mitochondrial membrane potential[J].J Virol,2012,86(16):8359-8366.
[9] Cole J L.Activation of PKR:An open and shut case? [J].Trends Biochem Sci,2007,32(2):57-62.doi:10.1016/j.tibs.2006.12.003.
[10] Amici C,La Frazia S,Brunelli C,et al.Inhibition of viral protein translation by indomethacin in vesicular stomatitis virus infection:role of eIF2α kinase PKR[J].Cell Microbiol,2015,17:1391-1404.
[11] Stunden H J,Latz E.PKR stirs up inflammasomes[J].Cell Res,2013,23(2):168-170.doi:10.1038/cr.2012.125.
[12] Zhang P,Langland J O,Jacobs B L.et al.Protein kinase PKR-dependent activation of mitogen-activated protein kinase occurs through mitochondrial adapter IPS-1 and is antagonized by vaccinia virus E3L[J].J Virol,2009,83(11):5718-5725.
[13] Kamal R P,Kumar A,Davis C T,et al.Emergence of highly pathogenic avian influenza A (H5N1) virus PB1-F2 variants and their virulence in BALB/c mice[J].J Virol,2015,89(11):5835-5846.doi:10.1128/JVI.03137-14
[14] 卢建红,邵卫星,龙进学,等.A型流感病毒毒力因子研究进展[J].动物医学进展,2004,04:63-66.
[15] Košík I,Práznovská M,Košíková M,et al.The Ubiquitination of the influenza A virus PB1-F2 protein is crucial for its biological function[J].PLoS One,2015,10(4):e0118477.
[16] Deb A,Zamanian D M,Xu Z.et al.Protein kinase PKR is required for platelet-derived growth factor signaling of c-fos gene expression via Erks and Stat3[J].J EMBO,2001,20(10):2487-2496.
[17] Valchanova R S,Picard-Maureau M,Budt M,et al.Murine cytomegalovirus m142 and m143 are both required to block protein kinase R-mediated shutdown of protein synthesis[J].J Virol,2006,80:10181-10190.
[18] Habjan M,Pichlmair A,Elliott R M,et al.NSs protein of rift valley fever virus induces the specific degradation of the double-stranded RNA-dependent protein kinase [J].J Virol,2009,83:4365-4375.
[19] Feng Z,Cerveny M,Yan Z,et al.The VP35 protein of Ebola virus inhibits the antiviral effect mediated by double-stranded RNA-dependent protein kinase PKR [J].J Virol,2007,81:182-192.
[20] Li S,Min J Y,Krug R M,et al.Binding of the influenza A virus NS1 protein to PKR mediates the inhibition of its activation by either PACT or double-stranded RNA [J].J Virol,2006,349:13-21.
PB1-F2 Protein of Influenza A Virus Interacts with Protein Kinase R
YU Hong-min1,JIN Xin2,ZHANG Mao-lin1,DUAN Ming1,GUAN Zhen-hong1
(1.KeyLaboratoryofZoonosis,MinistryofEducation,InstituteofZoonosis,JilinUniversity,Changchun,Jilin,130062,China; 2.CollegeofAnimalScienceandTechnology,JilinAgricultralUniversity,Changchun,Jilin,130118,China)
To investigate the regulation mechanism of the crucial virulence factor PB1-F2 of influenza A virus (IAV) on protein kinase R (PKR),GST-PB1-F2 fusion protein was purified and the interaction between PB1-F2 and PKR was verified by GST pull-down assayinvitro.Then the interactional relationship between them was further conformed by immunofluorescence experiment.The results of real-time quantitative PCR showed that PB1-F2 decreased the mRNA transcription of PKR and IL-6.The mRNA level of IL-6 was also reduced when PKR gene was knocked down with PKR siRNA,which illustrated PB1-F2 might in part at least repress IL-6 mRNA expression through inhibition of PKR.The Western blot experiment was utilized to explore the effect of PB1-F2 on the phosphorylation of PKR and eIF-2α protein.The results demonstrated that the phosphorylation of PKR and eIF-2α was significantly down-regulated in response to PB1-F2 overexpression.This study provided the critical information for exploring the biological function of PB1-F2 protein.
Influenza A virus; PB1-F2; PKR; protein phosphorylation
2016-11-01
国家重点基础研究发展计划 (973 计划) (2012CB518901)
于洪敏(1989-),女,黑龙江绥化人,硕士研究生,主要从事流感病毒与宿主相互作用研究。*通讯作者
S852.659.5
A
1007-5038(2017)05-0001-05
