沙门菌sopB基因缺失诱导小鼠巨噬细胞死亡的研究
2017-05-18秦晓霞胡桂秋于水星韩文瑜杨勇军
戚 帅,秦晓霞,胡桂秋,张 杰,于水星,陈 巍,韩文瑜,杨勇军
(吉林大学动物医学学院,吉林长春 130062)
沙门菌sopB基因缺失诱导小鼠巨噬细胞死亡的研究
戚 帅△,秦晓霞△,胡桂秋,张 杰,于水星,陈 巍,韩文瑜,杨勇军*
(吉林大学动物医学学院,吉林长春 130062)
沙门菌是一种胞内寄生菌,能够引起人和多种动物疾病,是一种世界范围内的重要疾病。为了更好理解在沙门氏菌感染过程中效应蛋白SopB对巨噬细胞存活的影响,利用鼠伤寒沙门菌SL1344和sopB基因缺失菌株分别感染小鼠骨髓来源的巨噬细胞,对2株菌在巨噬细胞内存活情况进行统计。随后用Western blot检测DNA修复酶PARP的剪切情况,通过ELISA检测培养上清中细胞因子和趋化因子的分泌情况。结果发现sopB基因缺失之后,沙门菌在巨噬细胞内的存活显著降低;培养上清中细胞因子和趋化因子分泌增强,巨噬细胞坏死增加。说明sopB基因缺失可促进巨噬细胞坏死。
沙门菌;SopB;巨噬细胞;细胞死亡;坏死
沙门菌是革兰阴性胞内寄生菌,无芽胞,周身具有鞭毛,有2 000多种血清型[1]。沙门菌感染主要通过摄入污染的食物和饮水引起,能够导致婴儿、老年人及免疫低下人群严重并发症甚至死亡,是一种世界范围内的重要疾病。经过长期进化,沙门菌获得多种编码毒力因子的基因,帮助细菌成功建立感染。表达这些毒力因子的基因构成沙门菌毒力岛(Salmonellapathogenicity island,SPI)。SPI-1和SPI-2是沙门菌最重要的2个毒力岛,决定了沙门菌的侵入以及在细胞内的存活。沙门菌一旦被宿主细胞吞噬后,在细胞内建立含沙门菌的囊泡(Salmonellacontaining vascular,SCV),为沙门菌逃避模式识别受体的识别和胞内存活提供有利的环境。SopB是由SPI-1编码的效应分子,具有肌醇磷酸酶活性[2],在沙门菌感染过程中发挥重要作用。感染早期,SopB通过肌醇磷酸酶活性募集Rab5和Vps34 PI3-kinase至SCV膜,促进SCV的成熟[3],随后通过Rab7依赖的方式获得溶酶体糖蛋白(只含有微量的组织蛋白酶D)[4],阻止SCV与溶酶体的融合,有利于沙门菌的复制。研究表明,SopB通过肌醇磷酸酶活性改变初期SCV的膜电位,导致依赖于强阴离子才能募集的到SCV膜上的蛋白质解离,而这些蛋白通常具有促进吞噬溶酶体形成的作用,sopB基因缺失株则引起相反的结局[5]。
先天性免疫反应在抵抗多种病原感染和促进适应性免疫反应形成方面发挥着重要作用。巨噬细胞是先天性免疫系统中重要的组成部分,能够通过模式识别受体感知病原微生物入侵宿主的首要成分,从而启动免疫应答,形成了先天免疫与适应性免疫之间的关键环节。由于沙门菌能逃逸机体免疫识别,导致延迟的适应性免疫反应[6-8],因此先天性免疫反应在抵御沙门菌入侵方面具有重要作用。沙门菌感染期间,病原相关分子模式和损伤相关分子模式启动先天免疫系统,激活巨噬细胞,产生促炎性细胞因子如白介素6(IL-6)、白介素1β(IL-1β)、肿瘤坏死因子α(TNF-α)和γ干扰素(IFN-γ)。巨噬细胞作为哺乳动物体内主要的清除细菌的细胞类型[9],能迅速控制沙门菌感染[10-11],同时诱导的巨噬细胞死亡作为机体重要的防御机制[12]。一方面,细胞死亡诱导炎症反应;另一方面,在沙门菌侵袭的过程中,宿主细胞(上皮细胞、巨噬细胞等)分泌大量的细胞因子和趋化因子,限制病原扩散[13]。
1 材料与方法
1.1 材料
鼠伤寒沙门菌SL1344(Salmonellaentericasubsp.entericaserovar.typhimuriumSL1344),sopB基因缺失株ΔsopB均由本实验室保存。rTaqDNA聚合酶、dNTPs、DNA marker购自宝生物工程(大连)有限公司;PCR引物由哈尔滨博仕生物技术有限公司合成;ELISA试剂盒均购自R&D公司;aiti-β-tubulin购自北京锐抗生物科技有限公司,anti-rabbit-IgG-HRP、anti-mouse-IgG-HRP抗体购自Santa Cruz公司,anti-PARP抗体购自Cell Signaling technology公司;Triton X-100购自Sigma公司;其他试剂为国产分析纯试剂。
1.2 方法
1.2.1 鼠伤寒沙门菌sopB基因缺失株的鉴定 在沙门菌sopB基因CDS区两侧设计上、下游引物SopB-outer-F、SopB-outer-R,以及sopB基因CDS区内设计引物SopB-inner-F、SopB-inner-R,引物序列如表1所示。通过以上2对引物鉴定SopB基因的缺失情况。
1.2.2 小鼠骨髓来源巨噬细胞的分离、培养和处理 分离C57BL/6小鼠后肢骨,并置于10 mL RPMI1640(含0.1%双抗)培养基中。在无菌环境下,用RPMI1640培养基冲洗骨髓腔,将冲洗液1 000 r/min 离心10 min,弃上清,用含30% LCCM、10% FBS、0.1% P/S的RPMI1640重悬细胞,随后接种于90 mm皿中,37℃ 5% CO2培养6 d。第7天用10 g/L胰酶消化,细胞计数后接种于6孔板或24孔板,过夜培养贴壁。用RPMI1640培养基洗去未贴壁细胞,随后用SL1344和ΔsopB分别感染细胞(MOI=20),于感染后1 h弃去培养上清,添加含抗生素的RPMI1640培养基继续培养,于不同时间点收样。
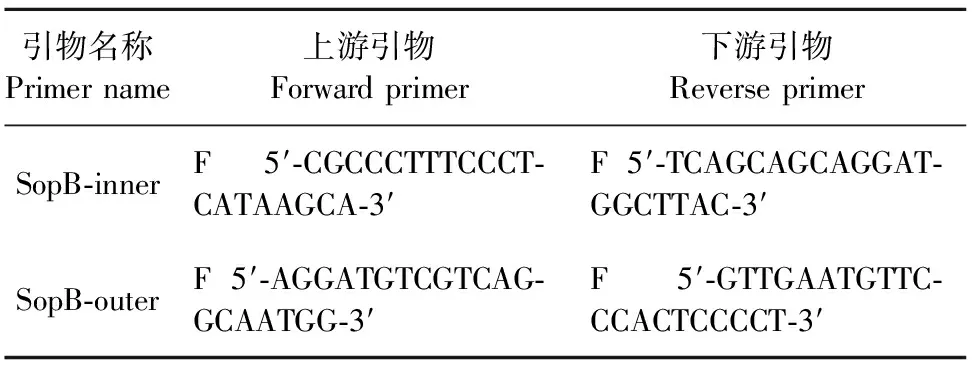
表1 PCR引物
1.2.3 Western blot检测 用含蛋白酶抑制剂的RIPA裂解液充分裂解细胞,提取总蛋白。BCA法测定蛋白浓度,取等质量蛋白裂解液,加入等体积的甲醇和1/4体积的氯仿,4℃ 13 000 r/min离心10 min,弃上清,加入1 mL甲醇后离心,弃上清,待液体挥发完成之后加入15 μL 1×SDS,沸水浴5 min,置于-80℃保存备用。取30 μg蛋白样品进行SDS-PAGE电泳;75 V冰浴转膜1 h,50 g/L脱脂奶粉室温封闭2 h;4℃一抗结合过夜,1×TBST洗4次,每次15 min;二抗室温结合1 h,1×TBST洗4次,每次15 min;ECL显色,于暗室内曝光显影。
1.2.4 ELISA检测 按照R&D公司的Duo Set ELISA试剂盒说明书,检测鼠伤寒沙门菌感染后细胞上清中的细胞因子及趋化因子的分泌情况。
1.2.5 细菌胞内存活的测定 鼠伤寒沙门菌感染细胞后,弃去培养上清,加入400 μL 10 g/L Trition X-100充分裂解细胞,将裂解后上清涂于含链霉素抗性的LB平板,培养过夜,通过CFU计算细菌的胞内存活情况。
1.2.6 统计学分析 采用GraphPad prism 6进行统计学分析,计量资料均以平均值±标准误表示,组内差异检验采用t检验,*P<0.05,**P<0.01,***P<0.001。
2 结果
2.1ΔsopB菌株的鉴定
采用SopB-outer、SopB-inner两对引物分别对SL1344和ΔsopB菌株进行鉴定。如图所示,SL1344组分别被SopB-outer和SopB-inner引物扩增出218 bp和1906 bp目的条带;ΔsopB组分别被SopB-outer和SopB-inner引物扩增出0 bp和290 bp目的条带。鉴定结果表明,鼠伤寒沙门菌sopB基因缺失株构建成功。

M.DNA 标准 DL 2 000;1.SopB-inner引物扩增产物;2.SopB-outer引物扩增产物
2.2ΔsopB菌株在小鼠骨髓来源的巨噬细胞内的存活显著降低
鼠伤寒沙门菌和sopB基因缺失株感染小鼠骨髓来源的巨噬细胞2 h和24 h后,10 g/L Trition X-100充分裂解细胞,统计细胞内的细菌数,以log10(CFU/ml)作为计量资料。结果如图2所示,相比于SL1344组,ΔsopB组的细菌胞内存活显著降低。巨噬细胞能够对病原微生物进行主动吞噬,以内吞泡的形式包裹病原,随后与溶酶体结合,对病原菌进行裂解。沙门菌被吞噬后,能够形成SCV,而SopB具有促进沙门菌SCV成熟以及抑制吞噬泡与溶酶体融合的作用[14],故sopB基因缺失后,沙门菌逃逸免疫系统清除的机制减弱,进而在细胞内形成吞噬溶酶体,导致ΔsopB在巨噬细胞内的存活和复制显著降低。
2.3ΔsopB诱导小鼠骨髓来源巨噬细胞死亡增加
巨噬细胞作为机体主要清除病原菌的免疫细胞,在清除病原菌的同时,诱导自身细胞死亡作为机体的防御机制[12]。聚腺苷二磷酸核糖聚合酶[poly (ADP-ribose) polymerase,PARP]在细胞DNA损伤修复过程中发挥着重要作用。PARP能够被多种半胱氨酸蛋白酶(caspase)切割,通常认为被切割成的89 ku和24 ku片段与凋亡相关,72 ku和50 ku片段与坏死相关。由图3可知,与SL1344相比,ΔsopB感染巨噬细胞后,50 ku坏死带表达增强,在沙门菌感染后3 h,差异更为显著。

Y轴表示每毫升裂解液含有的细菌数,并以10的对数表示;X轴表示感染的时间点

图3 ΔsopB促进细胞死亡
2.4ΔsopB诱导巨噬细胞的炎症反应增强
在沙门菌感染过程中,宿主细胞分泌大量的炎性因子和趋化因子,作为机体清除沙门菌感染的重要机制[13]。由于ΔsopB缺少逃逸机体免疫反应的分子机制,能够诱导机体更强的炎症反应,以利于沙门菌的清除。同时,ΔsopB能够增强巨噬细胞坏死,不同于细胞凋亡,细胞坏死会产生大量的损伤相关分子模式,进一步刺激细胞诱导炎症反应。结果如图4所示,ΔsopB感染组分泌产生IL-1β、TNF-α、IL-6、CCL2和CCL5均显著高于SL1344感染组。即ΔsopB增强巨噬细胞的炎症反应。
3 讨论
沙门菌是一种胞内病原菌,能够感染人和多种动物。经过长期进化获得毒力基因,帮助沙门菌成功建立感染,逃逸宿主免疫防御。SopB是由SPI-1编码的一种重要的毒力基因,在沙门菌侵入和胞内存活中发挥重要作用。有研究表明,SopB具有抑制SCV与溶酶体融合[5]和促进SCV成熟的作用,sopB基因缺失导致SCV成熟受阻,使吞噬泡与溶酶体融合,促进巨噬细胞清除病原;在本研究中有相似的发现,sopB基因缺失后,细菌在巨噬细胞内的存活显著降低,说明sopB基因缺失株被巨噬细胞吞噬后,由于缺少诱导SCV成熟和抑制溶酶体结合的机制,导致sopB基因缺失株在细胞内的复制减少,被巨噬细胞裂解增加,因此,sopB基因缺失株的胞内存活显著降低。

Y轴表示每毫升培养上清中所含有的细胞因子或趋化因子的分泌量;X轴表示不同的感染时间点Y-axis represents the secretion of cytokine and chemokines per ml; X-axis represents different time points
鼠伤寒沙门菌可通过Ⅰ型干扰素信号诱导巨噬细胞发生坏死性凋亡[15]。本研究发现沙门菌能够诱导巨噬细胞坏死,而sopB基因缺失之后,其50 ku坏死条带表达量显著增强,说明sopB基因缺失之后,巨噬细胞坏死增加。这种增加的非程序性细胞死亡释放大量损伤相关分子模式,导致更加严重的不良结局,包括增强的炎症反应。尽管SopB可诱导AKT发生磷酸化,促进细胞存活,在沙门菌肠道感染过程中具有重要的保护作用[16-17],但巨噬细胞作为一种宿主先天性免疫反应中重要的免疫细胞,具有主动识别、吞噬和清除病原体的能力,本研究认为ΔsopB诱导巨噬细胞死亡增加,进而释放大量的损伤相关分子模式,促进巨噬细胞对病原菌及危险信号进行免疫识别,进而对病原进行清除,SopB的这一作用显得更为重要。
SopB在促进细胞存活,维持SCV稳定,调节炎症反应以及逃避宿主免疫反应中发挥重要的作用。细胞死亡作为机体清除病原的主要分子机制,对维持机体健康具有非常重要的意义。如图3所示,ΔsopB增强巨噬细胞坏死。与凋亡过程不同,细胞发生坏死时,细胞膜会迅速发生破裂,释放胞内的一系列的损伤相关分子模式。这些分子可被模式识别受体识别,诱发机体组织细胞产生炎症反应,从而对病原菌的进行清除。而ΔsopB通过何种信号增加细胞坏死还有待于进一步探究。
[1] 郭梦征,陈乃耀,阮海华.沙门菌SopB蛋白在侵袭宿主细胞中的作用机制 [J].环境与健康杂志,2013,30(6):557-60.
[2] Norris F A,Wilson M P,Wallis T S,et al.SopB,a protein required for virulence ofSalmonelladublin,is an inositol phosphate phosphatase [J].Proc Natl Acad Sci U S A,1998,95(24):14057-14059.
[3] Mallo G V,Espina M,Smith A C,et al.SopB promotes phosphatidylinositol 3-phosphate formation onSalmonellavacuoles by recruiting Rab5 and Vps34 [J].J Cell Biol,2008,182(4):741-752.
[4] Meresse S,Steele-Mortimer O,Finlay B B,et al.The rab7 GTPase controls the maturation ofSalmonellatyphimurium-containing vacuoles in HeLa cells [J].EMBO J,1999,18(16):4394-4403.
[5] Bakowski M A,Braun V,Lam G Y,et al.The phosphoinositide phosphatase SopB manipulates membrane surface charge and trafficking of the Salmonella-containing vacuole [J].Cell Host Microbe,2010,7(6):453-462.
[6] Luu R A,Gurnani K,Dudani R,et al.Delayed expansion and contraction of CD8+ T cell response during infection with virulentSalmonellatyphimurium[J].J Immunol,2006,177(3):1516-1525.
[7] Albaghdadi H,Robinson N,Finlay B,et al.Selectively reduced intracellular proliferation ofSalmonellaentericaserovartyphimuriumwithin APCs limits antigen presentation and development of a rapid CD8 T cell response [J].J Immunol,2009,183(6):3778-3787.
[8] Vidric M,Bladt A T,Dianzani U,et al.Role for inducible costimulator in control ofSalmonellaentericaserovartyphimuriuminfection in mice [J].Infect Immun,2006,74(2):1050-1061.
[9] Spano S.Mechanisms ofSalmonellatyphihost restriction [J].Adv Exp Med Biol,2016,915:283-294.
[10] O'Brien A D,Scher I,Formal S B.Effect of silica on the innate resistance of inbred mice toSalmonellatyphimuriuminfection [J].Infect Immun,1979,25(2):513-520.
[11] Salcedo S P,Noursadeghi M,Cohen J,et al.Intracellular replication ofSalmonellatyphimuriumstrains in specific subsets of splenic macrophagesinvivo[J].Cell Microbiol,2001,3(9):587-597.
[12] Stockinger S,Decker T.Novel functions of type I interferons revealed by infection studies withListeriamonocytogenes[J].Immunobiology,2008,213(9-10):889-897.
[13] Srikanth C V,Cherayil B J.Intestinal innate immunity and the pathogenesis ofSalmonellaenteritis[J].Immunol Res,2007,37(1):61-78.
[14] Hernandez L D,Hueffer K,Wenk M R,et al.Salmonellamodulates vesicular traffic by altering phosphoinositide metabolism [J].Science,2004,304(5678):1805-1807.
[15] Robinson N,McComb S,Mulligan R,et al.Type I interferon induces necroptosis in macrophages during infection withSalmonellaentericaserovartyphimurium[J].Nat Immunol,2012,13(10):954-962.
[16] Kum W W,Lo B C,Yu H B,et al.Protective role of Akt2 inSalmonellaentericaserovartyphimurium-induced gastroenterocolitis [J].Infect Immun,2011,79(7):2554-2566.
[17] Knodler L A,Finlay B B,Steele-Mortimer O.TheSalmonellaeffector protein SopB protects epithelial cells from apoptosis by sustained activation of Akt [J].J Biol Chem,2005,280(10):9058-9064.
Study on Murine Macrophage Death Induced bySalmonellasopB Gene Delation
QI Shuai,QIN Xiao-xia,HU Gui-qiu,ZHANG Jie,YU Sui-xing,CHEN Wei,HAN Wen-yu,YANG Yong-jun
(CollegeofVeterinaryMedicine,JilinUnversity,Changchun,Jilin,130062,China)
Salmonellais an intracellular pathogen which infection can cause a range of diseases in human and animals worldwide.To investigate the effect of SopB inSalmonella-induced cell death,in this study,bone marrow derived macrophages (BMDMs) were infected with SL1344 andΔsopBrespectively,the interacellular survivals of these two bacteria in BMDMs were investigated.Subsequently,the expression of cleaved PARP was detected via Western blot and the secretion of cytokine and chemokine were examined via ELISA.We found thatΔsopBhas a significant lower intracellular survival; however,the expression of cleaved PARP and the secretion of inflammatory cytokine were increased.Collectively,these results indicated that the SopB deletion could significantly promote the necrosis of macrophage.
Salmonella; SopB; macrophage; cell death; necrosis
2016-11-07
国家自然科学基金资助项目 (3A411V246604)
戚 帅(1989-),男,硕士研究生,主要从事天然免疫学研究。△同等贡献作者。*通讯作者
S852.4
A
1007-5038(2017)05-0038-05
