不同海拔和不同持续时间大鼠血浆3种白介素水平的变化
2017-05-18顾玉海郑晶晶解友邦
顾玉海,郑晶晶,解友邦*
(1.青海省人民医院,青海西宁 810007;2.青海大学,青海西宁 810000)
不同海拔和不同持续时间大鼠血浆3种白介素水平的变化
顾玉海1,郑晶晶2,解友邦1*
(1.青海省人民医院,青海西宁 810007;2.青海大学,青海西宁 810000)
测定不同海拔和不同持续时间大鼠血浆IL-6、IL-8和IL-10水平,探讨海拔和时间对大鼠血浆3种白介素含量变化的影响。选用88只清洁雄性Wistar大鼠随机分为对照组、中海拔组和高海拔组。对照组立即抽取下腔静脉血3 mL分离血浆保存,中、高海拔组饲养1、3、7、15、30 d后抽取下腔静脉血3 mL分离血浆保存,ELISA测定血浆白介素水平。结果表明,中海拔1、3、7天组IL-6、IL-8水平均高于对照组(P<0.05);高海拔组中不同时间组IL-6、IL-8水平均高于对照组(P<0.05),第7天上升至最高后呈下降,但仍高于对照组;中海拔组IL-10水平上升后呈下降趋势,不同时间组仍均高于对照组(P<0.05);IL-10水平在高海拔组中不同时间组均低于对照组(P<0.05),并随时间下降;IL-10水平在高海拔组同一时间组中均低于中海组同一时间组(P<0.05)。上述结果提示,中海拔可导致机体内出现炎症反应,7 d后逐渐下降至初始水平;高海拔环境中机体炎性反应增强,7 d后逐渐减轻,但持续存在炎症及免疫抑制反应。
大鼠;不同海拔;不同持续时间;白介素
目前,国内外关于低氧对机体的损伤的报道很多,而多数为低氧诱导因子等氧化/抗氧化通路相关研究及进展。近来报道指出,高氧暴露或低氧均具有致炎作用,能够激活炎性细胞、促进炎性因子释放、急性反应蛋白水平上升等[1-2]。在炎症反应中,白介素作为重要的炎性介质,成为炎症因子的典型代表之一。低氧常用指标为在海平面、静息状态下、呼吸空气时动脉血氧分压<80 mmHg[3]。缺氧在临床中较为常见,而全身性缺氧多与高原病、呼吸系统疾病及心血管疾病等有关,局部缺氧则多见于梗塞、炎症、肿瘤等相关疾病。目前报道的与缺氧有关的炎症因子主要有白介素6(interleukin 6,IL-6)[4-7]、白介素8(interleukin 8,IL-8)[8]和白介素10(interleukin10,IL-10)[7],机体缺氧时主要表现为促炎性细胞因子分泌增多,而后抑炎因子相继随之升高。但是关于缺氧引起的上述白介素变化趋势和海拔及发生变化的时间没有相关的报道,本研究通过检测不同海拔和持续时间大鼠血浆IL-6、IL-8和IL-10的水平,以明确海拔和低氧暴露时间对这些细胞因子表达的影响。
1 材料与方法
1.1 试验动物与分组
88只清洁级成年雄性Wistar大鼠(由甘肃中医药大学提供)随机分为11组,即对照组(兰州,海拔1 500 m)、中海拔组(Medium Altitude,以下简称MA))(西宁,海拔2 260 m)和高海拔组(High Altitude,以下简称HA)(低压氧舱模拟海拔5 000 m),其中,中、高海拔组中根据大鼠在海拔地暴露1 d、3 d、7 d、15 d、30 d的时间不同分为MA1、MA3、MA7、MA15、MA30和HA1、HA3、HA7、HA15、HA30,每组8只。饲料及垫料由甘肃中医药大学动物实验中心和青海省地方病研究所提供。对照组饲养于甘肃中医药大学动物实验中心(兰州),中海拔组饲养于青海大学医学院动物房(西宁),高海拔组饲养于青海大学医学院低压氧舱(24 h不间断模拟海拔5 000 m低压低氧环境,压力396.67 mmHg~397.52 mmHg,氧分压:42 mmHg,温度:16.9℃~24℃,湿度:37.3%~51%)。对照组在采购当地抽取大鼠下腔静脉分离血浆样本,中、高海拔组分别于暴露1 d、3 d、7 d、15 d、30 d是采取血浆样本。
1.2 大鼠血浆样本收集
各组按照试验规定的时间点用20%的乌拉坦麻醉后抽取大鼠下腔静脉血3 mL,EDTAK2抗凝管内以3 000 r/min的转速离心10 min后分离血浆,于-80℃保存备用。
1.3 检测方法及试剂
根据试剂盒说明采用ELISA法分别测定各组血浆中IL-6、IL-8和IL-10水平(检测试剂盒均购自武汉优尔生科技股份有限公司)。
1.4 数据处理
2 结果
各组血浆IL-6水平 对照组IL-6为2.62 pg/mL±0.74 pg/mL,MA1、3、7 d组及HA各组与其比较,P<0.05。中、高海拔各组间比较,同一时间除30 d组外,HA组均高于MA组IL-6水平(表1、图1)。
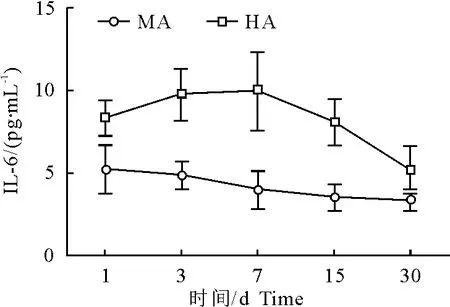
图1 中、高海拔组大鼠血浆IL-6检测结果
各组血浆IL-8水平 对照组IL-8为1.50 pg/mL±0.10 pg/mL,MA1、3、7 d组及HA各组与其比较,P<0.05。中、高海拔各组间比较,同一时间7 d及15 d组,HA组均高于MA组IL-8水平(表1、图2)。

图2 中、高海拔组大鼠血浆 IL-8检测结果
各组血浆IL-10水平 对照组血浆IL-10为10.57 pg/mL±0.10 pg/mL,MA中IL-10水平升高随后呈下降趋势,但各组仍均高于对照组(P<0.05);HA中各组均低于对照组(P<0.05),随时间延长呈下降趋势。同一时间HA各组均低于MA组血浆IL-10水平(P<0.05)(表1、图3)。
3 讨论

表1 中、高海拔不同暴露时间组大鼠IL-6、IL-8和IL-10检测结果
注:#与暴露1 d组比较P<0.05;●与暴露3 d组比较P<0.05;▲与暴露7 d组比较P<0.05;▼与暴露15 d组比较P<0.05,*与MA比较P<0.05。
Note:# Compared with the 1 d exposure groupP<0.05; ● Compared with the 3 d exposure groupP<0.05; ▲ Compared with the 7 d exposure groupP<0.05; ▼ Compared with the 15 d exposure groupP<0.05; * Compared with MA groupP<0.05.
氧是生命活动的必需物质,低氧会造成机体内环境一系列变化。缺氧指由于供氧不足或用氧障碍导致组织细胞代谢、功能和形态结构发生异常等一系列变化的病理过程[8],并且是存在于心功能衰竭、休克、呼吸衰竭、水肿中的最终病理过程。低氧通过会引起血管内皮等细胞释放活性物质,进而介导炎症反应的发生[11]。白介素最初是指由白细胞产生并作用于白细胞之间的一种细胞因子,现已证实白介素可以由多种细胞生成并作用于多种细胞之间。有研究报道,慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)急性加重期血清 IL-6、8、10、15与稳定期的比较均明显升高,并且外周血 T淋巴细胞计数与血清 IL-6、8、10、15水平均呈负相关[12],但IL-6、8、10、15的升高否和低氧有关仍不明确。

图3 中、高海拔组大鼠血浆 IL-10检测结果
IL-6被认为是一种典型的炎症因子代表,在炎症反应中变化较为敏感,参与机体的免疫反应及炎症反应,在局部及全身炎症反应中作为一项较为常用的指标而被研究者所熟悉。IL-6具有抗炎和促炎双向作用,其效应的发挥与其在机体中的浓度有关,当浓度处于较低水平时作为抗炎因子发挥保护机体的作用,但当较高或超过某一浓度时则发挥促炎作用并引发机体发生炎症反应[13],本研究主要探讨大鼠IL-6在高水平时的促炎作用与海拔及暴露时间的关系,结果显示,在中海拔低氧环境下,大鼠可能在急性低氧适应过程中炎症反应降低,但不存在长期影响,而高海拔低氧环境导致机体内炎症反应持续存在,且HA1组大鼠的IL-6水平较MA1组的高,提示IL-6水平在搞海拔比中海拔变化大,即随着氧浓度的降低,机体IL-6水平升高。结果与来顺等报道的关于不同海拔高度肺组织中IL-6水平的变化水平相一致[14],但血浆中IL-6的水平更能反映全身炎症反应的程度,而肺组织中IL-6水平更反应肺组织炎症反应的敏感性,因此本研究探讨血浆中白介素的变化规律反应海拔及暴露时间与机体炎症反应变化的整体趋势。
IL-8属于趋化因子家族成员之一,对以中性粒细胞为主的炎症细胞起到趋化作用,在某些介质的作用下使其定向运动到某一部位,进一步激活中性粒细胞释放活性产物导致机体炎症反应的发生,起到杀菌和损伤细胞的双向作用。已有研究报道,低氧环境下机体通过p38MAPK和NF-Кb途径增加IL-6和IL-8的浓度[15],也可通过HIF-1调控包括IL-8在内的促炎因子的表达[8]。本研究结果显示,将大鼠暴露于中、高海拔低氧环境下即可诱导IL-8的生成,促进机体炎症反应的发生。且HA1组的高于MA1组的水平,说明随海拔的升高及氧浓度的下降炎性反应加重,IL-8变化趋势与IL-6的一致。此外,高海拔组血浆IL-6、IL-8水平均于暴露7 d时达到最高界值点,提示高海拔低氧环境中前7 d机体内炎症反应达到极点,可能是由于在重度缺氧条件下机体炎症反应持续增强,第7天达到极点,随后随着机体对低氧环境的适应,炎性介质水平下降,机体炎症反应得以减轻。这一结果与复制高原动物模型的过程中,动物于前7 d死亡率最高的结论一致[16]。有报道显示,在高海拔缺氧条件下,IL-8暂时性上调[17],达到某一点后随时间延长呈现逐渐下降的趋势,因此推测可能是低氧诱导机体内释放的炎性因子导致了动物死亡。
IL-10属于抑炎因子的一种,此外还有一定的免疫调节功能,能够增强或抑制机体免疫功能。本研究中,中海拔低氧环境下,低氧适应的过程导致机体IL-6、IL-8水平升升高的同时抑炎因子IL-10水平也升高,可能对机体起到保护的作用。高海拔低氧环境下,IL-10水平反而下降,可能由于机体免疫反应受到限制,免疫细胞分泌抑炎因子的能力下降所致。此研究结果与不同缺氧程度下肺组织内IL-10水平变化一致[11]。
MA组大鼠血浆中IL-6、IL-8水平于前7天均高于对照组的水平,且呈逐渐下降的趋势,血浆中IL-10水平均高于对照组的。结果提示,中海拔低氧状态下机体促炎反应短期存在。因此中海拔低氧环境下机体促炎及抑炎反应均发挥作用,两者维持平衡状态保护机体免受损害。HA组的IL-10水平均低于对照组的水平,且IL-6、IL-8水平均于第7天达到最高值,随后呈下降趋势。有报道急性低压缺氧对细胞免疫功能有抑制作用,而对体液免疫功能没有影响,急性低压缺氧对细胞因子IL-1、IL-2 有抑制作用,而急性低压不缺氧对IL-1 、IL-2 却无影响,说明缺氧使细胞因子IL-1 、IL-2受到了抑制[18],这也提示在高海拔低氧环境中,IL-10水平的降低有也可能通过细胞免疫抑制,导致IL-10水平较正常或轻度低氧状态时低。但是机体的炎症刺激持续存在并呈上升趋势,当机体习服低氧环境后炎症反应逐渐降低。高海拔低氧损伤超出机体自身防御的抵抗范围,免疫系统功能受到抑制,不能抵抗外来病原微生物和低氧导致组织水肿、炎性细胞浸润、上调纤维化相关细胞因子表达、促进上皮细胞向间质细胞转化并增加细胞外基质沉积,提示低氧具有致纤维化作用导致组织器官受到损伤。从促炎因子的产生到抑炎因子的产生提示疾病病理变化的进展,促炎因子及抑炎因子的浓度也随着体内炎症反应的轻重而变化,因此在利用炎性因子进行低氧造成的损伤的相关治疗时需考虑到这一时间差问题[19]。
总之,大鼠血浆IL-6、IL-8和IL-10水平的变化提示不同程度低氧环境下机体炎症反应的程度甚至方向不同。轻度低氧促进炎症反应发生,重度低氧则抑制机体免疫功能;不同低氧环境下,轻度低氧时促炎因子逐渐降低并使内环境维持于平衡状态而保护机体;重度缺氧时,促炎因子上升后随着抑炎因子的作用反应性降低。促炎因子的水平受抑炎因子水平的影响,并且影响抑炎因子在机体内的浓度。因此在临床疾病的病理变化中,不能凭借单一的缺氧程度来评估机体的炎症反应程度,应根据疾病的严重程度或低氧程度来预测疾病的发展方向。
[1] Hafner C,Wu J,Tiboldi A,et al.Hyperoxia induces inflammation and cytotoxicity in human adult cardiac myocytes[J].Shock,2016,9:19.
[2] Wu X,Gu W,Lu H,et al.Receptor for advanced glycation end product ameliorates chronic intermittent hypoxia induced renal injury,inflammation,and apoptosis via P38/JNK signaling pathways[J].Oxid Med Cell Longev,2016:1015390.
[3] 何正平,谢 敏.低氧与致纤维化因子的关系[J].四川医学,2009,30(3):426-429.
[4] Manickam M,Tulsawani R.Survival response of hippocampal neurons under low oxygen conditions induced by hippophae rhamnoides is associated with JAK/STAT signaling [J].PLoS One,2014,9(2):e87694.
[5] Chang WenJ,Du Y,Zhao X,et al.Inflammation-related factors predicting prognosis of gastric cancer[J].World J Gastroenterol,2014,20(16):4586-4596.
[6] Cai M,Zhang X,Li Y,et al.Toll-like receptor 3 activation drives the inflammatory response in oxygen-induced retinopathy in rats[J].Br J Ophthalmol,2015,99(1):125-132.
[7] Yilmaz A,Ratka J,Rohm I,et al.Decrease in circulating plasmacytoid dendritic cells during short-term systemic normobaric hypoxia[J].Eur J Clin Invest,2016,46(2):115-122.
[8] Natarajan R,Fisher B J,Fowler A A.Hypoxia inducible factor-1 modulates hemin-induced IL-8 secretion in microvascular endothelium[J].Microvascular Res,2007,73(3):163-172.
[9] Lai Z,Kalkunte S,Sharma S.A critical role of IL-10 in modulating hypoxia-induced preeclampsia-like disease in mice[J].Hypertension,2011,57(3):505-514.
[10] Lei Xu,Pooja S.Hypoxia-induced activation of p38 mitogen- activated protein kinase and phosphatidylinositol 3'-kinase signaling pathways contributes to expression of interleukin8 inhuman ovarian carcinoma cells [J].Clin Cancer Res,2004,10(2):701-707. [11] 宗 峰,解伟平,王 虹.肺血管内皮细胞功能障碍与肺动脉高压[J].国际呼吸杂志,2009,29(6):370-374.
[12] 郭庆玲.慢性阻塞性肺疾病患者外周血CD4+和CD8+T淋巴细胞和GDF-15水平与其血清炎症因子水平的关系[J].实用医学杂志,2016(4):597-599.
[13] 张 岳.补肺益脾通窍汤对慢性鼻窦炎家兔模型IL6、IL-8的影响[J].中国临床研究,2015,7(5):4-5.
[14] 余来顺.不同海拔同一时间下大鼠肺组织白介素-6、白介素-8和白介素-10水平的变化[D].青海西宁:青海大学,2015.
[15] Wang C T,Lin H J,Cheng B C,et al.Attenuating systemic inflammatory markers in simulated high-altitude exposure by heat shock protein 70-mediated hypobaric hypoxia preconditioning in rats[J].J Formos Med Assoc,2015,114(4):328-338.
[16] 李晓栩,黄 瑊,谭小玲,等.复制慢性高原病动物模型实验教学中注意事项分析[J].现代医药卫生,2015,31(9):1410-1412.
[17] Patitucci M,Lugrin D,Pagès G,Angiogenic/lymphangiogenic factors and adaptation to extreme altitudes during an expedition to Mount Everest[J].Acta Physiol (Oxf),2009,196(2):259-265.
[18] 高 梅,王典瑞,徐 斌,等.5 km 急性低压缺氧及不缺氧对免疫系统的影响解放军预防医学杂志[J].1999,17(2):90-92.
[19] Shrivastava K,Llovera G,Recasens M,et al.Temporal expression of cytokines and signal transducer and activator of transcription factor 3 activation after neonatal hypoxia/ischemia in mice[J].Dev Neurosci,2013:35(2-3):212-225.
Study on the Three kinds of Interleukin Changes of in Rat Plasma at Different Altitude and Exposure Time
GU Yu-hai1,ZHENG Jing-jing2,XIE You-bang1
(1.QinghaiProvincialPeople'sHospital,Xining,Qinghai,810007,China;2.QinghaiUniversity,Xining,Qinghai,810007,China)
To investigate the effects of different altitudes and exposure time on the plasma levels of IL-6,IL-8 and IL-10 in Wistar rats,eighty eight male Wistar rats were randomly divided into control,medium altitude(MA) and high altitude(HA) groups.The blood of rats in MA and HA groups were collected at 1,3,7,15 and 30 days,interleukin levels of the plasma were detected by ELISA.The results showed the levels of IL-6 and IL-8 in the rats of MA group at the first,third and seventh days were higher than that in control group(P<0.05).The levels of IL-6 and IL-8 in rats of HA group were all higher than that in control group(P<0.05) and showed a down trend after reaching the peak at the seventh day while higher that in the control group.The levels of IL-10 in different time MA groups were higher than that in control group.The levels of levels of IL-10 in HA group at different time were lower than that in control group and showed a down trend (P<0.05).The levels of IL-10 in rats of HA group at different time were lower than that in MA group at the same time(P<0.05).The results suggested hypoxia environment caused inflammation in the rats at medium altitude.The inflammation enhanced on the seventh day and then came back to the initial level.High altitude environment can lead to significant inflammatory response in the rats.The inflammation was the most obvious on the seventh day.The inflammation and immunosuppressive reaction continuously existed.
Wistar rat; different altitude; different exposure time; interleukin
2016-11-21
青海省科技厅应用基础研究项目(2013-Z-741);青海省重点学科项目(呼吸科)(青财社字[2013]2578号)
顾玉海(1962-),男,主任医师,研究生导师,主要从事呼吸及高原病的基础及临床工作。 *通讯作者
S852.2
A
1007-5038(2017)05-0030-05
