静脉注射表达白细胞介素-12的HSV-1溶瘤病毒抗肿瘤机制的研究
2017-05-16秦晓伟李毅平
关 毅,秦晓伟,李毅平,赵 刚
(吉林大学第一医院 神经肿瘤外科,吉林 长春130021)
*通讯作者
静脉注射表达白细胞介素-12的HSV-1溶瘤病毒抗肿瘤机制的研究
关 毅,秦晓伟,李毅平,赵 刚*
(吉林大学第一医院 神经肿瘤外科,吉林 长春130021)
恶性肿瘤是一种严重威胁人类生命的疾病,据世界卫生组织公布数据显示,2012年全球新发癌症病人约1410万,病死率高达60 %左右[1]。虽然目前手术技术、放化疗和靶向药物等治疗手段方面均取得了显著的进步,但很难完全控制恶性肿瘤的侵袭、转移,导致病人治疗效果不佳。基因改造增殖裂解性I型单纯疱疹病毒,也叫HSV-I溶瘤病毒(onclytic HSV-I),是目前国际上恶性肿瘤治疗研究热点之一。在动物模型上,HSV-I溶瘤病毒被证明对胶质瘤、前列腺癌等多种恶性肿瘤具有明显的治疗效果[2,3]。溶瘤病毒传统给药方式是肿瘤内直接注射,在将来临床使用中有很大局限性。本研究的目的是通过静脉注射方式给药,在老鼠皮下肿瘤和脑肿瘤模型上,探讨HSV-I溶瘤病毒与表达白细胞介素12(IL-12)HSV-I溶瘤病毒的抗肿瘤机制。本研究使用的第三代HSV-I溶瘤病毒T-01(G47Δ-empty),是进一步将第三代HSV-I溶瘤病毒G47Δ ICP6区域基因打掉894对碱基,同时将表达鼠性融合型白细胞介素-12(IL-12)基因插入到ICP6区域而得到T-mfIL12。在体外乃至体内研究使用中,与G47Δ相比T-01的ICP6区域基因回复到野生型的几率进一步降低,从而安全性又得到提高[4]。
1 材料和方法
1.1 细胞和HSV-I溶瘤病毒质粒构建
低免疫原性小鼠Neuro2a (neuroblastoma)肿瘤细胞和Vero细胞购自美国ATCC公司,细胞培养如文献所述[2],每种细胞均定期检测,以防支原体感染。T-01(G47-empty)和T-mfIL12(表达鼠性IL-12的T-01)HSV-I溶瘤病毒质粒构建和增殖如文献所述[4],T-01是将第三代病毒G47Δ ICP6区域基因打掉894对碱基,同时将表达鼠性融合型IL-12基因插入到ICP6区域而得到T-mfIL12。利用Vero细胞采用空斑形成试验测定病毒质粒滴度。
1.2 皮下肿瘤动物模型建立
本研究所用5周龄雌性HSV-I敏感A/J小鼠购自日本Sankyo公司。肿瘤模型建立具体方法如文献所述[3],将5×106Neuro2a肿瘤细胞悬液(0.1 ml无血清DMEM/F12)注入A/J小鼠左侧肋腹部皮下,通常4天后会形成直径5 mm左右皮下肿瘤(我们定为day0),将小鼠随机分为3组(n=6),分别于day0、day2和day4实施治疗,通过小鼠尾静脉注射方式,分别将0.2 ml含有10%甘油PBS(对照组即mock组)、5×106pfu T-01和5×106pfu T-mfIL12(二者均为0.2 ml含有10%甘油PBS)注入小鼠体内,从第1次day0治疗开始,每周测量3次肿瘤体积和小鼠体重,肿瘤体积测算采用:体积(tumor volume)=长×宽×高(mm3)。当皮下肿瘤最大径≥24 mm时,处于人道主义终止实验。测量肿瘤体积同时测量小鼠体重。
1.3 脑肿瘤动物模型建立
脑肿瘤模型建立具体方法如文献所述[3],即通过立体定向方式将5×104Neuro2a肿瘤细胞悬液(5 μl无血清DMEM/F12)注入A/J小鼠右额叶内(day0),肿瘤细胞移植后第5、7、9天,通过尾静脉注射将上述相同治疗进行3次。从day0开始,观察老鼠生存期,死亡小鼠进行解剖,确认是否有脑肿瘤形成。1.4 尾静脉注射后小鼠体内脏器病毒分布测量
上述皮下肿瘤模型建立后,分别于day0、day2和day4尾静脉注射T-01,治疗结束后第1天(day5)收集皮下肿瘤、肺、肝、脾和脑(n=5)。DNA提取使用QIAamp DNA Mini Kit(QIAGEN公司),具体方法参考使用说明。采用real-time PCR测定病毒量(ABI Prism 7000),引物为:primer 1:5’-GTCCCGCCGAACGCATACAT-3’;primer 2:5’-CCTCTTCGCTATTACGCCAG-3’[5],50 μl反应体积包括18 μl dH2O,25 μl 2 x SYBR Green PCR Master Mix,1 μl 10 μM forward primer,1 μl 10 μM reverse primer,和 5 μl样品DNA。反应条件:95℃10 min;95℃15 s,60℃1 min,共40循环。病毒检出界限为100 pfu/mg,未治疗皮下肿瘤组织混有各种浓度T-01作为定量标准。最后结果由ABI Prism 7000软件测定
1.5 ELISA测定血清中IL-12和IFN-γ
皮下肿瘤建立后day0时三组分别静脉注射治疗1次,day1麻醉A/J小鼠,采取内眼睑静脉丛血(n=3),使用Mouse IL-12 p70 Immunoassay Kit (R&D)和Mouse IFN-γ ELISA Kit (ENDOGEN)分别测定血清中IL-12和IFN-γ含量。
1.6 统计学方法
皮下肿瘤体积测定分析采用t-test检验;脑肿瘤生存期分析采Kaplan-Meier法及Breslow-Gehan-Wilcoxon检验。
2 结果
2.1 静注HSV-I溶瘤病毒明显抑制皮下肿瘤生长
day14实验结束时,三组A/J小鼠皮下肿瘤平均体积:T-mfIL12组仅为2 100 mm3±930 mm3,T-01组为4000 mm3±389 mm3,而对照组mock组则为6 000 mm3±354 mm3,从day7到day14,3组间均有明显统计学意义(P<0.001)。结果说明HSV-I溶瘤病毒经静脉投药,具有显著抗肿瘤效果,而IL-12还可明显增强治疗效果(图1)。同时小鼠体重结果显示3组间无明显差别(P>0.05,结果未显示),我们没有观察到3组小鼠出现较明显的全身或神经毒性等副作用。

图1 A/J小鼠Neuro2a皮下肿瘤模型形成后(Day0),分别于day0、day2和day4通过尾静脉注射,分别将0.2 ml PBS(对照组即mock组)、5×106pfu T-01和T-mfIL12注入小鼠体内。day14实验结束时,T-01组(4000±389 mm3)皮下肿瘤体积明显小于对照组(mock组,6000±354 mm3),而T-mfIL12组(2100±930 mm3)又明显小于T-01组,从day7到day14,3组间均有明显统计学意义(P<0.001,t-test)。
2.2 静注T-mfIL12溶瘤病毒可明显延长脑肿瘤小鼠生存期
T-mfIL12组(平均生存期19±6.64天)与对照组mock组(平均14±3.94天)相比明显延长,有统计学意义(P<0.05),但与T-01组(平均18±7.25天)相比生存期无明显延长(P>0.05),T-01组与mock组之间也没有统计学意义(P>0.05)。所有死亡小鼠经解剖均明确证实有脑肿瘤生长(图2)。
2.3 静注投药皮下肿瘤内溶瘤病毒含量明显高于其他脏器
为了探讨静脉投药溶瘤病毒在小鼠体内脏器分布情况,在小鼠皮下肿瘤模型3次治疗结束后day 5,我们利用real-time PCR对各脏器内病毒含量进行测定。结果发现皮下肿瘤内溶瘤病毒含量最高,平均达1031pfu/mg,而肺、肝、脾、肾和脑内病毒平均含量仅为100-300 pfu/mg左右,明显低于皮下肿瘤内病毒含量。
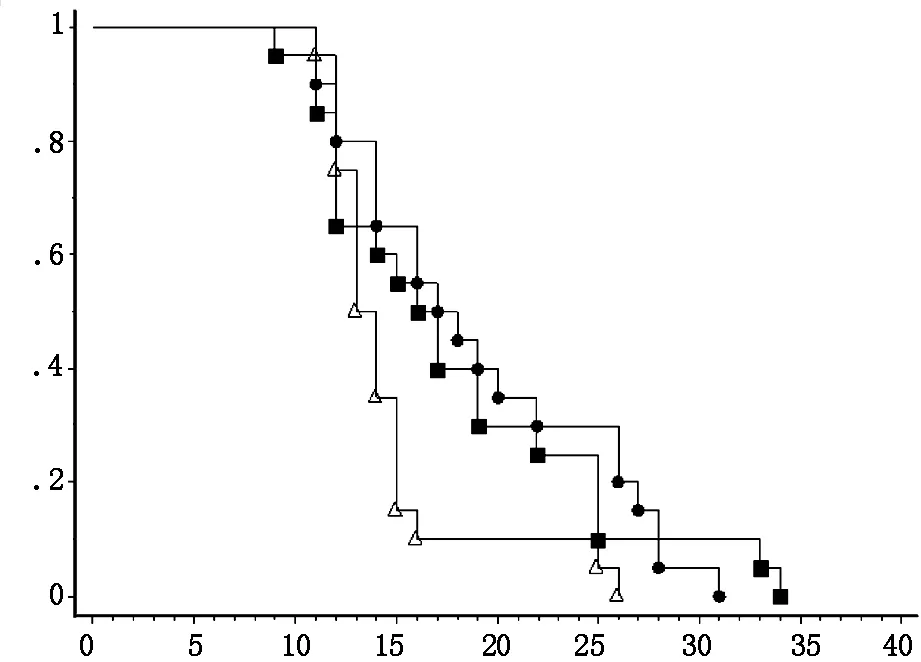
图2 A/J小鼠脑肿瘤模型建立(day0)后,于第5、7、9天,通过尾静脉注射HSV-1溶瘤病毒治疗3次(同皮下肿瘤模型)。T-mfIL12组(■)与对照组mock组(Δ)相比生存期明显延长(P<0.05),但与T-01组(●)相比生存期无明显延长(P>0.05),T-01组与mock组之间也没有统计学意义(P> 0.05)。
2.4 静注T-mfIL12溶瘤病毒明显促进IFN-γ分泌表达
皮下肿瘤模型静注治疗1次后小鼠釆血测定发现,T-mfIL12组血清中IL-12表达量为518 pg/ml,而其他2组未发现IL-12表达。同时T-mfIL12组血清中IFN-γ表达高达3989pg/ml,T-01组中IFN-γ表达为174 pg/ml,mock组最少仅为115 pg/ml。结果说明静脉投药,T-mfIL12可有效分泌表达IL-12,而IL-12又可显著促进血清中IFN-γ表达,达到抗肿瘤目的。
3 讨论
溶瘤病毒(oncolytic virus)疗法,是近些年来国际上恶性肿瘤治疗研究的热点之一。已应用临床研究的主要有I型单纯疱疹病毒(HSV-1)、腺病毒、麻疹病毒、新城疫病毒、呼肠孤病毒和牛痘病毒等[6,7]。HSV-1与其他病毒相比,具有很多优势和特点:①能感染几乎人类的所有细胞,宿主范围广;②能以较低病毒滴度感染杀死肿瘤细胞,且病毒复制周期短,仅需9到18小时便可产生大量子代病毒有效裂解肿瘤细胞;③与肿瘤选择性有关的多个病毒复制非必需基因已被证明,有利于病毒载体的改造;④病毒基因组大(152Kb),允许携带较长或多个外源目的基因;⑤病毒感染后可诱导机体产生长效的CD4+T细胞和CD8+T细胞抗肿瘤免疫应答;⑥安全性较高,病毒感染后并不整合到宿主细胞基因组中,而且已研制出多种有效抗疱疹病毒药物;⑦HSV-1 病毒疗法与现有放化疗并不拮抗,联合应用还可增强疗效[8]。
基因改造溶瘤病毒主要集中于与病毒病原性和DNA合成酶有关基因。代表性第二代HSV-I溶瘤病毒G207改造2个位点,一是敲除γ34.5基因,正常细胞感染HSV-I病毒后,细胞中双链RNA依赖蛋白激酶(PKR)磷酸化,包含病毒的蛋白质合成被阻断,γ34.5基因产物可拮抗这种PKR磷酸化,而合成病毒蛋白质,缺失γ34.5基因的HSV-1在正常细胞中不能复制增殖,但癌细胞本来的PKR活性低下,因此缺失γ34.5基因的HSV-1可在癌细胞中增殖。二是将lacZ插入ICP6编码区,使病毒复制关键酶之一核糖核苷酸还原酶(RR)失活,HSV-1不能在正常细胞中复制,但在增殖旺盛的癌细胞中,RR活性明显上升,可以代偿提供给RR已失活的HSV-1,使其复制增殖。通过以上基因改造,HSV-I溶瘤病毒就可以特异性选择在恶性肿瘤细胞中增殖。与只改造一处基因位点的第一代HSV-I溶瘤病毒相比,靶向性和安全性得到了很大的提高,因为病毒在细胞中复制增殖过程中回复到野生型病毒可能性大大降低。第三代溶瘤病毒G47Δ将G207的Δ47基因敲除,使感染细胞MHC-I表达明显增高,从而使肿瘤抗原呈递和抗肿瘤免疫性大大增加,研究证实G47Δ复制杀伤肿瘤细胞能力较G207显著提高[2,8]。本研究使用HSV-I溶瘤病毒如前文所述由G47Δ衍生而来。
目前国内外应用HSV-I溶瘤病毒主要通过瘤内注射,虽可使病毒最大限度在肿瘤细胞中增殖且不易发生扩散,但对很多深部肿瘤如颅内肿瘤,则存在诸多不便[9]。虽然现在神经导航和神经外科立体定向技术发展迅速,准确性和安全性有充分的保证,但在临床实际工作中,反复多次向颅内、特别是深部胶质瘤内直接注射投药,易引起肿瘤出血,也大大加重病人痛苦。本研究首先在小鼠皮下肿瘤模型上,探讨HSV-I溶瘤病毒经静脉注射投药的抗肿瘤效果。结果发现,T-01治疗组中肿瘤体积明显小于对照组(mock),有明显的统计学意义(P<0.001)。而且通过表达IL-12还可显著增强抗肿瘤效果(T-mfIl12 vs T-01:P<0.001,图1)。利用real-time PCR对各脏器内病毒含量测定发现,皮下肿瘤内病毒含量(平均1031 pfu/mg)明显高于肺、肝、脾、肾和脑等脏器(平均含量仅为100-300 pfu/mg)。这说明静脉注射方式用药,HSV-I溶瘤病毒可到达并进入肿瘤内部,且特异性选择在恶性肿瘤内大量复制增殖,进而裂解杀伤肿瘤细胞。其次,小鼠脑肿瘤模型治疗结果发现,只是T-mfIL12组的生存期与对照组相比有明显的延长(P<0.05),T-01组与对照组比没有统计学意义(P>0.05,图2)。我们考虑有以下原因:①病毒静注投药可能很难通过血脑屏障;②模型建立后第5、7、9天治疗3次,第11天小鼠出现死亡,治疗开始时间可能过晚,溶瘤病毒还未充分起效。同时我们没有发现因静注溶瘤病毒出现小鼠体重明显下降和神经毒性反应,说明病毒经静脉投药安全性有保障,提示我们未来病毒静脉注射方式投药,可能应用于神经外科临床工作中。
研究证明HSV-I溶瘤病毒可激起抗肿瘤免疫反应,受此启示人们将免疫治疗基因插入到病毒中以增强抗肿瘤效果。病毒在肿瘤细胞内增殖扩增过程中,不断分泌表达免疫因子,与普通质粒相比目的基因表达量高出数倍至数百倍。目前临床研究工作中IL-12被认为是最有效的抗肿瘤因子,它可以激活NK细胞、T淋巴细胞和巨噬细胞、促进DC成熟、抑制血管形成等[11,12]。可诱导产生干扰素-γ(IFN-γ)和其它免疫因子,表现出强大抗肿瘤效果。本研究证实,静脉注射表达IL-12的溶瘤病毒可有效表达IL-12,并且IL-12可诱导产生大量的IFN-γ,能显著增强HSV-I的抗肿瘤效果。有研究证实静注HSV-I溶瘤病毒可产生抗HSV-I抗体,我们前期研究工作证实抗HSV-I抗体可减弱静脉注射病毒的疗效,但有研究显示提高注射病毒剂量可拮抗这种作用。
总之,我们研究证实静脉注射HSV-I溶瘤病毒,可有效进入肿瘤内并裂解杀伤肿瘤细胞,同时病毒还可激起抗肿瘤免疫反应,IL-12可显著增强抗肿瘤免疫反应。研究证实HSV-I溶瘤病毒和现行的放化疗治疗并不拮抗,联合用药可明显增强疗效[8,13,14]。随着研究进一步深入,HSV-I溶瘤病毒经静脉注射用药可能应用于神经外科治疗胶质瘤工作中,将大大拓宽其临床使用范围和提高应用价值。我们相信HSV-I溶瘤病毒在治疗恶性脑肿瘤工作中会有美好的发展前景。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012 [J].Int J Cancer,2015,136(5):359.
[2]Todo T,Martuza RL,Rabkin SD,et al.Oncolytic herpes simplex virus vector with enhanced MHC class I presentation and tumor cell killing [J].PNAS,2001,98(11):6396.
[3]Todo T,Rabkin SD,Sundaresan P,et al.Systemic antitumor immunity in experimental brain tumor therapy using a multimutated,replication-competent herpes simplex virus [J].Hum Gene Ther,1999,10(17):2741.
[4]Fukuhara H,Ino Y,Kuroda T,et al.Triple gene-deleted oncolytic herpes simplex virus vector double-armed with Interleukin 18 and Soluble B7-1 constructed by bacterial artificial chromosome-mediated system [J].Cancer Res,2006,65(23):10663.
[5]Todo T,Feigenbaum F,Rabkin SD,et al.Viral shedding and biodistribution of G207,a multimutated,conditionally replicating herpes simplex virus type 1,after intracerebral inoculation in aotus [J].Mol Ther,2000,2(6):588.
[6]Russell SJ,Peng KW,Bell JC.Oncolytic virotherapy [J].Nat Biotechnol,2012,30(7):658.
[7]Eager RM,Nemunaitis J.Clinical development directions in oncolytic viral therapy [J].Cancer Gene Ther,2011,18 (5):305.
[8]Todo T.“Armed” oncolytic herpes simplex viruses for brain tumor therapy [J].Cell Adhesion & Migration ,2008,2(3):208.
[9]Varghese S,Rabkin SD.Oncolytic herpes simplex virus vectors for cancer virotherapy [J].Cancer Gene Ther,2002,9(12):967.
[10]Hirasawa K,Nishikawa SG,Norman KL,et al.Systemic reovirus therapy of metastatic cancer in immune-competent mice [J].Cancer Res,2003,63(2):348 .
[11]You CX,Shi M,Liu Y,et al.AAV2/IL-12 gene delivery into dendritic cells (DC) enhances CTL stimulation above other IL-12 applications:Evidence for IL-12 intracrine activity in DC [J].Oncoimmunology,2012,1(6):847.
[12]Yao L,Pike SE,Setsuda J,et al.Effective targeting of tumor vasculature by the angiogenesis inhibitors vasostatin and interleukin-12 [J].Blood,2000,96(5):1900.
[13]Chahlavi A,Todo T,Martuza RL,et al.Replication-competent herpes simplex virus vector G207 and cisplatin combination therapy for head and neck squamous cell carcinoma [J].Neoplasia,1999,1(2):162.
[14]Lin E,Nemunaitis J.Oncolytic viral therapies [J].Cancer Gene Ther,2004,11(10):643.
1007-4287(2017)04-0692-04
2016-07-13)
