超声影像组学对浸润性乳腺癌激素受体表达预测价值的探索性研究
2017-05-15李佳伟时兆婷胡雨舟乔梦云余锦华汪源源周世崇
李佳伟,时兆婷,郭 翌,胡雨舟,乔梦云,余锦华,汪源源,周世崇,常 才
1. 复旦大学附属肿瘤医院超声科,复旦大学上海医学院肿瘤学系,上海 200032;2. 复旦大学电子工程系,上海 200433
超声影像组学对浸润性乳腺癌激素受体表达预测价值的探索性研究
李佳伟1,时兆婷1,郭 翌2,胡雨舟2,乔梦云2,余锦华2,汪源源2,周世崇1,常 才1
1. 复旦大学附属肿瘤医院超声科,复旦大学上海医学院肿瘤学系,上海 200032;2. 复旦大学电子工程系,上海 200433

李佳伟,复旦大学附属肿瘤医院主治医师。2006年7月毕业于西安交通大学医学院,获取临床医学专业本科学历,2009年2月硕士毕业于香港理工大学医疗科技与资讯学系,2012年博士毕业于香港中文大学麻醉学系。2013年1月至2014年7月于香港中文大学麻醉学系从事高级研究员工作。2015年7月年完成放射影像学住院医师规范化培训,2016年7月完成肿瘤超声住院医师培训,现为复旦大学附属肿瘤医院超声科主治医师。对乳腺及甲状腺等浅表器官常见疾病的超声诊断积累了一定经验。其教育和工作经历体现了医工结合,多学科交叉的特点。主要社会任职有海医会超声医学专家委员会青年委员会青年委员,美国超声医师协会会员。发表国内外专业论文20多篇,会议论文30多篇,参与书籍《乳腺原位癌的超声诊断》《Musculoskeletal Ultrasound for Regional Anaesthesia and Pain Medicine》等的编写。
目的:探讨超声影像组学定量特征对浸润性乳腺癌激素受体表达的预测价值。方法:回顾性分析204例浸润性乳腺癌患者的术前超声图像及术后病理结果。根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor 2,HER-2)表达,将患者分为两组:激素受体阳性组(ER+、PR+、HER-2-),激素受体阴性组(ER-、PR-、HER-2-)。两名具有5年以上临床经验的超声科医师对乳腺癌肿块超声图像进行回顾性特征分析与评估,评估内容包括肿块的形态、边缘、内部回声、后方回声改变及钙化。然后,对同一个肿块利用基于相位信息的动态轮廓模型进行边缘分割。通过t检验,筛选出与激素受体相关性最强的特征参数,通过支持向量机分类器,运用径向基核函数进行分析与研究。为减少偏倚,采用留一法对分类性能进行验证。结果:激素受体阳性组与阴性组在形态、边缘毛刺成角、内部回声及后方回声改变等二维特征方面存在显著统计学差异(P<0.05)。定量分析选出54个定量特征,对激素受体表达具有较高准确率(准确率67.7%,曲线下面积73.2%)。此外,边缘、内部回声、后方回声及钙化等定量特征在激素受体阳性与阴性组之间均存在显著统计学差异(P<0.05)。结论:超声影像组学定量特征分析降低了传统超声影像的主观性,在预测浸润性乳腺癌激素受体表达方面具有较大优势,其在提高超声影像学特征对乳腺癌精准诊断及生物学行为预测方面的价值仍需进一步研究。
影像组学;定量超声特征;激素受体;浸润性乳腺癌
在中国乃至世界范围内,乳腺癌发病率位居女性癌症的首位。根据其分子标记的表达及生物学行为,可分为几种临床亚型[1-2],这些基于分子生物学的分型是临床上选择最适当治疗方法的重要参考,并在个体化治疗方面颇有价值[2-5]。在所有分子标记中,雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2 (human epidermal growth factor receptor 2,HER-2)的表达状态在个体化治疗决策中最重要,已有针对这些分子标记阳性表达的内分泌治疗及靶向治疗。然而,对于某些类型乳腺癌,如三阴性乳腺癌(triple negative breast cancer,TNBC),以上3个受体均缺乏表达,尚无针对性治疗,仅限于一般的细胞毒性化疗药物。TNBC往往肿块较大,分化级别较高,淋巴结转移概率较大,预后较差[4]。因此,能及早发现并鉴别诊断此类恶性程度高的乳腺癌对患者预后及临床诊治均有较大指导价值。目前,明确这些分子标记的表达主要依靠穿刺标本或手术切除肿块的免疫组织化学分析。
活检或手术标本检测只采取一部分肿瘤样本组织,存在一定的局限性,因为其忽略了肿瘤尤其是较大肿块可能存在的异质性[6]。影像学成像可提供肿瘤组织整体性解剖和功能特性,如大小、形状、边缘形态、内部回声或增强程度[7]。文献报道,ER阳性表达的乳腺癌往往表现为边缘模糊不光整及后方回声衰减,TNBC通常表现为边缘较光整和后方回声增强[8-14]。但文献报道结果不尽相同,且这些二维特征均为主观性判断,缺乏影像组学的定量分析。
目前,影像学已逐渐向自动化数据特征分析及高通量特征提取方向发展,即影像组学[15-17],其理论依据是不同患者肿瘤之间、同一患者不同肿瘤组织之间或同一肿瘤内部均存在基因异质性,这些基因异质性表现为不同的影像学表型。关于乳腺癌影像组学研究主要集中于MRI纹理分析对新辅助化疗的效果预测等方面[18-19],尚未有关于乳腺癌超声影像组学与免疫组织化学分子标记相关性研究。本研究旨在探索定量超声影像学特征对浸润性乳腺癌激素受体表达的预测价值。
1 资料和方法
1.1 研究对象
收集2014年4月—2016年6月于复旦大学附属肿瘤医院接受乳腺癌手术的411例患者并对其临床资料进行回顾性研究。收集内容包括术前超声图像及描述、手术方式和术后病理诊断资料。入选标准:女性,初发及单发乳腺癌结节,未接受术前新辅助化疗,术后石蜡病理证实为浸润性乳腺癌。根据肿块的免疫组织化学表达,选取HER-2阴性、ER和PR均阳性或均阴性的患者,最终204例入组。所有临床报告均由同一研究者分析校对。本研究获得复旦大学附属肿瘤医院伦理委员会的批准及对患者知情同意书的豁免。
1.2 仪器与二维超声图像特征分析
选用SUPERSONIC公司Aixplorer及GE公司Logiq E9超声仪器,探头频率6~13 MHz,超声检查按乳腺检查规范进行。根据每个患者的条件调节仪器频率、增益及时间增益补偿(time gain compensation,TGC)曲线以达到最佳灰阶超声成像质量,深度范围及焦点根据结节的深度调节。每个乳腺肿块的超声图像选取一帧以DICOM形式存储。两名具有5年以上临床经验的超声科医师对超声图像进行回顾性特征分析与评估,其对患者其他临床资料均不知情。对肿块的评价指标,按2013年乳腺影像报告和数据系统(Breast Imaging Reporting and Data System,BI-RADS)超声影像词典:形态、边缘、内部回声、后方回声改变及钙化[20]。对肿块定性分析出现不一致的患者,由两名医师共同讨论达成一致后记录数据资料。
1.3 超声影像组学特征分析
乳腺癌超声图像由计算机辅助定量分析。每个肿块先利用基于相位信息的动态轮廓模型(phase-based active contour,PBAC)进行分割[21]。该模型利用具有相位信息的能量方程,使其最小化可自动提取肿块的边界信息。对某些极其不规则及对比度差的肿块,如果自动分割肿块边界的效果较差,则改用手动分割方法来提取肿块边界。每一幅超声图像提取的特征共463个,分为四大类:形态、强度、质地、小波特征[22-24]。通过t检验,筛选出54个与激素受体相关性最强的特征参数,涵盖乳腺癌大小、形态、边缘、内部回声、后方回声及钙化等二维特征分类。具体描述如下:① 大小:肿块的面积。② 形态:肿块的坚固度,为肿瘤面积与其外接凸包面积的比,比值越大提示肿块形态规则的可能性越大。③ 边缘:5个特征用来描述肿块的边缘,其中边缘粗糙度最具特征性,为归一化的纵向长度直方图的熵[25]。粗糙度越大,边缘不光整程度越高。④ 内部回声:40个基于灰度共生矩阵(gray level co-occurrence matrix,GLCM)、灰度区域矩阵(gray level size zone matrix,GLSZM)、灰度游程矩阵(gray level run length matrix,GLRLM)、局部灰度差分矩阵(neighborhood gray-tone dif f erence matrix,NGTDM)及其小波分解的图像特征用来描述肿块的内部回声,其中NGTDM粗糙度与激素受体表达最相关,值越大提示肿块的不均质程度越高。⑤ 后方回声:肿块后方回声与周围区域回声的差值。⑥ 钙化:6个基于直方图的特征,其中定量分析中小波分解垂直分量的直方图能量相关性最高。
1.4 乳腺癌组织学特征
所有乳腺癌标本记录大小后经石蜡包埋,进行 4 μm 厚切片,对其进行常规苏木精-伊红(hematoxylin-eosin,HE)染色及免疫组织化学检查。HE染色标本记录内容包括病理类型、组织学分级、脉管内癌栓、乳头内癌栓。组织学分级分3类:Ⅰ级(高分化)、Ⅱ级(中分化)、Ⅲ级(低分化)[26-27]。ER、PR、HER-2、Ki-67表达的检测采用SP法,实验步骤严格按说明书进行。ER、PR及Ki-67 表达情况依细胞核着色情况进行判定,细胞核中出现棕黄色颗粒者为着色阳性细胞,视野中肿瘤细胞核着色细胞数<1%为阴性,≥1%为阳性[2]。HER-2 表达情况根据CerbB-2 结果进行判定,结果为-或+者为 HER-2 阴性,+++者为 HER-2 阳性。++为HER-2不确定患者,进一步用荧光原位杂交(fluorescence in situ hybridization,FISH)进行HER-2基因扩增状态检测。FISH技术通过荧光标记的DNA探针与细胞核内的DNA靶序列杂交,在荧光显微镜下观察并分析细胞核内杂交于DNA靶序列的探针信号,以获得细胞核内染色体(或染色体片段)中基因状态的信息。所有病理信息及免疫组织化学信息均从患者术后病理报告中获取并记录。Ki-67阳性表达以细胞核内出现棕黄色颗粒为标准,<20%为低表达,≥20%为高表达[2]。
根据ER、PR、HER-2 表达,将患者分为两组:激素受体阳性组(ER+、PR+、HER-2-,包括所有Luminal A型及部分Luminal B型),激素受体阴性组(ER-、PR-、HER-2-,即三阴性)。
1.5 统计学处理
统计学分析采用SPSS 18.0及Matlab R2015b。对连续性变量,首先用Kolmogorov-Smirnov检验数据的正态性,然后根据数据分布特点选用均数(标准差)或中位数(四分位数)。分类变量用频数(%,百分比)表达。t检验用于定量数据的比较,卡方检验用于分类数据的比较,P<0.05为差异有统计学意义。计算机定量分析中,t检验用于筛选与激素受体表达最相关的特征,然后将筛选出来的特征输入支持向量机(support vector machine,SVM)分类器,采用径向基核函数进行分析与研究。由于所使用的数据库相对较小,为减少偏倚,采用留一法对分类性能进行验证。预测效能用准确率、灵敏度、特异度及受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)来评估[28]。
2 结 果
2.1 患者基本信息
表1为患者基本信息、手术方式及术后病理总结。204例患者平均年龄为52.0岁(标准差11.3岁)。激素受体阳性组153例,占75%,平均年龄52.4岁(标准差11.5岁),其中Luminal A型77例、Luminal B型76例;激素受体阴性组51例,占25%,平均年龄50.8岁(标准差10.9岁)。激素受体阳性组与阴性组患者年龄差异无统计学意义(P=0.387)。两组患者的手术方式、病理类型、淋巴结转移情况、脉管内癌栓及乳头内癌栓均无统计学差异(P>0.05)。
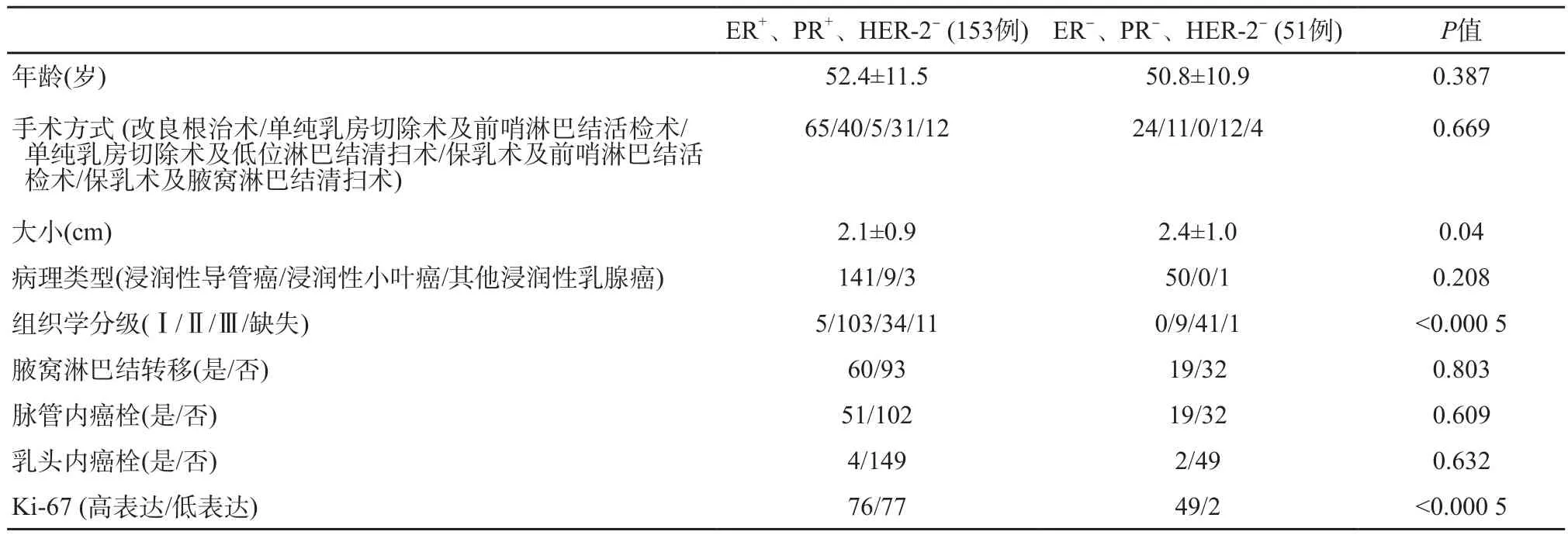
表1 患者基本信息、手术方式及术后病理
两组患者的肿瘤大小有统计学差异,激素受体阴性组肿块(均值2.4 cm)大于阳性组(均值2.1 cm,P=0.04)。激素受体阳性组肿瘤76.1%为组织学Ⅰ~Ⅱ级,23.9%为组织学Ⅲ级;激素受体阴性组肿瘤18.0%为组织学Ⅰ~Ⅱ级,82.0%为组织学Ⅲ级,差异有统计学意义(P<0.05)。此外,激素受体阴性组中Ki-67高表达患者比例(96.1%)明显高于激素受体阳性组(49.7%,P<0.05)。
2.2 乳腺癌超声特征分析及其与激素受体表达的关系
表2总结了乳腺癌肿块形态、边缘、内部回声、后方回声、钙化等定性特征在激素受体阳性组和阴性组患者中的分布。两组在形态、边缘毛刺成角、内部回声及后方回声改变等二维特征方面存在显著统计学差异 (P<0.05)。运用定量超声图像分析为每个二维特征选取一个最具代表性的定量特征并与激素受体表达相关联(表3)。除外形态,所有特征性指标在激素受体阳性与阴性组之间均存在显著统计学差异(P<0.05)。表4总结了所有定量超声特征对激素受体表达的综合评估(准确率57.4%~66.7%,AUC 56.0%~72.2%),内部回声的40个代表性特征对激素受体表达预测具有最高的准确率(66.7%)及AUC (72.2%),另外54个定量特征的联合分析更提高了对激素受体表达预测的准确率(67.7%)及AUC (73.2%)。
二维特征结果如下:① 大小:受体阳性组肿块的病理标本小于阴性组,有显著性差异[(阳性组(2.1±0.9) cm,阴性组(2.4±1.0) cm,P=0.04)]。定量分析也发现阳性组肿块面积小于阴性组(P=0.004)。② 形态:不规则形肿块在激素受体阳性组和阴性组中分别占91.5%、74.5%,有统计学差异(P=0.007),提示激素受体阴性组肿块更易表现为形态规则。定量分析中,两组的坚固度无统计学差异(P=0.181)。③边缘:肿块边缘不光整在激素受体阳性组和阴性组中分别占94.1%、90.2%,差异无统计学意义(P=0.337)。但边缘出现毛刺成角或微小分叶的肿块在激素受体阳性组所占比例(26.8%)高于阴性组(3.9%),差异有统计学意义(P=0.001)。定量分析中,激素受体阳性组边缘粗糙度高于受体阴性组(P=0.015)。④ 内部回声:两组中大部分肿块表现为低回声,实质混合性及囊实性肿块在激素受体阴性组出现的比例(17.6%)高于阳性组(8.5%,P=0.042)。定量分析中,激素受体阳性组肿块粗糙度高于受体阴性组(P<0.001)。⑤ 后方回声改变:两组大部分肿块表现为后方回声无改变,但激素受体阳性组后方回声衰减的比例(16.3%)高于后方回声增强(10.5%),激素受体阴性组后方回声增强的比例(33.3%)高于后方回声衰减(3.9%),差异均有统计学意义(P<0.000 5)。定量分析中,激素受体阳性组肿块后方回声低于周围区域,而阴性组肿块后方回声高于周围区域(P<0.000 1)。⑥ 钙化:钙化在激素受体阳性组和阴性组出现的比例分别为25.5%、25.5%,差异无统计学意义(P=1.0)。但定量分析中,激素受体阳性组中小波分解垂直分量的直方图能量低于阴性组(P=0.006)。
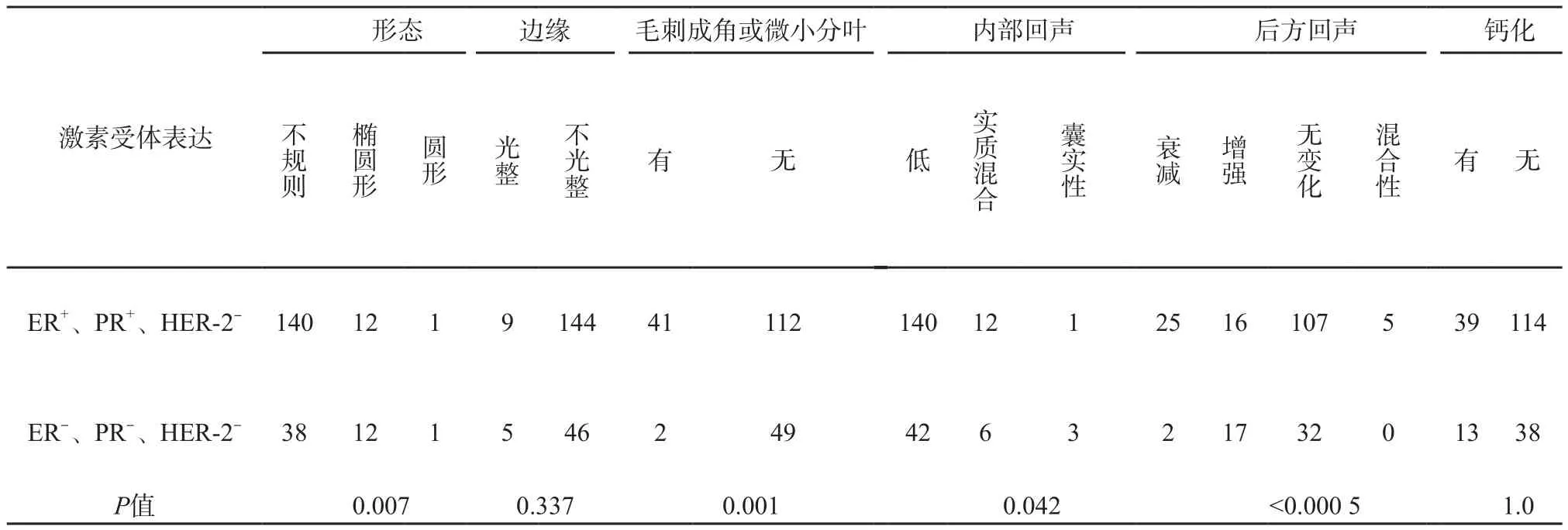
表2 二维超声图像特征与激素受体表达的关系
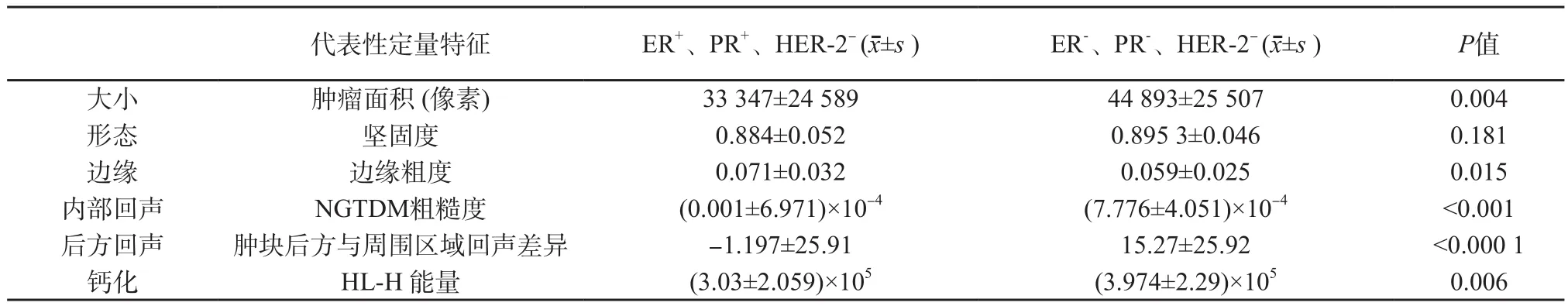
表3 定量超声图像特征与激素受体表达的关系
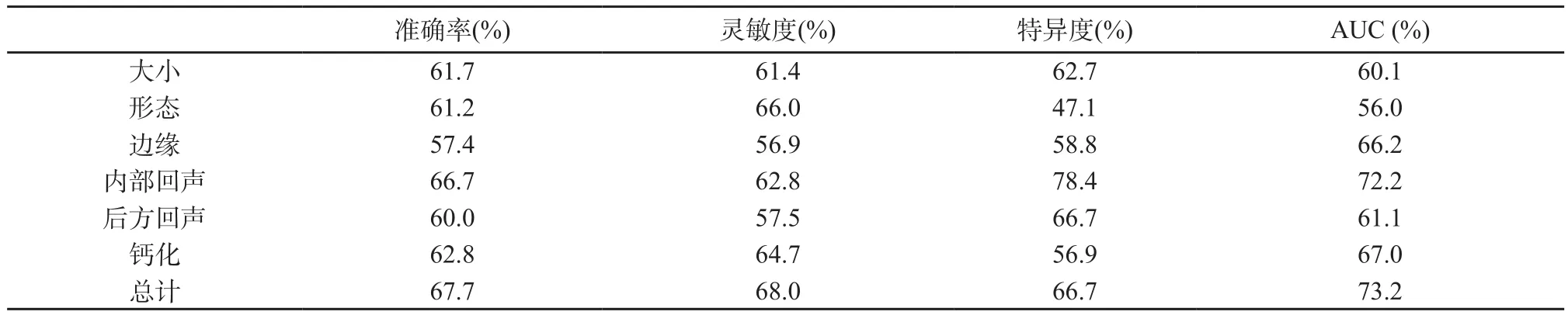
表4 运用留一法对乳腺癌肿块各个形态特征的分类性能评价
3 讨 论
随着化疗、内分泌治疗及靶向治疗的发展,乳腺癌的死亡率明显下降。除治疗方法的发展,影像学检查对乳腺癌的早期发现也有不可忽视的作用。影像学检查为乳腺癌诊断首选方法,但临床应用中其仅提供主观性、半定量信息。目前,影像学的发展已趋向于对肿瘤图像进行自动化数据特征分析及高通量特征提取,即影像组学。通过大量自动化数据特征化算法,将感兴趣区的影像数据转化为具有高分辨率的可发掘的特征空间数据。影像组学研究主要集中于对CT、MRI及PET/CT定量图像的定量特征分析[29-33]。研究表明,其可在很多方面辅助临床决策,如辅助前列腺癌明确诊断[30],预测肝癌[31]、脑胶质细胞瘤[34]及肺癌的预后[15],辅助肝癌个体化治疗选择[33],评估乳腺癌新辅助化疗效果[18-19]等。本研究初步探索了超声影像组学特征分析在浸润性乳腺癌中的应用,通过分析超声影像组学特征与分子标记的关系,发现超声影像组学定量特征对激素受体表达有一定预测价值。
本研究发现激素受体阳性组肿块较阴性组小,组织学分级低,Ki-67表达水平低,与文献报道一致[8,13]。临床研究也表明,激素受体阳性及HER-2阴性乳腺癌亚型的预后较好,激素受体阴性及HER-2阴性乳腺癌亚型的预后较差[4]。分子分型是乳腺癌治疗及预后预测的重要参考,在个体化治疗方面颇有价值[2-3]。分子标记表达与否及表达水平可导致肿瘤图像特征差异[14,35-36],这些均构成超声影像组学的发展基础。
本研究利用超声影像组学特征分析,对浸润性乳腺癌的形态、边缘、内部回声、后方回声、钙化特征进行定量分析。二维超声图像中,肿块的特征分类均为主观性,例如形态只分规则及不规则,边缘只分光整及不光整,内部回声及后方回声判读带有很大的主观性。而影像组学定量分析可克服二维超声主观性强的缺点,将肿瘤的图像特征定量性地提取出来,尤其经小波分析可提取隐藏在超声二维图像信号中的信息。本研究显示,大部分定量特征在激素受体表达阳性组与阴性组之间有显著性差异,所有特征的结合增加了对激素受体表达的预测价值,充分显示了影像组学定量特征分析相较于传统超声的优势所在。激素受体阳性组更多表现为形态不规则、边缘不光整、内部回声偏高、后方回声衰减的肿块,而阴性组更多表现为形态规则、边缘光整、内部低回声、后方回声增强的肿块,与文献报道基本一致[8,11-12,14,37-38]。
激素受体阴性组肿块更多表现为边缘光整[11-12],激素受体阳性组肿块更多表现为边缘毛刺成角或微小分叶[8,14]。可能原因为激素受体阳性肿块往往表现为低级别,细胞增殖慢,肿瘤与宿主相互作用,周围纤维结缔组织增生形成,导致肿块边缘不光整,甚至毛刺成角;相反,激素受体阴性肿块往往为高级别,细胞增殖快,肿瘤细胞与宿主缺乏相互作用[13]。肿块内部回声在二维超声中很难准确评估与分类,尤其是一些内部回声不均匀的肿块,导致文献报道不一致[8,11,13]。计算机辅助技术在评估肿块纹理特征方面独具优势,可提取出40个反映肿块内部回声的影像学特征。肿块的粗糙程度在受体阳性组高于阴性组,结果的可重复性有待于大样本研究来验证。后方回声增强与ER阳性及低级别肿瘤密切相关[8,11-13,35],可能原因是低级别肿瘤生长慢,能引起更多间质反应及结蹄组织增生,产生多个不同的声阻抗差别较大的反射界面,声反射及衰减肿块后方回声失落[14]。
目前,乳腺癌的个体化治疗主要着眼于应用基因组学和蛋白组学等组学技术检测其分子学特性,但基因组学与蛋白组学常规用于临床实践仍面临着很大挑战。临床对肿瘤治疗效果的评价主要依赖肿瘤大小的变化,忽略了其细胞代谢及增殖的变化。此外,由于肿瘤发展过程中空间和时间的异质性,这类方法的局限性愈加凸显,因为需活检以获取标本并分析小部分肿瘤组织,而这部分组织不能代表全部肿瘤组织特点。影像组学从某种程度上可弥补蛋白组学和基因组学的局限性,不但能为整个肿瘤提供全面的观察视角,还能基于进展期的肿瘤及其对治疗的反应进行持续监测,因此至关重要。2015年,St. Gallen国际乳腺癌研讨会提出采用ER、PR、HER-2、Ki-67作为乳腺癌的临床分型方法,但不够完善,主要争议在于对Luminal型的区分。目前,主要采用Ki-67来反映肿瘤增殖状态,但界定其表达的高低非常困难。对此类乳腺癌,临床决策遇到了瓶颈。对于Luminal分型,乳腺癌专家们认为多基因谱的方法更为可信。如果能将乳腺癌影像组学与基因表达相关联,将为临床医师的诊疗决策提供更多的信息。因此,进一步的研究将对乳腺癌基因进行测序,以期望提高影像学特征对肿瘤生物学行为预测的特异度。
本研究存在一定的不足,仅包括HER-2阴性表达患者,以后的研究将纳入更多乳腺癌免疫组织化学分子分型,并与定量超声特征相关联;另外,本研究为探索性研究,样本量较小,需大样本来进一步验证超声影像组学在乳腺癌精准诊断及个体化治疗中的价值。
超声影像组学定量特征分析降低了传统超声影像的主观性,在预测浸润性乳腺癌的激素受体表达方面具有较大优势,预期能提高超声影像学特征对乳腺癌精准诊断及生物学行为预测的价值,但仍需进一步研究。
[1] CURTIS C, SHAH S P, CHIN S F, et al. The genomic and transcriptomic architecture of 2 000 breast tumours reveals novel subgroups [J]. Nature, 2012, 486(7403): 346-352.
[2] GOLDHIRSCH A, WINER E P, COATES A S, et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013 [J]. Ann Oncol, 2013, 24(9): 2206-2223.
[3] BAGARIA S P, RAY P S, SIM M S, et al. Personalizing breast cancer staging by the inclusion of ER, PR, and HER2 [J]. JAMA Surg, 2014, 149(2): 125-129.
[4] VODUC K D, CHEANG M C, TYLDESLEY S, et al. Breast cancer subtypes and the risk of local and regional relapse [J]. J Clin Oncol, 2010, 28(10): 1684-1691.
[5] GABOS Z, THOMS J, GHOSH S, et al. The association between biological subtype and locoregional recurrence in newly diagnosed breast cancer [J]. Breast Cancer Res Treat, 2010, 124(1): 187-194.
[6] HARRIS J R, LIPPMAN M E, MORROW M, et al. Diseases of the breast [M]. 5th ed. Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins Healths, 2014.
[7] KITAGAWA K, SAKUMA H, ISHIDA N, et al. Contrast-enhanced high-resolution MRI of invasive breast cancer: correlation with histopathologic subtypes [J]. AJR Am J Roentgenol, 2004, 183(6): 1805-1809.
[8] ZHANG L, LIU Y J, JIANG S Q, et al. Ultrasound utility for predicting biological behavior of invasive ductal breast cancers [J]. Asian Pac J Cancer Prev, 2014, 15(19): 8057-8062.
[9] ZHANG L, LI J, XIAO Y, et al. Identifying ultrasound and clinical features of breast cancer molecular subtypes by ensemble decision [J]. Sci Rep, 2015, 5: 11085.
[10] YANG Q, LIU HY, LIU D, et al. Ultrasonographic features of triple-negative breast cancer: a comparison with other breast cancer subtypes [J]. Asian Pac J Cancer Prev, 2015, 16(8): 3229-3232.
[11] AHO M, IRSHAD A, ACKERMAN S J, et al. Correlation of sonographic features of invasive ductal mammary carcinoma with age, tumor grade, and hormone-receptor status [J]. J Clin Ultrasound, 2013, 41(1): 10-17.
[12] CELEBI F, PILANCI K N, ORDU C, et al. The role of ultrasonographic findings to predict molecular subtype, histologic grade, and hormone receptor status of breast cancer [J]. Diagn Interv Radiol, 2015, 21(6): 448-453.
[13] COSTANTINI M, BELLI P, BUFI E, et al. Association between sonographic appearances of breast cancers and their histopathologic features and biomarkers [J]. J Clin Ultrasound, 2016, 44(1): 26-33.
[14] IRSHAD A, LEDDY R, PISANO E, et al. Assessing the role of ultrasound in predicting the biological behavior of breast cancer [J]. AJR Am J Roentgenol, 2013, 200(2): 284-290.
[15] AERTS H, VELAZQUEZ E R, LEIJENAAR R T H, et al. Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach [J]. Nat Commun, 2014, 5: 4006.
[16] KUMAR V, GU Y, BASU S, et al. Radiomics: the process and the challenges [J]. Magn Reson Imaging, 2012, 30(9): 1234-1248.
[17] GILLIES R J, KINAHAN P E, HRICAK H. Radiomics: Images are more than pictures, they are data [J]. Radiology, 2016, 278(2): 563-577.
[18] TERUEL J R, HELDAHL M G, GOA P E, et al. Dynamic contrast-enhanced MRI texture analysis for pretreatment prediction of clinical and pathological response to neoadjuvant chemotherapy in patients with locally advanced breast cancer [J]. NMR Biomed, 2014, 27(8): 887-896.
[19] GOLDEN D I, LIPSON J A, TELLI M L, et al. Dynamiccontrast-enhanced MRI-based biomarkers of therapeutic response in triple-negative breast cancer [J]. J Am Med Inform Assoc, 2013, 20(6): 1059-1066.
[20] 周建桥, 詹维伟. 乳腺超声影像报告与数据系统解读[M]. 北京: 人民卫生出版社, 2015.
[21] CAI L Y, WANG Y Y. A phase-based active contour model for segmentation of breast ultrasound images [C]. Hangzhou: [出版者不像], 2013.
[22] HUANG Y L, CHEN D R, JIANG Y R, et al. Computer-aided diagnosis using morphological features for classifying breast lesions on ultrasound [J]. Ultrasound Obstet Gynecol, 2008, 32(4): 565-572.
[23] CHEN C M, CHOU Y H, HAN K C, et al. Breast lesions on sonograms: computer-aided diagnosis with nearly setting-independent features and artificial neural networks [J]. Radiology, 2003, 226(2): 504-514.
[24] SHAN J, ALAM S K, GARRA B, et al. Computeraided diagnosis for breast ultrasound using computerized BI-RADS features and machine learning methods [J]. Ultrasound Med Biol, 2016, 42(4): 980-988.
[25] CHOU Y H, TIU C M, HUNG G S, et al. Stepwise logistic regression analysis of tumor contour features for breast ultrasound diagnosis [J]. Ultra Med Biol, 2001, 7: 1493-1498.
[26] TAVASSOLI F A, DEVILEE P. World Health Organization classification of tumours. Pathology and genetics of tumours of the breast and female genital organs [M]. Lyon: IARC Press, 2003.
[27] ELSTON C W. Classification and grading of invasive breast carcinoma [J]. Verh Dtsch Ges Pathol, 2005, 89: 35-44.
[28] BALDI P, BRUNAK S, CGAYVIN Y, et al. Assessing the accuracy of prediction algorithms for classification: an overview [J]. Bioinformatics, 2000, 16: 412-424.
[29] COROLLER T P, GROSSMANN P, HOU Y, et al. CT-based radiomic signature predicts distant metastasis in lung adenocarcinoma [J]. Radiother Oncol, 2015, 114(3): 345-350.
[30] WIBMER A, HRICAK H, GONDO T, et al. Haralick texture analysis of prostate MRI: utility for differentiating non-cancerous prostate from prostate cancer and differentiating prostate cancers with different Gleason scores [J]. Eur Radiol, 2015, 25(10): 2840-2850.
[31] SEGAL E, SIRLIN C B, OOI C, et al. Decoding global gene expression programs in liver cancer by noninvasive imaging [J]. Nat Biotechnol, 2014, 25(6): 675-680.
[32] WANG J, KATO F, OYAMA-MANABE N, et al. Identifying triple-negative breast cancer using background parenchymal enhancement heterogeneity on dynamic contrast-enhanced MRI: A pilot radiomics study [J]. PLoS One, 2015, 10(11): e0143308.
[33] KUO M D, GOLLUB J, SIRLIN C B, et al. Radiogenomic analysis to identify imaging phenotypes associated with drug response gene expression programs in hepatocellular carcinoma [J]. J Vasc Interv Radiol, 2007, 18(7): 821-831.
[34] DIEHN M, NARDINI C, WANG D S, et al. Identification of noninvasive imaging surrogates for brain tumor gene-expression modules [J]. Proc Natl Acad Sci USA, 2008, 105(13): 5213-5218.
[35] KO E S, LEE B H, KIM H A, et al. Triple-negative breast cancer: correlation between imaging and pathological findings [J]. Eur Radiol, 2010, 20(5): 1111-1117.
[36] AU-YONG I T, EVANS A J, TANEJA S, et al. Sonographic correlations with the new molecular classification of invasive breast cancer [J]. Eur Radiol, 2009, 19(10): 2342-2348.
[37] 张晓晓, 周建桥, 朱樱, 等. 乳腺癌超声征象与分子亚型相关性的研究 [J]. 诊断学理论与实践, 2011, 10(2): 153-157.
[38] 陈慧琪, 郭顺华, 过新民. 乳腺癌超声征象与分子分型相关性分析 [J]. 中国超声医学杂志, 2015, 31(6): 498-500.
Value of ultrasound radiomics analysis in predicting expression of hormone receptors in invasive breast carcinoma
LI Jiawei1, SHI Zhaoting1, GUO Yi2, HU Yuzhou2, QIAO Mengyun2, YU Jinhua2, WANG Yuanyuan2, ZHOU Shichong1, CHANG Cai1
(1. Department of Medical Ultrasound, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Electronic Engineering, Fudan University, Shanghai 200433, China)
CHANG Cai E-mail: changcai@163.com
Objective:To investigate the automatic radiomics approach in predicting the association between quantitativeultrasound features and hormone receptor status in invasive breast carcinoma.Methods:A total of 204 patients who accepted breast cancer surgery were retrospectively reviewed for pre-operative ultrasound images and post-operative pathological reports. Based on the expressions of estrogen receptor (ER), progesterone receptor (PR) and human epidermal growth factor receptor 2 (HER-2), all patients were divided into hormone receptor positive (ER+, PR+, HER-2-) group and hormone receptor negative (ER-, PR-, HER-2-) group. Two dimensional features of shape, margin, echo pattern, posterior acoustic feature and calcif i cation were assessed by two experienced radiologists and correlated with hormone receptor status. The same ultrasound images were then segmented for using a phase-based active contour model. The high-throughput radiomics features were extracted based on the two dimensional sonographic features. Target features were selected using Students’ t-test. The support vector machine classif i er with radial basis function and leave-oneout-cross-validation were used to correlate quantitative sonographic features with the status of hormone receptor.Results:The two groups had signif i cant dif f erences in the objective sonographic characteristics of shape, angular/spiculated margin, echo pattern and posterior acoustic feature (P<0.05). In the quantitative radiomics analysis, 54 features were selected with high accuracy in predicting the status of hormone receptor (accuracy 67.7%, area under the curve 73.2%). In addition, in the quantitative analysis, the two groups showed signif i cant dif f erence in margin, echo pattern, posterior acoustic pattern and calcif i cation (P<0.05).Conclusion:The quantitative features of ultrasound radiomics were well correlated with hormone receptor status of invasive breast carcinoma. Further study is warranted to validate its value in the precise diagnosis and biological behavior prediction of breast carcinoma.
Radiomics; Quantitative ultrasonographic feature; Hormone receptor; Invasive breast carcinoma
R445.1
A
1008-617X(2017)02-0128-08
2017-04-01)
国家自然科学基金项目(No:61401102、81371575、81627804)
常才 E-mail:changcai@163.com
