感兴趣区和层面变化对前列腺外周带组织表观扩散系数图一级统计学特征测量的影响
2017-05-15刘晓航周良平彭卫军
刘晓航,刘 伟,周良平,彭卫军
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
感兴趣区和层面变化对前列腺外周带组织表观扩散系数图一级统计学特征测量的影响
刘晓航,刘 伟,周良平,彭卫军
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032

刘晓航,复旦大学附属肿瘤医院放射诊断科主治医师,2007年毕业于同济大学临床医学系,2012年获复旦大学影像医学与核医学博士学位。长期从事泌尿系统肿瘤的影像诊断工作,为肿瘤医院泌尿肿瘤多学科组成员,擅长肾脏及前列腺肿瘤的MRI诊断及新技术研发,对前列腺癌扩散加权成像的应用及各种计算模型进行了较深入的研究,以第一责任人承担国家自然科学青年基金一项。在国内外核心期刊发表学术论文10余篇,其中SCI收录期刊发表学术论文5篇。
目的:探讨感兴趣区(region of interest,ROI)的大小和层面变化对前列腺外周带正常和前列腺癌组织表观扩散系数(apparent diffusion coefficient,ADC) 图一级统计学特征测量的影响。方法:回顾性分析18例前列腺外周带癌患者的ADC图和常规MRI图像,对照病理结果,应用不同ROI测量前列腺癌与正常组织的一级统计学特征。ROI 1:根据T2WI图像特征在最大层面确定前列腺癌及正常组织;ROI 2:根据ADC图确定组织;ROI 3、ROI 4:大小分别为ROI 1的3/4和1/2;ROI 5:为多层面组成的整体病灶或组织。筛选前列腺癌与正常组织有显著差异的参数,进一步评价不同ROI之间测量结果差异。结果:共测量19个病灶和21个正常外周带组织的数据。肿瘤与正常组织的峰度值和偏度值无显著差异,而各ROI测量的正常组织ADC值均值及百分位数均显著高于前列腺癌。随着ROI缩小,肿瘤组织ADC值降低,正常组织变化不明显,两者平均ADC值对应的标准差(standard deviation,SD)在所有ROI之间均无显著差异。但正常组织不同百分位数ADC值对应的大部分SD值明显高于前列腺癌。测量整体体积与最大层面获得的ADC值及其百分位数、SD值不同并无显著差异。结论:不同面积ROI测量对ADC均值及百分位数均有显著影响,一级统计学特征测量可获得比平均ADC值更多有统计学意义的参数。
前列腺癌;扩散加权成像;统计学特征
前列腺癌是男性泌尿生殖系统最常见的恶性肿瘤之一,在欧美国家其发病率居恶性肿瘤首位;在亚洲国家,随着人口增长、人均寿命延长和生活习惯改变,以及检出手段的日益进步,其发病率及死亡率逐年上升[1]。
目前,前列腺癌诊断模式主要依赖直肠检查和血清前列腺特异性抗原(prostate-specific antigen,PSA),但两者诊断准确率均有待提高。扩散加权成像(diffusion weighted imaging,DWI)结合常规MRI具有清晰的软组织分辨率,可大幅提高前列腺癌的诊断准确率[2-3],已广泛用于前列腺癌治疗效果评估及治疗后随访等[4]。然而,目前前列腺癌的DWI诊断仍以医师人工判断模式为主,易受医师经验等主观因素影响,且只能考察图像的肉眼特征;与其他技术联合应用时,诊断结果也不易累加。由此,部分高通量的图像信息定量分析方法,如放射组学技术,开始应用于这一领域。作为目前新兴的图像信息采集和分析技术,放射组学可应用大量的自动化数据特征化算法,将感兴趣区(region of interest,ROI)的影像数据转化为具有高分辨率的可发掘的特征空间数据,评价肿瘤的各种表型,包括组织形态、细胞分子等各层次的状态。目前,放射组学在前列腺MRI检查中的应用较少,主要为可行性和可重复性测试[5-6],有关DWI或表观扩散系数(apparent diffusion coefficient,ADC)的文献报道更少,且应用特征主要是一级统计学特征,即均值、图像信号标准差、偏度(skewness)、峰度(kurtosis)及ADC值的百分位数。以上参数在良恶性组织间的差异及诊断意义,目前尚待大样本研究的验证;测量方法也无统一意见,文献报道的组织ADC值及其相关参数主要通过测量病变或正常组织的最大层面获得,而由于肿瘤的异质性,测量整体肿瘤可能更为准确[7];在ROI选择方面,也有基于T2WI和ADC图两种方式[8-9]。这些差异对测量结果的影响尚不确定。本研究旨在比较以上不同方法对测量结果的影响。
1 资料和方法
1.1 患者资料
收集2016年因PSA升高行MRI-DWI检查的患者202例,其中112例未经穿刺及任何治疗,92例检查后经穿刺有41例证实为前列腺癌。29例位于外周带,纳入研究,患者平均年龄63岁(52~73)岁,平均PSA 20.4 ng/mL (4~102 ng/mL);11例位于中央腺体或累及外周带及中央腺体,排除。所有患者均在3.0T MRI上行T2WI、DWI检查,且均在检查前签署知情同意书。
1.2 检查方法
采用SIEMENS公司Magnetom Skyra 3.0T MRI 8通道相控阵表面线圈。T2WI检查序列:快速翻转快速自旋回波(fast recovery fast spin echo,FRFSE)序列,重复时间(repetitive time,TR)/回波时间(echo time,TE)=5 840/85 ms,激发次数(number of excitations,NEX)=4,层厚3.5 mm,间距1 mm)。T1WI检查序列:梯度回波(gradient recalled echo,GRE)序列(TR/ TE=231/2.5 ms,层厚5.5 mm,间距 1.1 mm),矩阵512×512。DWI检查序列:分段读出平面回波成像(readout-segmented echo-planarimaging,RS-EPI)序列,b值为0、1 000 s/mm2,TR/TE=7 400/62 ms,视野(field of view,FOV) 130 mm×130 mm,NEX=2,矩阵80×80,层厚3.5 mm,间距1 mm,分段读出次数13,加用全局自动校准部分并行采集技术(generalized autocalibrating partially parallel acquisition,GRAPPA)。
1.3 病灶一级统计学特征的测量
1.3.1 最大层面不同大小ROI
采用GE公司ADW 4.3工作站,对病理结果确定且MRI上可见的病灶进行筛选和后处理。为保证测量的稳定性,只有>1 cm的病灶纳入进一步研究。ROI的设定为:ROI 1,前列腺癌为病理证实区域中的T2WI上低信号区,正常组织为病理证实区域的均匀高信号区;ROI 2,前列腺癌为病理证实区域中的ADC低值区,正常组织同ROI 1;ROI 3,前列腺癌为T2WI上低信号区中心区域,约占病灶面积的3/4,正常组织也为ROI 1的3/4;ROI 4,前列腺癌为T2WI上低信号区中心区域,约占病灶面积的1/2,正常组织以此类推。
ROI选定后,沿ROI剪裁图像,另存为Processed图像文件,分别发送至AW工作站中的Refomat软件及Matlab软件进行分析。
1.3.2 整体体积ROI
对病理结果确定且MRI上可见病灶的所有层面进行测量,ROI的设定为ROI 5:病理证实区域中的T2WI上低信号区(所有层面组成的立体病灶)。图像处理和保存方法同上。
以上ROI选定后,用Matlab软件自动生成峰度值和偏度值,Reformat软件生成不同百分位(平均值及10%、25%和50%百分位数)ADC值及相对应的SD值。
1.4 统计学处理
所有数据用STATA 10.0软件进行分析。首先,对前列腺癌与正常组织的不同参数采用t检验进行比较,对有统计学差异的参数进一步分析。其次,对ROI 1及ROI 5参数采用t检验进行比较,评价测量最大层面和整体体积的结果差异。应用单因素方差分析比较ROI 1~4以上参数的差异,如有差异,则进一步应用t检验进行两两比较,P<0.05为差异有统计学意义。应用单因素方差分析时附加Bonferroni校正,P<0.01为差异有统计学意义。
2 结 果
共18例患者纳入研究,另11例患者因病变过小或散在分布而排除。共测量19个病灶和21个正常外周带组织的数据。
肿瘤与正常组织的峰度值和偏度值无显著差异(表1),而各ROI测量出的正常组织ADC值所有百分位数均显著高于前列腺癌(P<0.05)。随着ROI缩小,肿瘤ADC值依次降低,均有显著性差异(P<0.05),而正常组织变化不明显(表2)。值得注意的是,ROI 1、ROI 2、ROI 4肿瘤与正常组织平均ADC值对应的标准差(standard deviation,SD)虽然没有差异,但ADC值百分位数对应的部分SD值有显著差异(P<0.05),尤其是10%ADC值和25%ADC值中,正常组织的平均SD值显著高于前列腺癌(表3)。随着百分位数下降,SD值相应下降,但前列腺癌组织下降较明显(图1~2),ADC值不同百分位数间比较均有显著差异(P<0.05)。此外,应用肿瘤整体体积与最大层面获得的ADC值及其百分位数、SD值无显著差异。

表1 前列腺癌与正常组织不同ROI上的偏度值和峰度值

表2 前列腺癌与正常组织不同ROI上的ADC值平均值及百分位数
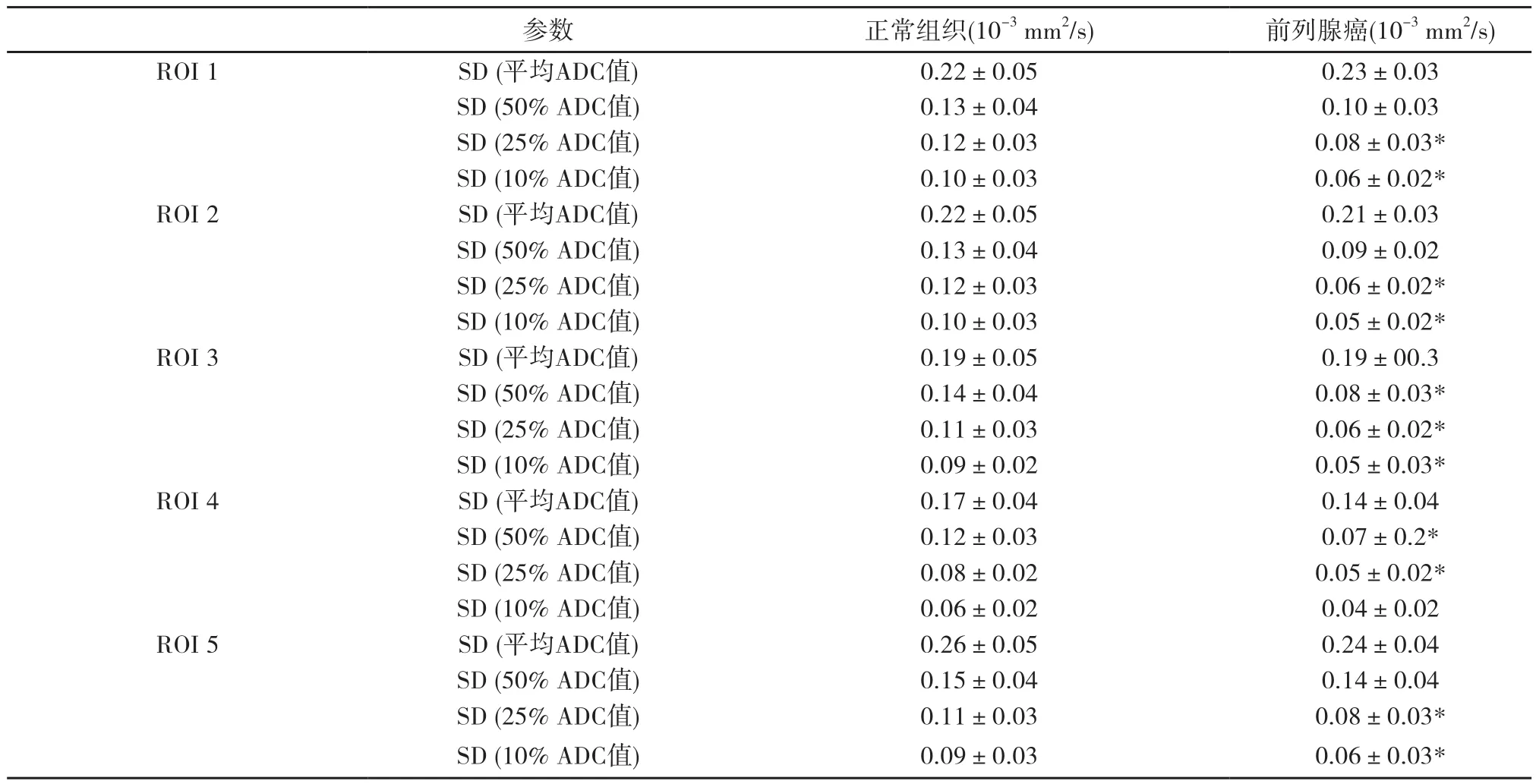
表3 前列腺癌与正常组织不同ROI上ADC值平均值和百分位数的SD值

图1 ROI 1~4上测量的ADC平均值及百分位数对应的SD值
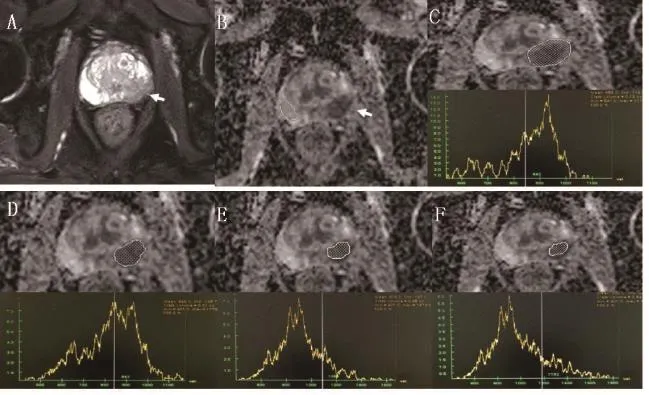
图2 前列腺癌ROI和层面变化时前列腺外周带组织ADC图
3 讨 论
本研究结果显示,肿瘤与正常组织的峰度值和偏度值无显著差异,而各ROI测量出的ADC值所有百分位数均有显著差异。值得注意的是,肿瘤与正常组织平均ADC值对应的SD值虽然无差异,但ADC值百分位数对应的SD值有显著差异。此外,不同大小ROI对肿瘤ADC值及相关参数的测量有较大影响,但测量肿瘤整体体积与最大层面获得的ADC值及其百分位数、SD值无显著差异。
肿瘤与正常组织的峰度值和偏度值是否有差异,文献中一直存在争议。Xu等[10]研究认为肿瘤与正常组织的峰度值无显著差异,而偏度值有显著差异,且Suo等[11]的研究提示这种差异与肿瘤组织的异质性有关。在一项子宫内膜癌研究中,肿瘤与正常组织的峰度值有显著差异,而偏度值无差异[12]。在肾上腺肿瘤研究中,两者在良恶性组织间均未见显著差异[13]。在前列腺癌相关研究中,虽然未明确证实峰度值和偏度值在前列腺癌与正常组织间的差别,但应用峰度值和偏度值对前列腺癌与正常组织进行鉴别诊断,受试者工作特征(receiver operating characteristic,ROC)曲线的曲线下面积(area under curve,AUC)值仅为0.46和0.59,提示两参数在前列腺癌与正常组织间差异不大,可能不具备临床鉴别意义[14]。本研究结果虽然与以上文献不完全一致,但并不支持峰度值和偏度值在肿瘤鉴别诊断中的作用。
在获取前列腺癌进行一级统计学特征时,测量肿瘤整体体积与最大层面所获结果无明显差异,这与其他部位肿瘤的研究结果[7]有一定差异。主要原因可能有两点:首先,前列腺癌极少发生坏死和出血[15],因而在肉眼可见的前列腺癌内部异质性相对较低,ADC值及其相关参数对测量层面和体积的变化不敏感;其次,大部分前列腺癌体积不大,横断位DWI图像上层面较少,因而最大层面的测量往往已涉及肿瘤的大部分,所得结果与整体测量结果没有太大差异。由于测量最大层面的便捷性明显高于整体组织,又能可靠地反映整体组织信息,所以目前常用的前列腺癌ADC值测量仍可作为此方面研究的常规方法。
不同ROI测量的肿瘤与正常组织ADC值及其所有百分位数均有显著差异。随着ROI缩小,前列腺癌组织ADC值逐步下降,而正常组织ADC值保持稳定。这些参数的趋势与前列腺癌的组织结构相吻合。前列腺癌的分布形式除局灶性分布形成肿块外,还有相当一部分呈散在分布,而肿瘤边界常有散在分布的肿瘤细胞或癌巢[8]。如以T2WI为标准进行测量,则可包括肿瘤组织,但同时混入正常组织,导致ADC值升高;而以ADC值为标准,或以本研究中相对较小的ROI 3、ROI 4进行测量,ROI内主要为肿瘤成分,ADC值较低,可能遗漏周边的肿瘤组织。ADC值是DWI诊断和评估前列腺癌的基本指标,近年来其百分位数在前列腺癌诊断中的应用逐渐增多。多项研究表明,部分百分位数,尤其是10%百分位数在鉴别诊断效能及与Gleason评分的相关性方面,均优于平均ADC值[9,14,16]。本研究中,以上参数随ROI大小的变化有较大波动,意味着使用这些参数进行良恶性鉴别及恶性程度评估时,同样面临稳定性的问题。由于缺乏整体病理切片对照,本研究未能进一步评估各种参数的优劣,但至少证明,提取前列腺癌病灶的统计学特征时,须有相对统一的标准。
肿瘤与正常组织平均ADC值对应的SD值没有差异,与既往文献报道吻合[10],但ADC值其他百分位数对应的SD值有明显差异,且随着百分位数缩小,前列腺癌组织ADC值对应的SD值相应下降。从公式SD=平均值×变异系数获知,SD值由变异系数即组织的混杂性和均值决定,肿瘤组织均值小,但常混有非肿瘤组织,因而变异系数大;正常组织均值大,但组织均质,变异系数小。因此,两者的方差在两种因素共同作用下差别可能不大。应用百分位数筛选出相对均质的像素后,肿瘤组织不仅像素样本缩小,更由于筛除了混杂的正常组织,变异系数变小,方差缩小快;而正常组织受到的影响较小,变化也相对小,因此两者差别增大。这一结果提示,百分位数可提供ADC值更丰富的信息,有利于肿瘤的鉴别诊断。
本研究有以下不足之处:首先,所有患者的研究基于穿刺结果,而非前列腺整体病理切片,由此带来对位准确性和假阴性等问题,且无法进一步比较各测量方法的优劣。其次,样本数较少,对各参数随测量方法改变而变化的趋势及机制未进一步研究。最后,由于技术限制,采用两种软件进行测量和计算,算法上的差异可能掩盖了部分参数间的关联性。此外,对测量整体体积与最大层面所获参数的比较仅以T2WI为参照,对其他方法所获结果未一一比较,有待采用更精确稳定的软件进行系统比较。
本研究结果显示,测量前列腺癌ADC图的一级统计学特征时,如定义病灶的标准相同,测量最大层面与测量整体体积对结果无显著差异,但不同面积的ROI对ADC值所有百分位数均有显著影响,用百分位数ADC值考察可获得比平均ADC值更多且有统计学意义的参数。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015 [J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] WEINREB J C, BARENTSZ J O, CHOYKE P L, et al. PI-RADS Prostate Imaging-Reporting and Data System: 2015, Version 2 [J]. Eur Urol, 2016, 69(1): 16-40.
[3] FUSCO R, SANSONE M, PETRILLO M, et al. Multiparametric MRI for prostate cancer detection: Preliminary results on quantitative analysis of dynamic contrast enhanced imaging, diffusion-weighted imaging and spectroscopy imaging [J]. Magn Reson Imaging, 2016, 34(7): 839-845.
[4] LAU W, LAI E. Hepatic resection for colorectal liver metastases [J]. Singapore Med J, 2007, 48(7): 635-639.
[5] CAMERON A, KHALVATI F, HAIDER M A, et al. MAPS: A quantitative radiomics approach for prostate cancer detection [J]. IEEE Trans Biomed Eng, 2016, 63(6): 1145-1156.
[6] KHALVATI F, WONG A, HAIDER M A. Automated prostate cancer detection via comprehensive multiparametric magnetic resonance imaging texture feature models [J]. BMC Med Imaging, 2015, 15: 27.
[7] HAINC N, STIPPICH C, STIELTJES B, et al. Experimental texture analysis in glioblastoma: a methodological study [J]. Invest Radiol, 2017. [Epub ahead of print].
[8] BORREN A, MOMAN M R, GROENENDAAL G, et al. Why prostate tumour delineation based on apparentdiffusion coefficient is challenging: an exploration of the tissue microanatomy [J]. Acta Oncol, 2013, 52(8): 1629-1636.
[9] LIU X, ZHOU B, ZHOU L, et al. Differentiation of prostate cancer and stromal hyperplasia in the transition zone with histogram analysis of the apparent diffusion coefficient [J]. Acta Radiol, 2017. [Epub ahead of print].
[10] XU X Q, HU H, SU G Y, et al. Utility of histogram analysis of ADC maps for differentiating orbital tumors [J]. Diagn Interv Radiol, 2016, 22(2): 161-167.
[11] SUO S T, CHEN X X, FAN Y, et al. Histogram analysis of apparent diffusion coefficient at 3.0 T in urinary bladder lesions: correlation with pathologic findings [J]. Acad Radiol, 2014, 21(8): 1027-1034.
[12] KIERANS A S, DOSHI A M, DUNST D, et al. Retrospective assessment of histogram-based diffusion metrics for differentiating benign and malignant endometrial lesions [J]. J Comput Assist Tomogr, 2016, 40(5): 723-729.
[13] UMANODAN T, FUKUKURA Y, KUMAGAE Y, et al. ADC histogram analysis for adrenal tumor histogram analysis of apparent diffusion coefficient in differentiating adrenal adenoma from pheochromocytoma [J]. J Magn Reson Imaging, 2017, 45(4): 1195-1203.
[14] HOANG D A, MELODELIMA C, SOUCHON R, et al. Quantitative analysis of prostate multiparametric MR images for detection of aggressive prostate cancer in the peripheral zone: a multiple imager study [J]. Radiology, 2016, 280(1): 117-127.
[15] EBLE G N, SAUTER G, EPSTEIN J I, et al. World Health Organization classification of tumors: pathology and genetics of tumors of the urinary system and male genital organs [M]. Lyon: IARC Press, 2004: 160-182.
[16] DONATI O F, MAZAHERI Y, AFAQ A, et al. Prostate cancer aggressiveness: assessment with whole-lesion histogram analysis of the apparent diffusion coefficient [J]. Radiology. 2014, 271(1): 143-152.
Effects of variety in region of interest and slice on measurement of first-order statistical features in apparent dif f usion coef ficient map of prostate peripheral zone
LIU Xiaohang, LIU Wei, ZHOU Liangping, PENG Weijun
(Department of Diagnostic Radiology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
PENG Weijun E-mail: cjr.pengweijun@vip.163.com
Objective:To investigate the ef f ects of variety in region of interest (ROI) and slice on the measurement of the first-order statistical features of apparent diffusion coefficient (ADC) map of prostate peripheral zone.Methods:Retrospective analysis of 18 subjects with prostate cancer in peripheral zone was performed. The fi rst-order statistical features of cancer and normal tissues were measured with different ROIs referring to the pathological data. ROI 1: the cancer lesions and normal tissues wereidentif i ed by T2WI image characteristic on the largest slice; ROI 2: identif i ed by ADC map; the areas of ROI 3 and ROI 4 were 3/4 and 1/2 of ROI 1, respectively; ROI 5 was the whole volume of the cancer lesions and normal tissues with multi-slice. Data which were signif i cantly dif f erent between cancer lesions and normal tissues were selected and further assessed their variety in dif f erent ROIs.Results:Data were obtained from 19 cancer lesions and 21 normal tissues. There was no signif i cant dif f erences in skewness and kurtosis between cancer lesions and normal tissues. The mean and percentile ADC values from all ROIs were all signif i cantly higher in normal tissues than cancer lesions. As the area of ROI reduced, the mean ADC value in the cancer lesions decreased, but in the normal tissues remained stable. Their standard deviation (SD) values were not signif i cantly dif f erent, but the SD values for most of the percentile ADC values were signif i cantly higher in normal tissues compared with cancer lesions. The ADC values, the percentile ADC values and their SD values measured on the largest slice were not signif i cantly dif f erent from those by whole volume.Conclusion:The area of ROI has remarkable ef f ect on the mean and percentile ADC values, and fi rst-order statistical features could provide more signif i cative data.
Prostate cancer; Apparent dif f usion coefficient; Statistical feature
R445.2
A
1008-617X(2017)02-0121-07
2017-04-01)
复旦大学附属肿瘤医院院级基金项目(No:YX201501)
彭卫军 E-mail:cjr.pengweijun@vip.163.com
