乳腺癌前哨淋巴结阳性时非前哨淋巴结转移的相关因素分析
2017-05-12施宝民崔乃鹏同济大学附属同济医院普外科上海00065河北大学附属医院肿瘤外科保定03000
张 涛,施宝民,王 洪,崔乃鹏,林 锐,季 堃.同济大学附属同济医院普外科,上海 00065;.河北大学附属医院肿瘤外科,保定 03000
·论 著·
乳腺癌前哨淋巴结阳性时非前哨淋巴结转移的相关因素分析
张 涛1,施宝民1,王 洪2,崔乃鹏2,林 锐1,季 堃1
1.同济大学附属同济医院普外科,上海 200065;2.河北大学附属医院肿瘤外科,保定 031000
目的 寻找可以预测非前哨淋巴结(non-sentinel lymph nodes,nSLNs)转移的因素。方法 回顾性分析1999年5月—2015年9月在同济大学附属同济医院进行乳腺癌前哨淋巴结(sentinel lymph nodes,SLNs)活检的病例,通过多因素分析判断哪些临床病理因素与nSLNs转移相关。结果 共有162例患者进行了SLNs活检和腋窝清扫,多因素分析表明,原发肿瘤直径>2 cm(P=0.023)、SLNs转移灶直径>2 mm(P=0.016)和脉管受侵(P=0.001)是nSLNs转移的独立预测因素,患者具有的不良因素越多,则nSLNs发生转移的可能性越大。结论 nSLNs是否转移与原发肿瘤大小、SLNs转移灶最大径和脉管受侵有关,对原发肿瘤及其SLNs进行详细的病理学检查将有助于筛查出真正需要进行腋窝清扫的患者。
腋窝清扫;乳腺癌;预测因素;前哨淋巴结
乳腺癌的治疗是以手术为主的综合治疗,不论是改良根治术还是保乳手术都需要清扫腋窝[1],而前哨淋巴结(sentinel lymph nodes,SLNs)活检可以使一部分患者免于腋窝清扫。当SLNs阳性时,大约40%~70%的患者腋窝淋巴结转移局限在SLNs,这部分患者同样可以避免腋窝清扫[2-3],因此,发现这些非前哨淋巴结(non-sentinel lymph nodes,nSLNs)未转移的患者使其免于腋窝清扫,不仅可以避免腋窝清扫的并发症,而且可以提高生活质量。本研究回顾性分析了收治的SLNs阳性患者中nSLNs转移的各种临床因素,希望对判断nSLNs是否转移有所帮助。
l 材料与方法
1.1 临床资料
SLNs转移患者,共162例,均为女性,年龄为29~71岁,平均(47.2±7.2)岁,绝经前90例,绝经后72例,肿物切除活检后的病例22例;肿瘤位于内上象限40例,内下象限40例,外上象限46例,外下象限36例;临床TNM分期均为T1-2N0M0,其中T1期40例,T2期122例;术式为改良根治术114例,保乳手术48例;病理为浸润性导管癌133例,浸润性小叶癌21例,其他8例。患者的临床信息见表1。
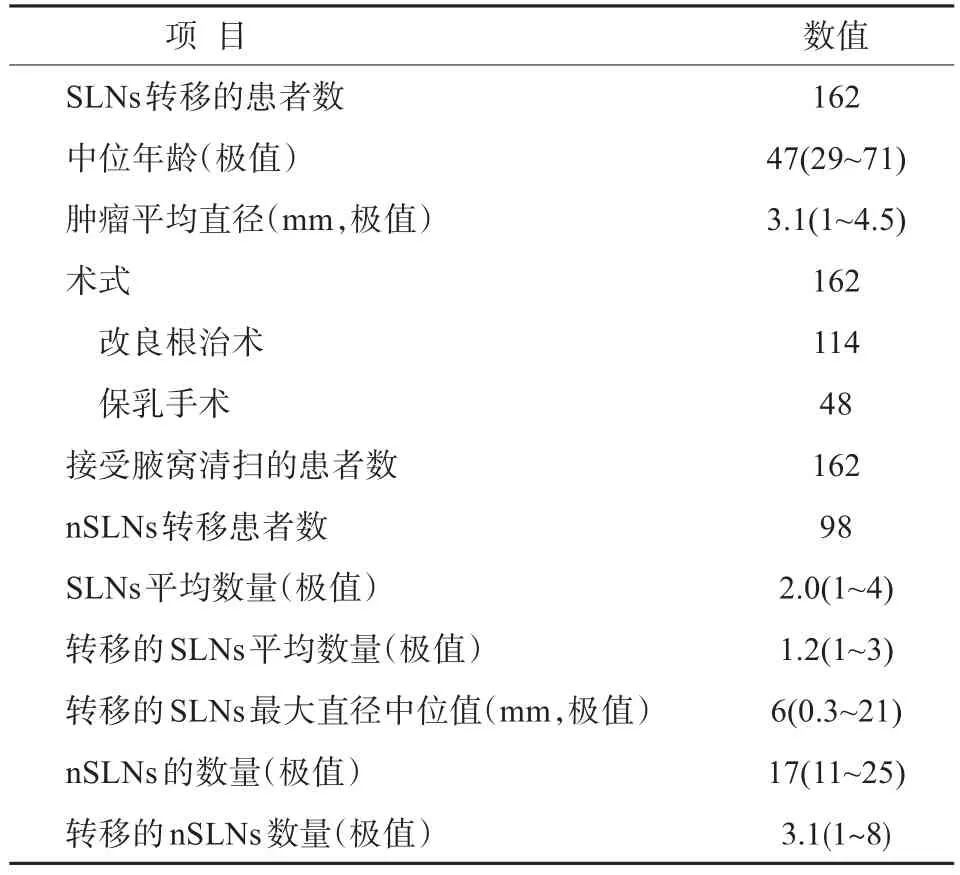
表1 临床信息Tab.1 Clinical data
1.2 方法
术前3 min乳晕区皮内注射亚甲蓝1 mL,腋窝做小切口,寻找蓝染的淋巴管,沿淋巴管寻找蓝染的淋巴结,这些蓝染的淋巴结即为SLNs,把全部SLNs切除后,继续完成乳腺癌改良根治术或者保乳手术。
1.3 病理学检查
全部SLN切成2~3 mm的薄片,分别用石蜡包埋,每个蜡块取1张切片进行苏木精-伊红(HE)染色,如果SLN(-),则继续进行免疫组织化学染色,方法为每个蜡块在原平面基础上间隔100 μm,在3个层面上进行间隔连续切片,每个层面切片4张,分别进行HE染色和免疫组化染色(抗体为AE1/3,muc1和CK19)。
1.4 统计学分析
应用统计软件SPSS19.0完成统计分析,单因素分析应用四格表精确概率法,多因素分析应用logistic回归分析模型,P<0.05为差异有统计学意义。
2 结果
SLN活检的成功率为96%,灵敏度为92%,特异度为100%,假阴性率为8%,假阳性率为0,准确率为96.6%,每例患者的SLNs为1~4个,nSLNs为11~25个。当原发肿瘤>2 cm时,nSLNs的转移率为66.4%(81/122),脉管受侵时为82.4%(42/51),SLNs转移灶最大径>2 mm时为68.6%(70/102)。如果原发肿瘤>2 cm,且脉管受侵,则nSLN的转移率为84.3%(27/32);原发肿瘤>2 cm,且SLNs转移灶最大径大于2 mm时为92.0%(23/25);脉管受侵,且SLNs转移灶最大径>2 mm时为93.1%(27/29)。如果原发肿瘤>2 cm,脉管受侵,且SLNs转移灶最大径>2 mm,则全部21例nSLNs都有转移,各种临床因素与nSLNs转移的关系见表2、表3。
3 讨论
在乳腺癌的治疗中,腋窝清扫具有重要价值,它不仅可以提供临床预后信息,而且通过清扫腋窝可以降低远处转移。因此,对于SLNs阳性的患者,腋窝清扫是标准治疗。但腋窝清扫的地位也在受到挑战,因为有大约50%的SLNs阳性患者在进行腋窝清扫后,在nSLNs中并没有发现转移,这些患者没有在腋窝清扫中获益,实际可以免除腋窝清扫[4]。ACOSOG Z0011研究中比较了SLNs转移患者腋窝清扫和不清扫患者的总生存率、无病生存率和局部控制率,IBCSG 23-01研究中比较了SLNs微小转移患者进行腋窝清扫和不清扫的区别,这些研究发现,对于SLNs转移数目较少的患者,不清扫腋窝并没有影响预后[5]。一些研究发现,下列因素与nSLNs转移相关,如原发肿瘤大小、SLNs转移灶的大小和脉管受侵[6-8]。
脉管受侵是判断nSLNs转移的一个重要因素[9],Giuliano等[10]研究发现,脉管受侵时超过80%的患者nSLNs有转移,而没有受侵时,此比例仅50%,Hwang等[11]的研究也发现,有脉管受侵时,62%患者的nSLNs有转移,本研究也支持脉管受侵是nSLNs转移的预后因素,本研究发现,有脉管受侵时,82.4%患者的nSLNs发生转移。
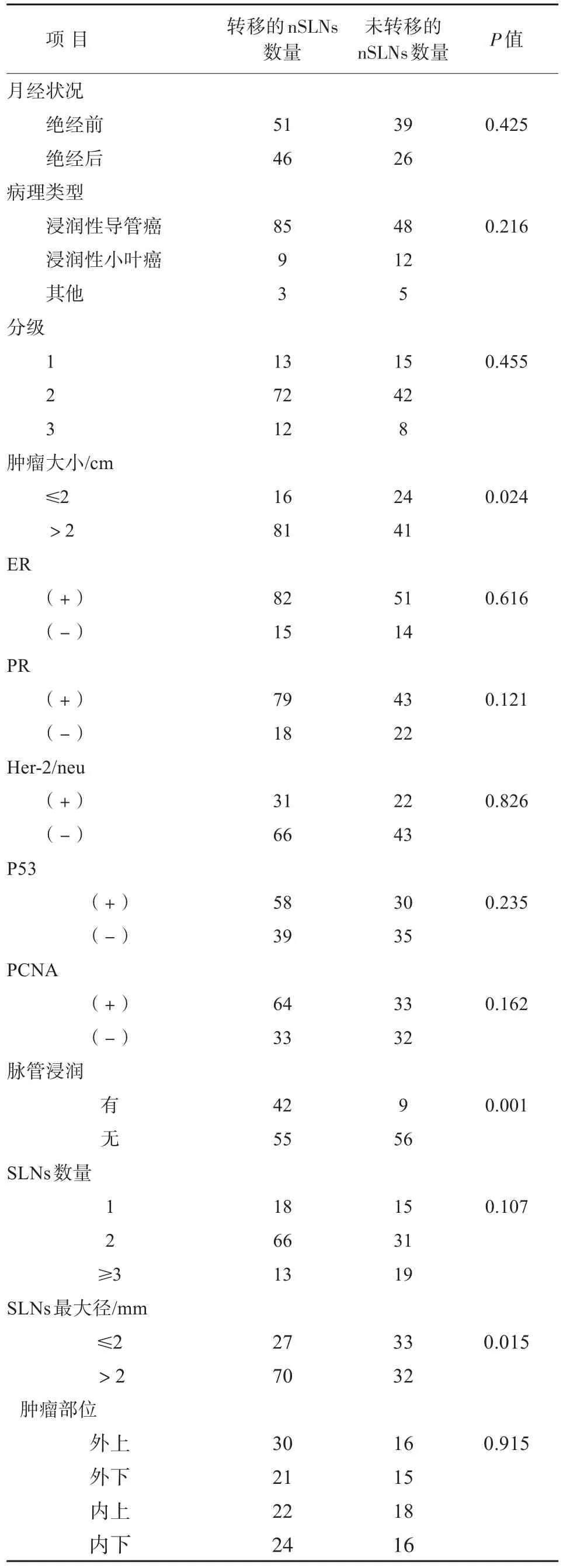
表2 nSLNs转移与临床病理因素的关系Tab.2 Correlation between clinicopathological features and positive nSLNs
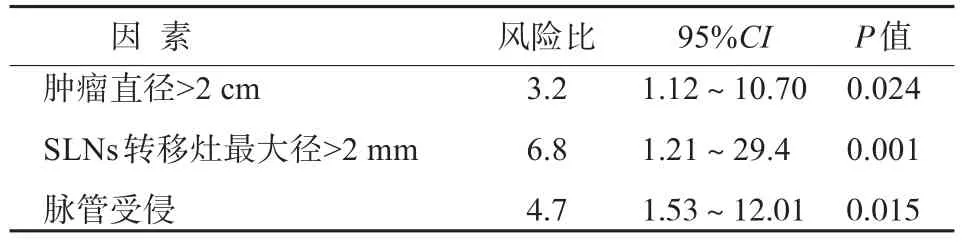
表3 nSLNs的预测因素Tab.3 Independent predictors of positive nSLNs
另一个nSLNs转移的预测因素是SLNs转移灶的大小。目前的研究中,转移灶大小的临界值是2 mm,SLNs转移灶大于2 mm是nSLNs转移的独立预后因素,相对于SLNs孤立的细胞转移,转移灶小于2 mm时,nSLNs发生转移的风险是3.1倍,而当转移灶大于2 mm时,该风险为4倍[12-13],因此,SLNs转移灶越大,nSLNs发生转移的风险越大。
关于nSLNs转移与原发肿瘤大小的关系,很多研究均发现原发肿瘤大小是一个很强的预测因素,原发肿瘤大于2 cm时,nSLNs转移明显增加,本研究也发现,原发肿瘤大于2 cm时,nSLNs发生转移的概率是小于2 cm的3.2倍,SLNs转移时,如果原发肿瘤为T1a,没有1例发生nSLNs转移,而T2肿瘤中,66.7%的nSLNs发生转移。
有研究在分析了206例SLNs转移病例后,Parra等[3]发现3个因素与nSLNs转移相关,如果原发肿瘤≤1.0 cm,没有脉管受侵且SLNs转移灶≤2 mm,则没有nSLNs发生转移。本研究中也发现了类似的情况,如果原发肿瘤>2 cm,脉管受侵且SLNs转移灶>2 mm,全部患者均发生了nSLNs转移。
基于对nSLNs转移的研究,不同的研究机构发布了自己的风险预测模型,如纽约纪念斯隆凯瑟琳癌症中心(MSKCC)、剑桥大学模型和斯坦福大学模型等,不同模型的预测结果不同,各有千秋,但在临床中并没有被广泛应用[14-15]。
总之,腋窝的外科处理需要个体化,预测nSLNs是否有转移可以使治疗更加精准化,其中,原发肿瘤大小、SLNs转移灶大小和脉管受侵与nSLNs转移相关,根据这些因素,可以提高预测nSLNs转移的准确性。
[1] Noguchi M,Morioka E,Ohno Y,et al.The changing role of axillary lymph node dissection for breast cancer[J].Breast Cancer,2013,20(1):41-46.
[2] Hessman CJ,Naik AM,Kearney NM,et al.Comparative validation of online nomograms for predicting non-sentinel lymph node status in sentinel lymph node-positive breast cancer [J].Arch Surg,2011,146(9):1035-1040.
[3] van la Parra RFD,Francissen CMTP,Peer PGM,et al. Assessment of the Memorial Sloan-Kettering Cancer Center nomogram to predict sentinel lymph node metastases in a Dutch breast cancer population[J].Eur J Cancer,2013,49(3):564-571.
[4] Galimberti V,Cole BF,Zurrida S,et al.Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases(IBCSG 23-01):a phase 3 randomised controlled trial[J].Lancet Oncol,2013,14(4):297-305.
[5] Tichauer KM,Samkoe KS,Gunn JR,et al.Microscopic lymph node tumor burden quantified by macroscopic dual-tracer molecular imaging[J].Nat Med,2014,20(11):1348-1353.
[6] Krag DN,Anderson SJ,Julian TB,et al.Sentinel-lymph-node resection compared with conventionalaxillary-lymphnode dissection in clinically node-negative patients with breast cancer:overallsurvivalfindingsfrom theNSABP B-32 randomised phase 3 trial[J].Lancet Oncol,2010,11(10):927-933.
[7] Berrang TS,Lesperance M,Truong PT,et al.Which prediction models best identify additional axillary disease after a positive sentinel node biopsy for breast cancer?[J].Breast Cancer Res Treat,2012,133(2):695-702.
[8] Gur A,Unal B,Ozbek U,et al.Validation of breast cancer nomograms forpredicting the non-sentinellymph node metastases after a positive sentinel lymph node biopsy in a multi-center study[J].Eur J Surg Oncol,2010,36(1),30-35.
[9] Koca B,Kuru B,Ozen N,et al.A breast cancer nomogram for prediction of non-sentinel node metastasis-validation of fourteen existing models[J].Asian Pac J Cancer Prev,2014,15(3):1481-1488.
[10] Giuliano AE,Hunt KK,Ballman KV,et al.Axillary dissection versus no axillary dissection in women with invasive breast cancer and sentinel node metastasis:a randomized clinical trial [J].JAMA,2011,305(6):569-575.
[11] Hwang RF,Krishnamurthy S,Hunt KK,et al.Clinicopathologic factors predicting involvementofnon-sentinel axillary nodes in women with breast cancer[J].Ann Surg Oncol,2003,10(3):248-254.
[12] van Deurzen CHM,Seldenrijk CA,Koelemij R,et al.The microanatomic location of metastatic breast cancer in sentinel lymph nodes predicts nonsentinel lymph node involvement[J]. Ann Surg Oncol,2008,15(15):1309-1315.
[13] Bolster MJ,Peer PGM,Bult P,et al.Risk factors for non-sentinel lymph node metastases in patients with breast cancer.The outcome of a multi-institutional study[J].Ann Surg Oncol,2007,14(1):181-189.
[14] Pal A,Provenzano E,Duffy SW,et al.A model for predicting non-sentinel lymph node metastatic disease when the sentinel lymph node is positive[J].Br J Surg,2008,95(3):302-309.
[15] van den Hoven I,Kuijt G,Roumen R,et al.A head to head comparison of nine tools predicting non-sentinel lymph node status in sentinel node positive breast cancer women[J].J Surg Oncol,2015,112(2):133-138.
Predictors of non-sentinel lymph node metastasis in breast cancer patients with positive sentinel lymph node
ZHANG Tao1,SHI Baomin1,WANG Hong2,CUI Naipeng2,LIN Rui1,JI Kun1
1.Department of General Surgery,Tongji Hospital,Tongji University School of Medicine,Shanghai 200065,China;2.Department of Oncology Surgery,Affiliated Hospital of Hebei University,Baoding 031000,China
Objective To identify factors that can predict metastatic involvement of non-sentinel lymph nodes(nSLNs).Methods We reviewed the records of all patients with invasive breast cancer who underwent sentinel lymph nodes(SLNs)biopsy at Affiliated Hospital of Tongji Hospital between May 1999 and September 2015.Multiple regression analysis was used to identify clinicopathologic factors in SLNs-positive patients that could predict metastatic involvement of nSLNs.Results A total of 162 patients had positive SLNs and underwent completion axillary lymph node dissection.Multiple regression analysis revealed that primary tumor>2 cm(P=0.023),SLNs metastasis>2 mm(P=0.016),and lymphovascular invasion(P=0.001)were independent predictors of nSLNs metastasis.The more above variables a patient had,the higher likelihood of nSLNs metastasis was.Conclusion The likelihood of positive nSLNs correlates with primary tumor size,size of the largest SLNs metastasis,and presence of lymphovascular invasion. Detailed pathologic examination of the primary tumor and its SLNs metastases may increase precision in the selection of patients for further axillary surgery.
Axillary dissection;Breast cancer;Predictive factor;Sentinel lymph node
R737.9
A
2095-378X(2017)01-0001-04
10.3969/j.issn.2095-378X.2017.01.001
2016-11-08)
张 涛(1972—),男,主任医师,博士,从事乳腺癌的临床和基础研究工作;电子信箱:doctor.zt@163.com
