华蟾素对人结肠癌SW480细胞增殖的影响及其作用机制研究
2017-05-11李萌周琴范盎然胡叶杨萌左明焕
李萌+周琴+范盎然+胡叶+杨萌+左明焕


[摘要] 目的 研究華蟾素(CINO)对人结肠癌SW480细胞增殖的影响及其作用机制。 方法 体外培养SW480细胞,取对数期细胞以4×103个/孔接种于96孔板中,用培养液定容至总体积200 μL,随机分为四组:空白对照组(Control组,200 μL培养基)和CINO 1 mg/mL组(用培养基稀释500倍取200 μL)、CINO 10 mg/mL组(用培养基稀释50倍取200 μL)、CINO 100 mg/mL组(用培养基稀释5倍取200 μL),采用MTT法检测CINO对SW480细胞的生长抑制作用,倒置荧光显微镜实时成像技术观察SW480细胞凋亡形态,酶联免疫吸附测定(ELISA)法检测CINO对SW480细胞血管内皮生长因子(VEGF)及血管内皮生长因子受体2(VEGF-R2)表达的影响。 结果 作用24、48、72 h后,MTT结果显示CINO 1、10、100 mg/mL组A540值均较Control组显著下降,差异有统计学意义(P < 0.05)。作用0、24、48 h后,倒置荧光显微镜观察CINO组(1、10、100 mg/mL)细胞凋亡数明显多于空白对照组。ELISA结果显示,CINO组能减少SW480细胞VEGF及VEGF-R2的蛋白表达,与空白对照组比较,差异有统计学意义(P < 0.05)。 结论 CINO能抑制结肠癌细胞增殖,诱导其凋亡,其机制可能与抑制肿瘤细胞自分泌VEGF、VEGF-R2有关。
[关键词] 结肠癌;华蟾素;SW480细胞;细胞凋亡;血管内皮生长因子
[中图分类号] R735.302 [文献标识码] A [文章编号] 1673-7210(2017)03(c)-0004-05
Effect of cinobufacini on proliferation of human colon cancer SW480 cells and study on its mechanism
LI Meng* ZHOU Qin* FAN Angran HU Ye YANG Meng ZUO Minghuan▲
Department of Oncology, Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China
[Abstract] Objective To study the effect of cinobufacini (CINO) on proliferation of human colon cancer SW480 cells and its mechanism. Methods The SW480 cells were cultured generally, the cells at logarithmic phase were inoculated into 96-well plates by 4×103/hole, the nutrient solution was used to filled to total volume 200 μL, and they were randomly divided into four groups: blank control group (control group, 200 μL complete medium), CINO 1 mg/mL group (CINO was diluted to 500 times using complete medium and take 200 μL), CINO 10 mg/mL group (CINO was diluted to 50 times using complete medium and take 200 μL), CINO 100 mg/mL group (CINO was diluted to 5 times using complete medium and take 200 μL). The anti-proliferative effect of CINO for SW480 cells was measured by MTT assay. The apoptotic morphology of SW480 cells were observed with inverted real-time fluorescence microscopy imaging. Enzyme linked immunosorbent assay (ELISA) method was used to detect the effects of SW480 cells for the expression of vascular endothelial growth factor (VEGF) and vascular endothelial growth factor receptor-2 (VEGF-R2). Results After 24, 48, 72 h, the MTT test showed that compared with the control group, the A540 of CINO 1, 10, 100 mg/mL groups was dropped significantly, the difference was statistically significant (P < 0.05). After 0, 24, 48 h, the inverted real-time fluorescence microscopy imaging showed that the number of apoptotic cells in CINO group (1, 10, 100 mg/mL) were significantly higher than those of control group. Compared with the control group, ELISA results showed that CINO group could reduce the protein expression of VEGF and VEGF-R2, the difference was statistically significant (P < 0.05). Conclusion CINO can inhibit the proliferation of colonic cancer cells, and induces apoptosis, and its mechanism may be related to inhibiting the autocrine of VEGF and VEGF-R2 in cancer cells.
[Key words] Colon cancer; Cinobufacini; SW480 cells; Cell apoptosis; Vascular endothelial growth factor
结肠癌(colon cancer)是全球最常见的恶性肿瘤之一,其发病率仍然呈逐年增高的趋势[1]。在结肠癌的形成、进展、浸润和迁移中,肿瘤细胞自分泌的血管内皮生长因子(VEGF)及其受体VEGF-R2扮演着重要的角色。华蟾素(cinobutacini,CINO)注射液是中华大蟾蜍皮经加工制成的水溶性制剂,在临床上广泛应用于治疗结肠癌[2]。本研究旨在观察CINO在体外对人结肠癌细胞系SW480生长增殖及细胞凋亡形态的影响以及分泌VEGF、VEGF-R1、VEGF-R2的代谢变化,为结肠癌的治疗提供新思路及实验依据。
1 材料与方法
1.1 细胞培养及细胞分组
人结肠癌SW480细胞系购于中国科学院细胞库。SW480细胞使用RPMI1640完全培养基中(内含10%胎牛血清、100 U/mL青霉素,100 μg/mL链霉素),在37℃、5%CO2培养箱中培养,细胞经胰酶消化、传代和收获,取对数生长期细胞,胰酶消化后进行细胞计数,以4×103个/孔接种于96孔板中,用培养液定容至总体积200 μL,细胞贴壁后更换培养基,加入待测药物,随机分为四组:①Control组(200 μL培养基);②CINO 1 mg/mL组(用培养基稀释500倍取200 μL);③CINO 10 mg/mL组(用培养基稀释50倍取200 μL);④CINO 100 mg/mL组(用培养基稀释5倍取200 μL)。包装细胞PT-67 RFP,包装细胞PT-67 H2b GFP由安泰康生物技术(北京)有限公司构建提供。
1.2 药品和试剂
CINO(5 mL,500 mg/mL,批号20150314)购自安徽华润金蟾有限公司,用时使用RPMI1640完全培养基(购自CORNING公司,批号为20141010)稀释至所需浓度。PBS(购自CORNING公司,批号为20140110)0.25%胰酶、Geneticin(G418Sulfate)购自Gibco公司(批号为20150106、20141220),DMSO(购自Sigma公司,批号为20150105),MTT(购自Amresco公司,批号为20141120),Hygromycin B购自Invitrogen(批号为106 87010),VEGF Human酶联免疫吸附测定(ELISA)Kit、Human VEGF-R2 ELISA BMS2019购自Abcam公司(批号分别为ab100665、ab100662)。
1.3 MTT法检测细胞增殖抑制率并绘制生长曲线
取对数生长期的Control组、CINO组(1、10、100 mg/mL)SW480细胞,每个组设置6个平行复孔,分别于24、48、72 h进行MTT检测,每孔加入20 μL的MTT溶液,CO2培养箱孵育4 h后,去上清,加入100 μL/孔DMSO溶液,充分溶解后,酶标仪测定540 nm吸光值(A)。计算细胞生长抑制率,绘制生长曲线。
1.4 倒置荧光显微镜观察细胞凋亡的形态学变化
1.4.1 双色荧光细胞的转染与筛选 稳定转染双色荧光细胞,是通过将绿色荧光蛋白(GFP)特异性转入已有的表达红色荧光蛋白(RFP)细胞的细胞核中进行稳定表达。将包装细胞PT-67 H2b RFP培养至对数期,收集培养4 h的新鲜上清液,0.22 μm滤膜过滤后,对SW480细胞进行转染后可见部分细胞质表达RFP,用Hygromycin B及G418进行单克隆筛选得到SW480 RFP。再用同样方法对SW480 RFP进行转染,最终得到双色荧光转染的SW480细胞(SW480 DUAL)。
1.4.2 荧光显微镜下形态学观察 将双色荧光人结肠癌细胞株SW480 DUAL细胞分为Control组及CINO组(1、10、100 mg/mL),CO2培养箱孵育0、24、48 h,倒置荧光显微镜进行成像,观察细胞形态。
1.5 ELISA法检测VEGF、VEGF-R2表达
1.5.1 ELISA法检测VEGF表达 取Control组及CINO组(1、10、100 mg/mL)干预48 h后的人结肠癌细胞SW480的上清液,1000 r/min离心20 min再取上清(离心半径15 cm),严格按照试剂盒说明操作,将不同浓度的VEGF标准品(8.23、24.69、74.07、222.2、666.7、2000、6000 pg/mL)以及不同组的细胞上清液于酶标仪中检测450 nm吸光度值和上清中VEGF吸光度值,每个浓度设3个平行孔,计算VEGF含量。
1.5.2 ELISA法检测VEGF-R2表达 将CINO组(1、10、100 mg/mL)及Control组的细胞上清弃掉,加细胞裂解液,离心后取上清,将不同浓度的VEGF-R2标准品(78.125、156.25、312.5、625、1250、2500、5000 pg/mL)以及不同组的细胞上清液于酶标仪中检测并计算VEGF-R2含量。
1.6 统计学方法
采用SPSS 19.0统计软件进行分析,计量资料数据以均数±标准差(x±s)表示,对成组设计的多个样本均数的比较进行方差分析,组间两两比较采用独立样本t检验。计数资料行χ2检验。以P < 0.05为差异有统计学意义。
2 结果
2.1 华蟾素對人结肠癌SW480细胞增殖的影响
MTT法结果显示,作用24、48 h及72 h后,不同浓度CINO组与Control组比较差异均有统计学意义(P < 0.05),见表1。药物浓度越高,作用时间越长,CINO对SW480细胞的抑制作用越强,见图1。
2.2 华蟾素对人结肠癌SW480细胞凋亡形态的影响
2.2.1 不同浓度华蟾素干预0 h的细胞形态比较 SW480 DUAL细胞经过过夜贴壁,在0 h时间点,各组细胞形态正常,RFP在细胞质表达,GFP在细胞核表达,细胞数量较少。见图2。
2.2.2 不同浓度华蟾素干预24 h的细胞形态比较 经过24 h后,Control组细胞增殖较快,大小均一,核质分明(图3A),CINO组(1、10、100 mg/mL)中,随着华蟾素浓度的增高,椭球形细胞逐渐增多(图3B~D),并且可见散落的细胞核碎片,细胞死亡已经开始。
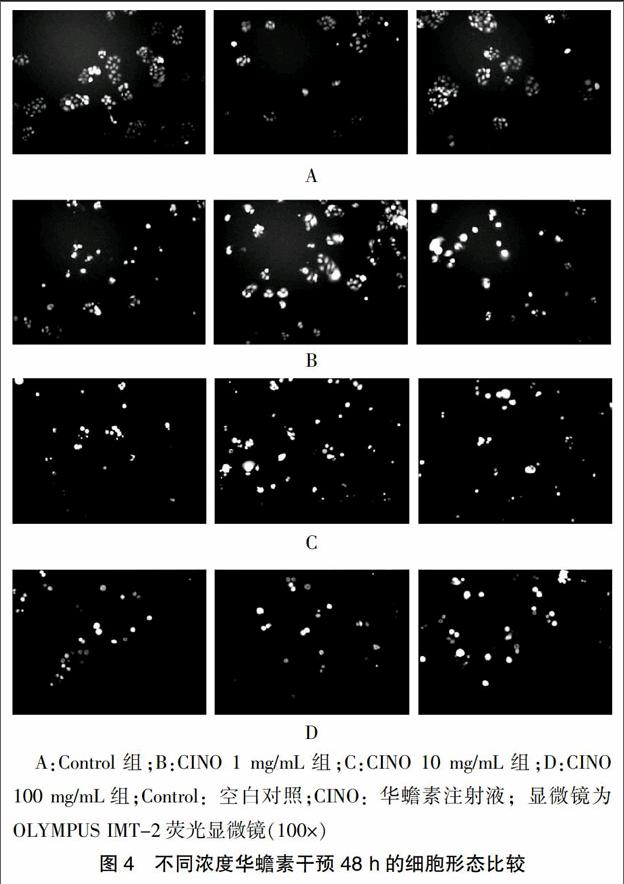
2.2.3 不同濃度华蟾素干预48 h的细胞形态比较 48 h后,Control组细胞呈现明显快速增殖,细胞形态正常(图4A),CINO组(1 mg/mL、10 mg/mL、100 mg/mL)(图4B~D)出现明显细胞形态失常,出现明显的核环状结构、核碎裂的细胞凋亡形态,空泡细胞质,散落的细胞碎片明显可见,随着浓度浓度增高,病变越明显,其中最高剂量组(图4D)出现大量明显凋亡形态学特征(核环状结构)。
2.3 ELISA检测VEGF、VEGF-R2的表达
2.3.1 ELISA检测VEGF含量 CINO组(1、10、100 mg/mL)VEGF蛋白的表达量分别为(271.10±0.32)、(240.99±18.63)、(207.76±18.97)pg/mL,与Control组[(285.65±31.12)pg/mL]比较,差异有统计学意义(P < 0.05),说明华蟾素呈浓度依赖性抑制SW480细胞分泌VEGF。
2.3.2 ELISA检测VEGF-R2含量 CINO组(1、10、100 mg/mL)VEGF-R2蛋白的表达量分别为(318.10±34.54)、(193.98±4.75)、(150.76±18.97)pg/mL,与Control组[(448.44±190.07)pg/mL]比较,差异有统计学意义(P < 0.05),说明华蟾素呈浓度依赖性抑制SW480细胞分泌VEGF-R2。
3 讨论
结肠癌的发病率逐年上升,病死率则位居癌症死亡原因第5位[1]。中医药治疗肿瘤历史悠久,近年来日益成为结肠癌综合治疗的重要组成部分[3-5]。
在中药抗肿瘤机制的研究中,VEGF及其受体的表达与结合一直是当前肿瘤治疗中的研究热点。VEGF是1989年Ferrara等[6]从牛的垂体滤泡细胞中分离出的一种能选择性促进血管内皮细胞分裂的蛋白质。肿瘤细胞分泌VEGF的方式分为旁分泌和自分泌两种形式。恶性肿瘤细胞分泌产生的VEGF可作用于相邻基质血管内皮细胞VEGF受体(主要为VEGF-R2),以此促进血管内皮细胞分裂、增殖,诱导肿瘤血管新生,此为VEGF的旁分泌作用。近年来,有研究表明某些恶性肿瘤细胞可选择性地表达VEGF受体,肿瘤细胞分泌的VEGF通过作用于上述表面受体使之发生磷酸化,进而激发胞内蛋白质发生一系列磷酸化反应形成所谓的肿瘤细胞VEGF自分泌环[7-12],此为VEGF的自分泌作用,而抑制肿瘤细胞自分泌VEGF及其受体也成为了肿瘤药物研究的新靶点。
CINO中的多种成分无论在临床研究中还是在实验研究中都被证实有明确的抗肿瘤作用[13]。然而既往的国内外研究中,多数探讨的为CINO诱导肿瘤细胞凋亡的机制[14-18],甚少有人从中药抑制结肠癌细胞自分泌VEGF及其受体的角度探讨中药治疗结肠癌的不同机制。
本研究中MTT实验及绘制的生长曲线说明CINO能显著抑制SW480细胞的生长增殖能力,且呈一定的量效与时效关系。采用肿瘤细胞的荧光蛋白转染技术,能够直观动态监测肿瘤细胞生长、凋亡、转移[19-21]。由双色荧光细胞成像图可见,CINO对人结肠癌细胞SW480有明显的增殖抑制、诱发凋亡的作用,并且随着时间延长和浓度增加,抑制增殖和促进凋亡的作用越强。ELISA显示CINO能使VEGF及VEGF-R2蛋白表达下降,并呈浓度依赖性,提示CINO能抑制SW480细胞的增殖作用,其机制可能与下调VEGF及VEGF-R2表达有关。这为CINO治疗结肠癌提供了客观的实验依据,同时也为进一步探讨CINO抗肿瘤分子机制提供部分研究基础。
[参考文献]
[1] 陈万青,郑荣寿,张思维,等.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-10.
[2] 李泉旺,孙韬,胡凯文.华蟾素抗肿瘤机制的研究进展[J].中华中医药杂志,2010,25(12):2075-2078.
[3] Deng S,Hu B,An HM,et al. Teng-Long-Bu-Zhong-Tang,a Chinese herbal formula,enhances anticancer effects of 5-Fluorouracil in CT26 colon carcinoma [J]. Bmc Completment Altern Med,2013,13(1):128.
[4] Wen XD,Wang CZ,Yu CH,et al. Salvia miltiorrhiza(Dan Shen)Significantly Ameliorates Colon Inflammation in Dextran Sulfate Sodium Induced Colitis [J]. Am J Chin Med,2013,41(5):1097-108.
[5] Cai YC,Xia Q,Luo RZ,et al. Berberine inhibits the growth of human colorectal adenocarcinoma in vitro and in vivo [J]. J Nat Med,2014,1(68):53-62.
[6] Ferrara N,Henzel WJ. Pituitary follicular cells secrete a novel heparin -binding growth factor specific for vascular endothelial cells [J]. Biochem Biophys Res Commun,1989,161(2):851-858.
[7] Vieira JM,Santos SC,Espadinha C,et al. Expression of vas-cular endothelial growth factor(VEGF)and its receptors inthyroid carcinomas of follicular origin:a potential autocrine loop [J]. Eur J Endocrinol,2005,153(5):701-709.
[8] Weigand M,Hantel P,Kreienberg R,et al. Autocrine vascular endothelial growth factor signalling in breast cancer. Evidence from cell lines and primary breast cancer cultures in vitro [J]. Angiogenesis,2005,8(3):197-204.
[9] Mercurio AM,Lipscomb EA,Bachelder RE. Non-angiogenic functions of VEGF in breast cancer [J]. J Mammary Gland Biol,2005,10(4):283-290.
[10] Lee TH,Seng S,Sekine M,et al. Vascular endothelial growthfactor mediates intracrine survival in human breast carcinoma cells through internally expressed VEGFR1/FLT1 [J]. PLoS Med,2007,4(6):1101-1116.
[11] Mulkeen AL,Silva T,Yoo PS,et al. Short interfering RNA-mediated gene silencing of vascular endothelial growth factor:effects on cellular proliferation in colon cancer cells [J]. Archsurg,2006,141(4):367-374.
[12] Podar K,Tonon G,Sattler M,et al. The small-molecule VEGF receptor inhibitor pazopanib(GW786034B)targetsboth tumor and endothelial cells in multiple myeloma [J]. P Natl Acad Sci USA,2006,103(51):19478-19483.
[13] 袁梅美,惠起源.華蟾素抗恶性肿瘤的研究进展[J].中国医药导报,2014,11(2):44-46.
[14] Jie W,Chao C,Wang S,et al. Bufalin inhibits HCT116 colon cancer cells and its orthotopic xenograft tumor in mice model through genes related to apoptotic and PTEN/AKT pathways [J]. Gastroent Res Pract,2015,2015(5):1-10.
[15] Tian X,Dai S,Sun J,et al. Bufalin Induces Mitochondria-Dependent Apoptosis in Pancreatic and Oral Cancer Cells by Downregulating hTERT Expression via Activation of the JNK/p38 Pathway [J]. Evid Based Complement Alternat Med,2015,2015:546210.
[16] Chen Y,Li M,Li Z,et al. Bufalin induces apoptosis in the U-2OS human osteosarcoma cell line via triggering the mitochondrial pathway [J]. Mol Med Rep,2016,13(1):817-822.
[17] Liu F,Tong D,Li H,et al. Bufalin enhances antitumor effect of paclitaxel on cervical tumorigenesis via inhibiting the integrin α2/β5/FAK signaling pathway [J]. Oncotarget,2016,7(8):8896-8907.
[18] Wang Q,Li C,Zhu Z,et al. miR-155-5p antagonizes the apoptotic effect of bufalin in triple-negative breast cancer cells [J]. Anti-Cancer Drug,2016,27(1):9-16.
[19] 朱燕,谢丽,杨觅,等.重楼抗肿瘤作用机制的研究进展[J].癌症进展,2015,13(2):164-166.
[20] Jiang P,Yamauchi K,Yang M,et al. Tumor cells genetically labeled with GFP in the nucleus and RFP in the cytoplasm for imaging cellular dynamics [J]. Cell Cycle,2006,5(11):1198-1201.
[21] Yang M,Jiang P,Hoffman RM. Whole-body subcellular multicolor imaging of tumor-host interaction and drug response in real time [J]. Cancer Res,2007,67(11):5195-5200.
(收稿日期:2016-12-09 本文编辑:张瑜杰)
