Fe(Ⅱ)-铁氰化钾阻抑分光光度法测定消毒液中过氧化氢
2017-05-10陶锁军张爱菊张小林
陶锁军, 张爱菊, 张小林*
(1. 甘肃省平凉市第一中学, 平凉 744000; 2. 甘肃医学院, 平凉 744000)
Fe(Ⅱ)-铁氰化钾阻抑分光光度法测定消毒液中过氧化氢
陶锁军1, 张爱菊2, 张小林2*
(1. 甘肃省平凉市第一中学, 平凉 744000; 2. 甘肃医学院, 平凉 744000)
过氧化氢是一种强氧化剂,有漂白、防腐和除臭的效果,广泛用于药物合成、环境监测、临床消毒、食品生产等方面,实现对过氧化氢的灵敏检测一直是许多研究者关注的焦点。测定过氧化氢的方法主要有容量法[1]、电化学法[2]、色谱法[3]和光度法[4-5]等。近年来基于铁(Ⅲ)-铁氰化钾体系测定还原性物质成为一大热点[6-9],但尚未见铁(Ⅱ)-铁氰化钾体系阻抑分光光度法测定过氧化氢的报道。研究发现,在硫酸介质中,Fe(Ⅱ)可与铁氰化钾反应生成可溶性普鲁士蓝KFe[Fe(CN)6][10],其最大吸收波长(λmax)为720 nm,过氧化氢对铁(Ⅱ)-铁氰化钾的显色反应有显著的阻抑作用。本工作据此提出了分光光度法测定消毒液中过氧化氢的含量。
1 试验部分
1.1 仪器与试剂
7230G型可见分光光度计;FA 2004型分析天平。
过氧化氢标准溶液:17 mg·L-1,移取30%(质量分数)过氧化氢溶液1.00 mL稀释至250 mL,用高锰酸钾法标定其准确质量浓度后逐级稀释。
Fe2+标准溶液:0.001 mol·L-1,称取在110 ℃干燥至恒重的硫酸亚铁0.152 0 g,用适量水溶解,滴加1 mol·L-1硫酸溶液至澄清,移至1 L容量瓶中定容。
铁氰化钾溶液:0.01 mol·L-1。
硫酸溶液:3 mol·L-1。
所用试剂均为分析纯,试验用水为蒸馏水。
1.2 试验方法
在两只50 mL容量瓶中,分别加入0.001 mol·L-1Fe2+标准溶液10.00 mL,3 mol·L-1硫酸溶液8.0 mL;在其中一只容量瓶中加入适量过氧化氢(阻抑体系),另一只不加(非阻抑体系),充分振荡1 min后,分别加入0.01 mol·L-1铁氰化钾溶液1.0 mL,用水稀释至刻度,摇匀后放置7 min。以水作参比,采用1 cm比色皿于波长720 nm处测量阻抑体系吸光度(A)和非阻抑体系吸光度(A0),计算ΔA(A0-A)。
2 结果与讨论
2.1 吸收光谱
按试验方法在波长400~850 nm内,分别测定阻抑体系和非阻抑体系的吸收光谱(ρH2O2=0.68 mg·L-1),结果见图1。

1-非阻抑体系;2-阻抑体系图1 吸收光谱Fig. 1 Absorption spectra
由图1可知:非阻抑体系的最大吸收峰在720 nm,峰形尖锐,峰值较高,峰数单一,表观摩尔吸光率(ε)为1.20×104L·mol-1·cm-1,达到强吸收水平。阻抑体系在720 nm处仍有最大吸收,吸光度随过氧化氢的加入呈阶梯式下降,但光谱形状基本不变,由此说明Fe2+与过氧化氢之间仅存在单纯的氧化还原反应,生成物Fe3+不影响Fe2+的显色反应。
2.2 试验条件的选择
2.2.1 反应时间和显色时间
在硫酸介质中,试验考察了非阻抑体系显色时间和阻抑体系反应时间对吸光度的影响。结果表明:显色过程是测定的控制环节;非阻抑体系的吸光度在6 min内快速增大,7 min后趋于稳定,吸光度在1 h内基本保持不变;当过氧化氢的质量浓度为2.0 mg·L-1时,阻抑体系在1 min内即完成对过氧化氢的彻底还原,7 min显色后吸光度达到稳定,同样在1 h内变化不大。因此试验选择反应时间为1 min,显色时间为7 min。
2.2.2 硫酸溶液的用量
过氧化氢为含氧型氧化剂,酸性环境更有利于反应进行,也有利于抑制Fe3+的水解,按试验方法考察了3 mol·L-1硫酸溶液的用量对溶液褪色程度的影响,结果见图2。
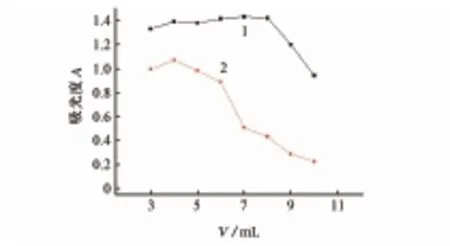
1-非阻抑体系;2-阻抑体系(a) 非阻抑体系和阻抑体系

(b) 分析体系图2 硫酸用量对吸光度的影响Fig. 2 Effect of amount of sulfuric acid on absorbance
由图2可知:阻抑体系的吸光度随3 mol·L-1硫酸溶液用量的增加而递减;非阻抑体系的最大承载体积为8.0 mL;分析体系中,硫酸溶液用量为8.0 mL以内时,ΔA随之增大,超过8.0 mL时,反而减小。试验选择3 mol·L-1硫酸溶液的用量为8.0 mL。
2.2.3 Fe2+标准溶液及铁氰化钾溶液的用量
固定过氧化氢溶液的质量浓度为2.0 mg·L-1,试验考察了0.001 mol·L-1Fe2+标准溶液的用量对体系A和ΔA的影响。结果表明:当Fe2+标准溶液的用量为10.00 mL时,吸光度的变化最大,此时非阻抑体系中Fe2+与铁氰化钾完全反应;当Fe2+标准溶液的用量在10.00~13.00 mL之间时,非阻抑体系显色反应后Fe2+严重过剩,阻抑体系褪色不明显,ΔA随之变小,方法的灵敏度降低;当Fe2+标准溶液的用量超过13.00 mL时,阻抑体系和非阻抑体系无明显差别,ΔA=0。
固定0.001 mol·L-1Fe2+标准溶液的用量为10.00 mL,过氧化氢溶液的质量浓度为2.0 mg·L-1,试验考察了0.01 mol·L-1铁氰化钾溶液的用量对测定的影响。结果表明:当0.01 mol·L-1铁氰化钾溶液的用量为0.5~0.8 mL时,ΔA随铁氰化钾溶液用量的增大而增大,当用量超过0.9 mL时,ΔA达到最大且趋于稳定。
为使非阻抑体系Fe2+反应完全,同时避免铁氰化钾大量过剩造成颜色干扰,试验选择0.001 mol·L-1Fe2+标准溶液和0.01 mol·L-1铁氰化钾溶液的用量分别为10.00,1.0 mL。
2.3 干扰试验
当过氧化氢溶液的质量浓度为16 mg·L-1时,试验考察了一些常见的无机离子和有机化合物对测定体系的干扰。结果表明:当相对误差不超过±5%时,除相同质量浓度的强氧化剂MnO42-、Cr2O72-有干扰之外,10倍的NH4+、Zn2+、Ca2+、Mg2+、葡萄糖、Al3+,3倍的Cu2+、NO2-、CO32-、SO32-、HCO3-均不影响测定。
2.4 标准曲线和检出限
按试验方法对过氧化氢标准溶液系列进行测定并绘制标准曲线。结果表明:过氧化氢的质量浓度在0.1~2.5 mg·L-1以内与ΔA呈线性关系,线性回归方程为ΔA=0.632 9ρ-0.242 4,相关系数为0.997 8。按试验方法平行测定空白溶液10次,标准偏差为0.01,计算方法的检出限(3s/k)为0.05 mg·L-1。
2.5 样品分析
移取医用过氧化氢消毒液(标示量为3%,含过氧化氢的质量分数为2.5%~3.5%) 1.00 mL稀释至1 L作为待测溶液。取待测溶液2.00 mL,按试验方法测定并进行加标回收试验,结果见表1。
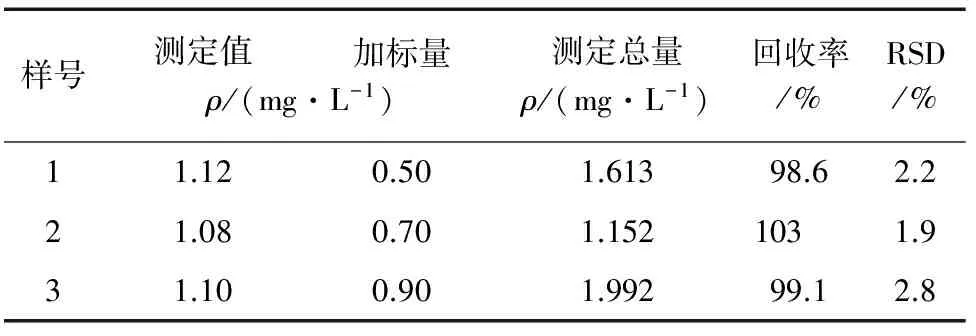
表1 样品分析结果(n=6)Tab. 1 Analytical results of samples
本方法可在室温下进行,简便快速、灵敏度高、选择性好,可用于药用消毒液中过氧化氢的测定,结果满意。
[1] 徐晓斌,王美蓉,邵可声,等.大气降水中H2O2的测定方法[J].环境化学, 1990,9(1):25-31.
[2] 陈昌国,董海峰,卢惠婷.普鲁士蓝修饰碳糊电极测定过氧化氢的研究[J].分析科学学报, 2009,25(2):232-234.
[3] 胡俊明,石文鹏,林少彬.高效液相色谱法测定化妆品中过氧化氢的方法研究[J].中国卫生检验杂志, 2003,13(5):593-596.
[4] 陈亚红,刘红梅,田丰收,等.酶催化分光光度法测定过氧化氢[J].理化检验-化学分册, 2009,45(4):401-403.
[5] 唐宁莉,蒙兴龙,凌悦菲.荧光光度法测定过氧化氢[J].分析试验室, 2012,31(8):20-22.
[6] 李洁,董文举,李全民.邻菲啰啉-Fe(Ⅱ)体系光度法间接测定头孢噻肟钠[J].分析试验室, 2007,26(11):42-44.
[7] 刘荣森,赵文善.普鲁士蓝分光光度法测定头孢氨苄[J].分析试验室, 2014,33(11):1305-1307.
[8] 温欣荣,涂常青.铁氰化钾-三氯化铁光度法测定药物中青霉胺[J].化学世界, 2015,56(8):21-24.
[9] 阮峥,过治军,周颖.邻菲啰啉-Fe(Ⅱ)体系光度法间接测定硫普罗宁[J].分析试验室, 2010,29(10):68-70.
[10] 北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学[M].3版.北京:高等教育出版社, 2002.
10.11973/lhjy-hx201702025
2016-02-25
O657.32
B
1001-4020(2017)02-0233-03
* 通信联系人。E-mail:zxlplyz2005@126.com
