英夫力西治疗炎症性肠病与肠道菌群改变的相关性研究
2017-04-26梅晨雪王恩铭扬林连捷王东旭郑长青
梅晨雪,王恩铭扬,孙 妍,林连捷,谭 悦,王东旭,郑长青*
英夫力西治疗炎症性肠病与肠道菌群改变的相关性研究
梅晨雪1,王恩铭扬2,孙 妍1,林连捷1,谭 悦1,王东旭1,郑长青1*
目的 探讨使用英夫力西(IFX)治疗炎症性肠病与肠道菌群改变的关系。方法 收集104例炎症性肠病患者,其中溃疡性结肠炎(UC)52例,克罗恩病(CD)52例,使用英夫力西治疗前后测定肠道菌群数量。另取30例健康志愿者新鲜粪便,定量培养进行菌群分析,同时测定三组C反应蛋白、血沉两项数据结果,分析其与肠道细菌组成变化的相关性。结果 治疗后,UC组酵母菌(1.09±0.17)、肠球菌(5.01±0.36)和消化球菌(3.99±0.23)的数量显著下降,乳酸杆菌(7.95±0.69)的数量显著上升(P<0.01);CD组酵母菌(1.06±0.19)、肠球菌(4.91±0.37)和消化球菌(3.90±0.19)的数量显著下降,乳酸杆菌(8.07±0.76)的数量显著上升(P<0.01)。治疗后,UC组CRP(10.33±4.64)、ESR(9.10±4.11)水平降低(P<0.01);CD组CRP(7.31±4.68)、ESR(9.27±3.13)水平降低(P<0.01)。结论 使用英夫力西治疗炎症性肠病患者后,酵母菌、肠球菌和消化球菌数量显著降低,乳酸杆菌数量显著增加,恢复到正常水平,炎症指标CRP和ESR下降,临床症状得到有效缓解。
英夫力西;炎症性肠病;肠道菌群;炎性指标
0 引言
炎症性肠病(Inflammatory bowel disease,IBD)是生活环境、遗传易感性、感染及免疫等因素共同作用下引发的一组慢性非特异性肠道炎症性疾病,主要包括溃疡性结肠炎(Ulcerative colitis,UC)和克罗恩病(Crohn′s disease,CD)[1]。其中,溃疡性结肠炎的主要病变区在黏膜下层和肠黏膜;克罗恩病的病变部位以回肠末端和结肠为主,多呈节段性、非对称性分布[2-3]。目前,IBD的治疗仍然以药物为主,但一些激素类的药物对于难治性结肠病没有很好的疗效,甚至出现激素依赖[4-5]。近年来,生物分子靶向药物的成功研制,特别是英夫力西的应用已经成为IBD患者避免切除肠管的挽救性治疗方法之一[6]。肠道菌群与IBD的发生发展密切相关,成为研究热点之一[7-9]。研究IBD患者肠道菌群的改变情况,可以为英夫力西的疗效提供佐证,并为后续的治疗策略和进行预后评估提供参考。本研究选取104例IBD患者作为研究对象,分析英夫力西的治疗效果和肠道菌群改变的相关性。
1 材料与方法
1.1 临床资料 选取2013年5月-2015年5月我院收治的IBD患者104例,均符合中华医学会消化病学分会炎症性肠病协作组在2012年制定的诊断标准[10]。排除标准:①严重心脑血管疾病;②入组前4周服用益生菌制剂、抗生素以及3个月内服用过与本次治疗相同药物的患者;③自身免疫性疾病;④患有肠道肿瘤疾病。其中UC患者52例,男35例,女17例,平均年龄(38.92±9.71)岁,平均患病时间(3.52±0.98)年;CD患者52例,男37例,女15例,平均年龄(40.33±6.49)岁,平均患病时间(3.42±0.96)年。另选择30例健康志愿者,男19例,女11例,内镜及其他检查均正常,并满足4周内未服用过益生菌或其他相似的药物。
1.2 肠道菌群检测 于治疗前1天及治疗后40周检测患者的肠道菌群指标。①采样:将无菌条件下获得的新鲜粪便(约5 g)迅速置入厌氧罐内送检;②培养基:酵母菌和肠球菌属于需氧型细菌,使用SB和EC培养基;乳酸杆菌和消化球菌属于厌氧性细菌,使用LC和PS培养基;③检测方法:采用日本光冈法检测[11],并应用细菌三级鉴定法将细菌鉴定到属的水平,在37 ℃培养72 h后,计算菌群数量(CFU/g),菌落数据结果以对数方式表示。
1.3 治疗方案 UC组和CD组给予英夫力西5 mg/kg,0、2、6时每8 h静点1次,于2~4周检测血象和肝、肾功能。于用药前1周和用药治疗40周后进行CRP和ESR检测。
1.4 统计学分析 所有数据均采用SPSS 19.0统计分析软件处理,治疗前肠道菌群数据资料的比较采用单因素方差分析;治疗前后,同组肠道菌群和炎症指标数据变化应用配对样本t检验;炎症指标数据资料的比较采用独立样本t检验。P<0.05为差异有统计学意义。相关系数r<0.4为弱相关关系,0.4≤r<0.7为中等相关关系,r≥0.7为强相关关系。
2 结果
2.1 治疗前菌群数量差异 如表1所示,与对照组相比,UC组酵母菌(2.30±0.13)、肠球菌(6.75±0.10)和消化球菌(6.33±0.11)数量显著增加(P<0.05),乳酸杆菌(5.56±0.72)数量显著减少(P<0.05);与对照组相比,CD组酵母菌(2.71±0.19)、肠球菌(6.94±0.11)和消化球菌(6.32±0.10)数量显著增加(P<0.05),乳酸杆菌(4.56±0.75)数量显著减少(P<0.05)。
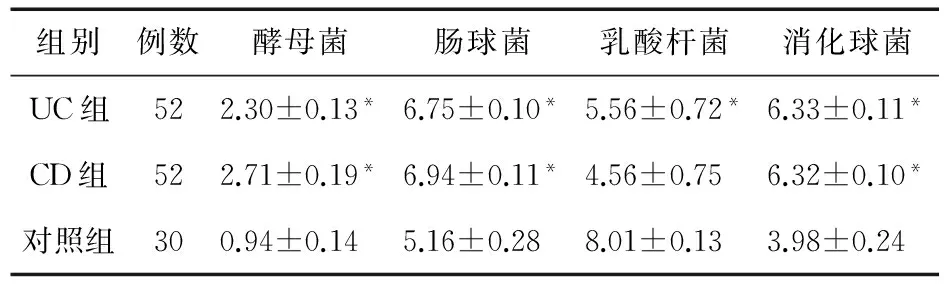
表1 英夫力西治疗前各组肠道菌群数量比较
2.2 治疗前炎症指标组间差异 如表2所示,与对照组相比,UC组CRP(13.44±4.63)和ESR(22.75±6.99)显著升高(P<0.05);CD组CRP(12.88±4.71)和ESR(23.6±5.94)显著升高(P<0.05)。

表2 英夫力西治疗前各组炎症指标比较
2.3 治疗后菌群数量变化 如表3所示,治疗后,UC组酵母菌(1.09±0.17)、肠球菌(5.01±0.36)和消化球菌(3.99±0.23)的数量显著下降,乳酸杆菌(7.95±0.7)的数量显著上升(P<0.01);在CD组中,酵母菌(1.06±0.19)、肠球菌(4.91±0.37)和消化球菌(3.9±0.19)的数量显著下降,乳酸杆菌(8.07±0.76)的数量显著上升(P<0.01)。此外,应用英夫力前后,肠道菌群数量的变化存在显著相关关系。且UC组和CD组患者在应用英夫力西治疗后,肠道菌群数量与对照组间差异无统计学意义(P>0.05)。
2.4 治疗后炎症指标的变化 如表4所示,治疗后,UC组中CRP(10.33±4.64)、ESR(9.1±4.11)水平显著降低(P<0.01);CD组CRP(7.31±4.68)、ESR(9.27±3.13)水平后显著降低(P<0.01)。且治疗后的数值均与对照组比较差异无统计学意义。此外,应用英夫力西和CRP以及ESR数值下降之间,存在显著相关关系(r>0.7)。
3 讨论
IBD是一种慢性非特异性炎症性疾病,虽然其患病机制尚不明确,但多项研究表明,遗传、环境、肠道菌群稳定性的改变和免疫应答异常等多种因素相互作用可导致IBD的发生[12-13]。

表3 英夫力西治疗后肠道菌群数量变化

表4 应用英夫力西治疗后各组炎症指标比较
英夫力西作为IBD治疗的有效手段越来越得到临床工作者的重视,Rutgeerts等[14]研究表明,英夫力西治疗UC和CD的疗效无显著差异,与本研究一致。近年来,国外学者相继发表了多篇英夫力西有效治疗IBD的报道[15-17]。目前,关于英夫力西的临床治疗数据显示,英夫力西具有较好的安全性以及较为平稳的不良反应率,且无严重的不良反应发生[18-20]。为了减少不良反应,在英夫力西治疗之前,应避免对过敏体质或肾功能障碍的患者用药;同时要注意对活动性肝炎和结核病患者的筛查,根据血药浓度调整用药剂量。
本研究所检测的4种细菌中,酵母菌、肠球菌和消化球菌属于条件致病菌,乳酸杆菌属于益生菌。从菌群数量的角度可以发现,与对照组相比,UC组患者酵母菌、肠球菌和消化球菌数量显著增加,乳酸杆菌数量显著减少;CD组呈现相同趋势。肠道的菌群组成与健康的对照组相比发生了很大的变化,其中酵母菌、肠球菌和消化球菌条件致病菌的增多,使得机体的免疫功能下降,肠黏膜的屏障功能减弱,并破坏了肠道原有的平衡。而乳酸杆菌的减少,更使得肠黏膜的屏蔽和恢复功能减弱,此结果同国外的一些研究结果一致[21-22]。因此,肠道细菌组成的改变对机体免疫功能和能量代谢有着重要的作用,有研究者用正常志愿者的肠道菌群移植到重症肠病患者的肠道内来解决肠道菌群紊乱的问题,取得了良好的效果[23]。
本研究采用CRP和ESR作为评估IBD病情的指标[24],用药前的炎症指标结果显示,IBD患者酵母菌、肠球菌等致病菌数量较健康组有显著增加,过多的致病菌会产生大量的代谢产物和累积过多的毒素,导致上皮细胞受损,肠黏膜屏蔽功能减弱,引起机体的炎症反应。
从应用英夫力西、炎症指标和菌群数量的相关性来看,三者普遍相关性较强,相关系数r均>0.7。使用英夫力西治疗IBD后,酵母菌、肠球菌和消化球菌数量显著降低,乳酸杆菌数量显著增加,与健康的对照组比较差异无统计学意义,炎症指标CRP和ESR显著下降,临床症状得到有效的缓解。
Danese[25]等的研究结果表明,IBD治疗的理想目标是使临床症状得到有效和快速的缓解,完全治愈不复发,恢复正常的生理功能。近年来,英夫力西等分子靶向药物在难治性IBD的治疗中取得了理想的治疗效果,但由于价格和不良反应等因素,部分患者无法使用。本研究显示,英夫力西对于肠道菌群紊乱有良好的治疗效果,同时可以降低炎症反应,未来可以进一步扩大样本量进行研究,并探索其不良反应的发生规律。
[1] 庞超,王玉珍.肠道菌群与微生态制剂[J].河北医药,2015,(1):108-110.
[2] Ordás I,Eckmann L,Talamini M,et al.Ulcerative colitis[J].Lancet,2012,380(9853):1606-1619.
[3] Baumgart DC,Sandborn WJ.Crohn′s disease[J].Lancet,2012,380(9853):1590-1605.
[4] Hanauer SB,Sandborn WJ.European evidence-based consensus on the diagnosis and management of Crohn′s disease[J].Gut,2007,56(2):161-163.
[5] Turner D,Walsh CM,Steinhart AH,et al.Response to corticosteroids in severe ulcerative colitis:a systematic review of the literature and a meta-regression[J].Clin Gastroenterol Hepatol,2007,5(1):103-110.
[6] Järnerot G,Hertervig E,Friisliby I,et al.Infliximab as rescue therapy in severe to moderately severe ulcerative colitis:a randomized,placebo-controlled study[J].Gastroenterology,2005,128(7):1805-1811.
[7] Sartor RB.Microbial influences in inflammatory bowel diseases[J].Gastroenterology,2008,134(2):577-594.
[8] Manichanh C,Borruel N,Casellas F,et al.The gut microbiota in IBD [J].Nat Rev Gastroenterol Hepatol,2012,9(10):599-608.
[9] DuPont AW,DuPont HL.The intestinal microbiota and chronic disorders of the gut[J].Nat Rev Gastroenterol Hepatol,2011,8(9):523-531.
[10]中华医学会消化病学分会炎症性肠病学组.炎症性肠病诊断与治疗的共识意见(2012年·广州)[J].胃肠病学,2012,51(12):818-831.
[11]Mazur PK,Einwächter H,Lee M,et al.Notch2 is required for progression of pancreatic intraepithelial neoplasia and development of pancreatic ductal adenocarcinoma [J].Proc Natl Acad Sci U S A,2010,107(30):13438-13443.
[12]Juste C,Kreil DP,Beauvallet C,et al.Bacterial protein signals are associated with Crohn′s disease[J].Gut,2014,63(10):1566-1577.
[13]Hold GL,Smith M,Grange C,et al.Role of the gut microbiota in inflammatory bowel disease pathogenesis:what have we learnt in the past 10 years[J].World J Gastroenterol,2014,20(5):1192-1210.
[14]Rutgeerts P,Sandborn WJ,Feagan BG,et al.Infliximab for induction and maintenance therapy for ulcerative colitis[J].N Engl J,2005,353(23):2462-2476.
[15]Sands BE,Tremaine WJ,Sandborn WJ,et al.Infliximab in the treatment of severe,steroid-refractory ulcerative colitis:A pilot study[J].Inflamm Bowel Dis,2001,7(2):83-88.
[16]Chey WY,Hussain A,Ryan C,et al.Infliximab for refractory ulcerative colitis[J].Am J Gastroenterol,2001,96(8):2373-2381.
[17]Kohn A,Prantera C,Pera A,et al.Anti-tumour necrosis factor alpha (infliximab) in the treatment of severe ulcerative colitis:result of an open study on 13 patients[J].Dig Liver Dis,2002,34(9):626-630.
[18]Chaparro M,Burgueo P,Iglesias E,et al.Infliximab salvage therapy after failure of ciclosporin in corticosteroid-refractory ulcerative colitis:a multicentre study[J].Aliment Pharmacol Ther,2012,35(2):275-283.
[20]Leblanc S,Allez M,Seksik P,et al.Successive treatment with cyclosporine and infliximab in steroid-refractory ulcerative colitis[J].Am J Gastroenterol,2011,106(4):771-777.
[21]De Cruz P,Kang S,Wagner J,et al.Association between specific mucosa-associated microbiota in Crohn′s disease at the time of resection and subsequent disease recurrence:a pilot study[J].J Gastroenterol Hepatol,2015,30(2):268-278.
[22]Morgan XC,Tickle TL,Sokol H,et al.Dysfunction of the intestinal microbiome in inflammatory bowel disease and treatment[J].Genome Biol,2012,13(9):R79.
[23]Grehan MJ,Borody TJ,Leis SM,et al.Durable alteration of the colonic microbiota by the administration of donor fecal flora[J].J Clin Gastroenterol,2010,44(8):551-561.
[24]Mowat C,Cole A,Windsor A,et al.Guidelines for the management of inflammatory bowel disease in adults[J].Gut,2011,60(5):571-607.
[25]Danese S,Colombel JF,Peyrinbiroulet L,et al.Review article:the role of anti-TNF in the management of ulcerative colitis-past,present and future[J].Aliment Pharmacol Ther,2013,37(9):855-866.
Correlation between changes of intestinal flora and infliximab as therapy in patients with inflammatory bowel disease
MEI Chen-xue1,WANG En-ming-yang2,SUN Yan1,LIN Lian-jie1,TAN Yue1,WANG Dong-xu1,ZHENG Chang-qing1*
(1. Shengjing Hospital of China Medical University,Shenyang 110022,China;2.Basic Medical College of China Medical University,Shenyang 110112,China)
Objective To investigate the correlation between infliximab treatment for inflammatory bowel disease (IBD) with the changes in intestinal flora.Methods We collected 104 IBD patients (including 52 cases with ulcerative colitis and 52 cases with Crohn′s disease) and 30 healthy volunteers.The intestinal flora was analyzed.The levels of CRP and ESR were detected to assess the correlation between intestinal flora and inflammatory markers.Results After treatment, the number ofSaccharomyces(1.09±0.17),Enterrococcus(5.01±0.36) andPeptococcus(3.99±0.23) decreased significantly, while that ofLactobacillus(7.95±0.69) increased markedly in patients with UC (P<0.01); the number ofSaccharomyces(1.06±0.19),Enterrococcus(4.91±0.37) andPeptococcus(3.90±0.19) decreased significantly,while that ofLactobacillus(8.07±0.76) increased markedly in patients with CD (P<0.01).The levels of CRP and ESR decreased significantly in UC patients(10.33±4.64,9.10±4.11,P<0.01) and CD patients (7.31±4.68, 9.27±3.13,P<0.01).Conclusion Infliximab therapy can decrease the number ofSaccharomyces,EnterrococcusandPeptococcus,while increase the number ofLactobacillusin patients with IBD,and decreased the levels of CRP and ESR,thus relieving the clinical symptoms effectively.
Infliximab;Inflammatory bowel disease;Intestinal flora;Inflammatory markers
2016-09-21
1.中国医科大学附属盛京医院,沈阳 110022;2.中国医科大学基础医学院,沈阳 110122
辽宁省自然科学基金(2014021083)
10.14053/j.cnki.ppcr.201704008
*通信作者
