LC-MS/MS法测定布洛芬颗粒剂的人体生物等效性研究
2017-04-26董晓茜张世良夏素霞
董晓茜,吴 怡,张世良,杨 瑞,唐 思,夏素霞
·药学研究·
LC-MS/MS法测定布洛芬颗粒剂的人体生物等效性研究
董晓茜,吴 怡,张世良,杨 瑞,唐 思,夏素霞*
目的 研究布洛芬颗粒在健康人体内的药动学及其生物利用度,以评价其与布洛芬混悬液的生物等效性。方法 23例健康男性志愿受试者,采用随机、开放、单剂量、双周期自身交叉试验设计。分别口服布洛芬颗粒(受试制剂)与布洛芬混悬液(参比制剂)后,采用液相色谱-串联质谱(LC-MS/MS)法测定血浆中布洛芬的药物浓度。结果 受试制剂与参比制剂的Cmax分别为(17.438 6±5.304 0)、(18.557 7±4.641 7) mg/L,AUC0-24分别为(59.000 3±13.935 3)、(58.506 4±16.720 2) mg/(h·L),AUC0-∞分别为(59.718 0±14.020 0)、(59.227 8±16.815 8) mg/(h·L),Tmax分别为(1.478 3±0.922 9)、(1.021 7±0.822 0) h。结论 空腹口服布洛芬颗粒受试制剂与参比制剂具有生物等效性。
布洛芬;血药浓度;LC-MS/MS;生物利用度;药代动力学
0 引言
布洛芬是一种非甾体抗炎药,通过抑制环氧化酶(COX)进而抑制前列腺素合成,缓解因前列腺素聚集引起的炎症反应、发热和疼痛。用于减轻中度疼痛,如关节痛、神经痛、肌肉疼、偏头疼、头痛、牙痛,也可减轻普通感冒或流行性感冒引起的发热[1-2]。既往研究多采用HPLC方法检测体内药物浓度,重复性好,但灵敏度低。本试验采用灵敏度较高的液相色谱-串联质谱(LC-MS/MS)法测定血浆中布洛芬的药物浓度。
1 材料
1.1 仪器 G6410A QQQ LC-MS/MS联用仪(美国Aglient公司),ESI离子源,数据处理系统:Aglient MassHunter Quantitative Analysis软件。XW-80A微型旋涡混合仪(上海沪西分析仪器厂),XS105分析天平(梅特勒-托利多仪器有限公司),SIGMA 3-18K低温冷冻离心机(德国SIGMA公司)。
1.2 试药 布洛芬标准物质(纯度:99.5%,中国食品药品检定研究院提供,批号:100179-201406);吲哚美辛标准物质(纯度:99.9%,购自中国食品药品检定研究院,批号:100258-200904);甲醇、醋酸铵均为色谱纯,冰醋酸为分析纯,空白血浆由辽宁中医药大学附属第二医院提供。
2 方法
2.1 研究对象 临床试验方案经伦理委员会讨论通过后,试验入选23例健康男性受试者,年龄18~40岁,体重不低于50 kg,且体重指数(BMI)为19~24 kg/m2,健康情况良好,对药物无过敏史,对布洛芬及辅料中任何成分不过敏[3]。实验前签署知情同意书和协议书。
2.2 给药方案 采用随机、开放、单剂量、双周期自身交叉试验设计。受试者禁食过夜至少10 h后,于试验第1天早晨空腹以250 mL温开水冲服受试制剂布洛芬颗粒1袋或参比制剂布洛芬混悬液10 mL。第1周期服药后的1周为清洗期,清洗期后交叉服药。第2周期的服药剂量及方法与第1周期一致。
2.3 血样采集与处理 分别于试验第1天服药前(0 h)及服药后0.25、0.50、0.75、1.00、1.50、2.00、3.00、4.00、6.00、8.00、10.00、12.00、16.00、24.00 h采集静脉血,总计15个采血点(每个点采血5 mL)。置预先标记好的肝素化试管中,3 000 r/min离心10 min,并于2 h内置超低温冰箱(≤ -70 ℃)中冷冻保存。
2.4 血浆样品分析方法的建立
2.4.1 血浆样品处理 精密量取血浆样品100 μL于1.5 mL空白离心管中,精密加入10 μL内标(吲哚美辛)溶液,涡旋混匀30 s,加入300 μL甲醇,涡旋混匀2 min,离心10 min (14 000 r/min),取上清液10 μL进样分析。
2.4.2 色谱条件 采用Aglient Poroshell 120 SB-C18(4.6 mm×75 mm,2.7 μm)色谱柱;流动相:10 mmol/L醋酸铵(含0.1%冰醋酸)-甲醇(24∶76);柱温:40 ℃;进样量:10 μL;流速:0.6 mL/min。
2.4.3 质谱条件 ESI离子源;负离子模式检测;扫描方式为选择反应监测(MRM);Gas流速9 L/min,Gas温度350 ℃,Nebulizer 40 psi,Capillary 4 000 V;用于定量的离子分别为布洛芬m/z205.1 →m/z161.0,Fragmentor 110,Collision Energy 0 V;内标吲哚美辛m/z356.1 →m/z312.1,Fragmentor 120,Collision Energy 1 V;扫描时间为200 ms[4-5]。
2.5 标准溶液与内标系列标准溶液的配制
2.5.1 标准系列溶液的配制 精密称取布洛芬标准物质34.57 mg,置25 mL量瓶中,用甲醇溶解并稀释至刻度,制成1.376 mg/mL的布洛芬储备液;用甲醇稀释储备液,制成浓度为1.101、5.504、11.01、22.02、88.06、110.1、275.2 μg/mL的布洛芬标准系列溶液。
2.5.2 内标溶液的配制 精密称取吲哚美辛标准物质13.27 mg,置于10 mL容量瓶中,用甲醇溶解并定容至刻度,得浓度为1.326 mg/mL吲哚美辛储备液,再用甲醇稀释至26.52 μg/mL作为内标工作溶液。
2.6 分析方法的确证
2.6.1 方法的选择性 精密量取6份不同来源的空白血浆各100 μL,按“血浆样品处理方法”进行操作(不加内标),得色谱图1A;取220.2 μg/mL的布洛芬标准溶液10 μL,N2下吹干,加入100 μL空白血浆,按“2.4.1”项下方法进行操作,得色谱图1B;取1号受试者口服受试制剂1 h后收集的血浆样品,按“血浆样品处理方法” 进行操作,得色谱图1C。结果显示,布洛芬的保留时间为3.6 min左右,内标吲哚美辛的保留时间为2.8 min左右,表明血浆中内源性物质不干扰布洛芬和内标的测定。
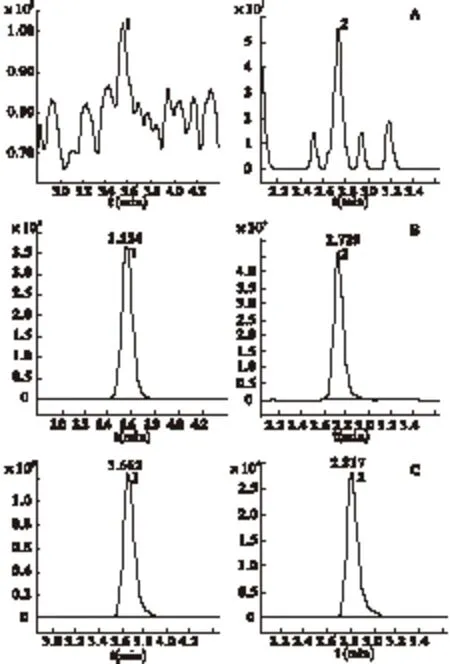
图1 专属性色谱图 注:1.布洛芬,2.吲哚美辛;A.空白血浆色谱图,B.空白血浆加 入布洛芬和吲哚美辛的色谱图,C.1号健康受试者口服受试制剂 1 h后血浆样品色谱图
2.6.2 标准曲线制备和定量下限 分别精密量取布洛芬系列标准溶液10 μL于1.5 mL空白离心管中,N2下吹干,加入100 μL空白血浆,涡旋混匀,配制成布洛芬浓度分别为0.110 1、0.550 4、1.101、2.202、8.806、11.01、27.52 μg/mL的标准含药血浆,建立标准曲线,进行LC-MS/MS分析。计算布洛芬的峰面积As和内标峰面积Ai的比值f(f=As/Ai),以待测物和内标浓度比为横坐标,以f值为纵坐标,用加权(权重系数:1/x2)最小二乘法进行线性回归运算,得回归方程线性范围为0.110 1~27.520 0 μg/mL,定量下限为0.110 1 μg/mL (S/N>10)。
2.6.3 方法精密度试验 分别精密量取不同浓度的布洛芬质控溶液,配制成布洛芬血浆低、中、高浓度分别为0.220 2、5.504、22.02 μg/mL的标准含药血浆,每个浓度各配制6份样品,按“血浆样品处理方法”进行操作。每天1批,连续3 d,共3批,计算批内和批间精密度。结果表明,低、中、高3个浓度(0.220 2、5.504、22.02 μg/mL)批内和批间质控样品的RSD均<15%,精密度和准确度结果均符合要求。
2.6.4 方法回收率试验 分别精密量取不同浓度的布洛芬溶液各10 μL于1.5 mL空白离心管中,N2下吹干,加入100 μL空白血浆(3份不同来源的),配制成布洛芬血浆低、中、高3个浓度分别为0.220 2、5.504、22.02 μg/mL的血浆样品各3份,再按“血浆样品处理方法”进行操作,10 μL进样分析;另取不同浓度的布洛芬溶液和内标溶液各10 μL于1.5 mL空白离心管中,N2下吹干,加入100 μL水,再加入300 μL甲醇,涡旋混匀,配制成低、中、高3个浓度分别为0.220 2、5.504、22.02 μg/mL,10 μL进样,每个浓度进行3个样本分析。结果表明,布洛芬的低、中、高3个浓度的提取回收率为88.56%~96.57%。
2.6.5 稳定性考察 分别精密量取布洛芬低、高质控溶液各10 μL于1.5 mL空白离心管中,N2下吹干,加入100 μL空白血浆,涡旋混匀,配制成布洛芬血药低、高2个浓度分别为0.220 2和22.02 μg/mL的标准含药血浆,制备5份(每份各浓度分别为3个样本)。其中一份于-70 ℃冰箱冷冻,待血浆融化后6 h,考察血浆样品的血浆融化后6 h稳定性;另一份血浆样品处理液在自动进样器中放置12 h后进样分析,考察血浆样品处理液在自动进样器中放置稳定性;另取其中2份血浆样品处理液,分别在室温下放置7 h和24 h后进样分析,考察血浆样品处理液在室温下放置稳定性;另一份血浆样品经历3次冷冻-解冻循环后,考察血浆样品冻融3次的稳定性;另取出冰箱中冷冻保存45 d的布洛芬长期冷冻血浆样品(血药浓度分别为0.219 6、21.97 μg/mL),考察血浆样品的长期冷冻稳定性。
结果表明,血浆样品室温放置6 h稳定,血浆样品处理液在自动进样器中放置12 h稳定,血浆样品处理液室温放置24 h稳定,血浆样品经过3次反复冻融稳定,血浆样品-70 ℃放置45 d稳定,以上稳定性考察数据,其RSD均<15 %。
3 结果
3.1 血药浓度-时间曲线 1号健康受试者单次口服受试制剂布洛芬颗粒0.2 g及参比制剂布洛芬混悬液(美林)0.2 g后,观察布洛芬血药浓度随时间的变化情况。布洛芬血药浓度-时间曲线见图2。
3.2 药代动力学参数 23例健康受试者分别口服受试制剂布洛芬颗粒0.2 g,布洛芬药代动力学参数见表1。

图2 布洛芬颗粒单次给药血浆中布洛芬的浓度-时间曲线 注:T.受试制剂布洛芬颗粒,R.参比制剂布洛芬混悬剂

表1 23例受试者口服受试制剂布洛芬颗粒0.2 g后布洛芬的药代动力学参数(T)汇总
4 讨论
以往研究中多采用HPLC方法检测体内药物浓度,不仅灵敏度较低,而且样品处理复杂,方法较为繁琐。本文建立LC-MS/MS联用法测定血浆中布洛芬浓度,可提高其灵敏度,方法简便快捷,适用于血浆样品中布洛芬的含量测定。
流动相的选择:本实验曾采用甲醇-水、甲醇-磷酸二氢钾(含磷酸)和乙腈-乙酸钠(含乙酸),均因为分离度不好而未选择,另外,由于血浆具有一定的pH值,对布洛芬的响应有一定影响,最终采用醋酸铵(含0.1%冰醋酸)-甲醇系统为最佳流动相,在该条件下,指标性成分和内标峰与内源性杂质峰均得到良好分离,且药物峰形好,灵敏度高,能达到血浆样品测定的要求。
实验过程中进行负离子检测时,[M-H]-和[M-Cl]-峰同时存在,后经过方法学考察发现[M-H]-峰不稳定,故选择[M-Cl]-峰作为定量离子。
[1] 万元胜,陈华庭,陈东升.布洛芬颗粒剂的人体生物等效性研究[J].中国药师,2008,1(5):508-510.
[2] 张轶雯,陈尧,谭志荣,等.布洛芬缓释胶囊单剂量与多剂量给药的人体药动学及生物等效性研究[J].中国临床药理学与治疗学,2014,19(3):297-301.
[3] 国家药典委员会.中华人民共和国药典(四部)[S].北京:化学工业出版社,2015:附录356-368.
[4] 李黎,段小涛,刘茜,等.液相色谱-串联质谱法快速测定人血浆中布洛芬[J].中国药学杂志,2008,43(21):1657-1661.
[5] 薛洪源,刘军,王宇奇,等.高效液相色谱-质谱法测定人血浆中布洛芬浓度[J].华北国防医药,2007,19(6):51-53.
Study on the human bioequivalence of ibuprofen granules by LC-MS/MS
DONG Xiao-qian,WU Yi,ZHANG Shi-liang,YANG Rui,TANG Si,XIA Su-xia*
(Academy of Traditional Chinese Medicine of Liaoning Province,Shenyang 110034,China)
Objective To study the pharmacokinetics and bioavailability of ibuprofen granules in healthy volunteers in order to compare its bioequivalence with ibuprofen suspension.Methods Totally 23 healthy male volunteers were tested by random,open,single dose and double cycle self crossover design.The drug concentrations of plasma were determined by liquid chromatography tandem mass spectrometry (LC-MS/MS) method after oral administration of ibuprofen granules (test preparation) and ibuprofen suspension (reference preparation).Results The Cmaxof test preparation and reference preparation was (17.438 6±5.304 0) and (18.557 7±4.641 7) mg/L respectively;AUC0-24was (59.000 3±13.935 3) and (58.506 4±16.720 2) mg/(h·L);AUC0-∞was (59.718 0±14.020 0) and (59.227 8±16.815 8) mg/(h·L);Tmaxwas (1.478 3±0.922 9) and (1.021 7±0.822 0) h.Conclusion The oral administration of ibuprofen granules has biological equivalence for the test preparation and reference preparation.
Ibuprofen;Blood drug concentration;LC-MS/MS;Bioavailability;Pharmacokinetics
2016-09-06
辽宁省中医药研究院,沈阳 110034
*通信作者
10.14053/j.cnki.ppcr.201704020
