氯化锂对移植到周围神经内神经干细胞的影响
2017-04-25张立群张文明刘志峰蓝文彬林建华
张立群, 张文明, 刘志峰, 蓝文彬, 林建华
氯化锂对移植到周围神经内神经干细胞的影响
张立群, 张文明, 刘志峰, 蓝文彬, 林建华
目的 研究氯化锂对移植到胫神经内的神经干细胞的存活、分化的影响;研究神经干细胞移植和氯化锂处理对宿主神经轴突溃变、炎症细胞浸润的影响。 方法 结扎成年大鼠右侧胫神经,将培养的神经干细胞注射到结扎部位远端,腹腔注射氯化锂或生理盐水,1周后用免疫荧光染色方法检测神经干细胞的巢蛋白(Nestin)、神经核抗原(NeuN)、胆碱乙酰转移酶(ChAT)、胶质细胞原纤维酸性蛋白质(GFAP)、神经纤丝蛋白200(NF200)、巨噬细胞抗原(ED1)的表达情况。 结果 移植到胫神经内的神经干细胞存活良好,并沿神经轴索间隙向周围扩散。移植后的神经干细胞未见Nestin阳性表达,大部分移植细胞呈GFAP阳性表达,无NeuN或ChAT阳性表达。腹腔注射氯化锂能显著减少移植细胞的GFAP阳性表达比例。胫神经结扎后,神经内轴突溃变明显。与未移植神经干细胞组比较,移植组胫神经内NF200阳性表达明显增多,联合应用氯化锂能进一步增加NF200的表达。应用氯化锂能显著减少神经干细胞移植后胫神经内的ED1表达。 结论 氯化锂能减少移植后的神经干细胞向胶质细胞方向的分化,神经干细胞移植联合应用氯化锂可以减少宿主神经轴突的溃变程度,同时能抑制神经干细胞移植后的炎症细胞浸润。
氯化锂; 神经系统/*细胞学; 干细胞; 移植; 周围神经系统疾病
神经干细胞(neural stem cell, NSC)具有多项分化潜能,已经成为中枢神经系统疾病或损伤时细胞替代治疗的重要组成部分。在脊髓损伤后,移植NSC也是脊髓损伤研究的重要方向[1]。由于脊髓损伤后局部环境不适合NSC生存,需要采用合适的方法保护NSC,增加移植后NSC的存活率,提高治疗效果。在周围神经损伤研究中,采用NSC移植修复周围神经损伤已取得较好的研究结果[2-4]。以周围神经作为NSC的载体,在脊髓损伤后移植携带有NSC的周围神经,有可能提高NSC的存活率,体现NSC的治疗作用。
研究表明,氯化锂能促进体外培养NSC的增殖,并抑制其分化[5]。同时也发现氯化锂能促进移植到脊髓内的NSC的增殖[6],但氯化锂对移植到周围神经内的NSC的影响尚不明确。本研究拟将NSC移植到结扎后的胫神经内,观察移植后NSC的存活、分化情况,研究氯化锂对NSC和移植神经的影响,为下一步将携带有NSC的胫神经移植治疗脊髓损伤打下基础。
1 材料与方法
1.1 材料
1.1.1 动物 绿色荧光蛋白(green fluorescent protein,GFP)转基因雄性SD大鼠由香港大学医学院吴武田教授赠送。健康雌性SD大鼠48只,体质量(250±20)g[上海斯莱克实验动物有限责任公司中心提供,许可证号:SCXK(沪)2007-0005]。
1.1.2 试剂 碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、表皮生长因子(epidermal growth factor,EGF,美国PeproTech公司);DMEM/F12,B-27,N-2及Accutase消化酶(美国Invitrogen公司);小鼠抗Nestin抗体、小鼠抗NeuN抗体、小鼠抗胆碱乙酰转移酶(cholin acetyltransferase,ChAT)抗体(美国Millipore公司);氯化锂、兔抗GFAP、小鼠抗NF200抗体(美国Sigma公司);小鼠抗ED1抗体(美国Serotec公司)。
1.2 方法
1.2.1 GFP转基因大鼠胚胎脊髓来源NSC的获取和培养 在清洁饲养环境下,将GFP转基因雄性SD大鼠与普通雌性SD大鼠同笼饲养,取怀孕13.5 d雌鼠,用10%水合氯醛(0.4 mL/100 g)腹腔注射麻醉后消毒腹部,在无菌条件下取出子宫和胚胎,在荧光解剖显微镜下挑选携带GFP基因的胚胎。在解剖显微镜下取出胚胎脊髓,剥除脊膜和神经根,剪成1 mm2大小碎块,用Accutase消化酶将脊髓分解成单细胞悬液,植入多聚赖氨酸包被的培养皿,用含有bFGF,EGF,B-27及N-2的DMEM/F12培养液培养。当原代NSC生长到80%汇合时,消化后传代培养。收获传代后的细胞,根据细胞计数加入适量培养液,调整细胞浓度为1×105μL-1用于神经内注射。
1.2.2 胫神经内注射NSC 将大鼠用10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉后固定于手术台上,右侧臀部及大腿后侧皮肤脱毛消毒。于右侧臀部及大腿后侧作2.5 cm长斜切口,切开皮肤,沿肌肉间隙分离,显露坐骨神经,在手术显微镜下分离胫神经和腓总神经。在坐骨神经分叉处稍远端,用显微镊垂直于胫神经干压榨胫神经10 s,在手术显微镜下见胫神经轴索完全中断,仅保留一层完整透明的神经外膜,压榨处用11-0显微缝线结扎。在胫神经结扎处远端约7 mm,将显微注射器针头逆行刺入胫神经约4 mm,缓慢注入NSC 1 μL,留针2 min后再缓慢注入NSC 1 μL,留针2 min,将针头缓缓退出,针眼再压迫2 min。用11-0显微缝线缝合神经穿刺口,逐层缝合关闭切口。
在胫神经结扎后,将实验动物随机分为生理盐水注射组(normal saline, NS组),氯化锂注射组(Li组),NSC移植+生理盐水注射组(NSC+NS组),NSC移植+氯化锂注射组(NSC+Li组)。每组10只,分别于手术次日开始腹腔注射氯化锂(85 mg/kg)或生理盐水(2 mL/100 g),持续1周。
注射NSC后1周,将大鼠用10%水合氯醛(0.5 mL/100 g)深度麻醉,打开胸腔,自心尖部向主动脉方向插入针头达升主动脉,灌注150 mL 0.01 mmol/L PBS后再灌注300 mL 4%多聚甲醛(0.1 mol/L,pH=7.4),随后在解剖显微镜下取出移植有NSC的胫神经段,4%多聚甲醛固定24 h后移入30%蔗糖溶液保存。
1.2.3 胫神经标本的包埋和冰冻切片 每组2例标本以注射部位为中心取3 mm长的胫神经段,包埋冷冻后按20 μm厚度进行连续横断冰冻切片;其余标本以注射部位为中心取6 mm长的胫神经段,包埋冷冻后按20 μm厚度沿胫神经长轴进行连续纵行切片。
1.2.4 免疫荧光染色和图像分析 标本取材切片后,将切片漂洗、10%山羊血清封闭,加入一抗4 ℃孵育过夜。次日根据一抗类型加入相应的荧光二抗,室温下避光孵育1 h。封片后,每例标本选取5张切片,在荧光显微镜下拍摄各组染色照片。用Image J软件测量每幅图像内各组阳性染色面积,计算染色范围的比例。
2 结 果
2.1 GFP转基因大鼠胚胎脊髓来源NSC的培养与鉴定 培养的NSC在多聚赖氨酸包被的培养皿上呈单层贴壁生长。培养第4~5天时细胞密度进一步增加,NSC发出的轴突相互交织呈网状。传代培养后,在倒置荧光显微镜下观察,可见所有的细胞都呈绿色,说明培养的细胞均携带GFP基因,经过免疫荧光染色,表达Nestin蛋白的细胞在荧光显微镜下显示为红色,经过图片融合处理后,见绝大多数细胞呈黄色,说明培养的细胞大多为NSC(图1)。经计数,Nestin阳性细胞的比例为(81.0±9.8)%。
2.2 胫神经内移植的NSC的迁移情况 胫神经内注射1周后,NS组和Li组移植的NSC在胫神经内均存活良好。在胫神经纵切片上,NSC沿注射方向在胫神经内纵行排列,并沿着轴突间隙向两端扩散。在横切片上,NSC在注射部位聚集成团,部分细胞沿轴索间隙向周围呈蟹爪样扩散蔓延(图2)。
2.3 胫神经内移植的NSC的分化情况
2.3.1 胫神经内NSC的Nestin表达情况 NSC移植到胫神经内1周后,移植的细胞有明显的GFP阳性表达,但对照组和Li组均未见明显的Nestin阳性染色(图3A),提示移植后的NSC可能已分化为Nestin表达阴性的细胞。
2.3.2 胫神经内NSC分化为神经元样细胞的情况 NSC移植到胫神经内1周后, 对照组和Li组移植的NSC均未见明显的NeuN(图3B)或ChAT(图3C)阳性染色,提示移植后的NSC未分化为NeuN或ChAT阳性的神经元。
2.3.3 胫神经内NSC分化为胶质细胞的情况 移植NSC到胫神经内1周后,经过GFAP染色,可见对照组和Li组均有大量的GFAP阳性染色。GFAP阳性染色区域基本在GFP着色范围内。对照组绝大多数的GFAP染色区域与GFP染色区域重叠;Li组GFAP阳性表达区域范围较小,与GFP染色区域重叠部分也较少(图4)。
分别测量GFAP和GFP染色区域的面积,计算GFAP染色面积占GFP染色面积的比例,对照组和Li组分别为(86.7±13.8)%和(69.8±8.2)%。Li组GFAP阳性面积比例小于对照组,差别具有统计学意义(P<0.05,图4)。
2.3.4 胫神经轴突溃变情况 胫神经结扎后1周,各组均有明显的轴突溃变。NS组NF200染色阳性的残留轴突呈颗粒状,散在分布;Li组残留轴突情况与前者相似;NSC+NS组的残留轴突呈颗粒状或短棒状,数量较多;NSC+Li组的残留轴突数量最多(图5)。

GFP:绿色荧光蛋白;Nestin:巢蛋白. A:传代培养的神经干细胞;B:Nestin阳性的细胞呈红色;C:融合后的图片.图1 神经干细胞的体外培养和鉴定( ×20)Fig 1 The growth and identification of cultured neural stem cells( ×20)

A, B:对照组胫神经纵向和横断切片;C, D:氯化锂组胫神经纵向和横断切片.图2 移植到胫神经内的神经干细胞的存活和迁移情况( ×10)Fig 2 The survival and migration of transplanted NSCs in tibial nerve( ×10)
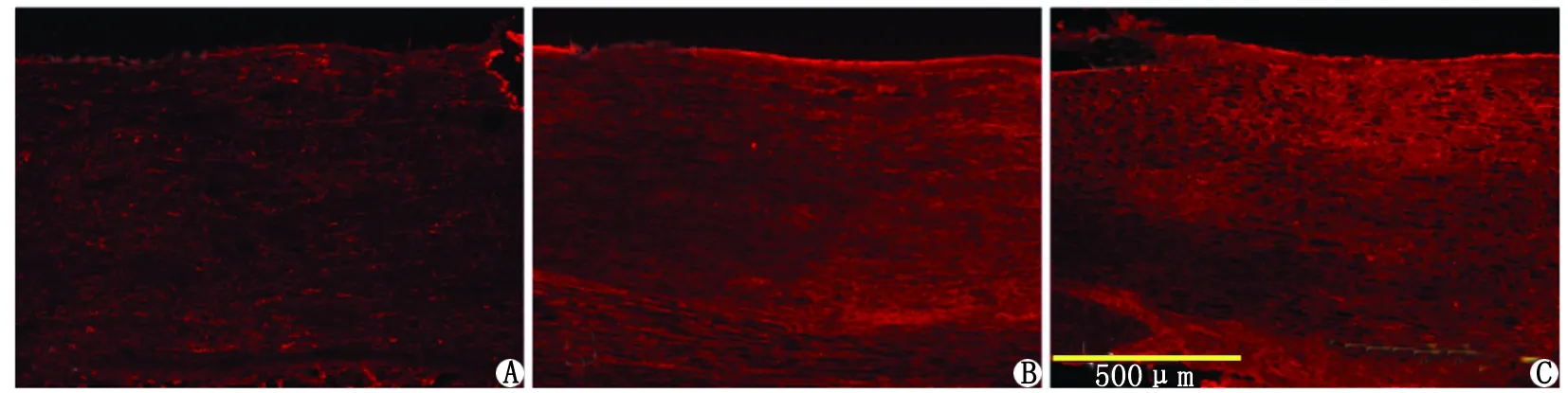
A:巢蛋白;B:神经核抗原;C:胆碱乙酰转移酶.图3 胫神经内移植的神经干细胞Nestin,NeuN和ChAT的表达情况( ×10)Fig 3 The expression of Nestin, NeuN and ChAT of transplanted NSCs in tibial nerve( ×10)
用Image J软件测量NF 200阳性染色占每个拍照视野的比例,各组的NF200阳性染色的覆盖率分别为:NS组(2.46±0.60)%,Li组(2.64±0.85)%,NSC+NS组(3.94±0.79)%,NSC+Li组(5.83±0.95)%。经过统计学分析,NS组和Li组的NF200覆盖率比较,差别无统计学意义(P>0.05);NSC+NS组和NSC+Li组的NF200阳性覆盖率显著高于前两组(P<0.01),NSC+Li组的残留轴突覆盖率也高于NSC+NS组(P<0.05,图5C)。
2.4 胫神经内炎症细胞浸润情况 实验1周后,NSC+NS组和NSC+Li组均可见到ED1阳性染色的巨噬细胞浸润。巨噬细胞浸润范围除了见于移植的NSC周围外,也见于胫神经内的其他部位。NSC+NS组和NSC+Li组单位视野内平均ED1阳性表达面积分别是(8.97±4.07)%和(6.31±2.78)%,NSC+NS组巨噬细胞浸润明显多于NSC+Li组,二者差别有统计学意义(P<0.01,图6),提示氯化锂对胫神经切断及NSC移植后引起的炎症反应有抑制作用。
3 讨 论
脊髓损伤后应用周围神经移植来修复和促进脊髓功能的恢复在不同的动物模型上都取得一定的效果,但也存在再生轴突无法通过远端移植物-宿主界面的情况[7]。研究发现,在脊髓损伤后移植预退变的周围神经(切断后留在原位7~10 d)比移植新鲜切断的神经有更多的再生轴突长入[8-9]。此外,在周围神经损伤后移植NSC,能不同程度地促进损伤神经的再生。Heine在胫神经切断的远端神经移植转染GDNF的NSC,4月后移植的NSC能促进新生轴突的形成[3]。Su的研究发现,在臂丛神经根性损伤后,在肌皮神经内移植NSC,12周后移植的NSC可以分化为神经元,表达NF200和ChAT,并能发出轴突与肌肉形成有功能的突触联系[10]。Gu在周围神经损伤后移植携带有NSC的神经段,4周后NSC可分化为神经元和小胶质细胞,并与再生轴突产生突触联系[11]。以上研究提示,在脊髓损伤后移植携带NSC的周围神经段可能对受损脊髓的轴突再生有促进作用。研究表明,氯化锂能促进体外培养NSC的增殖,并抑制其分化[5];保护小脑神经前体细胞免于凋亡[12],促进大鼠脊髓间充质干细胞的增殖和向神经元方向分化[13],也能促进移植到脊髓内的NSC的增殖[6]。如果氯化锂对移植到周围神经内的NSC也有类似的作用,则对脊髓损伤后的修复和轴突再生则更有意义。
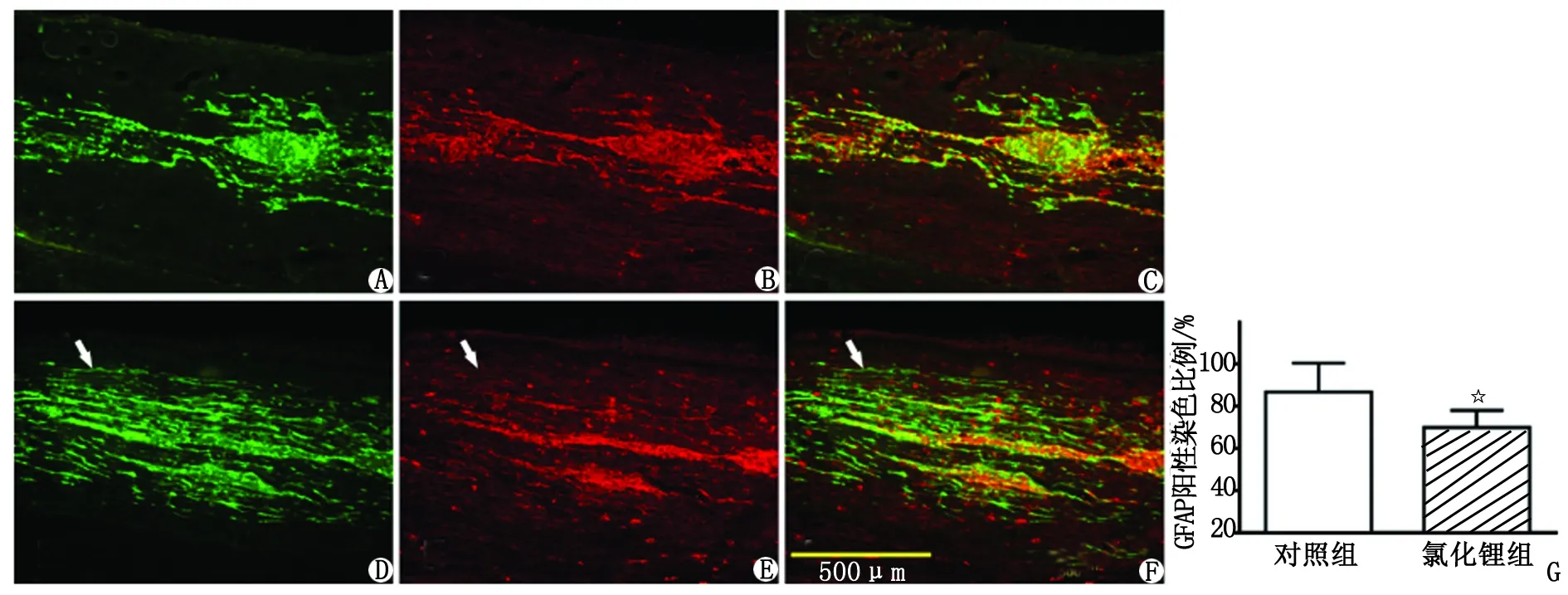
GFP:绿色荧光蛋白; NeuN:神经核抗原; ChAT:胆碱乙酰转移酶. A~C:对照组,D~F:氯化锂组,箭头显示GFAP阴性区域; G:2组GFAP阳性染色区域比例比较. 与对照组比较,☆:P<0.05.图4 胫神经内移植的神经干细胞GFAP表达情况( ×10)Fig 4 The expression of GFAP of NSCs in tibial nerve after transplantation( ×10)
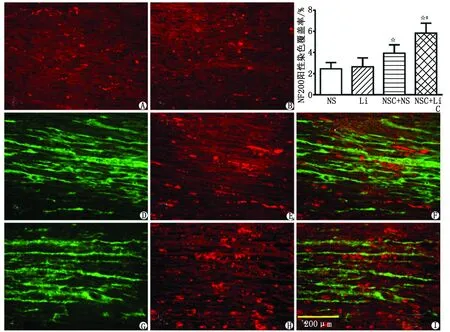
NSC:神经干细胞; GFP:绿色荧光蛋白;NF200:神经纤丝蛋白200. NS:生理盐水注射组; Li:氯化锂注射组; NSC+NS组:NSC移植+生理盐水注射组; NSC+Li组:NSC移植+氯化锂注射组. A:NS组;B:Li组;D~F:NSC +NS组;G~I:NSC+Li组; C:各组NF200阳性染色覆盖率的比较,与NS组、Li组比较,☆:P<0.01; 与NSC+NS组比较,#:P<0.05.图5 胫神经结扎后1周各组轴突溃变情况( ×20)Fig 5 The axonal degeneration of tibial nerve in different groups( ×20)

GFP:绿色荧光蛋白; ED1:巨噬细胞抗原. A~C:对照组; D~E:氯化锂组. A, D:GFP标记的神经干细胞; B, E:胫神经内ED1的表达情况; C, F:融合后的图片; G:胫神经内ED1的表达情况比较. 与对照组比较,☆:P<0.05.图6 氯化锂对移植后神经干细胞的胫神经内ED1表达的影响( ×10)Fig 6 The expression of ED1 in tibial nerve after NSC injection( ×10)
本实验中,移植到胫神经内的NSC存活良好,并能沿着神经轴索间隙向注射部位两端及周围迁移扩散。经过氯化锂处理后,移植1周后的NSC Nestin表达阴性,未见分化为NF200,NeuN或ChAT阳性的神经元,而大多数的NSC分化为GFAP阳性的胶质细胞,还有一部分GFAP阴性的细胞,与上述作者的结果不完全一致。造成这种结果的原因可能是:(1)周围神经内的环境更倾向于促进NSC向胶质细胞方向分化。周围神经损伤后,神经远端出现Wallerian变性,轴突溃变,髓鞘崩解,大量雪旺细胞增殖[14]。雪旺细胞分泌大量的神经营养因子以促进损伤神经的修复,包括NGF,NT-3,BDNF,GDNF,CNTF,GGF,LIF等[15]。虽然BDNF对NSC向神经元方向分化有促进作用,但周围神经损伤后,损伤神经内还有大量其他细胞以及各种因子对NSC的作用尚不明确,有可能影响NSC向胶质细胞方向分化。(2)本实验中,氯化锂干预的时间较短,对促进NSC向神经元方向分化的影响可能受到时间的限制,而上述实验均在移植后数月观察结果。在本实验条件下,短时间内局部环境下BDNF含量的提高可能尚不足以扭转其他细胞或因子对NSC的影响,如果延长氯化锂的干预时间,局部微环境进一步改善,氯化锂有可能促进NSC向神经元分化。此外,NeuN及ChAT都是成熟神经元表达的蛋白,本实验中还有一部分GFAP阴性的细胞,可能有分化为神经元的倾向,表达一些其他早期神经元标志物。(3)移植的NSC可能分化为其他细胞。Sekiguchi发现,将NSC移植到损伤的坐骨神经损伤内,发现雌激素可以促进NSC分化为内皮细胞[16]。而NSC和肌细胞共培养时,可分化为肌细胞,表达肌球蛋白[17]。本实验中,GFAP阴性的细胞有可能分化为其他细胞。目前NSC在周围神经内的分化情况及其机制仍不明确,需要进一步研究。
此外,移植的NSC和氯化锂对供体神经的退变也有影响。在周围神经损伤后,神经远端出现Wallerian变性,轴突溃变,髓鞘崩解,大量巨噬细胞进入神经内,清除髓鞘和轴突碎片,为神经再生提供条件。本实验中,未移植NSC的胫神经远端明显溃变,残留轴突呈颗粒状,Li组和NS组的轴突溃变情况没有显著差别,说明在胫神经损伤后1周,轴突溃变基本完成,氯化锂可能不影响巨噬细胞清除髓鞘和轴突碎片的作用。在损伤的周围神经内移植NSC以及NSC移植联合应用氯化锂后,残留的轴突呈短棒状或颗粒状,明显多于未移植NSC的对照组,提示NSC移植对胫神经损伤有明显的保护修复作用,联合应用氯化锂后保护作用更明显。研究显示,NSC可以抑制轴突溃变后产生的硫酸软骨素蛋白聚糖[3],而锂也可以通过抑制GSK-3间接抑制硫酸软骨素蛋白发挥轴突保护作用[18]。
氯化锂减轻轴突损伤的作用可能与抑制炎症反应有关。研究发现,脊髓内移植NSC,氯化锂能减轻移植后宿主脊髓的炎症反应[6]。本研究中,NSC+Li组的ED1表达量少于NSC+NS组,提示NSC移植和氯化锂对神经损伤后的炎症反应有抑制作用。研究发现,锂可以通过抑制GSK-3减轻实验性自身免疫性脑脊髓炎表现[19],通过抑制脂多糖或肌醇单磷酸酶对巨噬细胞产生抑制作用[20-21]。Ben-Hur发现,大脑内移植的NPC可以通过抑制T细胞而减轻化学物质引起的急慢性脑脊髓炎[22]。Busch也发现多能干细胞能显著减少巨噬细胞分泌基质金属蛋白酶-9,将巨噬细胞由致炎状态转化为抗炎状态来抑制炎症反应,减少轴突顶端坏死[23]。在移植有NSC的周围神经中,氯化锂有可能通过类似机制来抑制宿主神经的炎症反应。
总之,本实验初步观察到氯化锂对移植到周围神经内NSC分化、以及宿主神经轴突的溃变和炎症反应的影响。但由于观察时间较短,远期影响及其机制仍需进一步研究。
[1] Tetzlaff W,Okon E B,Karimi-Abdolrezaee S,etal. A systematic review of cellular transplantation therapies for spinal cord injury[J].JNeurotrauma,2011,28(8):1611-1682.
[2] Cheng L N,Duan X H,Zhong X M,etal. Transplanted neural stem cells promote nerve regeneration in acute peripheral nerve traction injury: assessment using MRI[J].AmericanJRoentgenology,2011,196(6):1381-1387.
[3] Heine W,Conant K,Griffin J W,etal. Transplanted neural stem cells promote axonal regeneration through chronically denervated peripheral nerves[J].ExpNeurol,2004,189(2):231-240.
[4] Dong M M,Yi T H. Stem cell and peripheral nerve injury and repair[J].FacialPlasticSurgery,2010,26(5):421-427.
[5] 景秀京,杨继飞,张 建,等. 氯化锂对培养神经干细胞增殖分化的影响及其机制研究[J]. 中国康复理论与实践,2007,13(9):850-852.
[6] Su H,Chu T H,Wu W. Lithium enhances proliferation and neuronal differentiation of neural progenitor cellsinvitroand after transplantation into the adult rat spinal cord[J].ExpNeurol,2007,206(2):296-307.
[7] Cote M P,Amin A A,Tom V J,etal. Peripheral nerve grafts support regeneration after spinal cord injury[J].Neurotherapeutics,2011,8(2):294-303.
[8] Kerns J M,Danielsen N,Holmquist B,etal. The influence of predegeneration on regeneration through peripheral nerve grafts in the rat[J].ExpNeurol,1993,122(1):28-36.
[9] Oudega M,Varon S,Hagg T. Regeneration of adult rat sensory axons into intraspinal nerve grafts: promoting effects of conditioning lesion and graft predegeneration[J].ExpNeurol,1994,129(2):194-206.
[10] Su H,Zhang W,Yang X,etal. Neural progenitor cells generate motoneuron-like cells to form functional connections with target muscles after transplantation into the musculocutaneous nerve[J].CellTransplant,2012,21(12):2651-2663.
[11] Gu S H,Xu W D,Xu L,etal. Regenerated host axons form synapses with neurons derived from neural stem cells transplanted into peripheral nerves[J].JIntMedRes,2010,38(5):1721-1729.
[12] Cabrera O,Dougherty J,Singh S,etal. Lithium protects against glucocorticoid induced neural progenitor cell apoptosis in the developing cerebellum[J].BrainRes,2014,1545(1):54-63.
[13] Dong B T,Tu G J,Han Y X,etal. Lithium enhanced cell proliferation and differentiation of mesenchymal stem cells to neural cells in rat spinal cord[J].IntJClinExpPathol,2015,8(3):2473-2483.
[14] Gaudet A D,Popovich P G,Ramer M S. Wallerian degeneration: gaining perspective on inflammatory events after peripheral nerve injury[J].JNeuroinflammation,2011,8(1):110-122.
[15] Terenghi G. Peripheral nerve regeneration and neurotrophic factors[J].JAnatomy,1999,194(Pt 1): 1-14.
[16] Sekiguchi H,Ii M,Jujo K,etal. Estradiol promotes neural stem cell differentiation into endothelial lineage and angiogenesis in injured peripheral nerve[J].Angiogenesis,2013,16(1):45-58.
[17] Rietze R L,Valcanis H,Brooker G F,etal. Purification of a pluripotent neural stem cell from the adult mouse brain[J].Nature,2001,412(6848):736-739.
[18] Dill J,Wang H,Zhou F,etal. Inactivation of glycogen synthase kinase 3 promotes axonal growth and recovery in the CNS[J].JNeurosci,2008,28(36):8914-8928.
[19] De Sarno P,Axtell R C,Raman C,etal. Lithium prevents and ameliorates experimental autoimmune encephalomyelitis[J].JImmunol,2008,181(1):338-345.
[20] de Meyer I,Martinet W,van Hove C E,etal. Inhibition of inositol monophosphatase by lithium chloride induces selective macrophage apoptosis in atherosclerotic plaques[J].BrJPharmacol,2011,162(6):1410-1423.
[21] Zhang M,Jin W,Zhou X,etal. Deregulation of Tpl2and NF-kappaB signaling and induction of macrophage apoptosis by the anti-depressant drug lithium[J].CellSignal,2009,21(4):559-566.
[22] Ben-Hur T. Immunomodulation by neural stem cells[J].JNeurologicalSciences,2008,265(1-2): 102-104.
[23] Busch S A,Hamilton J A,Horn K P,etal. Multipotent adult progenitor cells prevent macrophage-mediated axonal dieback and promote regrowth after spinal cord injury[J].JNeurosci,2011,31(3):944-953.
(编辑:张慧茹)
《福建医科大学学报》
双月刊 CN 35-1192/R 邮发代号 34-66
欢迎投稿 欢迎订阅
The Effect of Lithium Chloride on NSC Transplanted into Peripheral Nerve
ZHANG Liqun, ZHANG Wenming, LIU Zhifeng, LAN Wenbin, LIN Jianhua
Department of Orthopedics, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
Objective To investigate the effect of lithium chloride on the survival and differentiation of neural stem cells (NSCs) after transplanted into rat tibial nerve, and the effect of transplanted NSCs with lithium treatment on the axonal degeneration and inflammatory cell infiltration in host tibial nerve. Methods The right tibial nerve of adult rat was ligated, and the dissociated NSCs were injected into distal dump of tibial nerve, followed by intraperitoneal injection of either lithium or normal saline for one week. After that, the expression of Nestin, NeuN, choline acetyltransferase (ChAT), glial fibrillary acidic protein (GFAP) in transplanted NSCs, the expression of neurofilament 200 kD (NF200), and macrophages marker ED1 in host tibial nerve were studied. Results One week after transplantation, transplanted NSCs survived well and migrated from injection site to surrounding tissue through axon interspace. There was no obvious expression of Nestin, NeuN, and ChAT in transplanted NSCs, while most of the transplanted NSCs had GFAP expression. The lithium injection significantly reduced the expression of GFAP in the transplanted NSCs. After tibial nerve ligation, most of the axons degenerated. The animal that received NSC transplantation had more NF200 positive residual axons, compared to control group without NSC, and lithium injection enhance the expression of NF200. Lithium also reduces ED1 expression in tibial nerve after NSC transplantation. Conclusion Transplanted NSCs can survived well in tibial nerve, and most of the NSCs differentiated into GFAP positive glia. Lithium injection may reduce the GFAP differentiation of transplanted NSCs and inhibite macrophage infiltration after NSC transplantation.
lithium chloride; nervous system/*cytology; stem cells; transplantation; peripheral nervous system diseases
2016-08-03
福建省自然科学基金(2015J01458);福建省卫生教育联合攻关计划(WKJ-FJ-08);福建省临床重点专科建设项目(闽卫科教[2012]149号)
福建医科大学 附属第一医院骨科,福州 350005
张立群,男,副主任医师,医学博士. Email:zhanglq89@126.com
R329.24; R651.3; R916.3
A
1672-4194(2017)01-0017-07
