血清水通道蛋白4抗体与脑脊液寡克隆区带双阳性视神经脊髓炎谱系疾病患者临床特点研究
2017-04-25陈海康海娟刘诗蒙刘峥董会卿
陈海 康海娟 刘诗蒙 刘峥 董会卿
血清水通道蛋白4抗体与脑脊液寡克隆区带双阳性视神经脊髓炎谱系疾病患者临床特点研究
陈海 康海娟 刘诗蒙 刘峥 董会卿
目的 探讨血清水通道蛋白4(aquaporin-4,AQP4)抗体及脑脊液寡克隆区带(oligoclonal bands,OB)均阳性视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)患者的临床特点。方法。收集2013-02—2014-12期间于作者医院神经内科确诊为NMOSD患者60例的病例资料,进行回顾性分析。患者分为双阳组(血清AQP4抗体及脑脊液OB均阳性)、单阳组(仅血清AQP4抗体阳性)和双阴组(血清AQP4抗体及脑脊液OB阴性)。分析三组患者临床资料。结果 60例患者双阳组患者20例,单阳组患者25例,双阴组患者15例。三组患者累计发作次数差异有统计学意义〔双阳组4.2次,单阳组4.0次,双阴组2.4次,x2=9.00,P=0.011〕。双阳组患者累计发作次数最多。三组患者核MRI上胸髓及脑干病灶比例差异有统计学意义(χ2=7.42,P=0.025;χ2=7.55,P=0.023)。双阳组胸髓病灶比例高于双阴组〔85.00%(17)vs. 46.67%(7),χ2=5.84,P=0.016〕;双阴组脑干病灶比例高于单阳组〔60.00%(9)vs. 20.00%(5),χ2=6.59,P=0.010〕。三组患者自身免疫病相关抗体〔包括抗SSA抗体(Sjogren’s syndrome A antibody,SSA-Ab)、抗SSB抗体(Sjogren’s syndrome B antibody,SSB-Ab)、抗Ro-52抗体、甲状腺微粒体抗体(thyroid peroxidase antibody,TPO-Ab)、甲状腺球蛋白抗体(thyroglobulin antibody,TG-Ab)〕阳性率差异有统计学意义〔双阳组60.00%,单阳组24.00%,双阴组6.67%,χ2=12.43,P=0.002)。双阳组患者自身免疫病相关抗体阳性率高于单阳组及双阴组(χ2=6.00,P=0.014;χ2=10.44,P=0.001)。三组之间神经功能状态评分差异有统计学意义〔双阳组(4.15±1.822)分,单阳组(4.60±1.814)分,双阴组(2.97±1.642)分,F=4.021,P=0.023)〕。单阳组EDSS评分高于双阴组(t=2.853,P=0.007)。结论 血清AQP4抗体及脑脊液OB均阳性的NMOSD患者累计发作次数多,胸髓病灶比例高,脑干病灶比例低,易同时携带多种自身免疫病相关抗体。
视神经脊髓炎谱病;水通道蛋白4抗体;寡克隆区带;抗少突胶质细胞糖蛋白抗体
2007年,视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders,NMOSD)的概念被提出,NMOSD中主要包括血清水通道蛋白4(aquaporin-4,AQP4)抗体阳性的视神经脊髓炎(neuromyelitis optica,NMO)、NMO合并自身免疫病、亚洲型多发性硬化(multiple sclerosis,MS)等[1]。AQP4是中枢神经系统主要的水通道蛋白,其在跨膜水转运、维持血-脑屏障完整性和中枢神经系统内环境稳定性方面发挥重要作用。AQP4抗体的发现标志着NMO作为一种新的中枢神经系统自身免疫病而独立于MS[2]。约一半以上的NMOSD患者血清AQP4抗体阳性[3], 故该抗体可协助诊断NMOSD。脑脊液寡克隆区带(oligoclonal bands,OB)是检测中枢神经系统炎性病变鞘内免疫蛋白合成的可靠指标,具有较高的敏感性和特异性。MS患者脑脊液OB阳性率约为90%~95%,远高于NMOSD[4],脑脊液OB阳性有助于支持MS的诊断。但临床脑脊液OB阳性的NMOSD亦很常见。目前对于同时具备血清AQP4抗体阳性及脑脊液OB阳性的NMOSD,文献尚无针对性报道。本文主要通过与仅有血清AQP4抗体阳性患者、血清AQP4抗体及脑脊液OB均阴性的患者对比,探讨血清AQP4抗体和脑脊液OB同时阳性的NMOSD的特点。
1 对象和方法
1.1 观察对象 收集2013-02-01—2014-12-31期间宣武医院神经内科收治的确诊NMOSD患者60例,男13例、女47例(男︰女=1︰3.62),年龄~61岁,平均年龄为(37.5±13.0)岁。所有NMOSD患者的诊断均符合2015年NMOSD诊断新标准[5]。入组患者均病例资料(包括病史、影像学及AQP4抗体、OB等)齐全且无磁共振(MRI)检查禁忌。
1.2 方法 详细记录入组患者病例资料,包括性别、年龄、临床表现、累计发作次数、既往史、MRI病灶部位,血清AQP4抗体、血清MOG抗体及其他血清自身免疫病相关抗体〔包括抗SSA抗体(Sjogren’s syndrome A antibody,SSA-Ab)、抗SSB抗体(Sjogren's syndrome B antibody,SSB-Ab)、抗Ro-52抗体、甲状腺微粒体抗体(thyroid peroxidase antibody,TPO-Ab)、甲状腺球蛋白抗体(thyroglobulin antibody, TG-Ab)〕,脑脊液OB,既往用药情况等。2014年1月中旬以后入组者同时行血清MOG抗体的检查。入组患者均于入院当天由一名专科医师行扩展残疾状况评分量表(expanded disability status scale,EDSS)评分来评估其残障情况。
1.2.1 AQP4抗体、OB及其他自身免疫病相关抗体的检测:所有患者均于本次入院实施治疗前行血清AQP4抗体、其他血清自身免疫病相关抗体意见血清与脑脊液OB的检测。AQP4抗体的测定采用敏感性较高的细胞分析法。其他自身免疫病相关抗体采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)。脑脊液OB阳性的定义:血清OB阴性而脑脊液OB阳性,或血清OB阳性而脑脊液特异性寡克隆区带(specific oligoclonal bands,SOB)阳性。其他自身免疫病相关抗体阳性率:组内1种或多种其他自身免疫病抗体阳性患者例数/组内患者总例数。
1.2.2 影像学检查:所有患者均于入院后行头及脊髓MRI检查。部分患者影像学资料来源于其他医疗机构,但均与本次病情活动相关(表现在MRI出现新发病灶或原有病灶部位有强化)。计算不同部位位病灶患者比例。某部位病灶患者比例的确定:该部位病灶的患者例数/患者总例数。
1.2.3 分组及观察指标:根据血清AQP4抗体及脑脊液OB的阳性情况,将患者分为3组:(1)双阳组:血清AQP4抗体及脑脊液OB均阳性;(2)单阳组:仅血清AQP4抗体阳性;(3)双阴组:血清AQP4抗体及脑脊液OB均阴性。比较三组患者的累计发作次数、既往史、MRI病灶部位、血清自身免疫疾病相关抗体阳性率及EDSS分值。
1.3 统计学处理 采用SPSS17.0统计软件进行原始数据处理。计量资料数据以均数±标准差表示。计量资料的比较,方差齐性资料(如EDSS分值)采用ANOVA分析,组间两两比较采用LSD-t检验;方差不齐资料(如累计发作次数)采用秩和检验;各组之间率的比较采用χ2检验。以P<0.05为有差异统计学意义。
2 结果
60例患者AQP4抗体、OB抗体检测结果见表1。双阳组患者20例,单阳组患者25例,双阴组患者15例。

表1 60例AQP4抗体、OB抗体检测结果 (n,男/女)
注:*因3例患者脑脊液OB与SOB同时阳性,故总计例数大于入组患者总数
2.1 三组患者临床资料比较 三组患者病例资料见表2、表3。男女比例为1∶3.62(13/47),性别差异有统计学意义(P=0.018)。所有入组患者,首次发病9例,复发51例,复发患者占85%(51/60)。三组患者累计发作次数差异有统计学意义(x2=9.00,P=0.011),其中双阳组患者累计发作次数最多。患者首次发病累及部位有双眼/单眼视神经、脑干、颈髓、胸髓、长脊髓、脑内(皮质下、侧脑室旁、胼胝体、基底节区、中脑导水管周围结构、脑干等)等。单阳组患者中,5例患者首次发病同时累及颈髓及胸髓,归为长节段脊髓病灶。三组之间平均年龄、首发受累部位比例比较差异均无统计学意义。三组患者均有高脂血症史者,但三组间有高脂血症史者比例比较差异无统计学意义(χ2=2,80,P=0.247)。近2个月使用糖皮质激素和/或丙种球蛋白治疗的患者比例(主要除外此二种药物可能影响血清AQP4抗体测定的影响,两种药物均具有中和抗体的作用,故合并分析)三组间比较差异无统计学意义(χ2=0.19,P=0.388)。
2.2 头颅及脊髓MRI资料的比较 患者头MRI及脊髓MRI检查结果见表4。本研究入组患者头MRI表现为不具备皮层下或侧脑室旁圆形或类圆形的、长轴垂直于侧脑室的MS典型病灶,病灶最常见的部位有脑干、颈髓及胸髓。双阳组与单阳组各部位病灶所占比例比较差异无统计学意义(P=0.105)。三组患者皮质下、侧脑室旁、颈髓及脑内其他部位(脑内其他部位指胼胝体、基底节区、中脑导水管附近结构)病灶分布比例差异无统计学意义,而在胸髓及脑干病灶比例三组间比较差异有统计学意义(分别χ2=7.42,P=0.025,χ2=7.55,P=0.023)。双阳组患者胸髓病灶比例高于双阴组(17/20vs. 7/15,χ2=5.84,P=0.016),双阳组与单阳组脑干病灶比例均低于双阴组(5/20vs. 9/15,χ2=6.59,P=0.010)。
2.3 实验室检查的比较 结果见表5。三组间比较,其他自身免疫病相关抗体阳性率三组间比较差异有统计学意义(χ2=12.43,P=0.002)。双阳组患者自身免疫病相关抗体阳性率高于单阳组和双阴组(分别χ2=6.00,P=0.014;χ2=10.44,P=0.001),单阳组与双阴组两组间自身免疫病相关抗体阳性率比较差异无统计学意义(χ2=1.95,P=0.162)。双阳组13例、单阳组19例及双阴组13例患者行血清MOG抗体检查,三组患者血清MOG阳性率差异无统计学意义(χ2=2.625,P=0.269)。
2.4 神经功能状态的比较 60例患者平均EDSS为(4.04±1.865)分。双阳组患者EDSS为(4.15±1.822)分,单阳组患者为(4.60±1.814)分,双阴组患者为(2.97±1.642)分。三组之间神经功能状态评分差异有统计学意义(F=4.021,P=0.023)。单阳组EDSS评分均高于双阴组(t=2.853,P=0.007),双阳组与单阳组(t=-0.825,P=0.414)以及双阳组与双阴组(t=2.013,P=0.053)两组间比较差异均无统计学意义。

表2 NMOSD患者基本临床资料 (n)
注:#近2个月使用糖皮质激素和/或丙种球蛋白治疗;与双阴组比较,*P<0.05
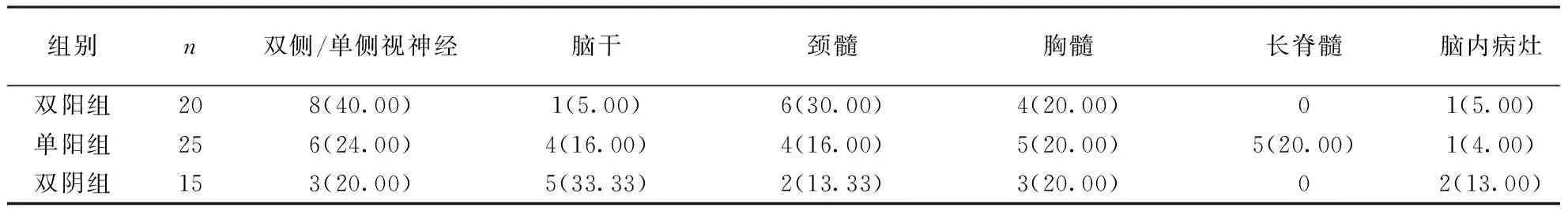
表3 NMOSD患者首发受累部位 〔MRI病灶,n(%)〕

表4 三组患者影像学病灶分布例数 〔n(%)〕
注:a颅内其他部位一般指胼胝体、基底节区、中脑导水管附近结构

表5 三组患者血清自身免疫病相关抗体例数、阳性率及MOG抗体阳性率比较
注:*其他自身免疫病相关抗体包括抗SSA抗体、抗SSB抗体、抗Ro-52抗体、TPO抗体、TG抗体
3 讨论
本研究是首次将血清AQP4抗体阳性同时合并脑脊液OB阳性的NMOSD患者进行临床特点、影像学表现及实验室检查的描述,并与单纯血清AQP4抗体阳性者、血清AQP4抗体及脑脊液OB均阴性者进行比较。
入组患者男女发病比例为1∶3.6,女性发病比例较MS更高,与Juryńczyk等[6]报道一致(男︰女为2︰1)。本研究发现三组中患者均有患者具有高脂血症史,但三组之间高脂血症比例差异无统计学意义(P=0.244)。关于高脂血症与NMOSD之间的关系,目前报道较少。研究发现脂溶性维生素如维生素A、D、E与缓解复发型MS的炎性标志物有内在联系,而β-干扰素可以打破其内在联系而发挥治疗作用[7]。也有文献报道载脂蛋白E参与MS动物模型的中枢神经系统炎性反应过程,载脂蛋白E主要是通过促进包括树突细胞在内的抗原提呈细胞的表达而发挥神经系统炎性脱髓鞘作用[8]。上述基础研究都表明血脂升高参与了中枢神经系统的免疫炎性反应,但在NMOSD中的作用尚需进一步研究探讨。
本研究中三组患者累计发作次数、EDSS评分差异均有统计学意义,其中双阳组患者累计发作次数多于双阴组,而双阳组与单阳组、单阳组与双阴组累计发作次数差别均无统计学意义;单阳组EDSS评分高于双阴组,双阳组与单阳组以及双阳组与双阴组(t=2.013,P=0.053)两组间比较差异均无统计学意义。上述结果可能与双阳组患者累计发作次数多、神经功能受累重、合并自身免疫功能异常者多有关,其中双阳组与双阴组EDSS评分差异均无统计学意义(t=2.013,P=0.053)可能与病例数较少有关,可进一步增加例数进行观察。NMOSD患者常合并自身免疫病,可有多系统如呼吸系统,循环系统,运动系统等受累的表现。EDSS只是单纯评价神经系统的残疾情况,对于评价NMOSD患者整体情况可能存在一定的局限性。
本研究NMOSD患者最常见的受累部位是脑干、颈髓及胸髓,这与先前研究发现中国大陆汉族人群中脑干病灶的患者大多数是MS有所不符[9]。NMOSD的一个亚型,其病灶局限于脑干,且双重阴性患者更易出现脑干脑干受累。目前对这一现象的具体机制尚不清楚,有待进一步研究。
双阳组患者自身免疫病相关抗体阳性率更高,常见有SSA、SSB、Ro-52、TG-Ab等,提示可能合并存在干燥综合征或混合性结缔组织病。与MS比,NMO可合并更高水平的自身免疫病相关抗体[10],比例达40%~50%[11-12]。本研究发现双阳组患者自身免疫病相关抗体阳性率高,而且大于前述的文献报道(60%vs. 40%~50%)。MOG抗体是近年来发现的新型抗体[13]。有研究发现在NMOSD患者中,MOG抗体阳性患者预后较AQP4抗体阳性者好(EDSS 2vs. 6,P=0.0173)[14],另有文献报道MOG抗体阳性而AQP4抗体阴性的脱髓鞘病患者发病年龄早、单相病程居多且预后较好[15]。由上述研究结果可推测血清MOG抗体的检查可能对判断预后有帮助。本研究中并MOG抗体阳性率在三组之间差异无统计学意义,但本研究样本量较小,故MOG抗体与AQP4抗体及脑脊液OB是否具有内在联系,尚不能定论,仍需进一步观察研究。
已知MS患者中OB阳性率较高,国外报道可达90%[16]。NMO患者中,脑脊液SOB阳性率波动范围较大且存在时间短暂,多数仅出现于NMO的复发期[17]。在NMO早期,脑脊液SOB阳性罕见;NMO复发期SOB阳性率约为27%[18]。本研究中NMOSD患者,85%多数处于复发期,脑脊液SOB阳性率为 33.3%(20/60),高于文献[18]报道,这提示MS与NMOSD可能存在共同的免疫通路,但血清AQP4抗体阳性同时合并脑脊液OB阳性的具体机制目前仍不清楚。入院前激素或丙种球蛋白可能影响血清及脑脊液相关抗体的滴度,本研究中三组患者近两月治疗史并无明显差异,推测对三组患者自身免疫病相关抗体阳性率结果应无明显影响。
综上,关于NMO的确切发病机制,目前仍不清楚。血清AQP4抗体及脑脊液OB均阳性的NMOSD患者更易携带自身免疫病相关抗体,提示可能有更多的系统免疫过程参与其发病。本组病例仅进行了小样本回顾性研究,并未随访及评估疗效,需要大型研究来弥补该不足,可开展时程长、规模大的病例对照研究来探讨血清AQP4抗体及脑脊液OB双阳性的NMOSD患者在表现、治疗反应及预后方面的特点。双阴组患者累计发作次数少,神经功能残疾程度相对轻,提示血清AQP4抗体及脑脊液OB阳性与否可能对判断预后有指导作用。这可能为探讨NMOSD的发病机制及治疗提供了重要的临床思路。
[1]Wingerchuk D, Lennon V, Lucchinetti C, et al. The spectrum of n euromyelitis optica[J]. Lancet Neurol, 2007, 6(9): 805-815.
[2]Lennon V, Wingerchuk D, Kryzer T, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis[J]. Lancet, 2004, 364(9451): 2106-2112.
[3]Sellner J, Boggild M, Clanet M, et al. EFNS guidelines on diagnosis and management of neuromyelitis optica[J]. Eur J Neurol, 2010, 17(8): 1019-1032.
[4]Marignier R, Bernard-Valnet R, Giraudon P, et al.Aquaporin-4 antibody-negative neuromyelitis optica: distinct assay sensitivity-dependent entity[J]. J Neurol, 2013, 80(24): 2194-2200.
[5]Wingerchuk DM, Banwell B, Bennett JL, et al.International consensus diagnostic criteria for neuromyelitis optica spectrum disorders[J]. J Neurol, 2015, 85(2): 177-189.
[6]Juryńczyk M, Craner M, Palace J.Overlapping CNS inflammatory diseases: differentiating features of NMO and MS[J]. J Neurol Neurosurg Psychiatry, 2015, 86(1): 20-25.
[7]Røsjø E, Myhr K, Løken-Amsrud K, et al.Increasing serum levels of vitamin A, D and E are associated with alterations of different inflammation markers in patients with multiple sclerosis[J]. J Neuroimmunol, 2014, 271(2014): 60-65.
[8]Shin S, Walz K, Angela S, et al.Apolipoprotein E mediation of neuro-inflammation in a murine model of multiple sclerosis[J]. J Neuroimmunol, 2014, 271(2014): 8-17.
[9]Liu Ying, Zhao Guixian, Yu Hai, et al.Differentiation of neuromyelitis optica from multiple sclerosis in a cohort from the mainland of China[J]. Chin Med J(Engl), 2014, 127(18): 3213-3218.
[10]Diogo C, Tauana S, Denise S, et al.Sjögren syndrome and neuromyelitis optica spectrum disorder co-exist in a common autoimmune milieu[J]. Arq Neuropsiquiatr, 2014, 72(8): 619-624.
[11]Iyer A, Elsone L, Appleton R, et al.A review of the current literature and a guide to the early diagnosis of autoimmune disorders associated with neuromyelitis optica[J]. Autoimmunity, 2014, 47(3): 154-161.
[12]Pittock SJ, Lennon VA, de Seze J, et al.Neuromyelitis optica and non organspecific autoimmunity[J]. Arch Neurol, 2008, 65(1): 78-83.
[13]Kitley J, Woodhall M, Waters P, et al.Myelin oligodendrocyte glycoprotein antibodies in adults with a neuromyelitis optica phenotype[J]. J Neurol, 2012, 79(12): 1273-1277.
[14]Kazutoshi Sato D, Callegaro D, Peixoto M, et al. Distinction between MOG antibodypositive and AQP4 antibody-positive NMO spectrum disorders[J]. J Neurol, 2014, 82(6): 474-481.
[15]Höftberger R, Sepulveda M, Armangue T, et al. Antibodies to MOG and AQP4 in adults with neuromyelitis optica and suspected limited forms of the disease[J]. Mult Scler, 2015, 21(7): 866-874.
[16]Bergamaschi R, Tonietti S, Franciotta D, et al. Oligoclonal bands in Devic’s neuromyelitis optica and multiple sclerosis: differences in repeated cerebrospinal fluid examinations[J]. Mult Scler, 2004,10(1): 2-4.
[17]de Seze J, Stojkovic T, Ferriby D, et al.Devic’s neuromyelitis optica: clinical, laboratory, MRI and outcome profile[J]. J Neurol Sci, 2002, 197(1-2): 57-61.
[18]Jarius S,Paul F,Franciotta D, et al.Cerebrospinal fluidfindings in aquaporin-4 antibody positive neuromyelitis optica: results from 211 lumbar punctures[J]. J Neurol Sci, 2011, 306(1-2): 82-90.
(本文编辑:邹晨双)
A study of clinical features of patients diagnosed with neuromyelitis optica spectrum disorders who were both AQP4-Ab seropositive and cerebrospinal fluid OB positive
CHENHai,KANGHai-juan,LIUShi-meng,LIUZheng,DONGHuiqing.
DepartmentofNeurology,XuanwuHospitalofCapitalMedicalUniversity,Beijing100053,China
DONG Huiqing, Email: shshtt@sina.com
Objective To evaluate the clinical features of patients with NMOSD who were both AQP4-Ab seropositive and cerebrospinal fluid OB positive. Methods All data of patients with NMOSD were retrospectively collected in our neurology department from 2013-02 to 2014-12. Those patients were divided into three groups as double positive group, single positive group and negative group. Patients in the double positive group were both serum AQP4-Ab and cerebrospinal fluid OB positive. Patients in the single positive group were just AQP4-Ab seropositive. Patients who were AQP4-Ab and OB both negative were named negative group. Clinical characteristics were analyzed among the three groups. Results Sixty patients participated in the research. There were 20 patients in the double positive group, 25 patients in the single positive group and 15 in the negative group.There were significant differences in the frequencies of attacks among those groups (4.2vs. 4.0vs. 2.4,χ2=9.00,P=0.011). Compared with others, participants in the double positive group had the highest frequency of attacks.The rates of patients with thoracic spinal cord and brainstem lesions in magnetic resonance imaging were significantly different among the three groups(χ2=7.42,P=0.025;χ2=7.55,P=0.023). The rate of patients with thoracic spinal cord lesions in the double positive group was higher than the negative group [85.00(17%) vs. 46.67(7%),χ2=5.84,P=0.016]. The rate of patients with brainstem lesions in the negative group was higher in the single positive group [60.00(9%)vs. 20.00(5%);χ2=6.59,P=0.010].The positive incidences of antibodies associated with autoimmune diseases were remarkably different among the three groups(χ2=12.43,P=0.002). Double positive group had more antibodies associated with autoimmune disease compared with others (χ2=6.00,P=0.014;χ2=10.44,P=0.001).There were prominent differences in EDSS in the three groups (F=4.021,P=0.023). Compared with the single positive group, patients in the negative group had lower scores(t=2.853,P=0.007).Conclusions Patients diagnosed with NMOSD who are both AQP4-Ab seropositive and cerebrospinal fluid OB positive may have higher frequencies of attacks, higher rate of thoracic spinal cord affection and more antibodies associated with autoimmune disease.
NMOSD; AQP4-Ab; OB; MOG-Ab
10.3969/j.issn.1006-2963.2017.02.006
北京市科委首都市民健康项目培育(Z131100006813020)
100053首都医科大学宣武医院神经内科
董会卿,Email:shshtt@sina.com
R744.5+2
A
1006-2963(2017)02-0094-06
2015-07-13)
