β-葡萄糖苷酶合成龙胆二糖及产物分离
2017-04-24张林王磊吴广兴勇强余世袁
张林,王磊,吴广兴,勇强,余世袁
(南京林业大学化学工程学院,南京210037)
β-葡萄糖苷酶合成龙胆二糖及产物分离
张林,王磊,吴广兴,勇强,余世袁*
(南京林业大学化学工程学院,南京210037)
以葡萄糖为原料,通过β-葡萄糖苷酶发生转糖苷反应制备龙胆二糖,研究不同来源的酶、反应温度、pH、加酶量、底物浓度、反应时间等对龙胆二糖的影响。结果表明:南京林业大学自产酶适合于龙胆二糖的制备,用900 g/L的葡萄糖溶液,加酶量为60 U/g葡萄糖,在pH 5、温度60℃的条件下,以80 r/min振荡转化24 h后得到浓度为46.9 g/L龙胆二糖。得到产物后采用高效阴离子交换色谱进行鉴定和定量。阳离子交换树脂2次洗脱分离后,得到纯度97.0%的龙胆二糖。用制备的龙胆低聚糖增殖青春双歧杆菌,36 h代谢了含有碳元素74.9 mmol/L的碳源,生成含有碳元素62.1 mmol/L的有机酸和7.1 mmol/L的菌体,菌体浓度增长了3.8倍,表明实验得到的龙胆二糖可以有效增殖对人体有益的青春双歧杆菌。
龙胆二糖;β-葡萄糖苷酶;阳离子交换树脂;青春双歧杆菌
随着经济发展、科技进步,食品添加剂中的糖也变得多样化。人们对健康的关注度越来越高,更加注重食品的营养、口感及调节生理活性的结合。人体胃肠道里没有能分解低聚糖的酶,所以低聚糖能到达消化系统的最末端,被双歧杆菌利用[1]。双歧杆菌是人类的生理性细菌,双歧杆菌的存在和含量是人体健康的重要标志,可以调理肠功能的紊乱,消除腹泻与便秘;可起双向调节功能,降低血内毒素,降低胆固醇浓度,对防止动脉硬化和高血压、抗肿瘤、提供机体免疫功能和延年益寿具有一定作用。
低聚糖具有调节肠道菌群平衡、促进钙磷吸收、预防龋齿、提高机体免疫力等功能,摄入后不会引起血糖、胰岛素的升值,可供糖尿病、高血压、肥胖等特殊人群食用[2]。龙胆低聚糖是一类由葡萄糖β-1,6糖苷键结合的新型功能性低聚糖,包括龙胆二糖、少量的三糖和四糖。与其他功能性低聚糖相比,它能更好地促进人体小肠中双歧菌和乳酸菌的繁殖,且耐热、耐酸,可应用于其他低聚糖不适宜使用的保健品中,其柔和、提神、苦味是龙胆低聚糖独特的性质[3-4]。虽然龙胆低聚糖有其独特的优点,但是目前只有日本进行大规模工业生产,且主要在日本国内销售,其两种产品规格分别为45%和80%[5]。我国也开始试产龙胆低聚糖,但产量较小,还没有大规模的产品。目前,龙胆低聚糖市场价格约700元/kg,作为一种功能性食品添加剂新资源,龙胆低聚糖具有广阔的市场前景。
β-葡萄糖苷酶能将纤维二糖或其他可溶性的纤维寡糖水解成葡萄糖分子,以消除纤维二糖和纤维寡糖对葡聚糖内切酶和葡聚糖外切酶的反馈抑制作用,在纤维素酶系中发挥非常重要的作用[6]。有些β-葡萄糖苷酶也有转糖苷活性,能够合成龙胆二糖[7]。使用高浓度的葡萄糖为底物,β-葡萄糖苷酶将游离的葡萄糖通过β-1,6糖苷键转移到其他糖底物上合成龙胆二糖或三糖。转糖基反应的过程是温和、安全、低成本并且低程度的污染,最终的产物易于从混合物中分离[8]。葡萄糖作为糖平台化学最主要的产物,产量大,价格低廉。在当今社会,可再生生物质资源均可向糖平台转化,利用生物炼制技术大规模生产生物能源和生物基产品(生物燃料、生物基化学品和生物基材料)已成为国际上的研究热点,一个全球性的产业革命正在朝着以碳水化合物为基础的经济时代发展[9-11]。
本研究从不同公司生产的β-葡萄糖苷酶中选择具有高转糖苷活性的酶催化剂,由不同浓度的葡萄糖底物、β-葡萄糖苷酶最适宜的反应pH和温度、酶添加量制备龙胆二糖,通过层析色谱手段对产物进行分离提纯,并将得到的龙胆二糖用于青春双歧杆菌厌氧增殖,以期为进一步大规模生产提供理论基础和指导。
1 材料与方法
1.1 主要试剂
β-葡萄糖苷酶共5种:Novozyme188购于Novozymes;购于Sigma公司的β-葡萄糖苷酶是提取苦杏仁得到的;黑曲霉来源的和提取苦杏仁冷冻干燥得到的购于上海将来实业股份有限公司;南京林业大学自产酶(NFBGL02)是热纤维素梭菌的β-葡萄糖苷酶基因重组于大肠杆菌制得。青春双歧杆菌(Bifidobacteriumadolescentis)CGMCC1.2190,严格厌氧菌株冻干粉,安培管保存,由中国普通微生物菌种保藏管理中心提供。
葡萄糖(≥99.5%)和麦芽糖标样(≥99%)购于Sigma公司;异麦芽糖标样(≥98%)购于阿拉丁公司;龙胆二糖标样(≥98%)购于生工生物工程(上海)股份有限公司;纤维二糖标样(≥99%)购于Fluke公司。
1.2 龙胆二糖的酶法合成及分离
1.2.1 龙胆二糖的酶法合成
配制柠檬酸-磷酸氢二钠缓冲液,溶解葡萄糖后放入高压蒸汽灭菌器灭菌。灭菌结束,待温度降至室温时加入β-葡萄糖苷酶,反应开始。转移至恒温振荡器中,调节适当的反应温度,水浴锅振荡幅度为80 r/min,按时取样0.1 mL,用超纯脱气水稀释样品,离子交换色谱对龙胆二糖含量进行定量测定。
1.2.2 层析色谱分离龙胆二糖
1.3 龙胆二糖增殖青春双歧杆菌历程
1.3.1 双歧杆菌的活化与增殖
基础培养基中各组分的浓度:胰蛋白胨,1.0 g/L;酵母粉,1.0 g/L;CaCl2·6H2O,0.005 g/L;MgSO4·7H2O,0.005 g/L;KH2PO4,0.02 g/L;K2HPO4,0.02 g/L;NaHCO3,1.0 g/L,NaCl,0.05 g/L;胆汁盐,0.25 g/L;L-半胱氨酸盐酸盐,0.25 g/L;吐温80,1 mL。
活化培养基是在基础培养基中加入质量浓度5.0 g/L的葡萄糖。增殖培养基是在基础培养基中加入适量的龙胆二糖。以上培养基经121℃灭菌15 min后使用。
1.3.2 双歧杆菌的活化
活化培养基转入厌氧培养箱(英国Ruskinn公司),厌氧箱内开启青春双歧杆菌安培管,吸取培养基至安培管,洗涤干粉至锥形瓶中塞紧橡皮塞,放入厌氧培养箱中的恒温培养箱37℃培养36 h,获得增殖培养用的双歧杆菌种母液[12]。
1.3.3 双歧杆菌的培养
龙胆二糖和氮源分别灭菌后转入厌氧培养箱,加入还原剂,在具塞螺纹试管中加入培养基,接入种母活化液,置于37℃恒温培养箱中培养36 h,定时取样分析。
1.4 分析方法
1.4.1β-葡萄糖苷酶活力的测定方法
β-葡萄糖苷酶酶活通常以4-硝基苯基-D-吡喃葡糖苷(pNPG)为底物进行测定,一个β-葡萄糖苷酶活力(U)单位定义为每分钟水解生成1 μmol对硝基苯酚所需要的酶量[13-14]。
1.4.2 龙胆二糖及副产物含量测定
离子交换色谱Dionex ICS-5000是美国赛默飞世尔科技公司 (Thermo Fisher Scientific)生产的,使用阴离子交换柱Dionex CarbopacTMPA10(2 mm×250 mm)检测龙胆二糖,以脱气水和200 mmol/L NaOH为淋洗液进行二元梯度洗脱;流速0.25 mL/min;柱温30℃;进样量10 μL;检测方式四电位脉冲安培检测。样品经过10 000 r/min离心10 min,取上清液用脱气超纯水稀释,离子交换色谱分析,电导检测池检测。
1.4.3 菌体浓度的测定
采用比浊法测定,具体操作方法如下:绘制菌液吸光度A值与菌体浓度Yg/L的标准曲线。Y=0.553 0A-0.064 0,R2=0.993 5。
样品测定:培养液离心,菌体经生理盐水洗涤3次后,无菌水再洗涤2次。将菌体浓度稀释到标准曲线方程线性范围内,摇匀后以无菌水为空白样,用分光光度计在620 nm测吸光度A值,根据标准曲线方程计算菌体浓度。
1.4.4 双歧杆菌代谢产物分析
采用高效液相色谱法分析样品中的乙酸、乳酸、丙酸、丁酸。调节pH,经0.22 μm膜过滤后,取上清液进行HPLC分析。色谱仪Agilent 1200;色谱工作站Chemstation;色谱柱Bio-Rad Aminex HPX-87H (300 mm×7.8 mm);洗脱液0.005 mol/L H2SO4;流速0.6 mL/min;柱温50℃;检测器示差检测器;进样量12 μL。
1.4.5 碳平衡计算
在青春双歧杆菌代谢龙胆二糖的实验中,采用分批培养,可将每一批次看作是1个黑箱,测定初始时进入系统的碳含量及培养结束时回收的碳含量。实验中测定底物含碳量、菌体含碳量及代谢产物中的含碳量[15]。生物质标准元素组成为CH1.8O0.5N0.2,其摩尔质量为24.6 g无灰分生物质。本实验采用CH1.8O0.5N0.2(分子量24.6)代表青春双歧杆菌元素组成[16]。青春双歧杆菌代谢产气较少,可以忽略气体中的碳含量。
2 结果与分析
2.1 龙胆二糖的制备
目前对β-葡萄糖苷酶的研究大多集中于其水解活性,而有关β-葡萄糖苷酶转糖苷活性的报道很少,利用于低聚龙胆糖生产的更是微乎其微。如朱婧等[17]采用紫外-60Co复合诱变米曲霉获得抗高浓度葡萄糖阻遏的β-葡萄糖苷酶高产菌用于制备龙胆低聚糖。刘玲玲[3]采用基因工程菌发酵获得的β-葡萄糖苷酶转化葡萄糖,得到50.0 g/L的龙胆低聚糖,然而其使用的DTF-02阳离子树脂分离,得到的最纯浓度才73.0%。本研究采用不同的酶和葡萄糖为原料转化生产为龙胆二糖。前期研究转糖苷反应条件,以期得到较高产量的龙胆二糖,实验得出Novozyme188和NFGBL02具有较高的转糖苷活性,优化NFBGL02转糖苷条件与Novozyme188的效果进行比较。
2.1.1 不同来源β-葡萄糖苷酶的筛选
考察5种不同来源的β-葡萄糖苷酶对合成龙胆二糖的效果。以pH 5.0的缓冲液配制900 g/L葡萄糖溶液,按60 U/g葡萄糖添加β-葡萄糖苷酶,在60℃、80 r/min的恒温振荡器中反应,反应24 h,每3 h取样分析,结果如表1所示。试验的5支酶,仅Novozyme188和NFBGL02具有良好的转糖活性,能合成龙胆二糖。

表1 β-葡萄糖苷酶的来源及24 h时的龙胆二糖浓度
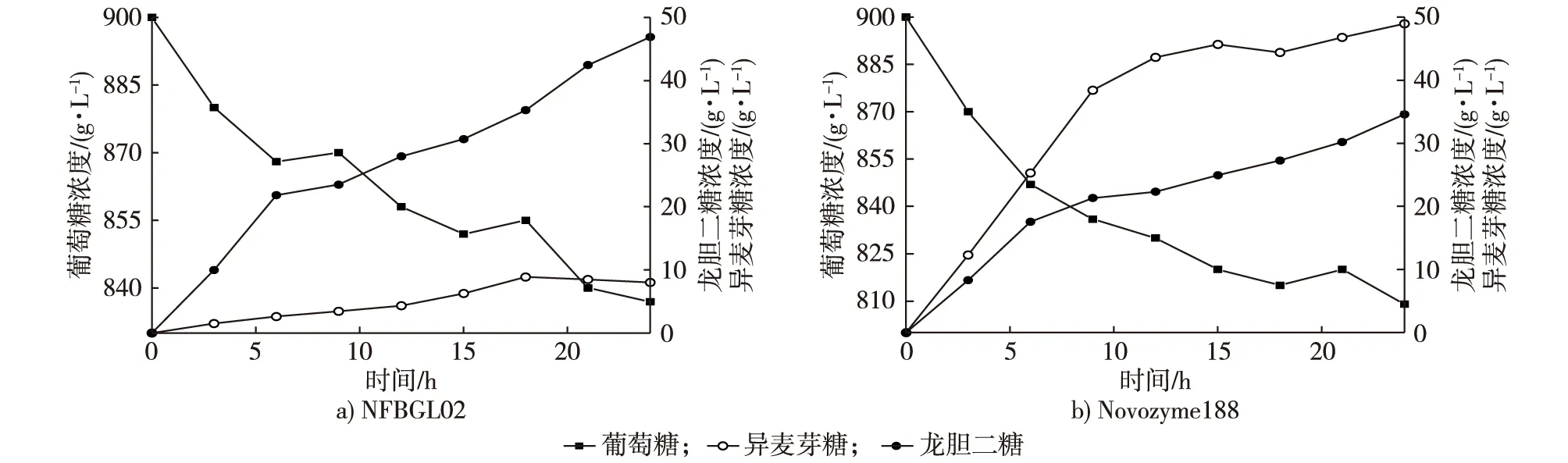
图1 Novozyme188与NFBGL02产龙胆二糖比较Fig. 1 The comparison between Novozyme188 and the enzyme produced by Nanjing Forestry University (NFBGL02)
NFBGL02与Novozyme188合成龙胆二糖的试验结果比较见图1。由图1可见,NFBGL02与Novozyme188在前9 h合成龙胆二糖的速率均很快,而后速率放缓,NFBGL02在24 h可以达到峰值46.9 g/L,Novozyme188在24 h时达到最大值34.6 g/L。NFBGL02生产的龙胆二糖产量比Novozyme188多36.1%。龙胆二糖与异麦芽糖生成构成竞争反应,Novozyme188在合成龙胆二糖的同时,生成的副产物异麦芽糖比目标产物还多,异麦芽糖生成速率与龙胆二糖相一致,相对Novozyme188而言,异麦芽糖抑制龙胆二糖的作用强于NFBGL02。异麦芽糖同龙胆低聚糖一样,也是功能性低聚糖,能够促进双歧杆菌的增殖。如果从生产低聚糖的角度出发,Novozyme188能得到更多的双歧因子。但如果以NFBGL02制备龙胆二糖,产物纯度更高。
2.1.2 转糖反应缓冲液pH、温度的确定
温度和溶液的pH是转糖反应进程的重要参数。在考察不同温度对NFBGL02酶活的影响时,固定pH为4.8,得到酶活最大时的温度;考察不同pH对酶活的影响时,固定最佳温度。考察NFB-GL02随温度和pH的变化结果如图2所示:60℃之前,酶活随温度增加而增加;β-葡萄糖苷酶最适反应温度为60℃,在50~70℃之间,β-葡萄糖苷酶的相对酶活均在50%以上,说明酶活在此区间都是稳定的。由图2可知,β-葡萄糖苷酶酶活随pH波动较大,最适反应pH为5.0,在pH在3.6~6.0之间,β-葡萄糖苷酶相对酶活均在50%以上。因此,转糖反应条件为:pH为5.0,温度60℃。
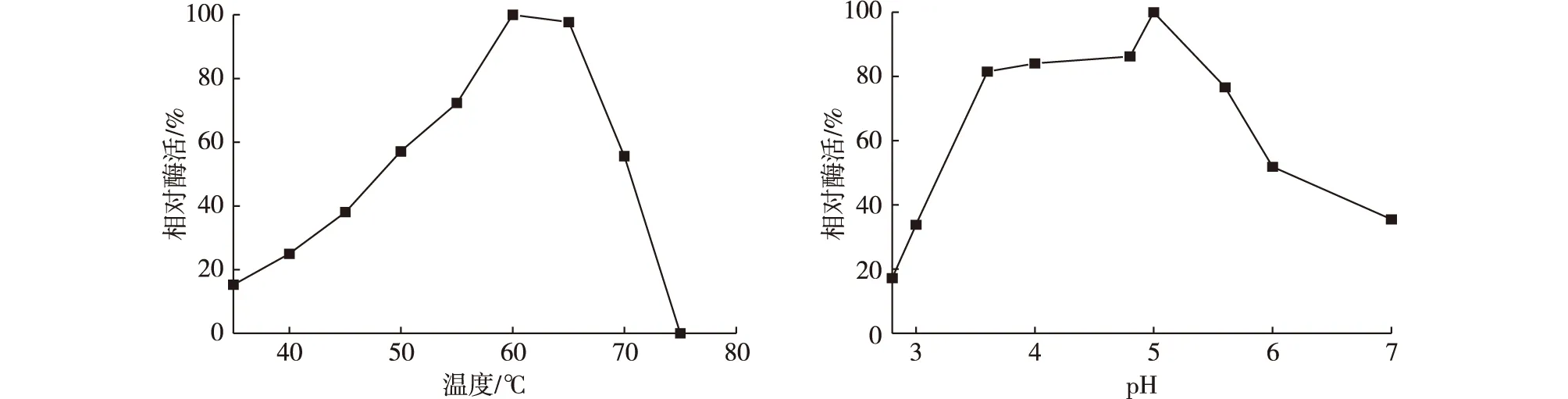
图2 NFBGL02在不同温度、pH下的相对酶活Fig. 2 Relative enzyme activity of the produced enzyme under different temperature, pH
2.1.3 最佳加酶量的确定

图3 加酶量对龙胆二糖合成的影响Fig. 3 Effects of enzyme dose on the synthesis of gentiobiose
选取NFBGL02不同加酶量,如20,40,60,80,100 U/g葡萄糖进行实验,反应温度60℃,底物浓度600 g/L,pH为5,转糖苷反应36 h。通过测定龙胆二糖的浓度,确定NFBGL02的加酶量对龙胆二糖含量的影响,结果如图3所示。前12 h,随着加酶量的增加,龙胆二糖浓度增加与加酶量有关。在反应前期,龙胆二糖浓度较低,其反馈抑制作用不是很强,而反应物浓度很高,龙胆二糖的生成速率与加酶量成正比,与米氏方程相符。而在22~36 h内,龙胆二糖浓度生成速率变得平缓,24 h处为速率变化转折点,而不同加酶量的样本(40,60,80,100 U/g葡萄糖)最终生成的龙胆二糖浓度趋于一致。但40 U/g葡萄糖的时候较60,80,100 U/g葡萄糖的时候得到的龙胆二糖浓度偏低,而60 U/g葡萄糖能达到80 U/g和100 U/g葡萄糖的效果,且生成的龙胆二糖浓度稳定。综合考虑β-葡萄糖苷酶的成本和龙胆二糖的得率,葡萄糖转糖反应的加酶量选择为60 U/g葡萄糖。
2.1.4 葡萄糖底物浓度对龙胆二糖合成的影响
为确定合适的葡萄糖底物浓度,对NFBGL02合成龙胆二糖反应进行考察。以不同浓度的葡萄糖溶液为原料,浓度由600 g/L,增加到1 000 g/L加酶量为60 U/g葡萄糖,60℃反应,pH 5.0,80 r/min条件下反应36 h,定时取样,用离子交换色谱法测定龙胆二糖的含量,结果见图4。葡萄糖底物浓度对转糖苷平衡有重要的影响,在一定温度下,增加葡萄糖浓度,反应平衡正向移动,有利于龙胆二糖的生成。图4表明:高浓度的葡萄糖溶液有利于龙胆二糖的生成;但生成的龙胆二糖浓度相对于葡萄糖并不是很高。因为龙胆二糖作为产物对反应有着抑制作用,是导致葡萄糖利用率不高的主要原因。

图4 葡萄糖浓度对龙胆二糖合成的影响Fig. 4 The effects of the glucose concentration on the synthesis of gentiobiose

图5 龙胆二糖混合物经离子交换树脂洗脱图谱Fig. 5 The ion exchange resin elution chromatography of the gentiobiose mixture
从整体来看,几乎所有浓度的葡萄糖溶液在0~7 h都是随时间的增加而增加的,并且增长的速率与时间类似于正比。从不同浓度的葡萄糖溶液比较来看,浓度增加确实会使产物增加,不同浓度的葡萄糖在相同时间得到的龙胆二糖浓度为900 g/L的最多,再者是800 g/L浓度的。但是浓度1 000 g/L的葡萄糖溶液得到的龙胆二糖浓度却是最低的,糖浓度过高,黏度增大,酶与糖液并不能发生较好的有效碰撞,可能是产率较低的主要原因。
2.1.5 反应时间对龙胆二糖的影响
为确定比较合适的酶转化时间,对NFBGL02合成龙胆二糖周期进行考察。以浓度为900 g/L的葡萄糖为原料,加酶量60 U/g葡萄糖,60℃反应,每隔12 h取样,用离子交换色谱法测定龙胆二糖的含量。在反应过程中,前24 h龙胆二糖的含量急剧上升,龙胆二糖浓度从0增加到46.6 g/L。随后龙胆二糖的含量略微减少,但是自反应48到72 h,龙胆二糖的含量又开始上升,增幅较小,龙胆二糖达到峰值49.7 g/L,葡萄糖利用率5.5%。之后龙胆二糖的含量在72到84 h内大幅度降低,其原因可能是转化反应达到平衡后,β-葡萄糖苷酶又将龙胆二糖当作底物水解了。所以反应是反复进行的,自84到108 h龙胆二糖的浓度又开始直线上升。虽然在72 h,龙胆二糖达到峰值,但在24 h时,龙胆二糖就能达到最大值的94.0%(46.9 g/L),从时间和得率的角度,选择24 h转化反应时间,葡萄糖的利用率为5.2%。此结果明显高于前人报道的利用纤维二糖为底物,A.niger来源的Family 3β-葡萄糖苷酶为转糖苷酶,50 mmol/L的纤维二糖仅得到6.5 g/L的龙胆二糖[3]。
2.2 龙胆二糖粗产品的分离提纯
龙胆二糖层析分离所进样中,龙胆二糖21.4 g/L,纤维二糖1.7 g/L和很少的异麦芽糖。图5a为葡萄糖与龙胆二糖的混合液经过第1次离子交换树脂分离,能够得到大部分组分为龙胆二糖的粗产品。收集第1次洗脱24.5~30.5 min的样品,龙胆二糖的纯度为50.9%,20.0~25.0 min出现的小峰可以推断是缓冲盐形成的,31.5~40.0 min洗脱的是葡萄糖与残余的龙胆二糖。将第1次离子交换树脂洗脱得到的龙胆二糖粗产品收集、浓缩,第2次洗脱得到图5b,可以看出葡萄糖和龙胆二糖能够实现很好的分离,收集图5b中第2次洗脱15.5~22.5 min的样品,龙胆二糖在总混合物中的纯度达到97.0%,在“M”峰底部能够检测到残余的龙胆二糖。
2.3 龙胆二糖增殖青春双歧杆菌
双歧杆菌是人体肠道内重要的优势菌群,它能保护宿主免受致病菌侵害,提高免疫力及促进营养物质吸收,同时其代谢的有机酸还能抑制肠道内有害菌、病原菌的生长[18]。以提纯酶法制得的龙胆二糖为碳源,稀释到5.0 g/L,在37℃恒温厌氧培养箱中培养。青春双歧杆菌代谢龙胆二糖36 h后,龙胆二糖质量浓度由5.0 g/L降低至3.7 g/L(图6a)。前24 h龙胆二糖消耗速率达到0.05 g/(h·L),24~36 h消耗速率为0.004 g/(h·L)。前12 h青春双歧杆菌菌体迅速增殖,从0.06 g/L增殖到0.2 g/L,这与龙胆二糖在此期间迅速降低相对应;而后在12~36 h期间匀速增殖,龙胆二糖浓度也相应地匀速降低。培养期间,青春双歧杆菌产生乳酸、乙酸、丙酸,导致pH从6.0降低到4.7,而pH的降低及菌体浓度的增长与龙胆二糖的降低有明显的相关性。前12 h,龙胆二糖浓度与pH迅速降低,而菌体浓度迅速上升;12~36 h,龙胆二糖浓度和pH近似匀速缓慢减少,而菌体浓度近似匀速缓慢增加。
青春双歧杆菌代谢龙胆二糖36 h后残糖浓度为3.7 g/L,而代谢相同浓度的葡萄糖36 h剩余葡萄糖1.8 g/L。由表2可知,龙胆二糖增殖青春双歧杆菌36 h后获得的菌体碳含量9.6 mmol/L,较0 h的菌体碳含量2.5 mmol/L增殖了3.8倍左右。而葡萄糖增殖青春双歧杆菌36 h得到菌体含碳量13.3 mmol/L。可见,龙胆二糖确有增殖青春双歧杆菌的能力,但较葡萄糖增殖效果偏差。葡萄糖虽然效果好,但其在到达肠道之前就已经被人体吸收利用了。人体胃肠内由于缺乏水解功能性低聚糖的酶系统,因此不能直接利用功能性低聚糖,但其可以被肠道内的有益菌群充分利用,功能性低聚糖是双歧杆菌、乳酸菌、肠球菌等有益菌群最直接、最有效的养料,它能排除消化系干扰,促使双歧杆菌等快速生长和大量繁殖[19]。

表2 青春双歧杆菌代谢龙胆二糖碳元素分布
青春双歧杆菌代谢龙胆二糖后,培养基pH降低,这是因为青春双歧杆菌产生代谢产物有机酸。由图6b可知,从2 h就开始产生乳酸、乙酸、丙酸和少量的丁酸。0~36 h,乳酸和乙酸的质量浓度随时间变化增加,而丙酸和丁酸的质量浓度变化不大,青春双歧杆菌产生的乙酸质量浓度是乳酸的7.8倍,总酸浓度从1.01 g/L增加到2.03 g/L。
青春双歧杆菌代谢龙胆二糖过程中,最大的碳损失为9.6%,因此可以认为青春双歧杆菌代谢过程碳元素是守恒的。碳源减少的碳元素都转移到菌体和有机酸的碳含量中,青春双歧杆菌36 h代谢了含有74.9 mmol/L碳元素的碳源,生成了含有碳元素62.1 mmol/L的有机酸和含有碳元素7.1 mmol/L的菌体。
3 结 论
1)通过对β-葡萄糖苷酶酶法合成龙胆二糖的研究,选择5种不同酶中的南京林业大学自产酶(NFBGL02)来制备龙胆二糖,其最佳反应条件:pH 5.0,温度60℃,60 U/g葡萄糖的加酶量,900 g/L的葡萄糖溶液,反应24 h,得到龙胆二糖46.9 g/L,葡萄糖的利用率为5.2%。
2)离子交换色谱分析结果表明反应结束后混合物中主要成分为葡萄糖、龙胆二糖和少量的异麦芽糖。以钙型阳离子交换树脂为介质,可以将龙胆二糖和葡萄糖有效分开,收集其中最好的分离组分龙胆二糖纯度达到97.0%。
3)龙胆二糖能够有效增殖青春双歧杆菌,菌体浓度较开始时增长了3.8倍左右;代谢产物含有乳酸、乙酸、丙酸和少量的丁酸,乳酸和乙酸随时间增加,丙酸和丁酸变化不大;36 h后,有机酸达到2.03 g/L。
[1]杨海军, 崔兆海. 浅谈我国功能糖市场发展分析[J]. 中国食品添加剂, 2011(S1):104-110. YANG H J, CUI Z H. China functional sugar market development and analysis[J]. China Food Additives, 2001(S1):104-110.
[2]胥九兵, 刘海玉, 李克文, 等. 高纯度功能性低聚糖的生产及应用[J]. 精细与专用化学品, 2013, 21(4):10-12. XU J B, LIU H Y, LI K W, et al. Production and application of high purity functional oligosaccharides[J]. Fine and Specialty Chemicals, 2013, 21(4):10-12.
[3]刘玲玲.β-葡萄糖苷酶转化葡萄糖制备低聚龙胆糖的研究[D]. 无锡:江南大学, 2009. LIU L L. Studies on production of gentiooligosaccharide from glucose withβ-glucosidase [D]. Wuxi:Jiangnan University, 2009.
[4]王钏, 齐香君. 酶法合成龙胆低聚糖得率测定方法学研究[J]. 食品科技, 2012, 37(7):276-278. WANG C, QI X J. Methodological for determining yield of gentiooligsaccharide prepared by enzyme[J]. Food Science and Technology, 2012, 37 (7):276-278.
[5]谷利伟, 赵金兰. 日本低聚糖开发新动态[J]. 食品与机械, 1999(2):27-28. GU L W, ZHAO J L. Recent advances of oligosaccharides development in Japan[J]. Food and Machinery, 1999(2):27-28.
[6]何海燕, 张健, 覃拥灵. 高转苷活性β-葡萄糖苷酶菌株复合选育[J]. 食品科技, 2012, 37(11):23-27. HE H Y, ZHANG J, QIN Y L. Breeding of a high transglycosylation activityβ-glucosidase-producing strain by composite mutation with UV and NTG[J]. Food Science and Technology, 2012, 37(11):23-27.
[7]RASTALL R A, BUCKE C. Enzymatic synthesis of oligosaccharides[J]. Biotechnology and Genetic Engineering Reviews, 1992, 10(1):253-282.
[8]SU E Z, XIA T, GAO L P, et al. Immobilization ofβ-glucosidase and its aroma-increasing effect on tea beverage[J]. Food & Bioproducts Processing, 2010, 88(2):83-89.
[9]余强, 庄新姝, 袁振宏, 等. 木质纤维素类生物质制取燃料及化学品的研究进展[J]. 化工进展, 2012, 31(4):784-791. YU Q, ZHUANG X S, YUAN Z H, et al. Research progress on fuel and chemicals production from lignocellulose biomass[J].Chemical Industry and Engineering Progress, 2012, 31(4):784-791.
[10]孙付保, 王亮, 谭玲, 等. 木质纤维素糖平台基质组成结构的分析表征技术研究进展[J]. 化工进展, 2014, 33(4):883-890,895. SUN F B, WANG L, TAN L, et al. Analytic technology of characterizing the substrate architecture in the lignocellulose-to-sugar platform[J]. Chemical Industry and Engineering Progress, 2014, 33(4):883-890,895.
[11]许庆利, 蓝平, 隋淼, 等. 木质纤维素水解制取燃料乙醇研究进展[J]. 化工进展, 2009, 28(11):1906-1912. XU Q L, LAN P, SUI M, et al. Progress in the hydrolysis of lignocellulosic biomass for fuel-ethanol production[J]. Chemical Industry and Engineering Progress, 2009, 28(11):1906-1912.
[12]张军华, 徐勇, 勇强, 等. 木二糖和木三糖的分离及其用于双歧杆菌的体外培养[J]. 林产化学与工业, 2005, 25(1):15-18. ZHANG J H, XU Y, YONG Q, et al. Preparative separation of xylobiose and xylotriose their in vitro applicaton in fermentation by bifidobacteria [J]. Chemistry and Industry of Forest Products, 2005, 25(1):15-18.
[13]BHATIA Y, MISHRA S, BISARIA V S. Biosynthetic activity of recombinantEscherichiacoli-expressedPichiaetchellsiiβ-glucosidase II[J]. Applied Biochemistry & Biotechnology, 2002, 102-103:367-379.
[14]PARK T H, CHOI K W, PARK C S, et al. Substrate specificity and transglycosylation catalyzed by a thermostableβ-glucosidase from marine hyperthermophileThermotoganeapolitana[J]. Applied Microbiology & Biotechnology, 2005, 69(4):411-422.
[15]STEPHANOPOULOS G N, ARISTIDOU A A, NIELSEN J. Metabolic pathway synthesis metabolic engineering-Chapter 7[J]. Metabolic Engineering, 1998:285-308.
[16]YU S, JEPPSSON H, HAHN-HGERDAL B. Xylulose fermentation bySaccharomycescerevisiaeand xylose-fermenting yeast strains[J]. Applied Microbiology & Biotechnology, 1995, 44(3/4):314-320.
[17]朱婧, 覃拥灵, 陈桂光, 等.β-葡萄糖苷酶高产菌株的选育及酶法转化葡萄糖生产龙胆低聚糖[J]. 食品与发酵工业, 2010, 36(4):21-24. ZHU J, QIN Y L, CHEN G G, et al. Selection of the highβ-glucosidase mutant and production of gentiooligosaccharide[J]. Food and Fermentation Industries, 2010, 36(4):21-24.
[18]张军华, 勇强, 余世袁. 青春双歧杆菌代谢低聚木糖机理研究[J]. 林产化学与工业, 2007, 27(5):1-5. ZHANG J H, YONG Q, YU S Y. Metabolism of xylooligosaccharides byBifidobacteriumadolescentis[J]. Chemistry and Industry of Forest Products, 2007, 27(5):1-5.
[19]黄德娟, 谈华平. 功能性低聚糖[J]. 生物学通报, 2005, 40(12):19-21. HUANG D J, TAN H P. Functional oligo saccharides[J]. Bulletin of Biology, 2005, 40(12):19-21.
Synthesis of gentiobiose by β-glucosidase and separation of the product
ZHANG Lin, WANG Lei, WU Guangxing, YONG Qiang, YU Shiyuan*
(College of Chemical Engineering, Nanjing Forestry University, Nanjing 210037, China)
Gentiobiose was prepared by glucose catalyzed byβ-glucosidase via transglycosylation. The effects of the source of theβ-glucosidase, reaction temperature, pH,β-glucosidase dose, substrate concentration and reaction time on the gentiobiose were analyzed. The enzyme produced by Nanjing Forestry University was selected for the synthesis of gentiobiose. It was found that optimal conditions for synthesis were as follows: glucose at a concentration of 900 g/L was added withβ-glucosidase at a dosage of 60 U/g glucose; the mixture was incubated at pH 5, temperature of 60℃ with a shaking speed of 80 r/min; after 24 h, 46.9 g/L of gentiobiose was obtained. Anion exchange chromatography was used to quantitatively detected gentiobiose. Separation and purification of the gentiobiose product was completed by ion chromatography. Cation exchange resin was used in 2-step separation. The results showed that the gentiobiose was well separated from glucose after 2 times elution, getting a purity of 97.0%. The prepared gentiobiose was used for the proliferation ofBifidobacteriumadolescentis. Sugar source containing 74.9 mmol/L of carbon was metabolized for 36 h, generating organic acids of 62.1 mmol/L carbon and bacterium biomass of 7.1 mmol/L carbon. The concentration of bacterium biomass increased by 3.8 times, indicating that the gentiobiose prepared in this study was an effective inducer forB.adolescentiswhich was beneficial to human health.
gentiobiose;β-glucosidase;cation exchange resin;Bifidobacteriumadolescentis
2016-08-08
2016-12-19
“十二五”国家科技支撑计划项目(2015BAD15B09)。
张林,男,研究方向为生物化工。通信作者:余世袁,男,教授。E-mail:syu@njfu.edu.cn
Q533
A
2096-1359(2017)02-0076-07
