基于高底物浓度的纤维素酶三段水解桑木粉得率与形貌分析
2017-04-24王燕云吴凯杨行杨静
王燕云,吴凯,杨行,杨静*
(1.西南林业大学云南省木材胶黏剂及胶合制品重点实验室; 2.西南林业大学材料工程学院,昆明650224)
基于高底物浓度的纤维素酶三段水解桑木粉得率与形貌分析
王燕云1,2,吴凯1,2,杨行2,杨静1,2*
(1.西南林业大学云南省木材胶黏剂及胶合制品重点实验室; 2.西南林业大学材料工程学院,昆明650224)
为改善高底物浓度酶水解过程中产物抑制问题,采用三段酶水解方法,通过在水解过程中及时移除反应产物纤维二糖和葡萄糖,降低产物抑制作用,增加酶反应速率,从而提高酶水解得率、缩短酶反应时间。与原料和经NaOH预处理的桑木比较,NaOH-Fenton预处理后的桑木中木聚糖含量明显降低,纤维素含量相对增加,木质素含量变化较小。无论是一段水解还是三段水解,纤维素酶水解得率均随底物质量浓度的升高而下降。在0.30 g/mL(m/V)底物质量浓度下,当酶用量增加为40 U/g(以纤维素质量计)时,三段(10+10+10)h酶水解得率74.16%,比一段水解72 h得率45.61%增长了62.60%,并且水解时间缩短了42 h。该研究结果对提高纤维素酶水解得率、降低纤维资源制取燃料乙醇成本具有指导意义。
木质纤维原料;预处理;纤维素酶;三段酶水解
纤维素酶水解是木质纤维原料制备燃料乙醇的重要技术步骤,酶水解的初速度和得率受水解底物浓度的影响。低底物浓度可以提高水解得率并缩短酶解时间,但设备的利用效率低,并导致后续酒精分离生产成本过高。过高的底物浓度又会使得酶解体系的黏度增加,影响传质效果,并形成强烈的产物抑制效应,但高底物浓度水解将带来高发酵糖浓度和高酒精浓度,进而降低后续蒸馏成本,并提高整个酒精工艺的劳动生产率[1-4]。
传统的木质纤维原料酶水解技术在0.10 g/mL底物质量浓度下进行,如果葡萄糖得率达到80%,发酵后的乙醇质量分数尚不到2%。而高底物浓度水解和发酵技术在以淀粉质原料制备燃料乙醇工艺中应用已较为成熟,当淀粉水解底物质量浓度为0.20 g/mL时,发酵后乙醇质量分数为10%。研究表明,只有糖液发酵后的乙醇质量分数达到4%~5%,后续的酒精分离过程才经济可行[5]。增加酶水解过程的底物浓度,可以提高体系中糖浓度和乙醇得率,并降低水解和发酵过程中操作费用,减少后续酒精分离的能量消耗和成本。有研究表明,当水解底物质量浓度从0.05 g/mL提高至0.08 g/mL时,每加仑燃料乙醇的成本将降低20%[6-7]。但是当底物质量浓度超过0.15 g/mL时,二步法糖化发酵技术和同步糖化发酵技术均未取得较好研究成果。主要存在以下问题:1)高底物浓度导致高传质和传热阻力;2)高底物浓度带来高发酵抑制物;3)高底物浓度引起高浓度产物抑制。
针对以上问题,国内外学者采用反应器设计或分批补料技术来减少传质和传热阻力,通过及时除去生成的单糖、同步糖化发酵技术或添加外源β-葡萄糖苷酶而降低产物抑制作用[8-10]。
解决高底物浓度引起的高浓度产物抑制问题,并建立高效利用纤维素酶各组分的酶解工艺及模式,已成为木质纤维原料糖化研究领域中亟待解决的问题。云南省大姚县广泛种植白桑,白桑生长速度较快,桑叶用于饲料喂养家蚕。每年雨季前(6—10月)需修剪桑木以提高叶片生长率,然而大量修剪枝条未得到较好利用。Fenton反应可无选择地氧化水中大多数有机物,特别适用化学或生物难降解的有机废水氧化处理,而用于降解木质纤维素方面的研究鲜见报道[11-13]。Fenton反应能够产生大量中间产物羟基自由基氧化分解有机物,起到解聚纤维素作用。本研究以缩短水解时间和提高水解效率为目的,以白桑枝条为原料,NaOH-Fenton反应为预处理方式,通过不同底物浓度的纤维素酶分段水解、不同酶用量的高底物浓度分段水解及预处理前后、酶水解后原料表面形貌变化,分析高底物浓度下纤维素酶分段酶水解的可行性,为纤维素乙醇的工业化生产提供技术支撑。
1 材料与方法
1.1 原 料
桑木(MorusalbaL.)采自云南省大姚县。纤维素酶(C2730),由里氏木霉(ATCC 26921)生产,丹麦诺维信(Novozyme)生产,Sigma公司提供,其滤纸酶活为128.10 U/mL,β-葡萄糖苷酶酶活为27 U/mL。
1.2 桑木原料预处理
桑木2% NaOH预处理:将桑木粉末用2% NaOH溶液(固液比1∶10),在65℃条件下处理2 h,待反应结束后,用蒸馏水洗涤固体残渣至中性。固体渣作为后续Fenton试剂预处理底物。
桑木Fenton试剂预处理:取20 g经2% NaOH预处理的绝干桑木置于1 L三角瓶中,加入质量分数30% 的H2O280 mL,16 mmol/L Fe2+溶液,固液比1∶15,使用醋酸调节pH至 3.0,在160 r/min 条件下处理12 h。反应结束后洗涤固体渣,并进行后续纤维素酶水解[14]。
1.3 高底物浓度纤维素酶一段水解NaOH-Fenton试剂预处理桑木
取绝干15 g NaOH-Fenton试剂预处理的桑木置于250 mL三角瓶中,加入一定量的水、柠檬酸缓冲液和纤维素酶液,使初始底物质量浓度为0.15 g/mL,分别在3,4和5 h补加绝干底物质量浓度0.05 g/mL, 使得最终反应体系中底物质量浓度为0.20,0.25和0.30 g/mL,酶用量为15 U/g(以总纤维素质量计,下同)。充分搅拌均匀后,置于50℃、150 r/min的摇床中反应。分别于2,4,8,12,24,48和72 h取样,于10 000 r/min转速下离心5 min,取清液适当稀释后采用高效液相色谱(HPLC)测定反应液中葡萄糖和纤维二糖的浓度变化,并计算酶解得率[15-16]。
1.4 高底物浓度纤维素酶(10+10+10)h三段水解NaOH-Fenton试剂预处理桑木
取绝干质量10 g NaOH-Fenton预处理桑木于250 mL三角瓶中,加入一定量的水、柠檬酸缓冲液和纤维素酶液,使底物质量浓度为0.10 g/mL,酶用量为15 U/g,pH为4.8。充分搅拌均匀后,置于50℃、150 r/min摇床中进行第一段10 h的酶水解,然后于10 000 r/min转速下离心5 min,收集上清液,HPLC测定其中纤维二糖和葡萄糖的含量,计算纤维素酶水解得率。酶解渣用100 mL蒸馏水洗涤两次,于10 000 r/min转速下离心5 min,收集酶解渣。将第一段洗涤后的酶解渣作为底物,添加1 mol/L柠檬酸缓冲液0.5 mL、纤维素酶3 U/g和蒸馏水,使反应体系总体积与初始反应一致,于pH 4.8、50℃、150 r/min的摇床中再酶解10 h后,按第一段方法进行固液分离,将第二段的酶解渣进行洗涤。将第二段洗涤后的酶解渣作为底物,添加1 mol/L柠檬酸缓冲液0.5 mL、纤维素酶2 U/g和蒸馏水,使反应体系总体积与初始反应一致,于pH 4.8、50℃、150 r/min的摇床中再酶解10 h后,按第一段方法进行固液分离,弃用酶解渣[17]。
1.5 扫描电镜(SEM)分析
取分段水解30 h后的预处理底物进行扫描电镜(SEM)观察。扫描电镜设备:日立HCP-2临界点干燥器、日立E-1010离子溅射仪、飞利浦Quanta200电子显微镜。处理步骤:将经过NaOH-Fenton预处理和30 h分段酶水解后的桑木,真空干燥,在40℃条件下处理4 h。干燥后粘于金属台上,真空喷金膜,采用飞利浦Quanta200电子显微镜进行扫描观察、拍照[18],分析预处理及水解后原料表面形貌变化。
1.6 分析方法
1.6.1 水分含量测定
水分含量采用红外线水分计FD-720测定。
1.6.2 纤维素、半纤维素和木质素测定
样品纤维素、半纤维素和木质素含量根据美国可再生能源实验室(NREL)标准测试方法DE-AC3608GO28308-2008进行测定[19]。
1.6.3 酶水解液中糖组分测定
采用HPLC法测定酶水解液中糖组分。使用Agilent1100 型高效液相色谱仪,糖柱为Bio-Rad Aminex HPX-87H色谱柱,流动相为0.005 mol/L的H2SO4,流速为0.6 mL/min,柱温55℃。采用示差
折光检测器检测,外标法测定。纤维素水解得率计算公式如下:
纤维素水解得率=
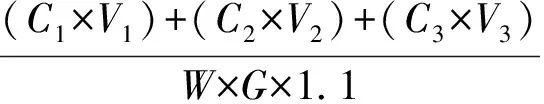
式中:C1、C2和C3分别为第一段、第二段和第三段水解液及洗液中纤维二糖和葡萄糖的质量浓度,g/L;V1、V2和V3分别为第一段、第二段和第三段水解液及洗液体积,L;G为原料质量,g;W为原料中纤维素的质量分数,%;1.1为纤维素和葡萄糖之间转换系数。
2 结果与分析
2.1 NaOH-Fenton试剂预处理前后桑木化学成分变化
未处理桑木、NaOH预处理桑木和NaOH-Fenton预处理桑木的化学成分变化见表1。原料桑木化学成分中纤维素占(38.80±2.1)%(质量分数,下同),木聚糖占(20.70±1.0)%,糖类化合物约占原料的59.5%。经NaOH处理(2% NaOH,65℃,2 h)后,纤维素含量提高至(42.25±1.8)%,木聚糖降低至(16.88±1.1)%,主要是由于部分半纤维素生成可溶性糖溶出,使得纤维素和木质素在固体残渣中含量相对增加。经NaOH-Fenton 试剂预处理后,桑木中纤维素含量为(53.99±1.9)%,木聚糖含量为(8.08±2.3)%,木质素(30.44±2.0)%,95%乙醇抽出物为(3.08±2.1)%。固体残渣中木聚糖的含量变化最大,表明NaOH-Fenton试剂预处理条件较为温和,主要是催化半纤维素糖苷键发生降解,纤维素和木质素等受到降解和破坏较少。

表1 预处理前后桑木化学成分
将桑木原料、NaOH预处理桑木和NaOH-Fenton预处理桑木在底物质量浓度为0.10 g/mL,pH 4.8,温度50℃,搅拌速度150 r/min,纤维素酶用量15 U/g条件下水解72 h,结果见图1。经2% NaOH预处理的桑木,72 h酶水解得率为16.13%,与未处理桑木相比增加了15.82个百分点;而经NaOH-Fenton预处理的桑木,72 h酶水解得率为60.46%,分别比未经处理和经2% NaOH预处理的酶水解得率增加了60.15和44.33个百分点。木质纤维原料是以纤维素作为骨架,半纤维素作为填充物,木质素作为黏结剂结合而成的,被认为是自然界中对生物作用和化学作用抗性最强的材料之一,因而酶水解对原料几乎不起作用[17]。原料经2% NaOH预处理后,其结构受到部分破坏(部分半纤维素溶解,表1),纤维素润胀,纤维素酶与纤维素的结合位点增加,使得酶水解得率增加。而Fenton预处理是通过模拟褐腐菌降解木质纤维素的原理,利用Fenton反应生成羟基自由基(·OH)破坏纤维素分子间或分子内的氢键结构,使木质纤维素解聚,最终起到提高酶水解得率作用。

图1 NaOH和NaOH-Fenton试剂预处理对酶水解得率的影响Fig. 1 Effect of NaOH and NaOH-Fenton pretreatment on hydrolysis yield
2.2 底物浓度对(10+10+10)h三段水解NaOH-Fenton预处理桑木影响
当初始底物质量浓度为0.15 g/mL,分别在3,4和5 h补加绝干底物质量浓度0.05 g/mL, 使得最终反应体系中底物质量浓度分别为0.20,0.25和0.30 g/mL,在纤维素酶用量为15 U/g,50℃、pH 4.8 和 150 r/min 条件下进行纤维素酶一段水解和(10+10+10)h三段水解,底物浓度对酶水解得率的影响如图2所示。
由图2a可知,纤维素酶一段水解NaOH-Fenton
试剂预处理桑木72 h 后,尽管水解液中纤维素降解产物纤维二糖和葡萄糖浓度随底物浓度的增加而升高,但纤维素酶水解得率随底物浓度增加而下降。当底物质量浓度从0.15 g/mL升至0.30 g/mL时,48 h的水解得率由43.11%降至32.78%,72 h 水解得率由45.44%降至34.76%。这主要是高底物浓度下酶扩散阻力增加和水解液中高浓度葡萄糖与纤维二糖对纤维素酶的反馈抑制作用增强的结果;与底物质量浓度为0.10 g/mL的一段水解相比较,底物质量浓度0.30 g/mL的水解体系中的反馈抑制更为强烈。本试验采用分段水解技术以解除高底物浓度下酶水解反应过程中产物抑制作用。
由图2b可知,在(10+10+10)h三段酶水解过程中,当底物质量浓度为0.15 g/mL时,30 h 水解得率为54.82%,较一段水解72 h 的水解得率45.44%增加了20.64%;当底物质量浓度为0.20和0.25 g/mL时,30 h水解得率分别为52.57%和50.18%;底物质量浓度为0.30 g/mL时,第一段、第二段和第三段的水解得率分别为19.73%,15.38%和13.30%,30 h 水解得率为48.41%,较一段水解72 h 的水解得率34.76%增加了39.27%,且水解时间缩短了42 h。研究表明,当底物质量分数低时,虽然酶解得率较高,但酶解液中的还原糖浓度较低。为提高后续发酵工艺效率,需增加酶解液中还原糖浓度,因此需提高水解底物浓度。
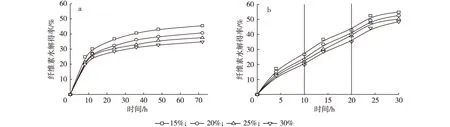
图2 不同底物浓度对纤维素酶一段水解(a)和(10+10+10)h三段水解(b)的影响Fig. 2 Effect of substrate concentration on one-stage (a) and three-stage (b) hydrolysis yield
由图2b可以看出,在(10+10+10)h分段酶水解过程中,当底物质量浓度为0.20,0.25和0.30 g/mL时,30 h水解得率变化不大。这可能是由第一段和第二段酶解残渣中粘附的高糖浓度导致的,当底物质量浓度高于0.20 g/mL时,尽管固体残渣经过两次洗涤,但其纤维二糖和葡萄糖浓度仍较高,尚存在产物对水解反应的抑制作用;另外,酶和底物的作用是通过酶和底物生成复合物进行,当底物浓度增大至某种程度时,酶的活性中心被饱和或趋于饱和,反应速度达到一个极限值,故水解得率变化不大[20]。
2.3 不同酶用量对高底物浓度纤维素酶三段(10+10+10)h水解得率影响
当初始底物质量浓度为0.15 g/mL时,分别在3,4和5 h补加绝干底物0.05 g/mL, 使得最终反应体系中底物质量浓度为0.30 g/mL,纤维素酶用量为20,25,30,35和40 U/g条件下,纤维素酶用量对一段水解得率的影响见图3a,酶用量对(10+10+10)h三段水解得率的影响如图3b所示。
由图3可知,一段水解和三段水解的纤维素酶水解得率均随酶用量的增加而升高,在底物质量浓度0.30 g/mL条件下,酶用量增加使底物可吸附更多纤维素酶,从而提高平均酶反应速率。当酶用量由20 U/g升至40 U/g时,在一段酶水解中,72 h纤维素酶水解得率由23.29%升至45.61%;在三段(10+10+10)h酶水解中,30 h纤维素酶水解得率由52.59%升至74.16%。
在不同酶用量的三段(10+10+10)h酶水解过程中,第一段(0~10 h)期间酶用量对纤维素酶水解得率的影响不大;而在第二段(10~20 h)和第三段(20~30 h)中,当酶用量为30~40 U/g时,酶水解得率呈显著增加趋势。当酶用量增加至一定程度时,水解得率增加缓慢,主要是由于纤维表面最初吸附的酶形成单分子层,当结合位点全部被纤维素酶分子饱和后,即使再增加过量的纤维素酶也起不到提高水解得率的作用[20]。因此,在木质纤维原料酶水解过程中,增加纤维素酶用量在一定程度上对水解有利,可以提高水解得率,但当纤维素酶量超过一定量后,对水解的影响不大,而且过高的纤维素酶用量将导致纤维素酶水解成本的增加。

图3 纤维素酶用量对一段(a)和三段(10+10+10)h(b)酶水解得率的影响Fig. 3 Effect of enzymatic dosage on one-stage (a) and three-stage (b) hydrolysis yield
2.4 扫描电镜(SEM)分析

图4 分段酶水解30 h固体残渣扫描电镜图Fig. 4 SEM micrographs of mulberry wood enzymatic hydrolyzed for 30 h
将桑木原料先后进行NaOH-Fenton试剂预处理和30 h分段酶水解后,水解固体残渣表面形态见图4。图4a为预处理底物经30 h酶水解后放大80倍的扫描电镜图,可以看出底物原本结构紧密有序,但完全受到破坏,纤维被不规则地解聚及断裂。在350倍扫描电镜下观察(图4b)发现,微纤维断裂部位,且经预处理和酶水解后,纤维束相互分开松散。在600倍下观察(图4c)发现,经酶水解后纤维质地变得更为柔软,结构变得更为疏松,该处糖化现象较为明显。在800倍下观察(图4d)可以看出,纤维间孔隙较大,有细小纤维剥离脱落现象。由扫描电镜分析结果可见,桑木原料经NaOH-Fenton预处理和纤维素酶水解后,纤维结构受到明显破坏,纤维长链被降解断开,部分木质纤维素已转化为水溶性糖。
3 结 论
本研究以桑木作原料,以NaOH-Fenton为预处理方法,通过分段酶水解技术改善高底物浓度水解过程中产物抑制问题。桑木经NaOH-Fenton预处理后,木聚糖含量明显降低,纤维素含量相对增加,木质素含量变化较小。对于一段水解和(10+10+10)h三段水解,纤维素酶水解得率均随底物浓度增高而下降。在底物质量浓度为0.30 g/mL,酶用量为15 U/g时,三段水解得率48.41%,比一段水解72 h 的水解得率34.76%增加了39.27%,且水解时间缩短42 h。当酶用量为40 U/g时,三段酶水解得率74.16%,比一段水解72 h得率45.61%增加了62.60%,且水解时间缩短42 h。在今后的研究工作中还需对预处理手段进行改进,并在酶反应机制和酶反应动力学方面进行深入研究。
[1]JØRGENSEN H, VIBE-PEDERSEN J, LARSEN J, et al. Liquefaction of lignocellulose at high-solids concentrations[J]. Biotechnology and Bioengineering, 2007, 96(5):862-870.
[2]WENG J, LI X, BONAWITZ N, et al. Emerging strategies of lignin engineering and degradation for cellulosic biofuel production[J]. Current Opinion in Biotechnology, 2008, 19(2):166-172.[3]CHEN M, XIA L M, XUE P. Enzymatic hydrolysis of corncob and ethanol production from cellulosic hydrolysate[J]. International Biodeterioration & Biodegradation, 2007, 59(2):85-89.
[4]HODGE D B, KARIM M N, SCHELL D J, et al. Soluble and insoluble solids contributions to high-solids enzymatic hydrolysis of lignocellulose[J]. Bioresource Technology, 2008, 99(18):8940-8948.
[5]ZACCHI G, AXELSSON A. Economic evaluation of preconcentration in production of ethanol from dilute sugar solutions[J]. Biotechnology and Bioengineering, 1989, 34(2):223-233.
[6]STENBERG K, BOLLK M, RÉCZEY K, et al. Effect of substrate and cellulase concentration on simultaneous saccharification and fermentation of steam-pretreated softwood for ethanol production[J]. Biotechnology and Bioengineering, 2000, 68(2):204-210.[7]WINGREN A, GALBE M, ZACCHI G. Techno-economic evaluation of producing ethanol from softwood:comparison of SSF and SHF and identification of bottlenecks[J]. Biotechnology Progress, 2003, 19(4):1109-1117.
[8]KNUTSEN J S, DAVIS R H. Cellulase retention and sugar removal by membrane ultrafiltration during lignocellulosic biomass hydrolysis[J]. Applied Biochemistry and Biotechnology, 2004, 114(1/3):585-599.
[9]YANG S, DING W Y, CHEN H Z. Enzymatic hydrolysis of rice straw in a tubular reactor coupled with UF membrane[J]. Process Biochemistry, 2006, 41(3):721-725.
[10]瞿丽莉.β-葡萄糖苷酶的分离纯化及在纤维素水解上的应用[D]. 南京:南京林业大学, 2008. QU L L. Separation and purification ofβ-glucosidase and its application in cellulose hydrolysis[D]. Nanjing:Nanjing Forestry University, 2008.
[11]MICHALSKA K, MIAZEK K, KRZYSTEK L, et al. Influence of pretreatment with Fenton’s reagent on biogas production and methane yield from lignocellulosic biomass[J]. Bioresource Technology, 2012, 119:72-78.
[12]DE HEREDIA J B, TORREGROSA J, DOMINGUEZ J R, et al. Kinetic modelfor phenolic compound oxidation by Fenton’s reagent[J]. Chemosphere, 2001, 45:85-90.
[13]ERDEN G, FILIBELI A. Improving anaerobic biodegradability of biological sludges by Fenton pre-treatment:effects on single stage and two-stage anaerobic digestion[J]. Desalination, 2010, 251:58-63.
[14]王燕云, 杨静. 稀碱-芬顿试剂预处理对云南苦竹酶水解得率的影响[J]. 生物质化学工程, 2015, 49(5):17-22. WANG Y Y, YANG J. The influence of alkaline-fenton pretreatment on the enzymatic hydrolysis yield of Yunnan bamboo[J]. Biomass Chemical Engineering, 2015, 49(5):17-22.
[15]BALLESTEROS I, OLIVA J M, NEGRO M J, et al. Enzymic hydrolysis of steam exploded herbaceous agricultural waste (Brassicacarinata) at different particule sizes[J]. Process Biochemistry, 2002, 38(2):187-192.
[16]CHEN M, ZHAO J, XIA L M. Enzymatic hydrolysis of maize straw polysaccharides for the production of reducing sugars[J]. Carbohydrate Polymers, 2008, 71(3):411-415.
[17]杨静. 木质纤维原料分段酶水解技术的研究[D]. 南京:南京林业大学,2010. YANG J. Multi-stage enzymatic saccharification of lignocellulosic materials[D]. Nanjing:Nanjing Forestry University, 2010.
[18]朱圆圆, 顾夕梅, 朱均均, 等. 两步碱法预处理对玉米秸秆组分及结构的影响[J]. 中国科技论文, 2015, 10(12):1376-1381. ZHU Y Y, GU X M, ZHU J J, et al. Effects of two-step alkaline pretreatment on components and structure of corn stover[J]. China Science Paper, 2015, 10(12):1376-1381.
[19]SLUITER A D, HAMES B, RUIZ R O, et al. Determination of structural carbohydrates and lignin in biomass:laboratory analytical procedure[R]. Golden:National Renewable Energy Laboratory, 2008.
[20]黄爱玲, 周美华. 玉米秸秆酶水解影响因素的研究[J]. 中国资源综合利用, 2004(8):25-27. HUANG A L, ZHOU M H. Study on affecting factor of enzymolysis corn stalk[J]. China Resources Comprehensive Utilization, 2004(8):25-27.
Multi-stage enzymatic hydrolysis in high substrate concentrationof NaOH-Fenton pretreated mulberry wood
WANG Yanyun1,2, WU Kai1,2, YANG Hang2, YANG Jing1,2*
(1. Yunnan Provincial Key Laboratory of Wood Adhesives and Glued Products, Southwest Forestry University; 2. College of Materials Engineering, Southwest Forestry University, Kunming 650224, China)
Since the large-scale bioethanol industrialization is not fully mature, as one of the main technical steps, the enzymatic hydrolysis process needs to be further studied. In this paper, the three-stage enzymatic hydrolysis method was used to solve the problem of high glucose concentration inhibition during the high substrate concentration hydrolysis process. The enzymatic hydrolysis rate was improved by the three-stage enzymatic hydrolysis method, which could increase the enzymatic hydrolysis rate and shorten the enzymatic reaction time by removing the reaction products, i.e., cellobiose and glucose, in the hydrolysis process, reducing the product inhibition and increasing the enzyme reaction rate. The hydroxyl radical produced by the fenton reaction caused the loose structure and changed the three-dimensional structure of the cellulose in the biomass, which was propitious to improve the hydrolysis efficiency of the subsequent enzyme by NaOH-Fenton pretreatment method. The results showed that 2% NaOH-Fenton pretreated sample had higher cellulose content and lower hemicellulose content compared with the materials with 2% NaOH pretreated sample. The enzymatic hydrolysis yield decreased with the increase of substrate concentration, either in one-stage or three-stages enzymatic hydrolysis. The NaOH-Fenton pretreated mulberry at 30% substrate concentration were performed the three-stage hydrolysis, using the enzyme dosage 40 U/g cellulose, and the three-stage hydrolysis could reach much higher hydrolysis yields of 74.16% in 30 h. Compared with the 72 h yield (45.61%) of the one-stage hydrolysis, a 62.60% increase in hydrolysis yield was achieved and 42 h hydrolysis time was reduced. The results have practical significance for improving the yield of cellulase hydrolysis and reducing the cost of making fuel ethanol from biomass resources.
lignocellulosic materials; pretreatment; cellulase; three-stage hydrolysis
2016-06-04
2016-09-25
云南省应用基础研究计划项目(2011FZ137);国家自然科学基金(31260162)。
王燕云,女,研究方向为生物质资源生物降解与转化。通信作者:杨静,女,副教授。E-mail:kmjingyang@163.com
TQ35
A
2096-1359(2017)02-0058-06
