辉河湿地河岸带土壤养分与酶活性特征及相关性研究①
2017-04-24苏德荣吕世海谢晶杰
罗 琰,苏德荣*,吕世海,布 和,贺 晶,谢晶杰
(1 北京林业大学草地资源与生态研究中心,北京 100083;2 中国环境科学研究院,北京 100012;3 内蒙古辉河国家级自然保护区管理局,内蒙古海拉尔 021100)
辉河湿地河岸带土壤养分与酶活性特征及相关性研究①
罗 琰1,苏德荣1*,吕世海2,布 和3,贺 晶1,谢晶杰1
(1 北京林业大学草地资源与生态研究中心,北京 100083;2 中国环境科学研究院,北京 100012;3 内蒙古辉河国家级自然保护区管理局,内蒙古海拉尔 021100)
以辉河湿地国家自然保护区内核心区为研究区,通过野外采样和室内分析相结合的方法,研究土壤养分和酶活性特征以及二者间的相关性。结果表明,随着距河岸距离的增大以及高程的增加,辉河湿地河岸带土壤理化性质发生明显的梯度变化,土壤全氮、全磷和有机质含量从岸边芦苇带到岸坡草本植物带呈先增大后下降的变化趋势,而土壤含水量呈下降趋势。同时,土壤酶活性(碱性磷酸酶、脲酶)也随着植被群落的陆向演替,呈现出一定的差异和变化规律,整体呈增大趋势,其活性与全氮、全磷、有机质呈极显著正相关(P<0.01),与土壤含水量呈极显著负相关(P<0.01)。综合分析表明,辉河湿地河岸带土壤酶活性不仅与土壤性质有关,与水文状况、微地形、植被演替也密切相关。
辉河湿地;河岸带;土壤水解酶;土壤性质
土壤作为生态系统中物质转换的主要媒介,不仅是植物的能源储存库,也是河岸湿地生态系统最主要的环境因子[1–2]。土壤酶作为土壤中活跃的成分[3],参与土壤中有机物质的分解、合成以及碳、氮等养分释放的全过程,直接或间接影响着土壤一系列的生物化学反应[4–5],常常作为湿地物质分解循环过程强度的指标[6]。河岸带具有独特的水文、生物和土壤特征,因此其土壤理化性质和植被均会对土壤酶活性产生影响,有关河岸湿地酶活性的影响因素研究也取得了一定的成果。研究表明,土壤酶活性与土壤理化性质密切相关[7–9]。此外,随着距河岸距离的远近变化、高程的梯度增加以及植物群落向陆地的演替,土壤酶活性都会受到影响而表现出一定的变化规律[10–11]。由此可知,土壤酶活性与环境因子密切相关。探讨土壤酶活性与多种环境因子的相关关系,有助于深入解析土壤生态过程,进而开展土壤系统的科学调控。
目前,针对草原河岸湿地土壤酶方面仍缺乏一定的基础研究。因此,本文以呼伦贝尔辉河草原湿地保护区为研究区域,选取参与土壤有机磷转化的碱性磷酸酶和与土壤氮素状况有关的脲酶两种水解酶,并结合土壤理化性质,以期为草原湿地土壤生物化学过程研究提供理论依据。
1 材料与方法
1.1 研究区域概况
研究区位于辉河湿地国家自然保护区内核心区,隶属于内蒙古自治区呼伦贝尔市鄂温克族自治旗,地理位置为118°48′ ~ 119°45′E,48°10′ ~ 48°57′N。气候属中温带大陆性季风气候,降水少,多大风,年平均气温 –2.4 ~ 2.2℃,无霜期为100 ~ 120天,年降水量300 ~ 350 mm,70% 集中在6—9月的夏秋季节。该区处于大兴安岭西北坡山地向呼伦贝尔高原的过渡地段,地势由东南向西北倾斜,平均海拔800 ~ 1 000 m。
本次试验选择人类干扰较弱的中游河段河岸带典型草原核心区,土壤类型为轻壤质暗栗钙土,群落建群种为羊草(Aneurolepidium chinese)、大针茅(Stipa grandis),优势种为糙隐子草(Cleistogens squarrosa)、冷蒿(Artemisia frigida)。经野外踏查,河岸带存在比较明显的植被梯度变化。距离水边近、地势较低洼的地方植被多为芦苇、水芹等植物,为分散生长型,分布不均匀;距离水边稍远、地势平坦的地方植被主要是草本,为密集生长型,分布较为均匀;而远离水边地势较高的地方植被类型为草本植物和少量灌丛混合生长,植物盖度小,分布稀疏。
1.2 样品采集
沿河岸边至岸坡陆向水平取一样带,约100 m设一个样点,共15个样点,并记录坐标、海拔、坡向、坡度。S1 ~ S3位于河岸边,主要植物群落为芦苇;S4 ~ S15依次位于岸坡,植物群落呈典型草原植被分布。每个样点随机取土壤样品3份等量充分混合,放入土壤样袋带回实验室风干、研磨、过筛以供测定土壤理化性质及酶活性。样品采集时间为2015年8月。
1.3 测定方法
土壤水分采用烘干法测定;有机质采用重铬酸钾滴定法测定;全氮采用半微量凯氏定氮法测定;全磷采用硫酸–高氯酸消煮–钼锑抗比色法测定[12]。脲酶采用苯酚钠比色法测定;碱性磷酸酶采用磷酸苯二钠比色法测定[13]。
1.4 数据分析
所有数据使用Excel软件进行整理,应用SPSS统计软件进行多重比较及相关性分析,用 Origin软件作图。
2 结果与分析
2.1 辉河湿地河岸带土壤养分特征
辉河湿地河岸带土壤养分特征的变化状况见表1。从岸边芦苇带到岸坡草本植物带,全氮、全磷、有机质含量呈先增加后下降的趋势。其中,全氮、全磷含量在S13样点显著高于岸坡其他样点,而后又呈下降趋势;土壤有机质含量则是在 S12样点达到最大,在S13 ~ S15有所下降。由此可见,辉河湿地河岸带土壤营养元素含量呈明显的陆向变化特征,即从岸边至岸坡先逐渐增大且各营养元素含量都显著高于岸边样点,此后又呈下降的变化趋势。

表1 辉河湿地河岸带土壤营养元素性质特征(g/kg)
2.2 辉河湿地河岸带土壤水分的陆向变化
土壤水分的梯度变化是河岸带的主要特征之一。从图2可以看出,从岸边到岸坡土壤水分存在显著的陆向变化。其中位于岸边的S1、S2和S3样点土壤水分含量分别为392.1、371.5 和230.9 g/kg,明显高于岸坡其他样点,而S4 ~ S15区域间的土壤含水量变化幅度较小。

图1 土壤水分的陆向变化(岸边距离为0 m)
2.3 辉河湿地河岸带土壤酶活性的陆向变化
图 2是辉河湿地河岸带土壤酶活性的陆向变化状况。碱性磷酸酶和脲酶活性随着植被从岸边芦苇带到岸坡草本植物带的演替,整体呈增大趋势。在样点 S1,碱性磷酸酶和脲酶活性最低,而后碱性磷酸酶活性逐渐增大,但在S8 ~ S10区域间酶活性有所下降,此后又逐渐升高,在 S15达到最大,为0.28 mg/(g·h),酶活性是S1的1.6倍;脲酶活性在S6和S7间出现大幅度下降,酶活性下降了10.8%,而后在S8 ~ S15区域间酶活性的变化较小,并且趋于活性的最高值。
2.4 辉河湿地河岸带土壤酶活性与土壤理化因子的相关性
由表2可知,碱性磷酸酶和脲酶活性与全氮、全磷和有机质呈显著的正相关(P<0.01),与土壤含水量呈显著的负相关(P<0.01),其中与全氮和有机质的相关性最大。

图2 土壤酶活性的陆向变化(岸边距离为0 m)
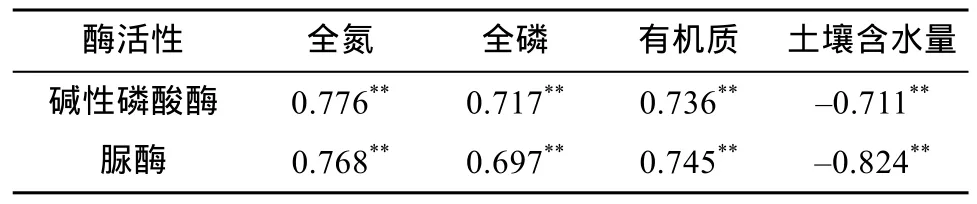
表2 土壤酶活性与土壤理化因子的相关性
3 讨论
3.1 辉河湿地河岸带土壤理化因子的陆向变化
随着距河岸距离的增大以及高程的增加,土壤全氮、全磷和有机质含量从岸边芦苇带到岸坡草本植物带呈先增大后下降的变化趋势。其原因可能是靠河岸较近,地势相对较低,水流冲刷会带走土壤表层的植被枯落物,不利于土壤有机质及养分的积累[14]。而从芦苇带到草本植物带,由于植被对水流的减速作用,植被的凋落物大量进入土壤成为有机质,因此越到群落演替的较高阶段,植株密度越高导致凋落物含量增加,从而使土壤的有机质含量增加[15]。本研究结果表明,随着植物群落的陆向演替,从湿地到水陆交错的干湿交替区域,植被密度较高且根系交错分布,土壤养分水平较高,与孔涛等[16]对于浑河上游典型植被河岸带土壤有机碳、全氮和全磷分布特征的研究结果一致,也进一步证实了在湿地中随着演替的发展土壤营养条件逐渐得到改善的结果[15]。此外,本研究结果也表明随着距河岸距离的增大以及高程的增加,土壤养分含量并不是持续上升,而是趋于最高值后呈下降趋势,可能是因为随着高程的进一步增加,植被生长所需的水热、肥力等条件不足而使植物生长受限,地表植被稀疏,植物残体等有机物稀少不利于土壤有机质及养分的积累,以致土壤养分水平降低,土壤有退化趋势。
3.2 土壤性质对酶活性的影响
土壤碳、氮、磷元素是土壤肥力的物质基础,当其含量增加时,土壤酶积极参与其转化分解过程,在土壤的生物化学过程中,酶的活性能够表征这些养分的循环状况[17–18]。
全氮能增加植被地上及地下活细根生物量,促进根际微生物生长,致使土壤中相关酶活性增强[19];有机质可改变土壤孔隙度、通气度与土壤团粒结构[20],具有显著的缓冲作用和持水力,是各种酶类的重要载体,为土壤酶发挥作用提供场所与适宜的条件;有效磷可促进植被根系生长,增强土壤微生物对土壤酶的合成,提高土壤酶活性。大量研究表明,土壤有机质、全氮、有效磷是影响酶活性的主要因子,与土壤酶活性呈显著和极显著正相关[14,22–23]。本研究结果与以上结论相一致,明了土壤碳氮磷对土壤酶活性的强弱起重要作用。
土壤水分被认为是影响酶活性的主要因子[24]。大部分研究表明,土壤水分的增加为各种酶促反应提供了反应条件与场所使土壤酶活性升高,其活性随土壤含水量的升高而增强[25–26];而在土壤积水条件下,会形成缺氧还原环境增加 Fe2+等抑制因子的浓度而影响土壤酶活性[27]。由表 2可知,两种酶活性均和土壤含水量呈显著负相关,因此可见土壤水分对酶活性的影响是复杂的。此外,湿地由于地下水位高,缺氧条件下需氧微生物对有机质的分解缓慢,导致土壤酶活性不高[28]。
除了土壤养分要素外,不同类型的植被通过凋落物和根系分泌物来影响土壤微生物,从而影响土壤酶活性的高低。本研究发现,随着植被群落由芦苇等水生植物向草本植物的陆向演替,土壤酶活性整体呈上升趋势,与前人研究结果相一致,即随着植被群落的演替,土壤酶活性发生着显著的变化[10–11,29]。
综上所述,在辉河湿地河岸带,由于复杂的水文状况、高程等微地形的变化和植被演替,引起了土壤性质的空间变异,从而对酶活性产生一定影响。而湿地土壤中酶的存在状态与活性是湿地生态系统中有机物质分解转化过程的关键,控制着湿地生态系统的物质循环,常常作为指示湿地物质分解循环过程强度很重要的指标[6],同时也表征着土壤肥力状况,是湿地土壤退化的重要表征指标,由此可见,研究湿地土壤酶有重要意义。因此,还需运用土壤控制实验手段,结合氧化还原酶和土壤速效养分进行深入长期研究。
4 结论
在辉河湿地河岸带,随着距河岸距离的增大以及高程的增加,辉河湿地河岸带土壤理化性质发生明显的梯度变化,土壤全氮、全磷和有机质含量从岸边芦苇带到岸坡草本植物带呈先增大后下降的变化趋势,土壤含水量则呈下降趋势。同时,碱性磷酸酶、脲酶活性也随着植被群落的陆向演替,呈现出一定的差异和变化规律,整体呈增大趋势。土壤性质对酶活性的影响为碱性磷酸酶和脲酶活性与全氮、全磷、有机质呈显著正相关而与土壤含水量呈显著负相关,表明土壤酶在一定程度上可表征土壤肥力状况。
影响土壤酶活力的因素是复杂的,湿地水文、微地形和植被演替引起土壤性质的空间变异从而影响酶活性,本研究只初步探讨了辉河湿地河岸带土壤养分、土壤酶的变化特征以及二者间的关系,要进一步了解土壤酶的变化规律、土壤酶与土壤养分间的相互作用机制还需开展长期研究,为辉河湿地生态系统的保护提供一定的基础理论数据。
[1] 崔保山. 湿地学[M]. 北京: 北京师范大学出版社, 2006
[2] 陆健健. 湿地生态学[M]. 北京: 高等教育出版社, 2006
[3] Marx M C, Wood M, Jarvis S C. A microplate fluorimetric assay for the study of enzyme diversity in soils[J]. Soil Biology & Biochemistry, 2001, 33(s 12/13): 1633–1640
[4] Hill B H, Elonen C M, Seifert L R, et al. Microbial enzyme stoichiometry and nutrient limitation in US streams and rivers[J]. Ecological Indicators, 2012, 18(4): 540–551
[5] Shackle V, Freeman C, Reynolds B. Exogenous enzyme supplements to promote treatment efficiency in constructed wetlands[J]. Science of the Total Environment, 2006, 361(1–3): 18–24
[6] Mclatchey G P, Reddy K R. Regulation of organic matter decomposition and nutrient release in a wetland soil [J]. Journal of Environmental Quality, 1998, 27(5): 1268–1274
[7] 陶宝先, 张金池, 愈元春, 等. 苏南丘陵地区森林土壤酶活性季节变化[J]. 生态环境学报, 2010, 19(10): 2349–2354
[8] 刘广深, 徐冬梅, 许中坚, 等. 用通径分析法研究土壤水解酶活性与土壤性质的关系[J]. 土壤学报, 2003, 40(5): 756–762
[9] 牛世全, 李君锋, 杨婷婷, 等. 甘南玛曲沼泽湿地土壤微生物量、理化因子与土壤酶活的关系[J]. 冰川冻土, 2010(5): 1022–1029
[10] 刘存歧, 陆健健, 李贺鹏. 长江口潮滩湿地土壤酶活性的陆向变化以及与环境因子的相关性[J]. 生态学报, 2007, 27(9): 3663–3669
[11] 刘艳, 侯龙鱼, 崔晓东, 等. 黄河三角洲冲积平原湿地土壤尿酶活性与养分通径分析[J]. 华中农业大学学报, 2007(3): 327–329
[12] 南京农学院. 土壤农化分析[M]. 北京: 农业出版社, 1980
[13] 麦克拉伦. 土壤生物化学[M]. 北京: 农业出版社, 1984
[14] 刘艳,马风云,宋玉民,等. 黄河三角洲冲积平原湿地土壤酶活性与养分相关性研究[J]. 水土保持研究, 2008, 15(1): 59–61
[15] He B, Wen G Y, Yuan X, et al. Studies on soil physical and chemical and enzyme activities of different mangroce communities in Luogang Bay of Guangxi[J]. Scientia Silvae Sinicae, 2002, 38(2): 21–26
[16] 孔涛, 张德胜, 寇涌苹, 等. 浑河上游典型植被河岸带土壤有机碳、全氮和全磷分布特征[J]. 土壤, 2014, 46(5): 793–798
[17] 贡璐, 张海峰, 吕光辉, 等. 塔里木河上游典型绿洲不同连作年限棉田土壤质量评价[J]. 生态学报, 2011(14): 4136–4143
[18] Sardans J, Peñuelas J, Estiarte M. Changes in soil enzymes related to C and N cycle and in soil C and N content under prolonged warming and drought in a Mediterranean shrubland[J]. Applied Soil Ecology, 2008, 39(2): 223–235
[19] 涂利华, 胡红玲, 胡庭兴, 等. 模拟氮沉降对华西雨屏区光皮桦林土壤酶活性的影响[J]. 应用生态学报, 2012, 23(8): 1277–1284
[20] 贾曼莉, 郭宏, 李会科. 渭北生草果园土壤有机碳矿化及其与土壤酶活性的关系[J]. 环境科学, 2014, 35(7): 2777–2784
[21] 周礼恺. 土壤酶学[M]. 北京: 科学出版社, 1987
[22] Taylor J P, Wilson B, Mills M S, et al. Comparison of microbial numbers and enzymatic activities in surface soils and subsoils using various techniques[J]. Soil Biology and Biochemistry, 2002, 34(3): 387–401
[23] 王群, 夏江宝, 张金池, 等. 黄河三角洲退化刺槐林地不同改造模式下土壤酶活性及养分特征[J]. 水土保持学报, 2012, 26(4): 133–137
[24] Brockett B F T, Prescott C E, Grayston S J. Soil moisture is the major factor influencing microbial community structure and enzyme activities across seven biogeoclimatic zones in western Canada[J]. Soil Biology and Biochemistry, 2012, 44(1): 9–20
[25] 王学娟, 周玉梅, 王秀秀, 等. 长白山苔原生态系统土壤酶活性及微生物生物量对增温的响应[J]. 土壤学报, 2014, 51(1): 166–175
[26] Jin K, Sleutel S, Buchan D, et al. Changes of soil enzyme activities under different tillage practices in the Chinese Loess Plateau[J]. Soil & Tillage Research, 2009, 104(1): 115–120
[27] Kang H, Freeman C. Phosphatase and arylsulphatase activities in wetland soils: Annual variation and controlling factors[J]. Soil Biology & Biochemistry, 1999, 31(3): 449–454
[28] 刘云鹏, 申卫博, 张社奇, 等. 黄河中游湿地土壤养分与酶活性特征及相关性研究[J]. 草地学报, 2013, 21(3): 474–478
[29] Sedia E G, Ehrenfeld J G. Differential effects of lichens and mosses on soil enzyme activity and litter decomposition[J]. Biology and Fertility of Soils, 2006, 43(2): 177–189
Characteristics and Correlation Analyses of Soil Nutrients and Enzyme Activities in The Riparian Zone of Hui River Wetland
LUO Yan1, SU Derong1*, LV Shihai2, BU He3, HE Jing1, XIE Jingjie1
(1 Grassland Resources and Ecology Research Center, Beijing Forestry University, Beijing 100083, China; 2 China Research Academy of Environmental Sciences, Beijing 100012, China; 3 Hui River National Nature Reserve Administration of Inner Mongolia, Hailar, Inner Mongolia 021100, China)
Characteristics and correlation analyses of soil nutrients and enzyme activities in the middle reaches of Hui River Wetland National Nature Reserve were studied by using field sampling and laboratory analysis. The increase of distance from the Hui River and elevation gradient result in significant gradient changes of physical and chemical properties of soil in the riparian zone of the Hui River Wetland. The contents of total nitrogen (TN), total phosphorus (TP) and organic matter (SOM) increased first and then decreased from reed to herb zones, but soil moisture content (MC) continues to declined. The activities of alkaline phosphatase and urease showed increasing trends along the land succession of vegetation communities, and were significantly positive correlated with the values of TN, TP and SOM (P<0.01), but negatively to MC (P<0.01). The comprehensive analysis showed that soil enzyme activities in the riparian zone of Hui River Wetland are not only related to soil properties, but also closely related to hydrological conditions, micro topography and vegetation succession.
Hui River Wetland; Riparian zone; Soil hydrolase; Soil properties
S154.2
A
10.13758/j.cnki.tr.2017.01.030
国家科技支撑计划项目(2015BAC06B01)和环保公益性行业科研专项项目(201509040)资助。
* 通讯作者(suderong@bjfu.edu.cn)
罗琰(1990—),女,甘肃酒泉人,硕士研究生,主要研究方向为草地资源与生态。E-mail:LuoyABC@163.com
