生长分化因子-15对慢性心力衰竭患者左室重构的预测价值
2017-04-23殷华马少雯杜一平
殷华,马少雯,杜一平
(新容奇医院心血管内科,佛山 528303)
慢性心力衰竭(chronic heart failure,CHF)是各种心脏病发展的最后阶段,随着我国老龄化社会的到来,其发病率明显增高。CHF终末期可导致重要脏器灌注不足,从而造成休克、心脏骤停、甚至死亡等严重并发症,致残率高[1]。近 30 年来,冠心病已成为CHF发病的主要原因,且随年龄增长,其发病率增高。CHF发病机制包括神经内分泌、循环内分泌、炎症因子、激素代谢等的持续激活和失衡[2]。CHF包括无症状的心功能不全、心脏重构和有症状的心力衰竭3个层面,而心肌重构一般早于心力衰竭症状的出现,且贯穿心力衰竭发展的全过程。及时了解心肌重构情况,对预防CHF有重要意义[3]。N-末端脑钠肽前体(N-terminal probrain natriuretic peptide,NT-proBNP)是传统检测心力衰竭的指标,但受到年龄、性别、肥胖、肺栓塞、肾功能不全等多种因素影响,因此单独应用NT-proBNP作为诊断CHF的指标其变异性较大。部分CHF患者发病早期NT-proBNP水平在正常范围或轻度升高,晚期依然出现严重的左室重构,可见NT-proBNP对左室重构的预测价值存在一定的局限性[4]。研究发现[5],生长分化因子-15(growth-differentiation factor-15,GDF-15)在正常的心肌细胞几乎不表达,但当心脏处于缺血再灌注损伤、压力或容量负荷升高、冠状动脉粥样硬化等多种病理状态时,迅速诱导GDF-15在心肌细胞强烈表达,反馈抑制心肌的损伤。故GDF-15能更好地预测CHF患者的左室重构,可作为CHF患者的预后评价指标。 本研究通过检测CHF患者GDF-15水平及心脏超声指标评估左室重构情况,探讨GDF-15水平变化对左室重构程度的影响,为预测CHF患者左心室重构提供新的方法。
1 对象与方法
1.1 研究对象
入选2015年6月至2016年6月期间在新容奇医院心血管内科住院的CHF患者共75例,其中男性40例,女性35例,年龄(68.5±4.2)岁。选取纽约心脏协会心功能分级(New York Heart Association,NYHA)Ⅱ~Ⅳ级的患者,其中Ⅱ级34例,Ⅲ级28例,Ⅳ级13例。依据引起心力衰竭的病因分为4个亚组:高血压心脏病组(n=22)、冠心病组(n=28)、瓣膜病组(n=17)和扩张性心肌病组(n=8)。入组人员均排除了严重肝肾功能不全、恶性肿瘤、肺功能不全、急慢性感染、甲状腺功能异常、急性心肌梗死及急性脑血管意外等。另选取同时期80名健康者作为对照组进行比较。
1.2 方法
采集个人资料(包括年龄、性别、身高、体质量、吸烟史、高血压病史、糖尿病病史等)。同时测定血清GDF-15水平及其他相关实验室指标。
1.2.1 血清GDF-15水平检测 患者空腹12 h,第2天清晨抽肘中静脉血4 ml注入抗凝试管中,室温下静置30 min,3000转/min离心10 min,收集上层血清编号,置于-70℃冰箱保存待测。血清GDF-15水平测定采用酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)法测定,试剂盒购自北京绿源博德生物科技有限公司,严格按照产品说明书精细操作。
1.2.2 心脏彩色多普勒超声检查 采用飞利浦IE33多普勒彩色超声诊断仪,由同一名经验丰富超声科医师用M型超声测量左心室舒张末期内径(left ventricular end-diastolic diameter,LVEDD)、左心房内径(left atrial diameter,LAD)、左室射血分数(left ventricular ejection fraction,LVEF)。
1.3 统计学处理

2 结 果
2.1 基线资料比较
CHF组患者合并糖尿病者31例,合并高血压者25例,两组在年龄分布、性别比例及吸烟史方面的差异均无统计学意义(P>0.05;表1)。

表1 两组患者基线资料的比较Table 1 Comparison of baseline data between two groups [n(%)]
CHF: chronic heart failure
2.2 两组实验室指标比较
CHF组的总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和血肌酐(serum creatinine,SCr)均显著高于对照组,差异具有统计学意义(P<0.05;表2)。
表2两组实验室指标比较
Table 2 Comparison of laboratory indices between two groups


ItemCHFgroup(n=75)Controlgroup(n=80)TC(mmol/L)5.65±0.72∗4.22±0.66TG(mmol/L)1.80±0.56∗1.20±0.14LDL⁃C(mmol/L)2.80±0.55∗2.14±0.11SCr(μmol/L)87.52±0.44∗71.43±0.26
CHF: chronic heart failure; TC: total cholesterol; TG: triglycerides; LDL-C: low-density lipoprotein cholesterol; SCr: serum creatinine. Compared with control group,*P<0.05
2.3 各组GDF-15水平比较
CHF组和对照组的GDF-15水平分别为(1195.48±43.26)和(345.28±42.25)ng/L,两组比较,差异具有统计学意义(P<0.05)。高血压心脏病组、冠心病组、瓣膜病组和扩张性心肌病组中GDF-15水平分别为(922.64±33.26)、(1278.54±45.24)、(1105.81±48.63)和(1521.56±45.28)ng/L,各亚组比较,差异无统计学意义(P>0.05)。
2.4 两组心功能指标的比较
与对照组相比,CHF组的LVEDD和LAD显著增高,而LVEF显著降低,差异均具有统计学意义(P<0.05;表3)。
表3两组患者LVEDD、LAD和LVEF的比较
Table 3 Comparison of LVEDD, LAD and LVEF between

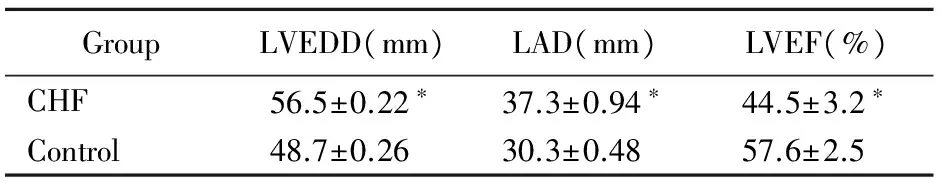
GroupLVEDD(mm)LAD(mm)LVEF(%)CHF56.5±0.22∗37.3±0.94∗44.5±3.2∗Control48.7±0.2630.3±0.4857.6±2.5
CHF: chronic heart failure; LVEDD: left ventricular end-diastolic diameter; LAD: left atrial diameter; LVEF: left ventricular ejection fraction. Compared with control group,*P<0.05
2.5 GDF-15水平与各指标相关性分析
Pearson相关分析发现,GDF-15水平与LVEDD(r=0.63)和LAD(r=0.68)呈显著正相关(P<0.05),与LVEF(r=-0.47)和TC(r=-0.36)呈显著负相关(P<0.05)。
3 讨 论
CHF发展的基本机制是心室重构,包括心肌肥厚和心肌肥大[6],是指心室肌在缺血、缺氧和(或)心肌负荷过重等因素的作用下,整个左心室逐渐发生大小、形态和功能改变的过程,并发症和死亡率高,因此早期预测左室重构并终止或延缓其发生、发展十分重要。
GDF-15是转化生长因子-β(transforming growth factor-β,TGF-β)超家族中一员,TGF-β家族具有调控细胞增殖、分化、凋亡、迁移和黏附的作用,在胚胎发育、免疫监视及干细胞诱导转化中也起着重要作用[7]。在生理条件下,胎盘和前列腺中的GDF-15呈高水平表达,而在正常的心肌细胞中仅少量存在[8];但在心肌细胞缺血或缺血再灌注损伤、压力超载、心力衰竭等情况下,GDF-15可被诱导表达,水平显著增高。因此,GDF-15水平与急性冠脉综合征、心力衰竭等心血管疾病都有密切关系,是一个重要的心血管保护因子[9]。Kempf等[10]发现,GDF-15在缺血-再灌注的心肌细胞中表达迅速增高,发挥抗凋亡、抗心肌肥厚作用。GDF-15通过抗心肌细胞凋亡与心肌缺血损伤相关,通过抗心肌肥大与心室压力负荷相关,通过阻止巨噬细胞聚集和稳定纤维帽的作用与动脉粥样硬化斑块稳定相关。本研究发现,CHF患者血清GDF-15的浓度较正常人显著升高,提示GDF-15是反映心力衰竭的标志物,可用于心力衰竭的预防诊断[10]。
Kempf等[11]发现,CHF患者的GDF-15水平和LVEF是全因死亡率的独立预测因子。Stahrenberg等[12]发现,在检测心力衰竭方面,GDF-15与NT-proBNP效果相近,两种指标的检测比单独检测NT-proBNP的效果更好,提示在一定程度上,CHF后左室重构的预后危险分层可用GDF-15水平进行评估[13]。本研究结果显示,GDF-15的表达水平与心力衰竭常见病因(包括高血压、冠心病组、瓣膜病和扩张性心肌病)无关,这可能与GDF-15在多种心血管病中均有表达有关。大量的动物实验发现,GDF-15在左室压力负荷增大的情况下,心肌细胞的分泌及表达均上调,本研究发现,GDF-15水平与LVEDD和LAD呈显著正相关,与LVEF呈显著负相关,说明血清GDF-15可作为间接评价CHF患者心室重构的一项指标,在心力衰竭的治疗及预后判断中具有重要参考价值。但GDF-15如何参与左室重构尚不很明确,推测在左室压力负荷增大的情况下,GDF-15在心肌细胞的分泌及表达均上调,一方面通过神经、体液机制促进左室重构,另一方面通过旁分泌形式发挥抑制心肌细胞凋亡和抗心肌肥大的效应,负反馈调节心室重构的进程。本文的不足之处是未能在心力衰竭的代偿期及失代偿期对GDF-15的升高水平进行探讨。期望后续研究可以在CHF患者疾病发展的不同阶段进行GDF-15检测,从而达到早期预防的目的。
【参考文献】
[1] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2014》概要[J]. 中国循环杂志, 2015, 30(7): 617-622. DOI: 10.3969/j.issn.1000-3614.2015.07.001.
Chen WW, Gao RL, Liu LS,etal. Outline of Chinese cardiovascular disease report 2014[J]. Chin Circul J, 2015, 30(7): 617-622. DOI: 10.3969/j.issn.1000-3614.2015.07.001.
[2] Betti I, Castelli G, Barchielli A,etal. The role of N-terminal PRO-brain natriuretic peptide and echocardiography for screening asymptomatic left ventricular dysfunction in a population at high risk for heart failure. The PROBE-HF study[J]. J Card Failure, 2009, 15(5): 377-384. DOI: 10.1016/j.cardfail.2008.12.002.
[3] 王萍, 苏增锋, 张颖. 血清胱抑素C与N端脑钠肽前体在老年心力衰竭患者中的表达及意义[J]. 中华老年多器官疾病杂志, 2016, 15(12): 886-890. DOI: 10.11915/j.issn.1671-5403.2016.12.213.
Wang P, Su ZF, Zhang Y. Levels of serum cystatin C and plasma N-terminal pro-brain natriuretic peptide and their significance in elderly heart failure patients[J]. Chin J Mult Organ Dis Elderly, 2016, 15(12): 886-890. DOI: 10.11915/j.issn.1671-5403.2016.12.213.
[4] Wu L, Zhang L, Ai Z,etal. Association between risk factors and left ventricular remodeling in middle-aged and aged population: a community-based study[J]. J Hypertens, 2012, 30(9): 1862-1873. DOI: 10.1097/HJH.0b013e3283563418.
[5] 张芃, 郑哲, 魏英杰, 等. 人血清生长分化因子15与器质性心脏病左心室重构程度的相关性研究[J]. 中国分子心脏病学杂志, 2010, 10(2): 81-85. DOI: 10.16563/j.cnki.1671-6272.2010.02.006.
Zhang P, Zheng Z, Wei YJ,etal. Association between serum growth differentiation factor 15 level and left ventricular geometry in patients with organic heart disease[J]. Mol Cardiol China, 2010, 10(2): 81-85. DOI: 10.16563/j.cnki.1671-6272.2010.02.006.
[6] Colucci WS. Molecular and cellular mechanisms of myocardial failure[J]. Am J Cardiol, 1997, 80(11A): 15L-25L.
[7] Feng XH, Derynck R. Specificity and versatility in TGF-β signaling through Smads[J]. Annu Rev Cell Dev Biol, 2005, 21: 659-662. DOI: 10.1146/annurev.cellbio.21.022404.142018.
[8] Bootcov MR, Bauskin AR, Valenzuela SM,etal. MIC-1, a novel macrophage inhibitory cytokine, is a divergent member of the TGF-beta superfamily[J]. Proc Natl Acad Sci USA, 1997, 94(21): 11514-11519.
[9] Santhanakrishnan R, Chong JP, Ng TP,etal. Growth differentiation factor-15, ST2, high-sensitivity troponin T, and N-terminal pro brain natriuretic peptide in heart failure with preservedvs. reduced ejection fraction[J]. Eur J Heart Fail, 2012, 14(12): 1338-1347. DOI: 10.1093/eurjhf/hfs130.
[10] Kempf T, Eden M, Strelau J,etal. The transforming growth factor-β superfamily member growth-differentiation factor-15 protects the heart from ischemia/reperfusion injury[J]. 2006, 98(3): 351-360. DOI: 10.1161/01.RES.0000202805.73038.48.
[11] Kempf T, von Haehling S, Peter T,etal. Prognostic utility of growth differentiation factor-15 in patients with chronic heart failure[J]. J Am Coll Cardiol, 2007, 50(11): 1054-1060. DOI: 10.1016/s1567-4215(07)60126-x.
[12] Stahrenberg R, Edelmann F, Mende M,etal. The novel biomarker growth differentiation factor-15 in heart failure with normal ejection fraction[J]. Eur J Heart Fail, 2010, 12(12): 1309-1316. DOI: 10.1093/eurjhf/hfq151.
[13] Liebetrau C, Gaede L, Dörr O,etal. Release kinetics of galectin-3, GDF-15 and NT-proBNP in patients with acute myocardial infarction[J]. J Am Coll Cardiol, 2014, 63(12): A255-A255. DOI: 10.1016/S0735-1097(14)60255-2.
