CFSE法检测刺激剂对淋巴细胞增殖与活化
2017-04-20薛妮娜来芳芳陈晓光
薛妮娜,董 凯,来芳芳,黄 蕊,陈晓光*
(1. 中国医学科学院药物研究所,天然药物活性物质与功能国家重点实验室/创新药物非临床药物代谢及PK/PD研究北京市重点实验室,北京 100050;2. 天津红日药业股份有限公司,天津 301700)
CFSE法检测刺激剂对淋巴细胞增殖与活化
薛妮娜1#,董 凯2#,来芳芳1,黄 蕊1,陈晓光1*
(1. 中国医学科学院药物研究所,天然药物活性物质与功能国家重点实验室/创新药物非临床药物代谢及PK/PD研究北京市重点实验室,北京 100050;2. 天津红日药业股份有限公司,天津 301700)
研究不同刺激剂对人外周血淋巴细胞增殖与活化的影响.采用密度离心法分离人外周血淋巴细胞,并采用1μmol/L 的CFSE进行标记,通过流式细胞术技术检测刺激剂抗CD3/28抗体、植物血凝素(PHA)和佛波酯(PMA)培养72 h对淋巴细胞分裂与增殖的影响.并采用ELISA法检测不同刺激剂对淋巴细胞上清IFNγ质量浓度的影响.0.125 μg/mL的抗CD3/28抗体和5或10 μg/mL的PHA可以显著诱导CFSE绿色荧光逐渐递,形成类似“五指峰”样图谱,说明这两者具有很强的诱导淋巴细胞分裂与增殖的作用.相比之下,单用PMA促进淋巴细胞分裂与增殖的作用较弱.此外,抗CD3/28抗体、PHA和PMA均可增加淋巴细胞IFNγ的分泌,但其作用强度如下:抗CD3/28抗体>PHA>PMA.采用CFSE标记法检测淋巴细胞增殖的实验,得出抗CD3/28抗体和PHA是高效的淋巴细胞活化刺激剂,而且最佳质量浓度分别为0.125 μg/mL和10 μg/mL.
淋巴细胞增殖;CFSE;干扰素γ;流式细胞术
肿瘤免疫治疗己成为继手术、化疗和放疗之后的第四种常用的肿瘤治疗方法.肿瘤免疫治疗是通过激发或调动机体的免疫系统,增强肿瘤微环境的抗肿瘤免疫能力,从而控制和杀灭肿瘤细胞.而效应T淋巴细胞是诱发有效的抗肿瘤免疫反应的主要执行者,行使对肿瘤细胞的识别和消灭作用[1].在肿瘤进展过程中,肿瘤细胞通过上调一些免疫检查点分子的配体,与T淋巴细胞表面这些共抑制性受体(PD1、CTLA4、LAG3等)相互作用,从而抑制T细胞的增殖与活化,形成肿瘤免疫逃逸微环境[2-3].目前,绝大多数上市或处于临床研究阶段的抗肿瘤免疫药物都是通过抑制T细胞的负性调控信号,通过激活T淋巴细胞的增殖和活性,强化T细胞的免疫应答,最终达到抵御肿瘤细胞增长的目的.因此,T淋巴细胞的增殖与活性水平的检测是细胞免疫功能研究的常用方法,也是目前抗肿瘤免疫药物研发中一个重要的考察指标[4].
氚标记胸腺嘧啶核苷(3H-TdR)掺入法被广泛用于淋巴细胞增殖的检测.但是其需要使用放射性同位素标记,具有潜在的污染,并且不容易大批量操作.其次,还有一些研究者采用MTT或MTS的方法检测淋巴细胞增殖.虽然MTT或MTS的操作方法相对简单,但灵敏性不高,且此方法不适合检测一些具有氧化还原性作用的药物,这类药物可直接与MTT反应,造成假阳性.此外,3H-TdR掺入法和MTT/MTS法均是以细胞的数量来反应增殖的变化,不能反应细胞的分裂情况,且无法测定不同亚群淋巴细胞的增殖情况[5-6].羧基荧光素乙酰乙酸(Carboxyfluorescein Diacetate Succinimidyl Ester, CFSE)染色是一种有效的检测淋巴细胞分裂与增殖的方法.CFSE可穿过细胞膜,不可逆地与细胞内的氨基共价结合偶联到细胞内蛋白.在细胞分裂增殖过程中,CFSE标记的荧光可平均分配到两个子代细胞中,出现连续的荧光强度递减现象,在流式细胞术检测过程中出现类似“五指峰”的特征[7-8].
抗CD3/28抗体、刀豆蛋白A(ConA)、植物血凝素(PHA)佛波酯(PMA)可刺激小鼠脾或人外周血T淋巴细胞增殖.目前,文献中尚未对这些刺激剂促进T淋巴细胞增殖的强度进行比较.而且报道的这些刺激剂的最佳有效剂量也不尽相同.因此,本文采用CFSE标记法检测不同刺激剂诱导人外周血淋巴细胞分裂与增殖的活性,为验证肿瘤免疫药物的活性提供有效的评价方法.
1 实验材料
1.1 全血
健康志愿者的抗凝血购自中国食品药品检定研究院.
1.2 主要试剂
人外周血淋巴细胞提取分离液购自达科为生物技术有限公司.CFSE、PMA、和PHA购自Sigma公司,人源抗CD3、CD28抗体购自美国Miltenyi?Biotec公司.人源IFN γ 的ELISA检测试剂盒购自cloud-clone公司.RPMI1640培养基和胎牛血清购自美国GIBCO公司.
1.3 主要仪器
FACSVerse流式细胞仪为美国BD公司产品,Synergy H1多功能酶标仪为美国Bio-Tek公司产品,CO2培养箱为日本三洋公司产品,冷冻离心机为美国Sigma公司产品.
2 实验方法
2.1 淋巴细胞的制备
将健康志愿者的抗凝血与PBS混合,再缓慢加至淋巴细胞分离液中(这三者的终体积比例为1∶1∶1),室温,800 r/min离心30 min.小心吸取中间的一层薄而致密的白膜(淋巴细胞层)至另一层离心管中,用PBS重悬洗涤2次,计数,调整细胞浓度为1×107/mL.
2.2 CFSE标记淋巴细胞
在上述淋巴细胞悬液中加入CFSE染液(CFSE,终浓度为1 μmol/L),37 ℃避光孵育10 min,每5 min混匀细胞.加入预冷的2 mL灭活牛血清冰上终止2 min,1 500 r/min离心5 min,用预冷的含10%灭活胎牛血清的PBS洗涤2次.离心,用含10%胎牛血清的RPMI1640培养基重悬,计数,将细胞调整为3×106/mL,加入96孔圆底板,每孔100 μL,洗涤及离心过程中注意避光.
2.3 流式细胞术检测淋巴细胞增殖活性
向上述接种至96孔圆底板的淋巴细胞中分别加入100 μL含不同剂量的刺激剂的RPMI1640完全培养基:抗CD3/28抗体(终质量浓度:0.125、0.5、1、1.5 μg/mL)、PHA(终质量浓度:1、5、10 μg/mL)和PMA(终质量浓度:1、5、10 ng/mL).每组实验做三个平行孔,置于37℃,5%CO2细胞培养箱中继续孵育72h.离心,收集细胞上清,冻于-80 ℃冰箱保存.将细胞用预冷PBS洗涤2次,并用200 μL PBS重悬,采用流式细胞检测仪(BD FACS Verse)检测淋巴细胞的分裂和增殖情况,并采用Flowjo 7.6软件计算淋巴细胞增殖情况(CFSE荧光强度减低的细胞百分比)和分裂指数(CFSE荧光强度减低的细胞百分比与CFSE荧光强度不变的细胞百分比的比值).
2.4 ELISA法检测淋巴细胞上清IFNγ质量浓度
取上述条件下淋巴细胞上清液,采用ELISA法检测IFNγ的质量浓度.操作步骤参照试剂盒说明书.简要步骤如下:1)加入100 μL倍比稀释的人源IFNγ标准品及淋巴细胞上清原液,室温静置1 h;2)充分弃上清,分别加入1∶100稀释的IFNγ的一抗,室温静置1 h;3)弃上清,洗涤三次后,加入1∶100稀释后的IFNγ的二抗,室温静置30 min;4)弃上清,洗涤5次后,加90 μL底物(TMB)显色,室温避光放置15 min;5)加50 μL的硫酸终止反应;6)酶标仪450 nmol/L下检测淋巴细胞培养上清液中IFNγ的含量.
2.5 统计分析
数据采用Mean±SD表示,用SPSS17.0软件对实验数据进行显著性分析,P≤0.05具有统计学意义.
3 实验结果
3.1 CFSE法淋巴细胞增殖实验中细胞门的确定
采用Flowjo 7.6软件对淋巴细胞分裂与增殖进行分析.根据前向散射角(FSC)和侧向角散射(SSC)显示图,发现排除了细胞碎片群外,在正常条件下,淋巴细胞主要分布为左下群,均一度较好的一簇细胞群.在接受不同刺激剂活化后,左下的淋巴细胞群开始往右上方移动,且出现比较散在的细胞群.根据流式细胞术的原理,我们认为在刺激剂活化淋巴细胞后,淋巴细胞出现不同程度的分裂和增殖,其细胞大小和均一度都发生改变,从而显示在右上方散在的细胞群.我们把原始淋巴细胞命名为R1门,刺激剂活化后的淋巴细胞命名为R2门(如图1(A)~(B)所示).且在正常条件下,R1门的细胞具有强的CFSE染色荧光(单峰);在刺激剂作用下,R2门内增殖的淋巴细胞出现逐渐递减的CFSE染色荧光(多峰)(如图1(C)~(D)所示).
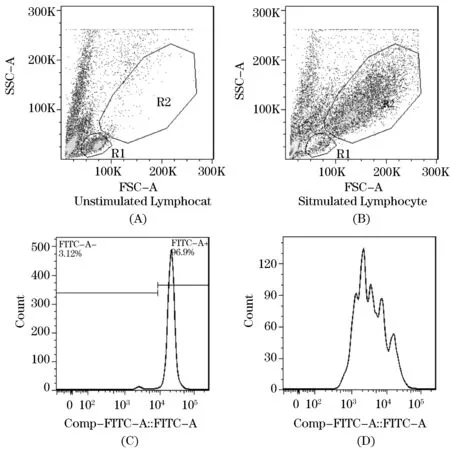
图1 淋巴细胞增殖实验中门的设立示意图
3.2 抗CD3/28抗体对淋巴细胞分裂与增殖活性的影响
抗CD3和CD28抗体分别在体外模拟特异性T淋巴细胞活化的第一信号和第二信号,是T淋巴细胞活化常用的刺激剂.我们采用CFSE染色,通过流式细胞术检测抗CD3和CD28抗体对淋巴细胞增殖的影响.如图2(A)~(B)所示,抗CD3/28抗体可以强效地诱导绿色荧光强度逐渐递减,形成类似“五指峰”样图谱,说明抗CD3/28抗体可以显著促进淋巴细胞分裂和增殖.且在0.125~1.5 μg/mL剂量范围内,抗CD3/28抗体诱导的“五指峰”图几乎重叠.对其增殖指数和分裂指数进行统计,如图2(C)~(D)所示,0.125~1.5 μg/mL 的抗CD3/28抗体诱导淋巴细胞增殖百分比基本可达到75%(P≤0.001),其诱导淋巴细胞分裂指数可达3倍(P≤0.001).但随着抗CD3/28抗体质量浓度的增加,1.5 μg/mL的抗CD3/28抗体诱导淋巴细胞分裂指数反而有所下降.因此,在诱导淋巴细胞增殖实验中,选用终质量浓度为0.125 μg/mL的抗CD3/28抗体即可.
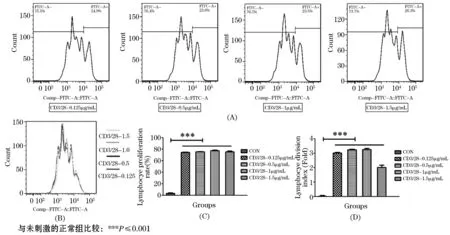
图2 不同质量浓度抗CD3/28抗体对淋巴细胞增殖的影响
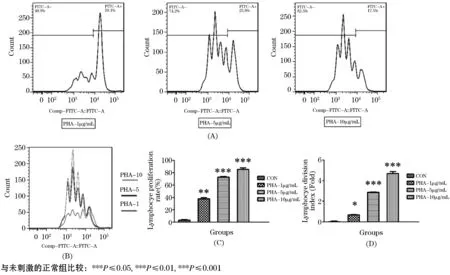
图3 不同质量浓度PHA对淋巴细胞增殖的影响
3.3 PHA对淋巴细胞分裂与增殖活性的影响
PHA是一种有丝分裂原,主要用于激活淋巴细胞.对PHA的不同质量浓度进行分析表明,PHA可以剂量依赖性地促进淋巴细胞分裂与增殖.1 μg/mL的PHA促进淋巴细胞增殖和分裂指数分别为40.9%和0.69倍.当质量浓度为10 μg/mL 时,PHA促进淋巴细胞增殖的效果最为明显,淋巴细胞增殖和分裂指数为85.7%和4.7倍(如图3所示).
3.4 PMA对淋巴细胞分裂与增殖活性的影响
PMA是PKC信号的激活物,PKC信号在T淋巴细胞活化中占据重要地位.所以PMA也是T淋巴细胞活化常用刺激剂之一.对PMA的不同质量浓度进行分析表明,虽然PHA也可剂量依赖性地促进淋巴细胞分裂与增殖,但其诱导淋巴细胞增殖能力较弱,5 ng/mL和10 ng/mL的PMA诱导淋巴细胞增殖指数才到达20%,此剂量下的分裂指数才达到0.2倍(如图4所示).
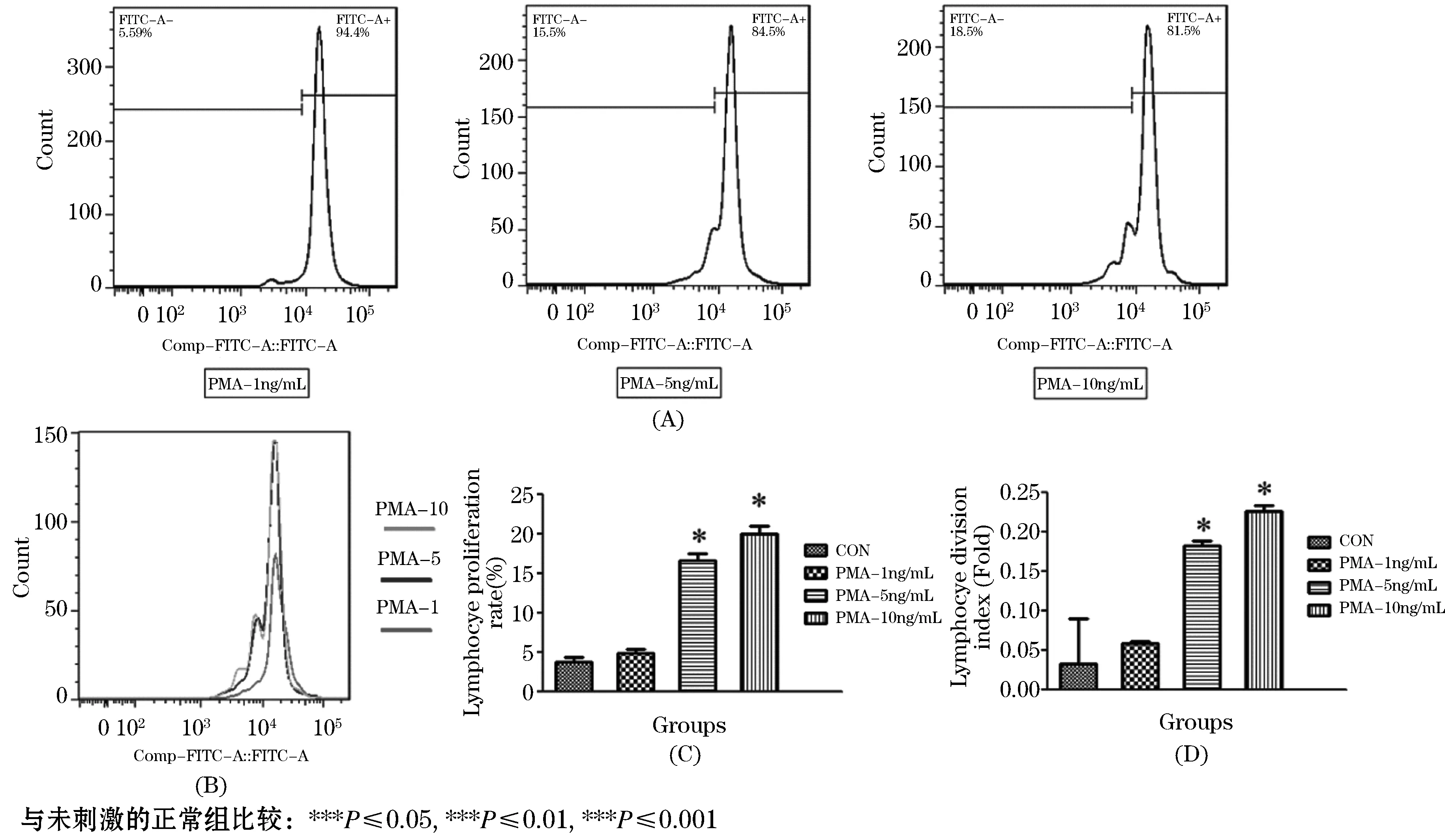
图4 不同质量浓度PMA对淋巴细胞增殖的影响
3.5 不同刺激剂对淋巴细胞IFNγ分泌的影响
收集不同刺激剂培养淋巴细胞72h后的上清液,采用ELISA法检测IFNγ的质量浓度.如图5所示,0.125 μg/mL抗CD3/28抗体、10 μg/mL PHA和10 ng/mL PMA均可显著增加淋巴细胞IFNγ的分泌(P≤0.001).但其增加淋巴细胞IFNγ分泌量的顺序是抗CD3/28抗体>PHA>PMA.
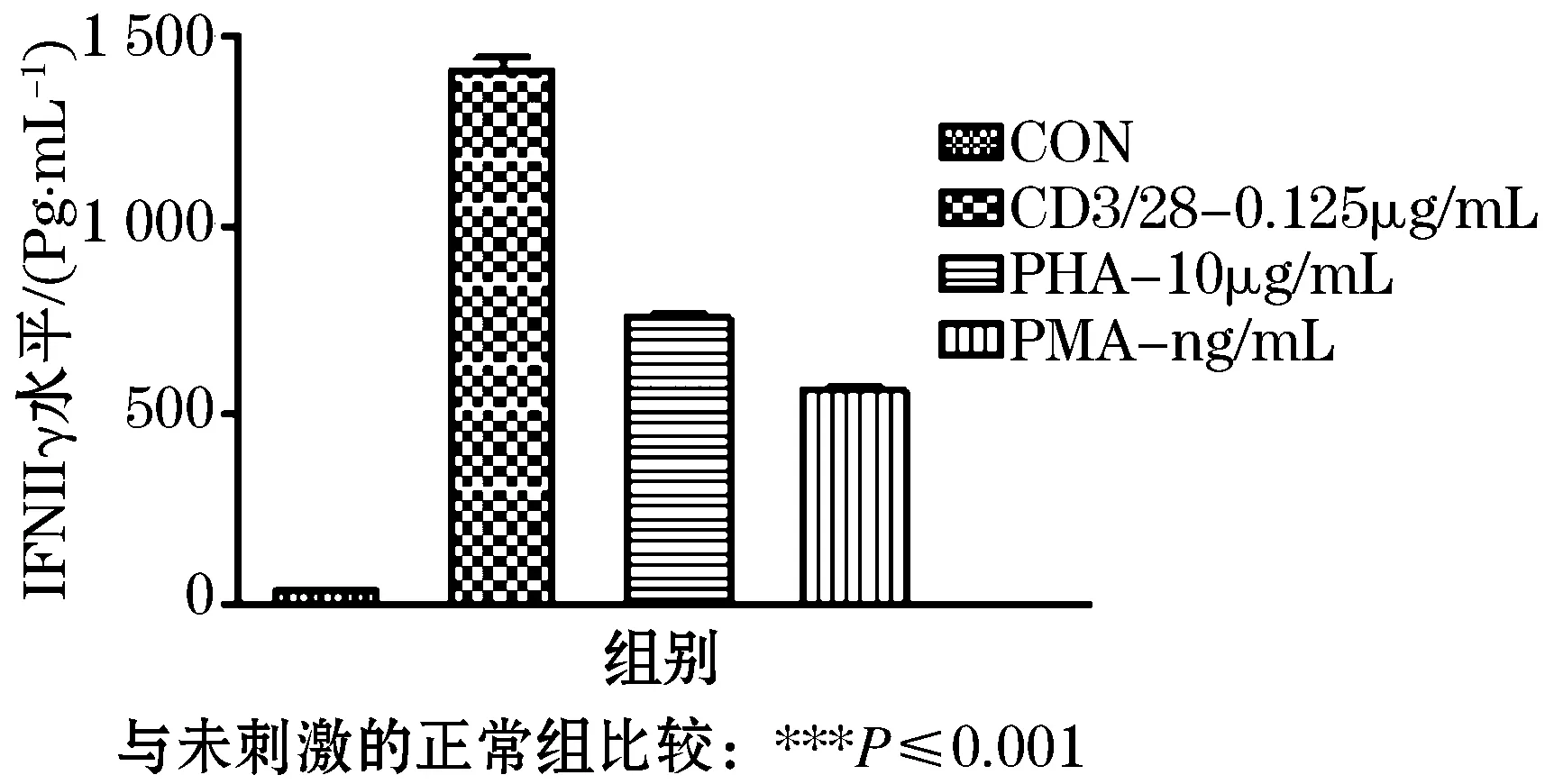
图5 不同刺激剂对淋巴细胞IFNγ分泌的影响
4 讨 论
淋巴细胞增殖实验是评价机体免疫功能的常用方法.CFSE染色法是近年来广泛代替3H-TdR掺入法和MTT显色法的一种快速、无污染的检测淋巴细胞增殖的方法.CFSE染色结合流式细胞术技术能在不同淋巴细胞亚群及单个细胞水平上动态的分析淋巴细胞增殖情况[9-11].
小分子药物单独作用在体外几乎不刺激淋巴细胞增殖,需要在淋巴细胞活化的基础上,进一步评价小分子药物调节淋巴细胞增殖的作用.因此,采用CFSE法,寻找不同刺激剂活化淋巴细胞的最佳剂量,是评价调节淋巴细胞增殖的小分子药物的必要前提.本实验采用人外周血提取获得淋巴细胞,在不同剂量的抗CD3/28抗体、PHA和PMA作用下,观察淋巴细胞的增殖和分裂指数.实验中发现,比以往报道用量更低的抗CD3/28抗体(0.12 5μg/mL)即可高效的刺激T淋巴细胞的分裂与增殖[12].5 μg/mL的PHA促进淋巴细胞增殖和分裂指数分别为75%和3倍,这与Fulcher D等研究者的报道一致[7].由于PHA可以剂量依赖性地增加淋巴细胞增殖与分裂,可根据需要活化的淋巴细胞的强弱选择合适的PHA的剂量,同时,PHA又便宜.因此,PHA可用于调节淋巴细胞增殖的化合物的大量筛选.相比之下,PKC信号的激动剂PMA促进淋巴细胞增殖的能力较弱.可能是因为T淋巴细胞的活化需要PKC信号和Ca2+信号共同参与,因此单一的PMA对淋巴细胞的活化作用较弱,需要与离子霉素联用(Ca2+激动剂)可能对显示出更强的促进淋巴细胞增殖的活性.这与Castagna M等人的研究相一致[13].IFNγ是T淋巴细胞活化的重要指标[14-15].实验发现抗CD3/28抗体、PHA和PMA都能显著增加淋巴细胞IFNγ的分泌,也证明了这三类刺激剂对T淋巴细胞的活化作用.并且这三种刺激剂增加IFNγ的分泌的程度与其诱导淋巴细胞分裂与增殖的程度相对应.后续将进一步研究这些刺激剂对不同亚群T淋巴细胞的促增殖作用.
[1] LANITIS E, POUSSIN M, KLATTENHOFF A W,etal. Chimeric antigen receptor T Cells with dissociated signaling domains exhibit focused antitumor activity with reduced potential for toxicity in vivo [J]. Cancer immunology research, 2013, 1(1): 43-53.
[2] YAO S, ZHU Y, CHEN L. Advances in targeting cell surface signalling molecules for immune modulation [J]. Nature reviews Drug discovery, 2013, 12(2): 130-146.
[3] NIRSCHL C J, DRAKE C G. Molecular pathways: coexpression of immune checkpoint molecules: signaling pathways and implications for cancer immunotherapy [J]. Clinical cancer research: an official journal of the American Association for Cancer Research, 2013, 19(18): 4917-4924.
[4] BOCHAROV G, LUZYANINA T, CUPOVIC J,etal. Asymmetry of Cell Division in CFSE-Based Lymphocyte Proliferation Analysis [J]. Front Immunol, 2013, 4(264): 1-7.
[5] 王 玲, 王 宏, 刘越坚, 等. 利用CFSE标记检测CD8+淋巴细胞增殖[J]. 大连医科大学学报, 2004, 26(4): 262-264.
[6] 季宇彬, 冯小燕, 高世勇, 等. 甜菜碱对小鼠脾淋巴细胞的增殖作用[J].哈尔滨商业大学学报:自然科学版, 2008, 24(4): 385-388.
[7] FULCHER D, WONG S. Carboxyfluorescein succinimidyl ester-based proliferative assays for assessment of T cell function in the diagnostic laboratory[J]. Immunol Cell Biol, 1999, 77(6): 559-564.
[8] POPMA S H, KRASINSKAS A M, MCLEAN A D,etal. Immune monitoring in xenotransplantation: the multiparameter flow cytometric mixed lymphocyte culture assay [J]. Cytometry, 2000, 42(5): 277-283.
[9] VENKEN K, THEWISSEN M, HELLINGS N,etal. A CFSE based assay for measuring CD4+CD25+ regulatory T cell mediated suppression of auto-antigen specific and polyclonal T cell responses [J]. J Immunol Methods, 2007, 322(1-2): 1-11.
[10] GANUSOV V V, MILUTINOVIC D, DE BOER R J. IL-2 regulates expansion of CD4+ T cell populations by affecting cell death: insights from modeling CFSE data[J]. J Immunol, 2007,179(2): 950-957.
[11] 包晶晶, 林海霞, 马 璟, 等. CFSE示踪与流式细胞仪检测法研究环磷酰胺对T淋巴细胞增殖的影响[J]. 中国药理学通报, 2010, 26(6): 828-831.
[12] THOMAS A K, MAUS M V, SHALABY W S,etal. A cell-based artificial antigen-presenting cell coated with anti-CD3 and CD28 antibodies enables rapid expansion and long-term growth of CD4 T lymphocytes [J]. Clin Immunol, 2002, 105(3): 259-272.
[13] CASTAGNA M, TAKAI Y, KAIBUCHI K,etal. Direct activation of calcium-activated, phospholipid-dependent protein kinase by tumor-promoting phorbol esters [J]. J Biol Chem, 1982, 257(13): 7847-7851.
[14] 严 俊, 姚 堃, 周瑶玺. T细胞活化、活化信号和IFN-γ诱生的关系研究[J].免疫学杂志, 1992, 8(2): 95-98.
[15] MCNANARA M J, HILGART-MARTISZUS I, BARRAGAN E D M,etal. Interferon-gamma production by peripheral lymphocytes predicts survival of tumor-bearing mice receiving dual PD-1/CTLA-4 blockade [J]. Cancer Immunol Res, 2016, 4(8): 650-657.
CFSE-labeled proliferative assays for assessment of T cell function induced by different stimulants
XUE Ni-na1#, DONG Kai2#, LAI Fang-fang1, HUANG Rui1, CHEN Xiao-guang1*
(1. State Key Laboratory of Bioactive Substances and Functions of Natural Medicines/Beijing Key Laboratory of Non-Clinical Drug Metabolism and PK/PD Study, Institute of Materia Medica, Chinese Academy of Medical Sciences, Beijing 100050, China; 2. Tianjin Chase Sun Pharmaceutical Co.LTD, Tianjin 301700, China)
The aim of this paper is to investigate the effect of different stimulants on the proliferation and activation of human peripheral blood lymphocytes. Human peripheral blood lymphocytes were isolated by density centrifugation and labeled with CFSE with the final concentration of 1μmol/L. Flow cytometry analysis was used to detect the division and proliferation of lymphocytes after administration of anti-CD3/28 antibody, phytohemagglutinin (PHA) and phorbol ester (PMA) for 72 h. In addition, IFNγ content that reflects the activation of T lymphocytes was detected by ELISA method.And found that 0.125μg/mL of anti-CD3/28 antibody and 5 or 10μg/mL of PHA could induce the gradual reduction of green fluorescence, with a "Multi-peak" pattern in flow cytometry analysis, the results indicated that both anti-CD3/28 antibody and PHA are potential had strong stimulants for lymphocyte division and proliferation. In comparison, the role of PMA alone in promoting lymphocyte division and proliferation was weak. Furthermore, anti-CD3/28 antibody, PHA and PMA almost could increase the IFNγ secretion from lymphocytes. However, anti-CD3/28 antibody was the most stimulator,PHA, and PMA was the weakest agent for stimulating the production of IFNγ in lymphocytes. In the CFSE-based proliferative assays for assessment of T cell function, this paper concluded that both anti-CD3/28 antibody and PHA were effective stimulants for the proliferation and activation of lymphocytes, with the optimal concentrations of 0.125 μg/mL and 10 μg/mL, respectively.
lymphocyte proliferation; CFSE; interferon γ; flow cytometry
2016-12-27.
中国医学科学院中央级公益性科研院所基本科研业务费项目(2016ZX350041、2016ZX350002)#标注为共同第一作者
薛妮娜(1986-),女,博士,助理研究员,研究方向:抗肿瘤免疫药物的寻找及分子机制研究;董 凯(1974-),男,硕士. 研究方向:小分子和多肽创新药物的分子设计及研发.
陈晓光(1958-),女,博士,研究员,研究方向:抗肿瘤分子药理.E-mail:chxg@imm.ac.cn.
R446
A
1672-0946(2017)02-0129-06
