H型和Na型羧基纤维素表面改性接枝己内酯的比较研究
2017-04-20付时雨
刘 瑞 付时雨
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
H型和Na型羧基纤维素表面改性接枝己内酯的比较研究
刘 瑞 付时雨*
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
利用TEMPO/NaBr/NaClO反应体系将纤维素表面的C6-伯羟基氧化成羧基,获得羧基纤维素;以羧基纤维素为原料、己内酯为接枝共聚改性剂,通过开环聚合,合成了表面接枝聚己内酯的纤维素产物。讨论了H型和Na型羧基纤维素接枝己内酯的情况;红外光谱、核磁共振、X射线衍射、表面光电子能谱、表面接触角、热重等分析表明,H型羧基纤维素接枝己内酯的接枝率高于Na型羧基纤维素,且其接枝产物的疏水性更好、热稳定性更高。
羧基纤维素;聚己内酯;接枝改性;疏水性;热稳定性
纤维素的氧化是纤维素改性的重要手段之一。纤维素的氧化体系主要是高碘酸盐[1-2]、TEMPO(tetramethylpiperidine-1-oxyl)氧化[3- 6]、过硫酸铵氧化[7- 8]和混酸[9]等体系。TEMPO氧化体系是较常用的氧化体系,其可将纤维素葡萄糖单元的仲羟基氧化成醛基或者羧基。TEMPO氧化体系也用来制备羧基纳米纤维素[10-12],并用于制备纳米纤维素膜[10,13]、胶体粒子[5]、复合材料[14-16]以及应用于污水处理[9,17]等领域。
聚己内酯(PCL)是一种由己内酯开环聚合得到的热塑性半结晶聚酯。其熔点为59~64℃,玻璃化转变温度为-60℃,具有良好的加工性和柔韧性,同时其因具有良好的生物相容性、无毒、低免疫性、优良的机械和热塑性能等特点,目前被广泛用于制备生物支架材料和羧基生物复合材料[18-20]。
本研究将己内酯通过聚合方法接枝到羧基纤维素上,纤维素的接枝改性能够降低纤维素表面的亲水性,提高纤维素的疏水性[21-22],克服纤维素与疏水性聚合物混合成复合材料时相容性不好[23]、增强效果低[24]的问题,并且接枝大分子质量的聚合物比接枝小分子质量聚合物更能提高纤维素的疏水性和热稳定性[24-25]。提高羧基纤维素的热稳定性和疏水性及表面接枝聚合物可使纤维素有效地分散在有机溶剂中,或者与疏水性物质共混。同时,引入的侧链还可以赋予羧基纤维素多种优异性能,增强其功能性。
1 实 验
1.1 试剂与仪器
纤维素粉末(棉短绒)由山东煊元棉麻机械有限公司提供,α-纤维素含量>98%、含水量约8%。TEMPO、ε-己内酯(ε-CL)和辛酸亚锡(Sn(OCt)2)购自阿拉丁化学有限公司(上海,中国)。其他试剂如溴化钠(NaBr)、次氯酸钠(NaClO)、氢氧化钠(NaOH)、甲苯、丙酮、二氯甲烷、苯甲醇等均为分析纯,购自广州化学试剂厂(广州,中国)。己内酯使用前用氢化钙干燥48 h后减压蒸馏,并在氩气氛围下保存。丙酮用高锰酸钾除水并蒸馏。甲苯用金属钠除水并蒸馏。其他试剂均不做进一步处理。
1.2 实验过程
将一定量纤维素粉末用TEMPO/NaBr/NaClO反应体系氧化,到达反应终点后,用去离子水多次离心洗涤,并透析至pH值为8左右,得到Na型TEMPO氧化的羧基纤维素(TEMPO oxidized cellulose-COONa,记为TOC-COONa)。在TOC-COONa悬浮液中缓慢滴加1 mol/L的HCl直至pH值为2,搅拌2 h,经多次去离子水洗涤,并透析至无氯离子检出,得到H型TEMPO氧化的羧基纤维素(记为TOC-COOH)。采用电导滴定法[26]测得TEMPO/NaBr/NaClO反应体系氧化得到的2种羧基纤维素的羧基含量均为1.28 mmol/g。
反应前,通过溶剂交换分别对所得的Na型和H型羧基纤维素悬浮液进行处理。溶剂交换即将2.0 g羧基纤维素从悬浮液中转移到无水丙酮中,再转移到无水甲苯中,以去除羧基纤维素中残留的水。加入己内酯单体(ε-CL)20 g,超声处理5 min以保证羧基纤维素分散在ε-CL中,将悬浮液转移到干燥的两口烧瓶中,将此反应体系升温至110℃,在氩气保护下,向反应体系中缓慢加入2%(质量分数,相对于单体用量)的辛酸亚锡催化剂和苯甲醇引发剂,反应24 h以上。反应结束后降至室温,接枝产物中加入二氯甲烷并浸泡搅拌2天,使自聚的PCL和未反应的ε-CL完全溶解在二氯甲烷中,过滤得到接枝产物,然后用二氯甲烷洗涤并索氏抽提48 h,以进一步去除反应中自聚的PCL和未反应的ε-CL。洗涤后的产物在45℃下真空干燥48 h,得到接枝PCL的羧基纤维素,并称量。
接枝率GP由式(1)得到:
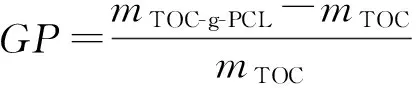
(1)
式中,mTOC-g-PCL是接枝后产物的质量,mTOC是接枝前羧基纤维素的质量。
1.3 结构表征
采用傅里叶红外光谱仪(Bruker TENSOR27)对样品进行红外光谱(FT-IR)分析。5 mg样品和 100 mg KBr混合均匀,压片,用透射光谱法对样品进行测试,波数400~4000 cm-1。
13C-NMR固体核磁谱图通过BrukerAvance-III HD 400M(德国)在100 MHz(磁场9.4T)的条件获得。样品在室温下于4 mm的ZrO2转子中5 kHz魔角旋转,接触时间1500 ms,弛豫时间1.5 s,扫描1000次。
利用D8 ADVANCE广角X射线衍射仪(Bruker公司,德国)在铜靶、40 kV、40 mA、步长0.04°、扫描速度35.4 s/步、扫描范围2θ为5°~60°的条件下进行X射线衍射(XRD)分析。
元素分析仪(Vario EL cube Elemental,德国)可同时对有机固体、敏感性和高挥发性物质中C、H、N、S元素的含量进行定量测定。将约5 mg样品进行粉碎研磨,然后包入锡囊,经自动进样器进入燃烧反应管中,通过在纯氧条件下的燃烧测定样品中的C、H、S元素含量。
利用XPS(X射线光电子能谱,Axis Ultra DCD,英国Katos公司)分析羧基纤维素及其改性产物表面化学组成。仪器扫描参数如下:光源为配有电荷补偿电子枪的单色A1 Ka X射线,功率150 W,高分辨光谱同能40 eV,低分辨光谱同能160 eV,分析室中真空度大于6.66×10-7Pa。
采用高精度视频接触角测量仪(Data Physics OCA 40 Micro,德国)对接枝后的样品进行接触角测定。具体步骤如下:在玛瑙研钵中将样品研成粉末,在1 MPa的压力下使用压片机将粉末状样品压成表面光滑的小圆片。在样品表面滴1滴5~10 μL的超纯水,并记录其在样品表面的轮廓图像。在基线与液体轮廓形成的切线的交接点处测定接触角并用杨氏-拉普拉斯方程进行修正。
2 结果与讨论
2.1 羧基纤维素接枝己内酯产物的结构分析
为了阐明纤维素上羧基对己内酯接枝改性的影响,利用TEMPO氧化法将天然纤维素改性成羧基纤维素(TOC-COONa和TOC-COOH),并通过FT-IR进行分析。
Na型和H型羧基纤维素接枝PCL前后的FT-IR谱图如图1所示。由接枝前的谱图(见图1中的A和B)可以看出,TOC-COONa和TOC-COOH均在1160 cm-1和3400 cm-1附近出现了—OH和C—O—C特征峰,并且均在1610 cm-1处出现了COO—的吸收峰,表明纤维原料表面的部分伯羟基被氧化成羧基[27],此结果与文献[28-29]的研究结果一致。TOC-COOH和TOC-COONa的FT-IR谱图大部分相同,不同的是TOC-COOH在1730 cm-1处出现了吸收峰,这是羧基酸化后生成—COOH 的缘故[27]。

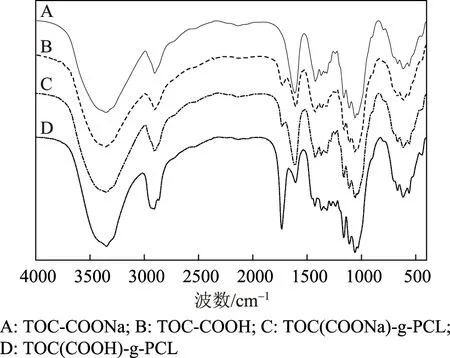
图1 不同羧基纤维素及其接枝产物的FT-IR谱图
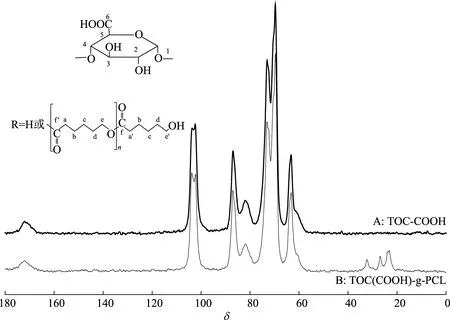
图3 羧基纤维素及其接枝产物的13C-NMR谱图
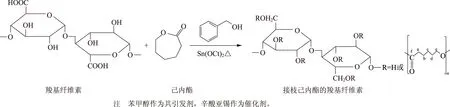
图2 羧基纤维素(TOC)与己内酯(ε-CL)单体开环聚合反应示意图
2.2 羧基纤维素接枝后化学成分分析
元素分析(Elemental analysis,EA)可进一步定量说明2种羧基纤维素对接枝反应的差别,同时,还可以计算出改性前后羧基纤维素中C元素的含量,进而估算接枝产物中PCL的含量(见式(2))。接枝率和EA测定的羧基纤维素改性前后的C元素含量及相应的O/C原子比如表1所示。
(100-WPCL)×Wbefore+WPCL×63.15=Wafter×100
(2)
式中,WPCL为接枝产物中PCL含量,%;Wbefore和Wafter为接枝反应前后羧基纤维素中的C元素含量,%;63.15为根据化学式计算出的PCL中C元素的理论含量,%。
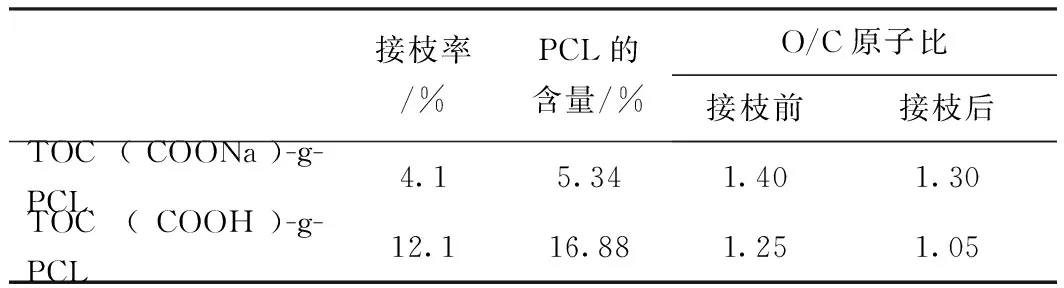
表1 接枝前后不同羧基纤维素的元素分析
由表1可知,TOC-COONa的接枝率只有4.1%,而TOC-COOH的接枝率达12.1%。通过EA可知,TOC(COOH)-g-PCL中PCL含量为16.88%,高于TOC(COOHNa)-g-PCL中PCL的含量(5.34%),再次证明TOC-COOH的接枝率高,接枝效果优于TOC-COONa。
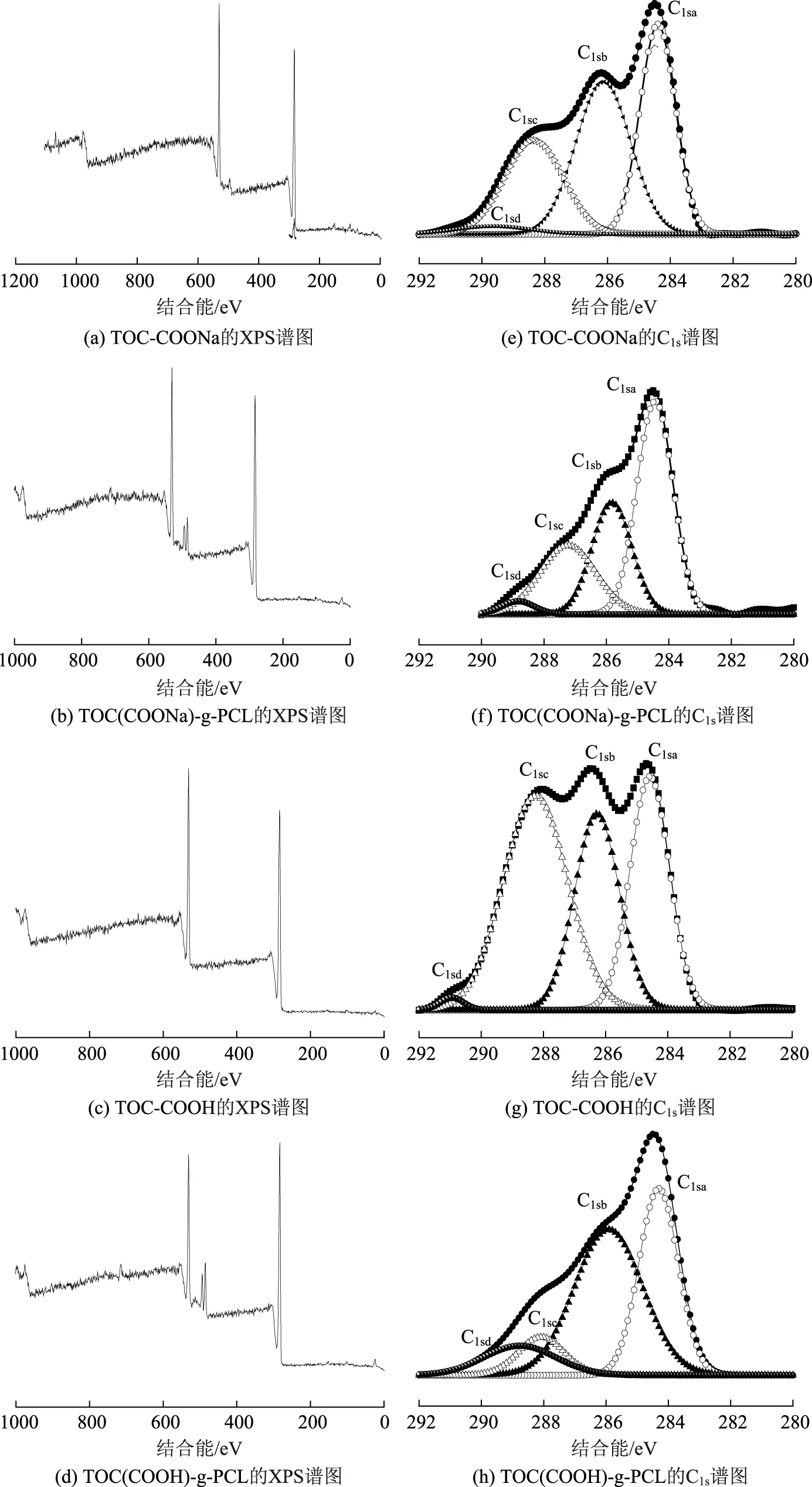
图4 不同羧基纤维素接枝前后的XPS谱图(a~d)及其对应的高分辨率的C1s谱图(e~h)
此外,接枝前TOC-COONa和TOC-COOH的O/C原子比分别为1.40和1.25,接枝后O/C原子比降至1.30和1.05,下降幅度分别高达7.1%和16.0%。由于PCL中O/C原子比为0.33,接枝产物中O/C原子比的下降说明PCL已接枝到羧基纤维素表面,同时表明TOC-COOH接枝的己内酯含量较TOC-COONa多。
2种羧基纤维素接枝己内酯时,TOC-COOH的接枝效果好于TOC-COONa的接枝效果,而且,TOC-COOH更有利于开环聚合接枝己内酯。
为进一步分析改性前后Na型和H型羧基纤维素的表面化学成分的变化,利用XPS分析对上述结果进行了进一步验证,验证结果(见图4)表明,H型羧基纤维素的接枝效果优于Na型羧基纤维素。这2种羧基纤维素的接枝效果可通过改性前后样品中不同化学键的C原子分数的变化来体现。

从低分辨率谱图(见图4a~d)可以看出,羧基纤维素及其改性产物的主要组成元素为C和O元素,出现在285 eV和532 eV处。TOC-COONa表面的O/C原子比为0.21,TOC-COOH的表面O/C原子比为0.19,两者比较相近。接枝聚合反应后,TOC-COONa表面的O/C原子比从0.21降至0.19,降低了9.5%,TOC-COOH表面的O/C原子比从0.19降至0.16,降低了15.8%。由于PCL中O/C原子比为0.33,接枝产物表面O/C原子比的降低说明PCL已接枝到羧基纤维素表面,并且接枝PCL后,TOC-COOH表面的O/C原子比下降的幅度比TOC-COONa表面的O/C原子比下降幅度大,说明TOC-COOH接枝己内酯的效果比TOC-COONa的效果好。
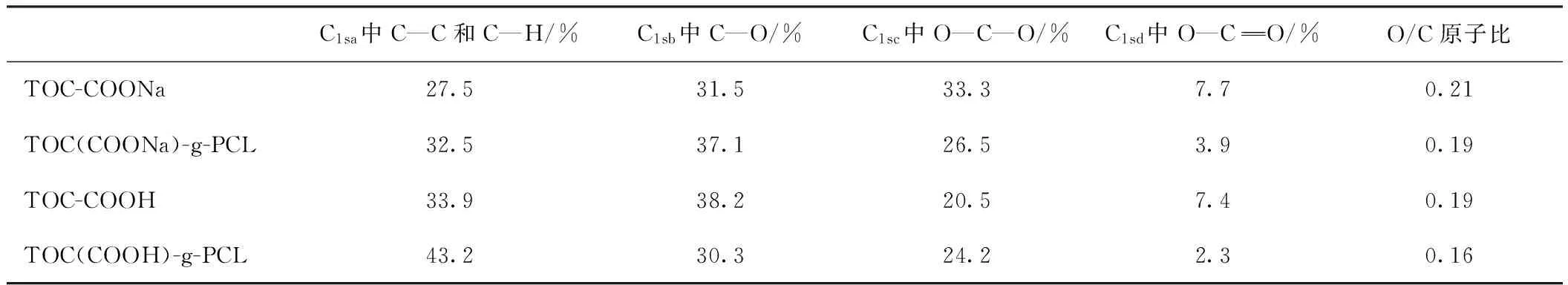
表2 不同羧基纤维素及其接枝产物C1s谱图中不同化学键的C原子分数及O/C原子比
注 结合能在287 eV左右。
C1s的高分辨图谱(见图4e~h)进一步验证了2种羧基纤维素的接枝效果。改性前2种羧基纤维素C1sa键含量大致相同,Na型和H型羧基纤维素的C1sb键含量分别为27.5%和33.9%。改性后TOC(COOH)-g-PCL的C1s峰中,C1sa键所占比例从33.9%增至43.2%,增加部分来源于接枝的PCL链中的C—C键,这一结果与文献[29,31]的结果相符,但是与这些结果相比,本实验结果C1sa所占比例增加的幅度不明显,其原因可能与接枝率低、接枝产物中PCL的含量不高有关。与TOC(COONa)-g-PCL相比,TOC(COOH)-g-PCL的C1s峰中C1sa键所占比例提高较多,说明H型羧基纤维素开环聚合接枝己内酯时,己内酯的接枝率更高、接枝密度更大。
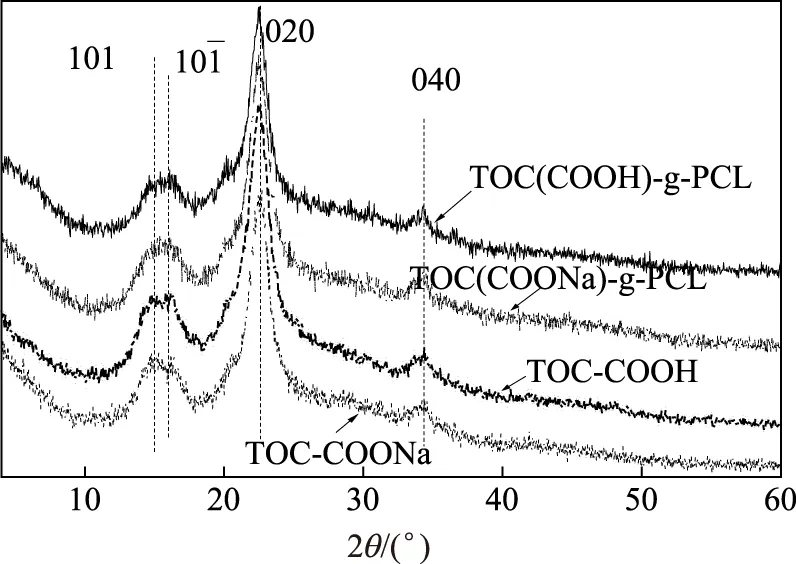
图5 不同羧基纤维素及其接枝产物的XRD谱图
2.3 接枝反应对羧基纤维素晶体结构的影响
利用XRD分析了2种羧基纤维素及其改性产物的晶体结构,得到了如图5所示的XRD图谱,相应结晶度的计算结果见表3。
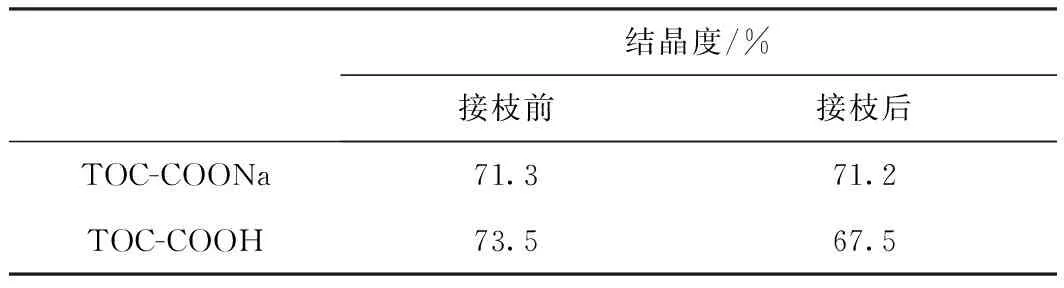
表3 不同羧基纤维素接枝前后结晶度的变化
从图5可以看出,TOC-COONa和TOC-COOH均表现出典型的纤维素I晶体结构,而且这2种羧基纤维素的改性产物均保持了主要晶面的衍射峰,说明在聚合反应过程中,羧基纤维素的主要晶体结构未发生改变。PCL的特征衍射峰理论上应出现在2θ为21.3°处,但在这2种改性产物的XRD图谱中均未出现该峰。这主要是因为纤维素I的020晶面在2θ为22.8°处有一个较强的衍射峰。此峰的位置与PCL特征峰的位置相近,且由于该峰强度较大,会与PCL特征峰重合并遮盖其峰形[25]。由这2种羧基纤维素及其改性产物的结晶度可知,在接枝反应前,TOC-COOH的结晶度(73.5%)略高于TOC-COONa(71.3%)。接枝反应后,TOC-COOH的结晶度从73.5%降至67.5%,说明接枝过程中羧基纤维素的结晶区受到一定程度的破坏。反应过程中羧基纤维素表面部分羟基被PCL链所取代,使羧基纤维素晶体间氢键作用减弱,一定程度上破坏了羧基纤维素的结晶结构[32]。同时,TOC-COONa结晶度的降低并不十分明显,说明接枝到TOC-COONa表面的PCL链密度较小,对羧基纤维素晶体结构的影响较小,这与元素分析(EA)和XPS分析结果相符。
2.4 不同羧基纤维素改性前后疏水性的比较
通过静态接触角分析了2种羧基纤维素改性前后的疏水性。一般来说,接触角在0~90°范围内为亲水性物质。在90°~180°范围内为疏水性物质。不同羧基纤维素改性前后的接触角(CA)图像如图6所示。
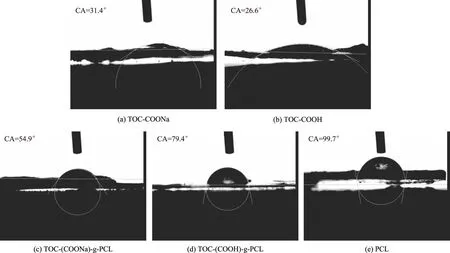
图6 不同羧基纤维素及其接枝产物的接触角图像
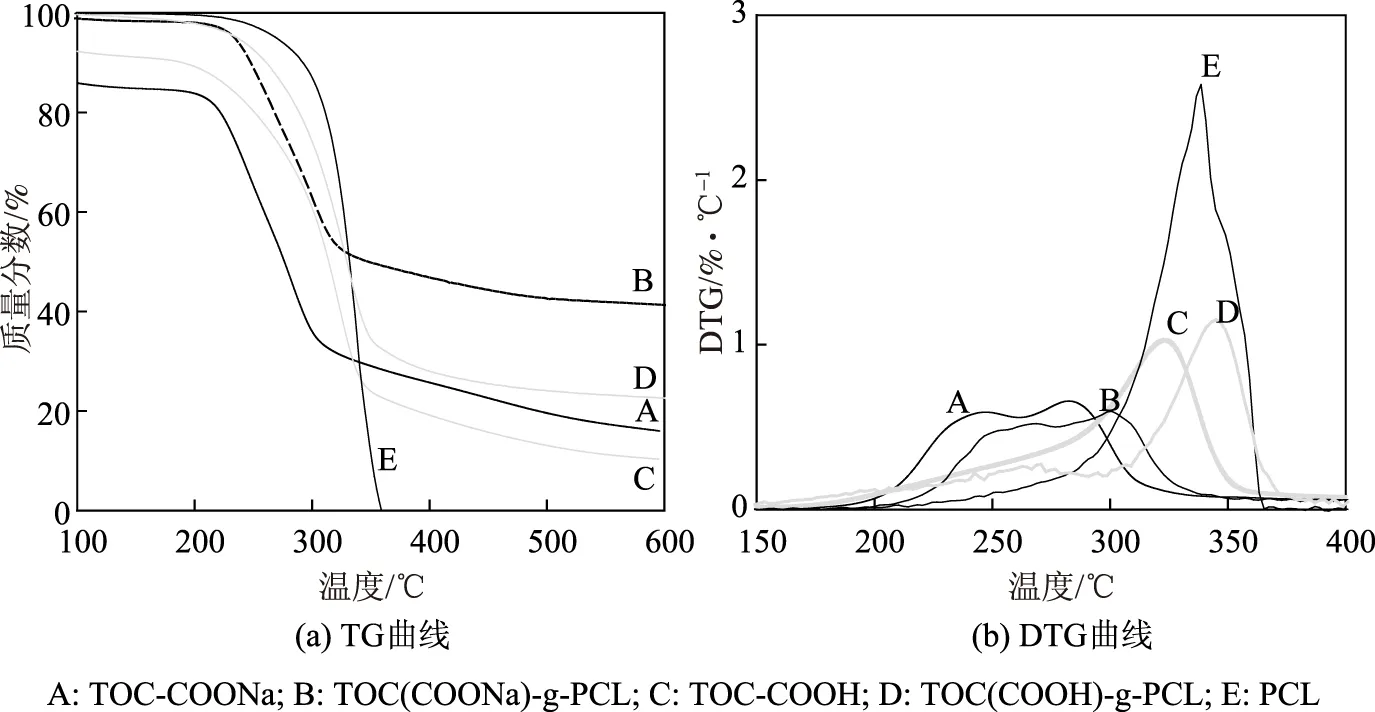
图7 不同羧基纤维素及其接枝产物的TG曲线和DTG曲线
从图6可知,Na型和H型羧基纤维素的接触角均较小,且在实验过程中,样品表面对水滴的吸收速度很快,说明其亲水性很强。PCL均聚物的接触角为99.7°,为疏水性物质。接枝反应后,2种改性产物的表面接触角均有所增大,且样品表面对水滴的吸收速度减慢。因此,TOC(COONa)-g-PCL和TOC(COOH)-g-PCL接触角的增大是其表面覆盖疏水性PCL导致的[33]。同时,TOC(COOH)-g-PCL的接触角(79.4°)明显大于TOC(COONa)-g-PCL的接触角(54.9°),TOC(COOH)-g-PCL的接触角更接近PCL均聚物的接触角,说明更多的疏水性PCL接枝在H型羧基纤维素的表面。
2.5 不同羧基纤维素改性前后热稳定性的比较
图7显示了不同羧基纤维素及其改性产物的热稳定性;降解过程中热降解温度Td和最高热降解温度Tmax(见表4)的不同,说明2种羧基纤维素及其接枝产物在热稳定性上存在差异。
由图7可以看出,所有样品在100℃附近损失较少,这是样品表面所吸附的水蒸发引起的。接枝前,TOC-COONa的热降解温度为217℃,TOC-COOH的热降解温度为223℃,此外,TOC-COONa和TOC-COOH的最高热降解温度有显著差异,TOC-COONa的最高热降解温度出现在246℃和283℃,这可能与脱水葡萄糖醛酸钠单元有关[28],TOC-COOH的最高热降解温度为323℃。接枝前TOC-COOH的热稳定性高于TOC-COONa。
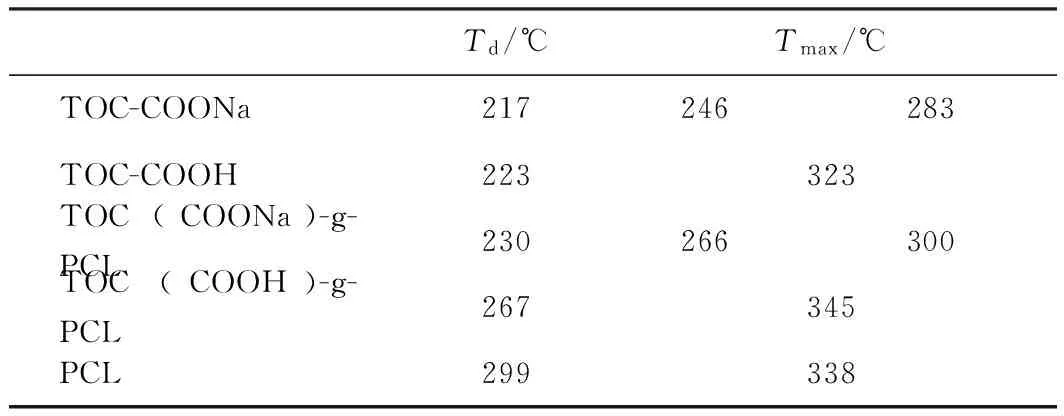
表4 不同羧基纤维素及其接枝产物的热降解参数
由于接枝物PCL的热降解温度为299℃、最高热降解温度为338℃,其热稳定性高于羧基纤维素。羧基纤维素接枝PCL后热稳定均有所提高,接枝后,Na型羧基纤维素的热降解温度提高到230℃,但有2个最高热降解温度,分别从246℃提高到266℃和从283℃提高到300℃;H型羧基纤维素的热降解温度提高到267℃、最高热降解温度提高到345℃,热降解温度和最高热降解温度均有较大幅度的提高。接枝产物TOC(COOH)-g-PCL的热稳定性明显高于TOC(COONa)-g-PCL,这与TOC-COOH的接枝率高于TOC-COONa的接枝率有关。
3 结 论
棉短绒经TEMPO/NaBr/NaClO选择性氧化可使表面的部分伯羟基氧化成羧基,成为羧基纤维素;在碱性环境下该羧基呈羧钠型,经酸化后变成羧基氢型。氧化后的纤维原料接枝己内酯,可以在纤维素分子链上形成聚己内酯侧链,且H型羧基纤维素的接枝率高于Na型羧基纤维素的接枝率。
H型和Na型羧基纤维素接枝产物的疏水性和热稳定性都有大幅度提高。接枝前纤维素样品亲水性很强,接枝后,疏水性PCL接枝在纤维素表面,因此,接枝产物疏水性增强。H型羧基纤维素的热降解温度提高幅度大于Na型羧基纤维素,这与更多的热稳定高的聚己内酯接枝在了H型羧基纤维素的表面有关。
[1] Liimatainen H, Visanko M, Sirviö J A, et al. Enhancement of the Nanofibrillation of Wood Cellulose through Sequential Periodate-Chlorite Oxidation[J]. Biomacromolecules, 2012, 13(5): 1592.
[2] Visanko M, Liimatainen H, Sirviö J A, et al. Amphiphilic Cellulose Nanocrystals from Acid-Free Oxidative Treatment: Physicochemical Characteristics and Use as an Oil-Water Stabilizer[J]. Biomacro-molecules, 2014, 15(7): 2769.
[3] De Nooy A E, Besemer A C, Van Bekkum H. Highly selective nitroxyl radical-mediated oxidation of primary alcohol groups in water-soluble glucans[J]. Carbohydrate Research, 1995, 269(1): 89.
[4] Lin N, Bruzzese C, Dufresne A. TEMPO-Oxidized Nanocellulose Participating as Crosslinking Aid for Alginate-Based Sponges[J]. ACS Applied Materials & Interfaces, 2012, 4(9): 4948.
[5] Peyre J, Paakkonen T, Reza M, et al. Simultaneous preparation of cellulose nanocrystals and micron-sized porous colloidal particles of cellulose by TEMPO-mediated oxidation[J]. Green Chemistry, 2015, 17(2): 808.
[6] Gu J, Hsieh Y L. Surface and structure characteristics, self-assembling, and solvent compatibility of holocellulose nanofibrils[J]. ACS Appl Mater Interfaces, 2015, 7(7): 4192.
[7] Cheng M, Qin Z, Liu Y, et al. Efficient extraction of carboxylated spherical cellulose nanocrystals with narrow distribution through hydrolysis of lyocell fibers by using ammonium persulfate as an oxidant[J]. Journal of Materials Chemistry A, 2014, 2(1): 251.
[8] Hu Y, Tang L, Lu Q, et al. Preparation of cellulose nanocrystals and carboxylated cellulose nanocrystals from borer powder of bamboo[J]. Cellulose, 2014, 21(3): 1611.
[9] Yu H-Y, Zhang D-Z, Lu F-F, et al. New Approach for Single-Step Extraction of Carboxylated Cellulose Nanocrystals for Their Use As Adsorbents and Flocculants[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(5): 2632.
[10] Fujisawa S, Okita Y, Fukuzumi H, et al. Preparation and characterization of TEMPO-oxidized cellulose nanofibril films with free carboxyl groups[J]. Carbohydrate Polymers, 2011, 84(1): 579.
[11] Fukuzumi H, Saito T, Isogai A. Influence of TEMPO-oxidized cellulose nanofibril length on film properties[J]. Carbohydr Polym, 2013, 93(1): 172.
[12] Hiraoki R, Ono Y, Saito T, et al. Molecular mass and molecular-mass distribution of TEMPO-oxidized celluloses and TEMPO-oxidized cellulose nanofibrils[J]. Biomacromolecules, 2015, 16(2): 675.
[13] Fan Y, Fukuzumi H, Saito T, et al. Comparative characterization of aqueous dispersions and cast films of different chitin nanowhiskers/nanofibers[J]. International Journal of Biological Macromolecules, 2012, 50(1): 69.
[14] Endo R, Saito T, Isogai A. TEMPO-oxidized cellulose nanofibril/poly(vinyl alcohol) composite drawn fibers[J]. Polymer, 2013, 54(2): 935.
[15] Fujisawa S, Ikeuchi T, Takeuchi M, et al. Superior Reinforcement Effect of TEMPO-Oxidized Cellulose Nanofibrils in Polystyrene Matrix: Optical, Thermal, and Mechanical Studies[J]. Biomacromolecules, 2012, 13(7): 2188.
[16] Fujisawa S, Saito T, Kimura S, et al. Comparison of mechanical reinforcement effects of surface-modified cellulose nanofibrils and carbon nanotubes in PLLA composites[J]. Composites Science and Technology, 2014, 90: 96.
[17] Isobe N, Chen X, Kim U J, et al. TEMPO-oxidized cellulose hydrogel as a high-capacity and reusable heavy metal ion adsorbent[J]. J Hazard Mater, 2013, 260: 195.
[18] Li D, Wu T, He N, et al. Three-dimensional polycaprolactone scaffold via needleless electrospinning promotes cell proliferation and infiltration[J]. Colloids and Surfaces B: Biointerfaces, 2014, 121: 432.
[19] 郭延柱. 两亲性纤维素及其自组装纳米胶束的制备与应用研究 [D]. 广州: 华南理工大学, 2013.
[20] Goffin A-L, Habibi Y, Raquez J-M, et al. Polyester-grafted cellulose nanowhiskers: A new approach for tuning the microstructure of immiscible polyester blends[J]. ACS Applied Materials & Interfaces, 2012, 4(7): 3364.
[21] Lönnberg H, Zhou Q, Brumer H, et al. Grafting of cellulose fibers with poly (ε-caprolactone) and poly (L-lactic acid) via ring-opening polymerization[J]. Biomacromolecules, 2006, 7(7): 2178.
[22] Lönnberg H, Larsson K, Lindström T, et al. Synthesis of Polycaprolactone-Grafted Microfibrillated Cellulose for Use in Novel Bionanocomposites-Influence of the Graft Length on the Mechanical Properties[J]. Acs Applied Materials & Interfaces, 2011, 3(5): 1426.
[23] Baiardo M, Frisoni G, Scandola M, et al. Surface chemical modification of natural cellulose fibers[J]. Journal of Applied Polymer Science, 2002, 83(1): 38.
[24] Habibi Y, Goffin A-L, Schiltz N, et al. Bionanocomposites based on poly (ε-caprolactone)-grafted cellulose nanocrystals by ring-opening polymerization[J]. Journal of Materials Chemistry, 2008, 18(41): 5002.
[25] Habibi Y, Dufresne A. Highly Filled Bionanocomposites from Functionalized Polysaccharide Nanocrystals[J]. Biomacromolecules, 2008, 9(7): 1974.
[26] Saito T, Isogai A. TEMPO-mediated oxidation of native cellulose. The effect of oxidation conditions on chemical and crystal structures of the water-insoluble fractions[J]. Biomacromolecules, 2004, 5(5): 1983.
[27] Lasseuguette E. Grafting onto microfibrils of native cellulose[J]. Cellulose, 2008, 15(4): 571.
[28] Fukuzumi H, Saito T, Okita Y, et al. Thermal stabilization of TEMPO-oxidized cellulose[J]. Polymer Degradation and Stability, 2010, 95(9): 1502.
[29] Tian C, Fu S, Habibi Y, et al. Polymerization Topochemistry of Cellulose Nanocrystals: A Function of Surface Dehydration Control[J]. Langmuir, 2014, 30(48): 14670.
[30] Dong H, Xu Q, Li Y, et al. The synthesis of biodegradable graft copolymer cellulose-graft-poly (l-lactide) and the study of its controlled drug release[J]. Colloids and Surfaces B: Biointerfaces, 2008, 66(1): 26.
[31] Benkaddour A, Jradi K, Robert S, et al. Grafting of Polycaprolactone on Oxidized Nanocelluloses by Click Chemistry[J]. Nanomaterials, 2013, 3(1): 141.
[32] Yin C, Li J, Xu Q, et al. Chemical modification of cotton cellulose in supercritical carbon dioxide: Synthesis and characterization of cellulose carbamate[J]. Carbohydrate Polymers, 2007, 67(2): 147.
[33] Labet M, Thielemans W, Dufresne A. Polymer grafting onto starch nanocrystals[J]. Biomacromolecules, 2007, 8(9): 2916.
(责任编辑:关 颖)
The Comparison of Grafting Polycaprolactone on Carboxylate Celluloses in H or Na Form
LIU Rui FU Shi-yu*
(StateKeyLaboratoryofPulpandPaperEngineering,SouthChinaUniversityofTechnology,Guangzhou,GuangdongProvince, 510640)
(*E-mail: shyfu@scut.edu.cn)
The main objective of this work is the comparison of the grafting polycaprolactone (PCL) on the surface of carboxylate celluloses in H or Na form via ring-opening polymerization (ROP) in order to enhance the compatibility between the cellulose and the hydrophobic polymer matrix. In this work, cellulose was oxidized with catalysts of 2,2,6,6-tetramethylpiperidine-1-oxyl radical (TEMPO), sodium hypochlorite and sodium bromide in water. The primary hydroxyl groups were selectively oxidized into carboxyl groups. TEMPO-oxidized cellulose with sodium carboxylate groups(TOC-COONa) was completely converted to individual TEMPO-oxidized cellulose with free carboxyl groups (TOC-COOH) and dispersed in water. The two carboxylate celluloses (TOC-COONa and TOC-COOH) were dewatered and grafted with PCL by ROP. The PCL-grafted cellulosic materials were characterized by Fourier transform infrared (FT-IR), X-ray diffraction, elemental analysis, X-ray photoelectron spectroscopy (XPS), contact angle measurement, Carbon-13 nuclear magnetic resonance spectroscopy (13C-NMR) spectroscopic techniques and thermogravimetric (TG) analyses, respectively. The results indicated that TEMPO-oxidized cellulose with free carboxyl groups (TOC-COOH) was more likely to be modified by PCL, and its corresponding PCL-grafted cellulosic materials was more hydrophobic and thermal stable than that of TEMPO-oxidized cellulose with sodium carboxylate groups (TOC-COONa).
carboxylate celluloses; polycaprolactone; grafting; hydrophobic; thermal stabilization
2016- 07-14
国家自然科学基金(31570569);广东省自然科学基金(2014A030311030)。
刘 瑞,女,1990年生;在读硕士研究生;主要研究方向:纤维素及纳米纤维素功能化。
*通信联系人:付时雨,E-mail:shyfu@scut.edu.cn。
TS7
A
1000- 6842(2017)01- 0032- 08
