趋化因子CXC配体12/CXC受体4在前列腺癌细胞的表达及其对细胞增殖的作用机制
2017-04-20曲修胜刘媛媛孙华威梁立春齐亚灵王伟群
曲修胜 刘媛媛 孙华威 梁立春 李 玥 齐亚灵 王伟群
(佳木斯大学附属第一医院肿瘤内科,黑龙江 佳木斯 154002)
趋化因子CXC配体12/CXC受体4在前列腺癌细胞的表达及其对细胞增殖的作用机制
曲修胜 刘媛媛 孙华威 梁立春1李 玥1齐亚灵2王伟群1
(佳木斯大学附属第一医院肿瘤内科,黑龙江 佳木斯 154002)
目的 检测DU145、PC-3和LNCaP前列腺癌细胞中趋化因子CXC配体(L)12及其受体(R)4的表达,探讨重组人CXCL12对上述细胞增殖的影响及其机制。方法 逆转录聚合酶链反应(RT-PCR)研究CXCL12/CXCR4在DU145、PC-3和LNCaP细胞的表达;CCK-8实验研究重组人CXCL12对DU145、PC-3和LNCaP细胞增殖的作用;Wettern印迹实验研究重组人CXCL12对DU145细胞外调节蛋白激酶(ERK)和磷酶化ERK(pERK)表达的影响。结果 DU145、PC-3和LNCaP细胞均表达CXCL12和CXCR4,重组人CXCL12可明显促进上述细胞的增殖,重组人CXCL12虽然不能改变DU145细胞ERK1/2表达,但可上调pERK1/2的表达。结论 前列腺癌细胞表达CXCL12 及其受体CXCR4,CXCL12/CXCR4可通过活化丝裂原活化蛋白激酶(MAPK)/ERK信号通路促进前列腺癌细胞的增殖。
前列腺癌;趋化因子CXC配体(L)12;CXC受体(R)4;细胞外调节蛋白激酶(ERK)
前列腺癌是临床上最常见的泌尿生殖系统恶性肿瘤之一,其致死率位列所有男性肿瘤的第二位〔1〕。目前认为,前列腺癌的发生与多种因素有关,高危因素包括年龄、吸烟、炎症、雄激素水平、饮食和遗传等。其中,炎症反应在恶性肿瘤中的作用越来越引起人们的关注,其已被认为是癌症发生的第七大危险因素〔2〕。趋化因子属于细胞因子超家族成员,其具有吸引、活化、调节各种类型白细胞运输的功能。近年来的研究成果表明,趋化因子也可通过促进肿瘤微环境中血管的生成、肿瘤细胞的增殖、侵袭和转移而参与肿瘤的发生与演进过程〔3〕。本研究观察趋化因子CXC配体(L)12及其受体(R)4在前列腺癌细胞的表达并探讨CXCL12对前列腺癌细胞增殖的作用及其机制。
1 材料与方法
1.1 实验细胞及试剂 人类前列腺癌细胞系DU145、PC-3和 LNCaP(中科院上海细胞库,中国),胎牛血清(NQBB,美国),青、链霉素和细胞计数试剂盒(CCK)8(博士德,中国),RPMI1640培养基(Gibco,美国),Trizol(Invitrogen,美国),TIANScript RT试剂盒(天跟,中国),外源性CXCL12(PeproTech,美国),苯甲基磺酰氟(PMSF)、放射免疫沉淀(RIPA)裂解液和二喹啉甲酸(BCA)蛋白定量试剂盒(碧云天,中国),兔抗细胞外调节蛋白激酶(ERK)和兔抗磷酸化ERK(pERK)(Affinity,美国),鼠抗β-actin、辣根过氧化物酶(HRP)标记二抗(中杉金桥,中国)。
1.2 细胞培养 DU145、PC-3和 LNCaP细胞被接种和培养在含10% 胎牛血清、100 μg/ml青、链霉素的RPMI1640培养基中,待细胞密度达到90%以上时,细胞受胰蛋白酶消化,离心后收集细胞沉淀或传代,备用。
1.3 逆转录聚合酶链反应(RT-PCR)实验 用Trizol试剂常规提取DU145、PC-3和LNCaP细胞的总RNA并测量其浓度,利用TIANScript RT试剂盒按操作规程将2 μg总RNA逆转录成cDNA,并行PCR实验。PCR扩增中各基因引物及PCR反应条件见表1。

表1 PCR引物及反应条件
1.4 细胞增殖实验 取对数生长期DU145、PC-3和 LNCaP细胞重悬于RPMI1640完全培养基中(含10% 胎牛血清、100 μg/ml青、链霉素)。待计数板计数细胞后,将1.5×103细胞/孔分别接种于96孔板中,并于37℃含5% CO2培养箱中培养过夜。待第2天细胞完全贴壁后,小心吸取培养基,向每孔中加入含外源性CXCL12完全培养基100 μl,使各孔中外源性CXCL12终浓度分别为0、10、20、40和 60 ng/ml,将孔板置于上述培养箱中继续培养,72 h后用CCK8试剂盒检测细胞增殖情况。
1.5 Western印迹实验 将细胞培养在10 cm培养皿中,待细胞融合度达到90%以上后,收集细胞沉淀,加入含PMSF 的RIPA蛋白裂解液充分裂解细胞,待BCA蛋白定量试剂盒测量各样本浓度后将样本存于-80℃冰箱中备用。Western印迹流程如下:取50 μg的总蛋白于12%的十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶中电泳(电压为110 V);将凝胶中蛋白转移至聚偏氟乙烯(PVDF)膜上(电流为300 mA,2 h);5%的脱脂奶粉室温封闭3 h;Tween-20磷酸盐缓冲液(PBST)洗膜3×5 min;一抗4℃孵育过夜(β-actin、ERK和pERK浓度均为1∶1 000),PBST洗膜3×5 min; HRP标记的二抗(1∶10 000)37℃孵育45 min;PBST洗膜4×5 min;向膜上加入电化学发光(ECL)显影液,并于全自动化学发光系统中曝光、拍照。
1.6 统计学方法 应用SPSS19.0统计软件行q检验。
2 结 果
2.1 前列腺癌细胞表达CXCL12及其受体CXCR4 DU145、PC-3和 LNCaP均表达CXCL12及其受体CXCR4。见图1。半定量分析表明,与PC-3(0.51±0.08)和DU145(0.29±0.06)比较,LNCaP细胞 CXCL12 mRNA表达量(1.34±0.14)明显增高,而CXCR4的mRNA水平在DU145中最高(0.99±0.08),LNCaP次之(0.62±0.09),PC-3最低(0.47±0.06)。
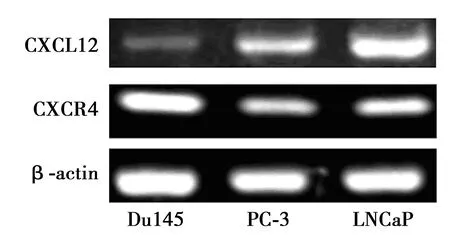
图1 前列腺癌细胞表达CXCL12及CXCR2 mRNA
2.2 外源性CXCL12促进前列腺癌细胞增殖 细胞培养72 h后,CCK8实验结果表明,外源性CXCL12均可促进DU145、PC-3和 LNCaP的增殖,但是各细胞促进增殖的浓度有明显差异(P<0.05),DU145的促增殖浓度为10、20和40 ng/ml,PC-3为60 ng/ml,而LNCaP为10、20、40和60 ng/ml。见表2。
2.3 外源性CXCL12促进DU145细胞ERK磷酸化(pERK) 与0 ng/ml CXCL12(0.70±0.35、0.55±0.13)比较,10、40 ng/ml的CXCL12不能改变ERK的水平(1.01±0.15、0.94±0.14,P>0.05),但可明显促进pERK的表达(1.55±0.14、1.56±0.18,P<0.05)。见图2。

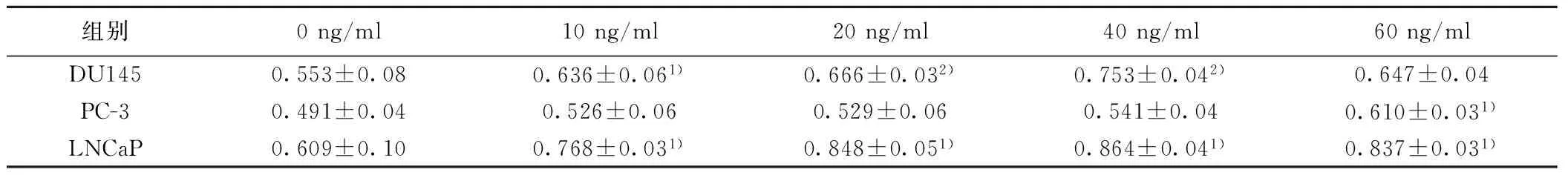
组别0ng/ml10ng/ml20ng/ml40ng/ml60ng/mlDU1450.553±0.080.636±0.061)0.666±0.032)0.753±0.042)0.647±0.04PC-30.491±0.040.526±0.060.529±0.060.541±0.040.610±0.031)LNCaP0.609±0.100.768±0.031)0.848±0.051)0.864±0.041)0.837±0.031)
与0 ng/ml比较:1)P<0.05;2)P<0.01

1~3:0、10、40 ng/ml CXCL12图2 外源性CXCL12上调DU145 细胞pERK水平
3 讨 论
前列腺癌在欧美被称为男性健康的第一大杀手,其发病率位居西方世界男性恶性肿瘤的第一位,而死亡率也已升至第二位,仅次于肺癌〔4〕。前列腺癌在北京男性泌尿生殖系肿瘤中排名第一位、所有肿瘤疾病中排名第五位〔5〕。
炎症反应是机体在进化演进过程中形成的具有抵抗及清除病原微生物、异物及坏死组织的一种保护机制。该过程有助于生物体清除异己,从而保证个体的生存,但炎症的长期存在,即慢性炎症,也会导致包括肿瘤在内的多种疾病发生〔6〕。全球约25%的肿瘤是由炎症发展而来的〔7〕。
趋化因子属于细胞因子超家族成员,根据邻近氨基端结构性半胱氨酸的排列,其可被分为CXC、CX3C、CC和C四个亚家族。其中CXC亚家族又可依据第一个保守半胱氨酸前是否存有谷氨酸-亮氨酸-精氨酸(ELR)结构,进一步分为ELR+CXC和ELR-CXC两类。尽管趋化因子在炎症和免疫反应中可以活化、吸引及调节粒细胞的迁移,但越来越多的证据显示,趋化因子也参与了肿瘤的增殖、侵袭、转移及血管生成〔8〕。
作为ELR+CXC类趋化因子中的一员,CXCL12是CXCR4的唯一配体。有研究已经证实,CXCL12/CXCR4参与了多种肿瘤的发生与演进过程。在包括卵巢癌、小细胞肺癌和脑胶质瘤的许多肿瘤中,CXCL12均可促进表达CXCR4肿瘤细胞的增殖与存活〔9~11〕。另外,CXCL12也参与肿瘤细胞的特异性器官转移,Müller等〔12〕研究表明,CXCR4高表达于乳腺癌细胞和乳腺癌组织,而乳腺癌常转移的靶组织则高表达其配体CXCL12,CXCR4可介导乳腺癌细胞肌动蛋白的聚合和伪足形成,并借助受体与配体的特异性结合,以实现其向靶组织的趋化及转移,这就是所谓的“归巢学说”,而阻断CXCL12/CXCR4的相互作用,则可抑制癌细胞的归巢和迁移。本研究提示,CXCL12的表达可能与雄激素信号有关。细胞增殖实验表明外源性给予CXCL12均可促进上述细胞的增殖,而当CXCL12浓度增加到一定数值后,其促DU145和LNCaP的增殖效应有所下降。Begley等〔13〕的研究证实同为ELR+CXC类趋化因子的CXCL5对前列腺癌细胞的增殖也具有双向调节作用,即一定浓度的CXCL5可促进癌细胞增殖,而超过一定浓度反而会出现抑制效应;推断这种现象可能与高浓度的配体导致受体下调有关。
丝裂原活化蛋白激酶(MAPK)/ERK通路在肿瘤中的作用已被广泛证实,其不仅参与了肿瘤细胞的增殖与血管发生,还在肿瘤的侵袭和转移中发挥重要作用〔14~16〕。本研究结果表明,外源性CXCL12虽然不能改变ERK1/2表达,但可上调pERK1/2的表达。由此可见活化MAPK/ERK信号通路可促进前列腺癌细胞的增殖。
1 Morales CP,Holt SE,Ouellette M,etal.Absence of cancer-associated changes in human fibroblasts immortalized with telomerase〔J〕.Nat Genet,1999;21(1):115-8.
2 Laskowski P,Klim B,Ostrowski K,etal.Local inflammatory response in colorectal cancer〔J〕.Pol J Pathol,2016;67(2):163-71.
3 Caronni N,Savino B,Recordati C,etal.Cancer and chemokines〔J〕.Methods Mol Biol,2016;1393:87-96.
4 Weingartner K,Ben-Sasson SA,Stewart R,etal.Endothelial cell proliferation activity in benign prostatic hyperplasia and prostate cancer:an in vitro model for assessment〔J〕.J Urol,1998;159(2):465-70.
5 叶定伟,朱 耀.中国前列腺癌的流行病学概述和启示〔J〕.中华外科杂志,2015;53(4):249-52.
6 Lin WW,Karin M.A cytokine-mediated link between innate immunity,inflammation,and cancer〔J〕.J Clin Invest,2007;117(5):1175-83.
7 Hussain SP,Harris CC.Inflammation and cancer:an ancient link with novel potentials〔J〕.Int J Cancer,2007;121(11):2373-80.
8 Strieter RM.Chemokines:not just leukocyte chemoattractants in the promotion of cancer〔J〕.Nat Immunol,2001;2(4):285-6.
9 Scotton CJ,Wilson JL,Scott K,etal.Multiple actions of the chemokine.CXCL12 on epithelial tumor cells in human ovarian cancer〔J〕.Cancer Res,2002;62(20):5930-8.
10 Phillips RJ,Burdick MD,Lutz M,etal.The stromal derived factor-1/CXCL12-CXC chemokine receptor 4 biological axis in non-small cell lung cancer metastases〔J〕.Am J Respir Crit Care Med,2003;167(12):1676-86.
11 Barbero S,Bonavia R,Bajetto A,etal.Stromal cell-derived factor 1alpha stimulates human glioblastoma cell growth through the activation of both extracellular signal-regulated kinases 1/2 and Akt〔J〕.Cancer Res,2003;63(8):1969-74.
12 Müller A,Homey B,Soto H,etal.Involvement of chemokine receptors in breast cancer metastasis〔J〕.Nature,2001;410(6824):50-6.
13 Begley LA,Kasina S,Mehra R.CXCL5 promotes prostate cancer progression〔J〕.Neoplasia,2008;10(3):244-54.
14 Chin CC,Li JM,Lee KF,etal.Selective β2-AR blockage suppresses colorectal cancer growth through regulation of EGFR-Akt/ERK1/2 signaling,G1-phase arrest,and apoptosis〔J〕.J Cell Physiol,2016;231(2):459-72.
15 Hou X,Zhang Y,Qiao H.CCL18 promotes the invasion and migration of gastric cancer cells via ERK1/2/NF-κB signaling pathway〔J〕.Tumour Biol,2016;37(1):641-51.
16 Teng JA,Wu SG,Chen JX,etal.The activation of ERK1/2 and JNK MAPK signaling by insulin/IGF-1 is responsible for the development of colon cancer with type 2 diabetes mellitus〔J〕.PLoS One,2016;11(2):e0149822.
〔2015-12-17修回〕
(编辑 苑云杰)
The expression of CXCL12/CXCR4 axis in prostate cancer cells and its action mechanism on cells proliferation
QU Xiu-Sheng,LIU Yuan-Yuan,SUN Hua-Wei,etal.
Medical Oncology,the First Affiliated Hospital,Jiamusi University,Jiamusi 154002,Heilongjiang,China
Objective To test the expression of chemotactic factor CXCL12 and its receptor CXCR4 in DU145,PC-3 and LNCaP prostate cancer cell,and explore the effect and mechanism of human recombinant CXCL12 on the proliferation of cells mentioned above.Methods RT-PCR experiments were utilized to study the expression of CXCL12/CXCR4 in DU145,PC-3 and LNCaP cells;CCK-8 experiments were used to investigate the proliferative effects of human recombinant CXCL12 on DU145,PC-3 and LNCaP cells;Western blot experiments were performed to explore the effect of human recombinant CXCL12 on the expression of ERK and pERK.Results CXCL12 and CXCR4 were expressed in DU145,PC-3 and LNCaP cells.Human recombinant CXCL12 obviously promoted proliferative response on the three cell lines,which didn’t change the expression of ERK1/2 in DU145 cells,whereas up-regulated pERK1/2 expressionConclusions Prostate cancer cells express CXCL12 and its receptor CXCR4,CXCL12/CXCR4 axis contributes prostate cancer cells proliferation by activating MAPK/ERK signaling pathway.
Prostate cancer;CXCL12;CXCR4;ERK
国家自然科学基金面上资助项目(No.81272854);黑龙江省自然科学基金资助项目(No.D201129);佳木斯大学研究生科技创新项目(No.YM2016_006)
1 佳木斯大学基础医学院 2 海南医学院
王伟群(1974-),男,医学博士,副教授,硕士生导师,主要从事肿瘤病理生理学研究。 齐亚灵(1967-),女,医学博士,教授,博士生导师,主要从事肿瘤发病机制研究。
曲修胜(1979-),男,主治医师,主要从事肿瘤放化疗研究。
R737.25
A
1005-9202(2017)07-1568-03;
10.3969/j.issn.1005-9202.2017.07.003
