老年肿瘤患者术后急性肺纤维化的诊治
2017-04-20薛晓艳
刘 音,薛晓艳
(航天中心医院重症医学科, 北京 100049)
老年肿瘤患者术后并发急性肺纤维化并不常见,且起病隐匿,表现为进行性气急、呼吸困难、及以低氧血症为主的呼吸衰竭,双肺可闻及细湿啰音及干鸣音,有不同程度发绀,晚期可出现右心衰竭体征[1-3]。但病情进展迅速,死亡率高,应引起临床医师的重视。本文对2015年4月至2016年10月航天中心医院重症医学科收治的3例该类患者的临床特点、诊断、治疗方法及预后进行回顾性分析,以期为老年肿瘤术后突发急性肺纤维化患者的诊断和治疗提供依据。
1 临床资料
2015年4月至2016年10月本院重症学科共收治3例老年肿瘤术后急性肺纤维化患者。肺纤维化的诊断依据患者影像学表现。第1例患者既往因肺结核行右肺上叶切除术,术前CT提示存在右下叶胸膜下肺间质纤维化,但并未有明确感染灶;第3例病例为肺部占位手术患者,术前肺CT示两肺胸膜下可见间质增多,网格改变;二者入院痰培养、痰涂片未见阳性结果。二者高分辨率CT(high resolution CT,HRCT)符合2011年美国胸科学会(American Thoracic Society,ATS)/ 欧洲呼吸学会(European Respiratory Society,ERS)/日本呼吸学会(Japanese Respira Society, JRS)和拉丁美洲胸科学会(Latin American Thoracic Society, LATS)(ATS/ERS/JRS/LATS)发表的特发性肺纤维化诊治指南中对于特发性间质肺炎放射学表现的普通型间质性肺炎(usual interstitial pneumonia, UIP)描述[1,4],加之手术、输血等打击,考虑这二者为特发性间质肺炎急性加重、发展至急性肺间质纤维化。第2例患者为严重腹腔感染、同时入院胸片亦可见双肺感染灶,并不能完全排除急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的诊断,但该患者出现呼吸困难1天后HRCT就呈现出严重的肺间质纤维化,考虑与典型的ARDS肺纤维进展过程不符。这3例患者均在短期内发展至严重肺纤维化。
病例1,男,83岁,主因“便血5 d”入院,肠镜病理示:结肠中分化腺癌,行腹腔镜结肠癌根治手术。50年前曾因肺结核行右肺上叶切除术。此次术后第3日起患者感喘憋,呼吸困难,起始面罩给氧后经无创呼吸机辅助呼吸,后患者氧合仍进行性下降,术后第5日给予气管插管,机械通气;术后两周肺CT检查(图1B)示双肺广泛间质纤维化渗出等改变,合并局部肺部感染,考虑肺间质纤维化急性加重。立即给予激素甲泼尼龙500 mg/d,连续3 d,患者氧合改善不明显,第3日给予联合环磷酰胺 600 mg/d,及人免疫球蛋白20 g/d 减轻免疫反应,后停用激素,环磷酰胺400 mg/d,连用2 d,但在确诊急性肺间质纤维化后第6日,患者因病情进展多器官功能衰竭死亡,共住院26 d。

图1 患者1手术前后高分辨率CT影像变化
病例2,男,78岁,主因“腹痛伴间断恶心呕吐3 d”以“消化道穿孔”入院,行急诊腹腔镜探查术,术中见腹腔大量脓苔,诊断为直肠肿瘤伴坏死性穿孔,遂行直肠癌根治术、乙状结肠造瘘术。术后第4日拔管撤机,第5日病情反复,出现呼吸衰竭,氧合指数<100,储氧面罩吸氧,次日肺CT(图2B)示双肺间质炎症;考虑患者因急性肺损伤,诱发急性肺纤维化,并予以甲泼尼龙80 mg/d及环磷酰胺600 mg/d,连用3 d后减量至40 mg,环磷酰胺隔日应用,第3次时减量至400 mg,给予亚胺培南、利奈唑胺及卡泊芬净抗感染治疗;患者鼻导管吸氧,氧合指数恢复至约300,术后第11日复查肺CT(图2C)提示患者肺间质改变较前好转。但患者腹部感染控制不佳,血培养为革兰氏阴性杆菌,存在败血症、多器官功能衰竭,术后2周家属放弃治疗,自动出院。
病例3,男,73岁,主因“体检发现右肺占位1个月余”入我院行右肺中上叶、右肺下叶楔形切除术。病理示结直肠来源的中分化腺癌。术后当日脱机拔管。但渐感喘憋,逐渐调高吸氧浓度,至术后第4日夜间患者喘憋加重,呼吸急促且费力,双肺音粗,可闻及湿啰音。面罩吸氧升高至10 L/min,氧饱和度下降至85%,血气示:二氧化碳分压(carbon dioxide partial pressure,PCO2)37.6 mmHg,氧分压(oxygen partial pressure,PO2)54.7 mmHg,氧合指数<100,给予无创呼吸机辅助呼吸,术后第5日即行肺CT,显示急性肺间质纤维化改变。给予甲泼尼龙160 mg/d,联合环磷酰胺400 mg/2 d冲击治疗,激素连用5 d后减量至80 mg/d,环磷酰胺第2次给药时减量至每次200 mg,现患者仍处于治疗中,氧合指数已恢复至约300,呼吸困难较前明显好转。
3例患者均为高龄,既往肺功能基础较差,生活质量尚可,肺功能可代偿一般体力活动,但经过手术、全麻、气管插管、输血等应激因素打击下,诱发患者出现急性肺间质纤维化,表现为进行性呼吸衰竭。比较3例患者的预后,可发现起病3 d内启动激素和环磷酰胺治疗可明显改善氧合,缓解呼吸衰竭。
2 讨 论
原发性疾病手术及肿瘤性疾病如支气管肺泡癌、肺淋巴瘤等是引起急性肺纤维化的病因之一[1]。可能的机制为肺泡壁炎症诱发炎性免疫反应,刺激肺纤维母细胞分泌胶原蛋白进行肺间质组织的修补,造成肺结构紊乱;导致肺泡气体交换单元进行性丧失[2-4]。
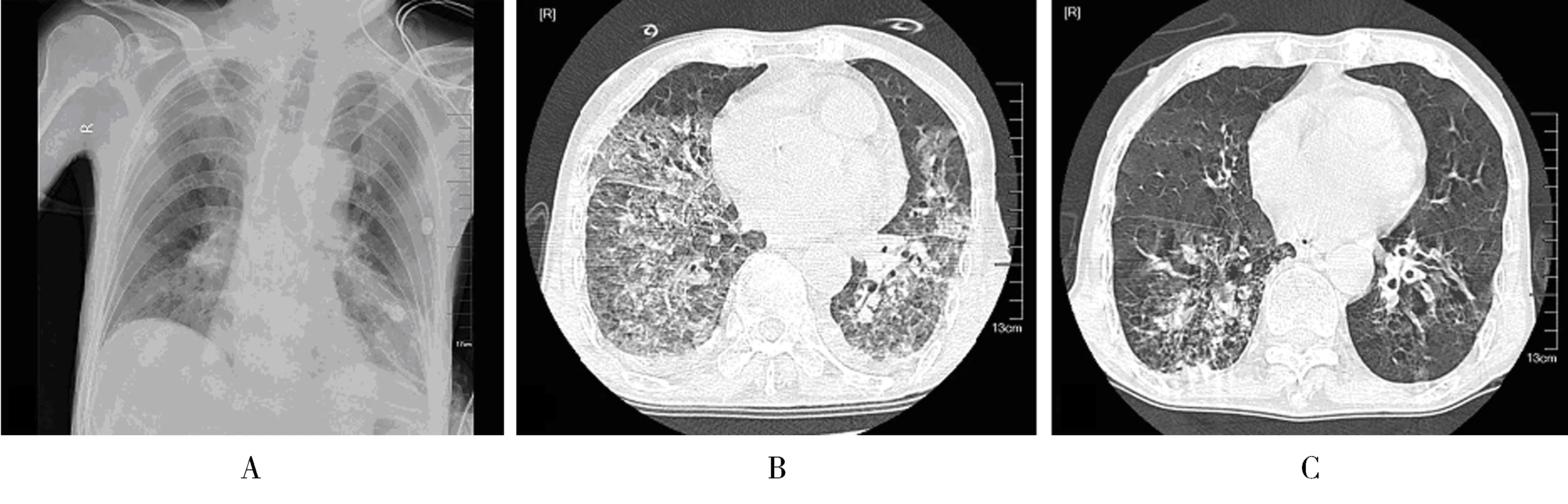
图1 患者2影像学演变

图3 患者3手术前后高分辨率CT影像变化
目前国内外对于急性肺纤维化、尤其是老年肿瘤术后患者突发肺纤维化的报道少之又少。对于该类患者的诊治,我们一方面以2011年ATS/ERS/JRS/LATS发布的《特发性肺纤维化诊治指南》为依据[2,4],另一方面又从国内众多百草枯中毒患者的急性肺纤维化救治报道中吸取经验[5-7]:病变可能与免疫介导的细胞损伤有关。糖皮质激素可(1)通过降低肺毛细血管通透性,减轻肺泡炎性渗出,抑制肺泡上皮细胞、内皮细胞凋亡,抑制炎症介质生成、释放和激活;(2)稳定细胞膜,对抗自由基损伤、增加肺泡表面活性物质;(3)产生强大的抗炎和非特异性免疫抑制作用,同时抑制成纤维细胞DNA合成和毛细血管增生,阻碍胶原沉积,抑制肺纤维化进程。免疫抑制药物如环磷酰胺、硫唑嘌呤和长春新碱等也可抑制炎症、免疫反应,被公认为是临床治疗肺纤维化的首选药物。目前有研究报道,与甲氨蝶呤或硫唑嘌呤相比,用环磷酰胺治疗能抑制几乎所有的细胞和体液免疫,缓解炎症的反应强度。此外,环磷酰胺可致白细胞减少,降低白细胞介素-1等细胞因子,减轻白细胞诱导的肺部炎症;抑制DNA合成,使肺纤维化患者肺活量得到更明显的改善[8]。但也有报道指出静脉应用环磷酰胺与口服硫唑嘌呤在肺功能参数和气体交换方面没有显著差异,而静脉注射环磷酰胺治疗可显著提高肺纤维化患者的存活率[9]。环磷酰胺和糖皮质激素联合使用,发挥协同作用,可降低死亡率,有效抑制肺纤维化[10]。
我们体会,对于老年肿瘤患者,尤其是既往肺功能差者,术前应仔细评估,积极控制炎症,术后出现氧合差、呼吸衰竭时,应尽量创造条件完善肺部影像学或支气管镜等检查,明确肺部情况变化。我们救治的患者1,术后3 d即开始出现呼吸困难等症状,至术后2周才完善CT,明确诊断,虽给予激素及环磷酰胺治疗,但最终患者仍因病情急剧进展而死亡,分析原因为肺纤维化已进展至晚期不可逆阶段。对于后两例患者,我们吸取第1例患者治疗经验,在病情变化时及时行肺CT检查,明确发生肺纤维化后即刻治疗,肺部情况明显好转。
对于激素及环磷酰胺的给药方式,我们认为第1例患者的序贯给药方式不如后两例患者同时给药效果佳。对于激素剂量选择,我们以国内2012年颁布的《糖皮质激素类药物临床应用指导原则》为依据[11],对于急危重症给予冲击剂量,所以患者1予以甲强龙500 mg/d冲击治疗,这有利于终止病变的急性恶化。而对于第2例和第3例患者,考虑到糖皮质激素和环磷酰胺同时给药的协同效应,我们给予了>1.0 mg/(kg·d)的大剂量治疗;环磷酰胺则按3~10 mg/kg给予。患者病情复杂,同时要考虑到患者的免疫力及当时的感染程度,我们认为剂量要个体化应用,不可一概而论。本文病例数量有限,尚需大样本临床研究进一步为急性肺纤维化诊疗提供依据。
由此可见,对于老年肿瘤术后患者急性肺纤维化,应提高认识,早诊断,在抗炎及支持治疗的同时,予以激素联合环磷酰胺个体化治疗,终止炎症介质的瀑布样反应,调节免疫极度紊乱,是治疗成功的关键因素。
【参考文献】
[1] 倪 楠, 林 琳. 特发性肺间质纤维化合并肺癌9例诊治体会[J]. 中华老年多器官疾病杂志, 2016, 15(2): 146-147. DOI: 10.11915/j.issn.1671-5403.2016.02.034.
Ni N, Lin L.Diagnosis and treatment of 9 cases of idiopathic pulmonary fibrosis with lung cancer[J]. Chin J Mult Organ Dis Elderly, 2016, 15(2): 146-147. DOI: 10.11915/j.issn.1671-5403.2016.02.034.
[2] Raghu G, Rochwerg B, Zhang Y,etal. An official ATS/ERS/JRS/ALAT clinical practice guideline: treatment of idiopathic pulmonary fibrosis. An update of the 2011 clinical practice guideline[J]. Am J Respir Crit Care Med, 2015,192(2): 3-19. DOI: 10.1164/rccm.201506-1063ST.
[3] 樊启民, 刘 芳. 浅析急性间质性肺炎的临床特征[J].中国卫生标准管理, 2013, 4(21): 5-7. DOI: 10.3969/J.ISSN.1674-9316.2013.21.002.
Fan QM, Liu F. The clinical features of acute interstitial pneumonia[J]. China Health Stand Manage, 2013, 4(21): 5-7. DOI: 10.3969/J.ISSN.1674-9316.2013.21.002.
[4] Raghu G, Collard HR, Egan JJ,etal. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011, 183(6): 788-824. DOI: 10.1164/rccm.2009-040GL.
[5] Lin JL, Lin-Tan DT, Chen KH,etal. Repeated pulse of methylprednisolone and cyclophosphamide with continuous dexamethasone therapy for patients with severe paraquat poisoning[J]. Crit Care Med, 2006, 34(2): 368-373.
[6] 朱 华.不同剂量激素联用环磷酰胺治疗百草枯中毒[J].皖南医学院学报, 2014, 33(4): 342-344. DOI: 10.3969/j.issn.1002-0217.2014.04.018.
Zhu H. Different dosage of glucocorticoid plus cyclophosphamide in treatment of paraquat poisoning[J]. J Wannan Med Coll, 2014, 33(4): 342-344. DOI: 10.3969/j.issn.1002-0217.2014.04.018.
[7] 李晓莉, 龚 媛, 张 浩, 等. 环磷酰胺对百草枯中毒致急性肺损伤的疗效及安全性分析[J].中国全科医学, 2013, 16(9): 3124-3125. DOI: 10.3969/j.issn.1007-9572.2013.26.065.
Li XL, Gong Y, Zhang H,etal.Effectiveness and safety of cyclophosphamide for treating patients with paraquat induced-acute lung injury[J]. Chin Gen Pract, 2013, 16(9): 3124-3125. DOI: 10.3969/j.issn.1007-9572.2013.26.065.
[8] Oda K, Yatera K, Fujino Y,etal. Efficacy of concurrent treatments in idiopathic pulmonary fibrosis patients with a rapid progression of respiratory failure: an analysis of a national administrative database in Japan[J]. BMC Pulm Med, 2016, 16(1): 1-9. DOI: 10.1186/s12890-016-0253-x.
[9] 张 蕾. 环磷酰胺治疗特发性肺纤维化的疗效观察[J]. 中国医院药学杂志, 2014, 34(5): 395-399. DOI: 10.13286/j.cnki.chinhosppharmacyj.2014.05.18.
Zhang L. Study on the effects of cyclophosphamide therapy in idiopathic pulmonary fibrosis[J].Chin Hosp Pharm J, 2014, 34(5): 395-39. DOI: 10.13286/j.cnki.chinhosppharmacyj.2014.05.18.
[10] 裴 俊. 间质性肺疾病药物治疗研究进展[J]. 中国现代药物应用, 2009, 3(18): 188-190. DOI: 10.3969/j.issn.1673-9523.2009.18.153.
Pei J. Research advances in pharmacotherapy of interstitial lung disease[J]. Chin J Mod Drug, 2009, 3(18): 188-190. DOI: 10.3969/j.issn.1673-9523.2009.18.153.
[11] 马志中, 王卫庆, 王建祥, 等. 糖皮质激素类药物临床应用指导原则[J]. 中华内分泌代谢杂志, 2012, 28(2): 1-32.
Ma ZZ, Wang WQ, Wang JX,etal. The clinical practice guidelines of glucocorticoid[J]. Chin J Endocrinol Metab, 2012,28(2): 1-32.
