老年慢性阻塞性肺疾病急性加重期营养不良干预与治疗的意义
2017-04-20薛运昕杨沈佳郭天聪边明艳孟晓丹
倪 楠,林 琳,薛运昕*,杨沈佳,宁 欣,郭天聪,边明艳,孟晓丹
(1辽宁省金秋医院呼吸内科,沈阳 110016;2中国医科大学附属第四医院普外科,沈阳 110016)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD) 是老年人常见疾病之一,病程长且逐年进展。老年COPD患者自身的生理特点及体内炎症因子的改变等因素可导致营养不良,并且急性加重期营养状况会进一步恶化。研究表明,住院COPD患者营养不良发生率达30%~60%,出院后也会有高达45%的患者存在营养不良[1,2]。营养不良会加速患者病程发展,缩短患者寿命,而合理的营养支持对改善患者营养状况、缓解病情、改善肺呼吸功能和预后有积极的作用[3]。因此,老年COPD患者的营养支持治疗已得到广泛关注。本研究通过对62例老年急性加重期COPD(acute exacerbation of COPD,AECOPD)合并营养不良或营养不良风险的患者在常规治疗基础上进行营养支持治疗,取得了满意疗效,现报道如下。
1 对象与方法
1.1 研究对象
入选2015年8月至2016 年8月辽宁省金秋医院呼吸内科的AECOPD患者62例。其中男性41例,女性21例,年龄65~87(74.46±5.33)岁,病程9~20年。纳入标准:所有患者均符合2013年中华医学会呼吸病分会制定《COPD 指南》[4]标准和2001年微型营养评价简表(short-form mini-nutritional assessment,MNA-SF)评分0~11分。62例患者按其意愿分为营养治疗组及对照组,各31例。
排除标准:(1)伴有严重基础疾病或脏器功能不全;(2)伴有其他呼吸系统疾病;(3)恶性肿瘤;(4)其他与营养代谢相关的疾病;(5)不能坚持治疗或治疗期间出现COPD急性加重;(6)患者意识障碍,依从性差;(7)对所用的营养制剂有胃肠道反应,如腹泻、呕吐及皮疹等过敏反应。
1.2 方法
两组患者均接受抗感染、吸氧、祛痰、平喘等COPD常规治疗,治疗时间为8周。在此基础上,对照组仅接受饮食指导,而营养治疗组由营养医师和主管医师共同对患者进行营养教育及给予专业的营养咨询,并制订营养支持治疗方案,通过口服或鼻胃(肠)管进行营养治疗。
对照组饮食指导如下:(1)尊重患者饮食习惯,发放常见食物营养成分表,指导患者按需更换食物种类及烹调方法;(2)嘱患者在日常饮食中适量增加瘦肉、鱼、蔬菜等高蛋白、高纤维素和高脂肪食物。
营养治疗组的营养支持疗法包括以下几个方面:(1)根据Harris-Benedict方程计算每日基础能量消耗(basic energy expenditure,BEE)。男:BEE=66.473+13.751 6×体质量(kg)+5.003 3×身高(cm)-4.675 6×年龄;女:BEE=66.595+9.563 4×体质量(kg)+1.896×身高(cm)-4.675 6×年龄。每日热量供应(kcal)=BEE×1.16×1.1×1.3,其中,系数1.1为使患者的体质量下降得以纠正,应增加的10%BEE;系数1.3为轻度活动系数[5]。通常脂肪供给占总能量的50%~55%,糖类供给占30%~35%,蛋白质供给占15%~20%[6]。(2)根据患者营养不良的程度及体质状况,制订个体化的营养支持治疗方案。包括营养教育、安排食谱等。(3)若普通饮食不能满足患者的热量需求,给予口服整蛋白肠内营养补充剂(安素或能全力)。
1.3 观察指标
营养支持治疗过程中记录发生的不良反应及病情急性加重情况。在治疗前1天及治疗后8周对患者各做1次评估。(1)人体测量:应用卷尺测量肱三头肌皮褶厚度(triceps skin fold,TSF)、上臂围长(mid-arm circumference,MAC)、体质量指数(body mass index,BMI)。(2)实验室检查:所有受试者空腹12 h,清晨取肘静脉血,测量血清总蛋白(total protein,TP)、血清白蛋白(serum albumin,ALB)、血红蛋白(hemoglobin,Hb)等。(3)肺功能检查:应用德国产Jeager肺功能仪测定,第1秒用力呼气容积(forced expiratory volume in the fisrt second,FEV1)、用力肺活量(forced vital capacity,FVC)和实测第1秒用力呼气容积与预计第1秒用力呼气容积的比值(实测FEV1/预计FEV1)。(4)生活质量以圣乔治呼吸问卷(St.George’s Respiratory Questionnaire,SGRQ)判定,包括症状评分、活动评分及疾病对患者日常社会活动和心理的影响评分3个问卷,得分越低表明生活质量越高。
1.4 统计学处理
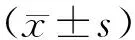
2 结 果
2.1 两组治疗前后人体测量指标比较
治疗前两组患者的TSF、MAC及BMI差异无统计学意义(P>0.05);治疗后两组的TSF、MAC及BMI均较治疗前明显增加,差异有统计学意义(P<0.05),且营养治疗组治疗后的TSF、MAC及BMI增加程度高于对照组,差异有统计学意义(P<0.05;表1)。
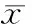
表1 两组治疗前后TSF、MAC及BMI比较
TSF: triceps skin fold; MAC: mid-arm circumference; BMI: body mass index. Compared with before treatment,*P<0.05; compared with control group,#P<0.05
2.2 两组治疗前后实验室检查指标比较
治疗前两组患者的TP、ALB及Hb水平差异无统计学意义(P>0.05);治疗后两组的TP、ALB及Hb均较治疗前明显改善,差异有统计学意义(P<0.05),且治疗后营养治疗组TP、ALB及Hb的改善程度均高于对照组,差异有统计学意义(P<0.05;表2)。
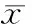
表2 两组治疗前后TP、ALB及Hb比较
TP: total protein; ALB: serum albumin; Hb: hemoglobin. Compared with before treatment,*P<0.05; compared with control group,#P<0.05
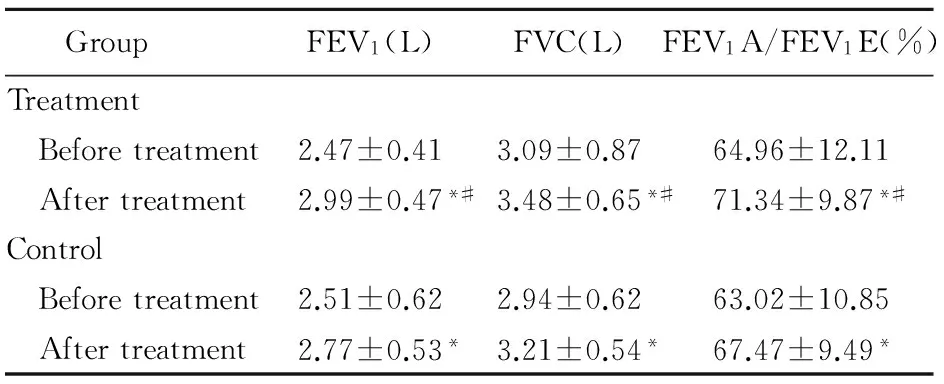
2.3 两组治疗前后肺功能指标比较
治疗前两组患者的肺功能指标差异无统计学意义(P>0.05);治疗后两组的肺功能均较治疗前明显改善,差异有统计学意义(P<0.05),且营养治疗组肺功能改善程度明显高于对照组,差异有统计学意义(P<0.05;表3)。
2.4 两组治疗前后生活质量比较
两组治疗前SGRQ问卷总分差异无统计学意义(P>0.05);治疗8周后,两组SGRQ总分均显著下降(P<0.01),且营养治疗组总分显著低于对照组,差异有统计学意义(P<0.01;表4)。
表3两组治疗前后肺功能比较
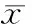
Group FEV1(L)FVC(L)FEV1A/FEV1E(%)Treatment Beforetreatment2.47±0.413.09±0.8764.96±12.11 Aftertreatment2.99±0.47*#3.48±0.65*#71.34±9.87*#Control Beforetreatment2.51±0.622.94±0.6263.02±10.85 Aftertreatment2.77±0.53*3.21±0.54*67.47±9.49*
FEV1A: actual FEV1; FEV1E: expected FEV1; FVC: forced vital capacity. Compared with before treatment,*P<0.05; compared with control group,#P<0.05
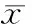
表4 两组治疗前后SGRQ评分比较
SGRQ: St.George’s Respiratory Questionnaire. Compared with before treatment,**P<0.01; compared with the control group,##P<0.01
3 讨 论
COPD是常见的老年肺部疾病,老年COPD患者常因各种原因伴有不同程度的营养不良。营养不良是 COPD 预后不良的独立因子[7]。目前研究表明,营养不足与老年COPD患者日常饮食摄入不足、抵抗力较低、多易合并感染、 焦虑等因素有关,这些因素导致机体能量消耗较大、蛋白质合成障碍及蛋白降解加速及代谢平衡紊乱[8,9];还可能与某些细胞因子有关[10]。
许多研究证实[11,12],营养不良是影响COPD患者结局的主要不利因素之一[13]。(1)营养不良可导致呼吸肌(尤其是膈肌) 萎缩和呼吸肌力减弱,降低呼吸肌功能,改变其固有结构,并最终发展为呼吸肌疲劳和呼吸肌衰竭。(2)营养不良可引起中枢神经驱动不足和呼吸肌的肌力不足,对缺氧的反应能力下降,因而难以迅速调节呼吸以适应机体对氧的需求,从而使呼吸衰竭进一步加重。(3)营养不良者全身和呼吸道免疫防御功能减弱,以细胞性免疫功能降低最明显。低体质量和营养不良是老年 COPD 患者预后和运动能力恢复的不良因素。
本研究表明,老年COPD合并营养不良及营养不良风险患者通过科学的营养支持治疗,一方面患者TSF、MAC、BMI, TP、ALB、Hb均升高,且较普通饮食指导的对照组升高更明显;另一方面对其肺功能改善也有明显益处,营养治疗组较对照组的肺通气功能指标得到更明显改善,阻止了呼吸系统进行性减退,与相关研究结果一致[14,15]。ALB是血清总蛋白的主要蛋白质成分,在维持血液胶体渗透压、营养均衡及体内代谢物质运输等方面均有重要作用。研究表明,血清ALB水平下降与稳定期COPD分级明显相关[16]。BMI<21 kg/m2患者的死亡风险明显高于BMI≥21 kg/m2的患者,提示BMI是影响COPD预后的独立因素[17]。伴有营养不良的COPD患者FEV1% 与FVC显著低于营养状况正常的COPD患者,其FEV1与FVC随实际体质量和标准体质量的百分比降低而降低,两者之间呈显著正相关[18]。本研究结果虽然提示营养状态改善可能是导致肺通气功能改善的原因,但并不能确定是营养状态单一因素致使患者肺功能好转,还是患者先出现肺功能改善后,机体缺氧纠正致使其营养摄入、蛋白质等营养物质生成增加而导致的好转,笔者认为这是一个良性循环过程。
本研究表明经营养治疗后COPD患者的生活质量提高,且营养治疗组患者的生活质量提高程度高于对照组。因此,如果能对COPD患者及时进行营养评估,及早进行营养支持治疗,并在饮食基础上经口给予营养补充剂,增加其氮及能量摄入,减少肌肉流失,使他们缓慢持续获得体质量,不仅可改善营养状态,而且还可维护器官、组织的免疫功能,促进脏器、组织恢复,减少并发症、降低患者的住院率和病死率,提高生存质量、缩短住院时间和节省住院费用[19]。
合理的营养治疗原则对于改善COPD患者的营养状态至关重要。有研究人员认为[20],为了防止过多的糖份摄入产生大量CO2,加重呼吸衰竭,对COPD患者应给予低糖的营养支持;COPD患者分解代谢强,蛋白质补充不足会发生低氧血症及低碳酸血症,因此需要高蛋白质的营养支持。同时COPD患者通过饮食适量补充不饱和脂肪酸有利于肺表面活性物质的生成,减少高糖负荷和蛋白质摄入,有利于脂溶性维生素的吸收和利用。但若营养支持中脂肪比例过高,可能会引起高脂血症、血黏度增高、红细胞膜被脂肪覆盖,甚至脂肪栓形成,影响气体弥散及运输,以及形成肺动脉高压,因此,需要适当高脂肪的营养支持。当然,也有很多研究指出,增加饮食中膳食纤维的摄入量,如增加每日蔬菜水果的摄入量,可以降低COPD发病风险,改善肺功能,对老年COPD患者的营养状况改善会有很大帮助[21]。新鲜蔬菜水果中含有多种维生素,具有较强的抗氧化作用,可以帮助清除体内的氧自由基,保护肺组织免受氧化物质的损害,促进肺功能康复[22]。
综上,营养支持治疗对改善老年COPD患者全身状态及预后有显著作用,可提高患者的生活质量。但在目前的临床工作中,专科医师对疾病的专科治疗重视有余,而对与疾病密切相关的营养风险筛查、评估及干预治疗的重要性认识不足,营养治疗尚未规范化,因此,除常规治疗外,营养支持治疗也格外重要,呼吸内科医师应重视COPD患者的综合治疗。
【参考文献】
[1] Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis[J]. Respirology, 2013,18(4): 616-629. DOI: 10.1111/resp.12070.
[2] Correia MI, Hegazi RA, Diaz-Pizarro Graf JI,etal. Addressing disease-related malnutrition in healthcare: a Latin American perspective[J]. JPEN J Parenter Enteral Nutr, 2016, 40(3): 319-325. DOI: 10.1177/0148607115581373.
[3] Yu G, Chen G, Huang B,etal. Effect of early enteral nutrition on postoperative nutritional status and immune function in elderly patients with esophageal cancer or cardiac cancer[J]. Chin J Cancer Res, 2013, 25(3): 299. DOI: 10.3978/j.issn.1000-9604.2013.06.01.
[4] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 255-264. DOI: 10.3760/cma.j.issn.1001-0939.2013.04.007.
Chronic Obstructive Pulmonary Disease Group of Chinese Thoracic Society. Guideline for Chronic Obstructive Pulmonary Disease (revised 2013)[J]. Chin J Tuberc Respir Dis, 2013, 36(4): 255-264. DOI: 10.3760/cma.j.issn.1001-0939.2013.04.007.
[5] 蔡柏蔷,李龙芸. 协和呼吸病学[M]. 北京: 中国协和医科大学出版社, 2005: 549.
Cai BQ, Li LY. PUMC Respirology[M]. Peking: Peking Union Medical College Press, 2005:549.
[6] Vestbo J, Hurd SS, Rodriguez-Roisin R; GOLD Science Com-mittee. An overview of global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease (GOLD)(revised 2011)[J]. Chin Med J, 2012, 92(14): 937.
[7] Cole CG. Surrogates of mortality in chronic obstructive pulmonary disease[J]. Am J Med, 2006, 119(10): 54-62. DOI: 10.1016/j.amjmed.2006.08.008.
[8] Fried TR, Vaz Fragoso CA, Rabow MW. Caring for the older person with chronic obstructive pulmonary disease[J].JAMA, 2012, 308(12): 1254. DOI: 10.1001/jama.2012.12422.
[9] Romme EA, Rurlten EP, Smeenk FW,etal. Vitamin D status is associated with bone mineral density and functional exercise capacity in patients with chronic obstructive pulmonary disease[J]. Ann Med, 2012, 45(1): 91-96. DOI: 10.3109/07853890.2012.671536.
[10] 张建仪. 营养支持治疗对老年慢性阻塞性肺疾病影响的临床观察[J]. 齐齐哈尔医学院学报, 2015, 36(4): 537-538.
Zhang JY. Clinical observation of nutritional support treatment for chronic obstructive pulmonary disease in elderly patients[J]. J Qiqihar Med School, 2015, 36(4): 537-538.
[11] Carreia MI, Waltzberg DL. The impact of malnutrition on morbidity, mortality, length of hospital stay and costs evaluated through a multivariate model analysis[J]. Clin Nutr, 2003, 22(3): 235-239. DOI: 10.1016/S0261-5614(02)00215-7.
[12] Montero PM, Garcia LM,Carpintero BP. Malnutrition as a prognostic factor in elderly patients with hip fractures[J]. Med Clin(Barc), 2007, 128(19): 721-725. DOI: 10.1157/13106126.
[13] 刘文沛, 贺程远, 薛 颖. 慢性阻塞性肺疾病(COPD) 住院患者营养状况调查分析[J]. 世界最新医学信息文摘, 2015, 15(58): 15-16. DOI: 10.3969/j.issn.1671-3141.2015.58.009.
Liu WP, He CY, Xue Y. Survey of nutritional status of hospita-lized patients with chronic obstructive pulmonary disease[J]. Dig World Latest Med Inf, 2015, 15(58): 15-16. DOI: 10.3969/j.issn.1671-3141.2015.58.009.
[14] 马 刚. 慢性阻塞性肺疾病住院患者营养风险与肺功能关系的研究[J]. 中国医药指南, 2014, 12(11): 57-58.
Ma G. Nutritional risk and pulmonary function in hospitalized patients with chronic obstructive pulmonary disease[J]. Guide Chin Med, 2014, 12(11): 57-58.
[15] 王敏红, 缪琪蕾, 莫丽亚. 营养支持治疗在老年慢性阻塞性肺疾病中的应用[J]. 实用临床医药杂志, 2013, 17(24): 41-44.
Wang MH, Miao QL, Mo LY. Application of nutritional support in chronic obstructive pulmonary disease in the elderly[J]. J Clin Med Prac, 2013, 17(24): 41-44.
[16] 徐 英, 王永秀. 血清白蛋白与稳定期慢性阻塞性肺疾病分级关系的探讨[J].现代临床医学, 2009, 35(1): 24.
Xu Y, Wang YX. Association of serum albumin and grading of chronic obstructive pulmonary disease in stable state[J]. J Clin Exp Med, 2009, 35(1): 24.
[17] 邱桂凤, 曾伟光, 杨 曦, 等. 探讨慢性阻塞性肺疾病患者体重指数与肺功能指标的相关性[J]. 临床肺科杂志, 2012, 17(8): 1546.
Qiu GF, Zeng WG, Yang X,etal. The association between BMI and indices of pulmonary function in patients with chronic obstructive pulmonary disease[J]. J Clin Pulmon Med, 2012, 17(8): 1546.
[18] 任立新, 杨敬平, 剖鹏珍, 等. 营养支持与呼吸操提高COPD患者生存质量的探讨[J].临床肺科杂志, 2006, 11(3): 331-332.
Ren LX, Yang JP, Pou PZ,etal. Nutritional support and respiratory exercise improve life quality of COPD patients[J]. J Clin Pulm Med, 2006, 11(3): 331-332.
[19] Monto AS. The seasonality of rhinovirus infections and its implications for clinical recognition[J]. Clin Ther, 2002, 24(12): 1987-1997. DOI: 10.1016/S0149-2918(02)80093-5.
[20] Cai B, Zhu Y, Ma Yi,etal. Effect of supplementing a high-fat, low-carbohydrate enteral formula in COPD patients[J]. Nutrition, 2003, 19(3): 229-232. DOI: 10.1016/S0899-9007(02)01064-X.
[21] Fonseca Wald EL, van den Borst B, Gosker HR,etal. Dietary fibre and fatty acids in chronic obstructive pulmonary disease risk and progression: a systematic review[J]. Respirology, 2014, 19(2): 176-184. DOI: 10.1111/resp.12229.
[22] Root MM, McGinn MC, Nieman DC,etal. Combined fruit and vegetable intake is correlated with improved inflammatory and oxidant status from a cross-sectional study in a community setting[J]. Nutrients, 2012, 4(1): 29-41. DOI: 10.3390/nu4010029.
