艾塞那肽通过抑制黄嘌呤氧化酶-活性氧类降低内皮细胞缺氧复氧损伤
2017-04-20王红雷韩延辉贾静静来利红朱继红董平栓
王红雷,韩延辉,贾静静,来利红,朱继红,董平栓
(河南科技大学第一附属医院心血管内科,洛阳 471003)
经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是目前治疗急性心肌梗死(acute myocardial infarction,MI)的最有效手段[1,2]。然而开通血管后,虽然消除了血管的机械性阻塞,但远端的分支及末端微血管并未得到有效灌注[3],各分支血管供应的心肌组织仍处于缺氧状态,甚至开通血管后,梗死面积进一步扩大,即PCI术后的缺血/再灌注损伤(ischemia/reperfusion injury,IRI)[4]。IRI的发生减少了血运重建带给患者的益处。再灌注阶段活性氧类(reactive oxygen species,ROS)的爆发以及随后发生的细胞凋亡是IRI发生重要因素。冠状动脉分支末梢的心肌微血管内皮细胞(cardiac microvascular endothelial cells,CMEC)是血管与心肌细胞之间的第1道屏障,在IRI发生时最早受到影响[5,6]。因此,在防治PCI术后的二次打击中,降低IRI诱导的CMEC氧化应激损伤起到至关重要的作用。胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)是由肠道内分泌细胞分泌的肠促胰岛素,可被二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)迅速降解[7,8]。艾塞那肽(exenatide,Exe)是GLP-1受体激动剂,能更好地耐受DPP-4降解,使低血糖事件发生率降低[9]。此外,Exe还具有减少心肌梗死面积、抑制心肌细胞凋亡等作用[10,11]。但Exe对IRI诱导的CMEC氧化应激损伤的保护机制尚未完全明确。因此,我们通过建立体外缺氧复氧模型(hypoxia/reoxygenation model,H/R),探究氧化应激损伤诱导CMEC凋亡的信号通路及Exe的保护机制。
1 材料与方法
1.1 试剂与仪器
小干扰RNA(small interfering RNA,siRNA)(Santa Cruz,上海),一抗黄嘌呤氧化酶(xanthine oxidase,XO)(1∶1000,Abcam,上海),β-actin(1∶2000,Santa Cruz,上海),Fura-3AM荧光探针试剂盒和DCFH-DA荧光探针试剂盒(Molecular probe,美国),JC-1染色试剂盒(碧云天,上海)。共聚焦显微镜(OLYMPUS DX51,日本),酶标仪(Epoch 2,美国)。
1.2 CMEC的提取及鉴定
在文献基础上进行改良[12]。5只5~6 d的SD大鼠处死后取出左心室,75%乙醇中浸泡15 s,清洗后剪碎,采用I型胶原酶和胰蛋白酶37℃水浴消化10 min,离心后重悬于培养液中,培养4 h,去除悬浮未贴壁的细胞。细胞固定封闭后,分别滴加Ⅷ因子多克隆抗体和CD31单克隆抗体(均为1∶100),孵育过夜。倒置荧光显微镜观察,计数3个视野及均数。
1.3 H/R模型的建立以及Exe干预
CMEC缺氧处理4 h,换氧含量正常的复箱放置4 h,建立H/R模型。为了考察Exe对H/R模型的影响,分别5组:正常对照组、H/R模型组、1 nmol/L Exe组、10 nmol/L Exe组和100 nmol/L Exe组。采用完全培养基[20%胎牛血清(fetal bovine serum,FBS)+高糖DMEM)], 37°C、5% CO2条件下放置12 h。
1.4 Ca2+和siRNA干扰技术对H/R模型的影响
1.4.1 Ca2+对XO表达量的影响 采用Western blotting检测XO的表达量。分为5组:正常对照组、H/R 模型组、H/R+Exe组、H/R+BAPTA组和H/R+Iono组。其中BAPTA为胞浆Ca2+螯合剂,而Iono为胞浆Ca2+激活剂。
1.4.2 siRNA干扰技术对ROS的影响 为证实XO是胞浆过量ROS的主要来源,采用2’,7’-二氯荧光黄双乙酸盐(DCFH-DA)荧光探针检测各组胞浆ROS荧光强度,分为5组:正常对照组、H/R模型组、H/R+Exe组、H/R+siRNA组和H/R+siRNA对照组。其中H/R+siRNA组采用siRNA干扰技术敲低XO蛋白。将SD大鼠XO的siRNA序列修改为5’-CCACCUCCAAGAUUCAUAUTT-3’。CMEC细胞培养至80%融合,梯度更换低浓度血清培养基,培养24 h并同步化细胞。加入Lipo2000 和对应的siRNA,确定最终转染时间。XO表达的抑制时间为48 h。
1.5 ROS对线粒体结构和功能的影响
分为6组:正常对照组、H/R模型组、H/R+Exe组、H/R+siRNA组、H/R+siRNA对照组和H/R+N-乙酰半胱氨酸(NAC)组。其中NAC为胞浆ROS清除剂。
1.5.1 JC-1染色 依据JC-1染料在正常细胞线粒体中为红色荧光、而在受损线粒体中为绿色荧光的特质,考察ROS对线粒体结构和功能的影响。各组中添加JC-1 染料于37℃条件下孵育30 min,荧光显微镜下拍照。Jmage Pro软件荧光半定量检测膜电位。使用四甲基若丹明乙酯酸铵染料,于细胞处理结束后,添加染料与细胞共同孵育30 min,随后用酶标仪测定520 nm 处吸光度值(A520 nm),计算相对值为膜孔道开放程度。
1.5.2 细胞色素-C释放 细胞色素-C(cytochrome-C, Cyt-C)释放是线粒体膜电位受损、膜孔道开放比例增加的结果。在培养板中将已爬好细胞的玻片用4%的多聚甲醛固定爬片15 min;0.5% Triton X-100室温通透20 min;在玻片上滴加正常山羊血清,室温封闭30 min;吸水纸吸掉封闭液,滴加足够量稀释好的Cyt-C一抗并放入湿盒,4℃孵育过夜;加荧光二抗;滴加DAPI避光孵育5 min,对标本进行染核,封片。共聚焦显微镜观察并检测caspase-3和caspase-9的活性。
1.6 TUNEL检测
处理组:50 μl脱氧核苷酸末端转移酶(terminal deoxynucleotidyl transferase,TdT)+450 μl荧光素标记的脱氧尿嘧啶核苷三磷酸(dUTP)。对照组:50 μl 荧光素标记的dUTP。37℃孵育细胞30 min,50 μl TdT介导的dUTP 缺口末端标记测定法(TdT-mediated dUTP nick end labeling,TUNEL)反应混合液加入标本中,暗湿盒中反应60 min。每组细胞随机选10个不同视野,荧光显微镜下计数凋亡细胞均值,重复3次。
1.7 免疫荧光检测
细胞爬片固定、通透、封闭后,分别加入CD31抗体(1∶500,Abcam)、Ⅷ因子(1∶1000,Abcam)和Cyt-C(1∶500,Abcam)孵育, 4℃过夜,加入驴抗兔二抗(1∶2000,Sigma),孵育2 h。加细胞核染料4’,6-二脒基-2-苯基吲哚(DAPI)后孵育3 min,荧光显微镜观察。
1.8 统计学处理

2 结 果
2.1 CMEC的培养、鉴定及Exe对CMEC的毒性作用
CMEC于培养瓶中贴壁生长24 h后逐渐铺展;72~96 h铺满瓶底,呈典型铺路石样结构。CD31和Ⅷ免疫细胞荧光染色检测结果显示,双阳性率>95%,证实为CMEC(图1)。MTT检测示,各组细胞细胞间活性差异无统计学意义(图2)。
2.2 Exe对H/R诱导的细胞凋亡的影响
与正常组相比,H/R模型组表现为TUNEL绿色荧光显著增强。予以Exe预处理 12 h,其以浓度依赖的方式降低TUNEL绿色荧光(P<0.05)[13]。荧光半定量实验结果表明,10 nmol/L为Exe的最佳抗凋亡浓度,因此作为后续干预的最佳处理条件(图3)。
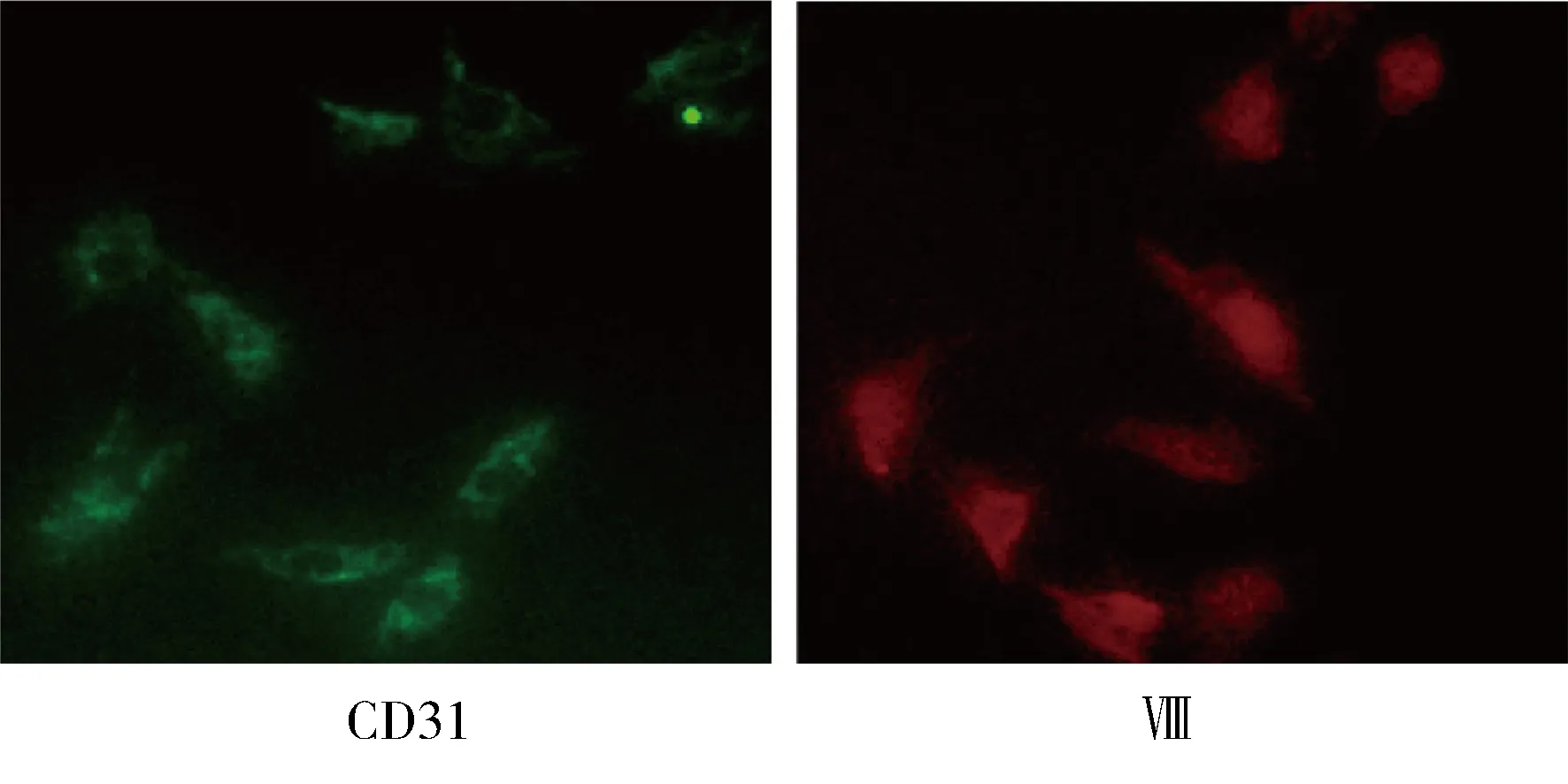
图1 CMEC的免疫组织化学染色鉴定Figure 1 Identification of CMEC by immunohistochemistry (×400) CMEC: cardiac microvascular endothelial cells

图2 Exe对CMEC活性的影响Figure 2 Effect of Exe on cell viability (n=3) Exe: exenatide; CMEC: cardiac microvascular endothelial cells
2.3 Ca2+对H/R模型内XO表达量的影响
与H/R组和H/R+Iono组相比,H/R+Exe组和H/R+BAPTA组的XO表达量均显著降低,差异均具有统计学意义(P<0.05;图4)。
2.4 siRNA干扰技术对H/R模型内ROS的影响
与H/R组和H/R+siRNA对照组相比,H/R+Exe组和H/R+siRNA组的ROS荧光强度均显著降低,差异均具有统计学意义(P<0.05;图5)。
2.5 JC-1染色结果
与H/R组和H/R+siRNA对照组相比,H/R+Exe组、H/R+siRNA组和H/R+NAC组的线粒体膜电位均显著增加,而膜孔道开放程度均显著降低,差异均具有统计学意义(P<0.05;图6)。
2.6 Cyt-C释放
通过共聚焦显微镜观察Cyt-C的亚细胞定位发现,H/R损伤模型导致Cyt-C荧光在胞质内呈弥散状分布,并伴随caspase-3和caspase-9活性的显著上升,提示H/R模型使得线粒体凋亡通路激活。而与H/R组和H/R+siRNA对照组相比,H/R+Exe组、H/R+siRNA组和H/R+NAC组均可在一定程度上减少Cyt-C的释放,并伴随caspase-3和caspase-9活性显著降低,差异均具有统计学意义(P<0.05;图7)。

图3 Exe对H/R诱导的CMEC凋亡的影响Figure 3 Effect of Exe on apoptosis of CMEC induced by H/R A: results of staining (TUNEL ×200); B: quantitative analysis (n=5). Exe: exenatide; H/R: hypoxia/reoxygenation model; CMEC: cardiac microvascular endothelial cells. Compared with control group, *P<0.05; compared with H/R group, #P<0.05
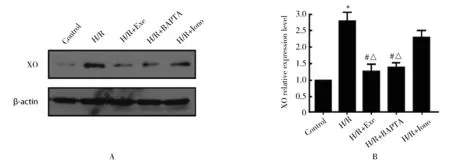
图4 Ca2+对XO表达量的影响Figure 4 Influence of Ca2+ on expression of XO (n=3) A: western blotting; B: quantitative analysis. XO: xanthine oxidase; Exe: exenatide; H/R: hypoxia/reoxygenation model. Compared with control group, *P<0.05; compared with H/R group, #P<0.05; compared with H/R+Iono group, △P<0.05

图5 siRNA干扰技术对ROS荧光强度的影响Figure 5 Influence of siRNA on intensity of ROS (n=5)
ROS: reactive oxygen species; Exe: exenatide; H/R: hypoxia/reoxygenation model. Compared with control group,*P<0.05; compared with H/R group,#P<0.05; compared with H/R+siCtrl group,△P<0.05
3 讨 论
尽管PCI术能迅速开通堵塞血管、恢复冠状动脉血流灌注,但也增加了组织发生IRI的可能[14,20]。ROS爆发可导致组织细胞呈现氧化应激状态,是损伤细胞亚结构、诱导细胞进入程序性死亡的关键点[15]。
内皮细胞中ROS的来源较多,如线粒体呼吸链损伤、胞浆中的XO,以及蛋白底物代谢过程中产生的负离子电荷[16,17]。内皮细胞中线粒体的含量相对缺乏,在CMEC中,线粒体主要作为信号传导器发挥作用。已有研究证实[18],在黄嘌呤脱氢酶大量转变为XO、以及XO自身转录增加的作用下,H/R环境中XO的表达量显著升高,其生成的ROS最终可诱导细胞凋亡的发生。
正常情况下,胞浆和线粒体内ROS的生成和清除处于动态平衡,但在病理情况下,CMEC胞浆的ROS生成过量,渗漏进入线粒体,导致线粒体呼吸链Ⅰ~Ⅳ型复合物的氧化,发生电子传递功能障碍,线粒体膜电位下降导致膜孔道开放,线粒体内膜与Cyt-C结合力下降,渗漏至胞浆,从而激活caspase-9/3线粒体凋亡蛋白家族[16]。已有研究证实[17],H2O2诱导的干细胞氧化应激损伤模型可以激活线粒体经典凋亡通路、诱导干细胞凋亡,这一过程也是通过上述途径完成的。而予以Exe则可逆转这一损伤过程,显著降低干细胞凋亡。本研究证实,在CMEC的H/R损伤过程中,施加Exe预处理能够有效逆转XO-ROS诱导的线粒体损伤。

图6 JC-1染色结果及mPTP开放程度检测Figure 6 Results of JC-1 staining and mPTP tests A: results of staining (×200); B: quantitative analysis. Exe: exenatide; H/R: hypoxia/reoxygenation model; mPTP: mitochondrial permeability transition pore. Compared with control group, *P<0.05; compared with H/R group, #P<0.05; compared with H/R+siCtrl group, △P<0.05

图7 Cyt-C释放检测结果Figure7 Results of Cyt-C discharge A: results of staining (×400); B: quantitative analysis (n=5). Exe: exenatide; H/R: hypoxia/reoxygenation model. Compared with control group, *P<0.05; compared with H/R group, #P<0.05; compared with H/R+siCtrl group, △P<0.05
Exe为GLP-1受体激动剂,作用于胰岛细胞,降糖作用明显[18]。近年来的研究发现[19],在循环血液中,Exe还可以与心脏上的GLP-1受体结合,进入细胞内,发挥抗凋亡作用,主要通过Camp/PKA信号转导途径,可显著改善线粒体功能。
综上所述,本研究证实了H/R损伤模型通过激活XO-ROS损伤信号,激活线粒体凋亡通路,引起CMEC结构和功能障碍。而予以Exe预处理可有效逆转此损伤信号通路,降低细胞的氧化应激损伤,提示Exe在I/R损伤过程中具有保护作用,不仅丰富了临床药物选择范围,也为应用Exe提供了可靠的理论基础。
【参考文献】
[1] Wong DT, Puri R, Richardson JD,etal. Myocardial ‘no-reflow’ — diagnosis, pathophysiology and treatment[J]. Int J Cardiol, 2013, 167(5): 1798-1806. DOI: 10.1016/j.ijcard.2012.12.049.
[2] Schwartz BG, Kloner RA. Coronary no-reflow[J]. J Mol Cell Cardiol, 2012, 52(4): 873-882. DOI: 10.1016/j.yjmcc.2011.06.009.
[3] Niccoli G, Kharbanda RK, Crea F,etal. No-reflow: again prevention is better than treatment[J]. Eur Heart J, 2010, 31(20): 2449-2455. DOI: 10.2174/1570161111311020014.
[4] Chen Y, Wang C, Yang X,etal. Independent no-reflow predictors in female patients with ST-elevation acute myocardial infarction treated with primary percutaneous coronary intervention[J]. Heart Vessels, 2012, 27(3): 243-249. DOI:10.1007/s00380-011-0144-2.
[5] Ndrepepa G, Tiroch K, Fusaro M,etal. 5-year prognostic value of no-reflow phenomenon after percutaneous coronary intervention in patients with acute myocardial infarction[J]. J Am Coll Cardiol, 2010, 55(21): 2383-2389. DOI: 10.1016/j.jacc.2009.12.054.
[6] Chan W, Stub D, Clark DJ,etal. Usefulness of transient and persistent no-reflow to predict adverse clinical outcomes following percutaneous coronary intervention[J]. Am J Cardiol, 2012, 109(4): 478-485. DOI: 10.1016/j.amjcard.2011.09.037.
[7] MacDonald PE, El-Kholy W, Riedel MJ,etal. The multiple actions of GLP-1 on the process of glucose-stimulated insulin secretion[J]. Diabetes, 2002, 51(Suppl 3): S434-S442. DOI: 10.2337/diabetes.51.2007.S434.
[8] Ryder RE. The potential risks of pancreatitis and pancreatic cancer with GLP-1-based therapies are far outweighed by the proven and potential (cardiovascular) benefits[J]. Diabet Med, 2013, 30(10): 1148-1155. DOI: 10.1111/dme.12301.
[9] Pratley RE, Reusch JE, Fleck PR,etal. Efficacy and safety of the dipeptidyl peptidase-4 inhibitor alogliptin added to pioglitazone in patients with type 2 diabetes: a randomized, double-blind, placebo-controlled study[J]. Curr Med Res Opin, 2009, 25(10): 2361-2371. DOI: 10.1185/03007990903156111.
[10] Lee CH, Yan B, Yoo KY,etal. Ischemia-induced changes in glucagon-like peptide-1 receptor and neuroprotective effect of its agonist, exendin-4, in experimental transient cerebral ischemia[J]. J Neurosci Res, 2011, 89(7): 1103-1113. DOI: 10.1002/jnr.22596.
[11] Frezza EE, Wachtel MS, Chiriva-Internati M. The multiple faces of glucagon-like peptide-1 — obesity, appetite, and stress: what is next? A review[J]. Dig Dis Sci, 2007, 52(3): 643-649. DOI: 10.1007/s10620-006-9096-2.
[12] Tomas E, Habener JF. Insulin-like actions of glucagon-like peptide-1: a dual receptor hypothesis[J]. Trends Endocrinol Metab, 2010, 21(2): 59-67. DOI: 10.1016/j.tem.2009.11.007.
[13] Nishida M, Carley WW, Gerritsen ME,etal. Isolation and cha-racterization of human and rat cardiac microvascular endothelial cells[J]. Am J Physiol, 1993, 264(2Pt2): H639-H652.
[14] Seemann I, Gabriels K, Visser NL,etal. Irradiation induced modest changes in murine cardiac function despite progressive structural damage to the myocardium and microvasculature[J]. Radiother Oncol, 2012, 103(2): 143-150. DOI: 10.1016/j.radonc.2011.10.011.
[15] Wei L, Sun D, Yin Z,etal. A PKC-beta inhibitor protects against cardiac microvascular ischemia reperfusion injury in diabetic rats[J]. Apoptosis, 2010, 15(4): 488-498. DOI: 10.1007/s10495-009-0439-2.
[16] Tseng CY, Wang JS, Chao MW. Causation by diesel exhaust particles of endothelial dysfunctions in cytotoxicity, pro-inflammation, permeability, and apoptosis induced by ROS gene-ration[J]. Cardiovasc Toxicol, 2016. DOI:10.1007/s12012-016-9364-0. [Epub ahead of print]
[17] Li CJ, Sun LY, Pang CY. Synergistic protection of N-acetylcysteine and ascorbic acid 2-phosphate on human mesenchymal stem cells against mitoptosis, necroptosis and apoptosis[J]. Sci Rep, 2015, 5: 9819. DOI: 10.1038/srep09819.
[18] Jarasch ED, Grund C, Bruder G,etal. Localization of xanthine oxidase in mammary-gland epithelium and capillary endothelium[J]. Cell, 1981, 25(1): 67-82.
[19] Zweier JL, Broderick R, Kuppusamy P,etal. Determination of the mechanism of free radical generation in human aortic endothelial cells exposed to anoxia and reoxygenation[J]. J Biol Chem, 1994, 269(39): 24156-24162.
