尼莫地平对MCAO/R模型大鼠不同时间点血流灌注量的影响
2017-04-19张枝雪杨志斌巫秀美张成桂大理大学昆虫生物医药研究院云南省昆虫生物医药研发重点实验室云南大理671000中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心云南大理671000药用特种昆虫开发国家地方联合工程研究中心云南大理671000
张枝雪 黄 茜 李 玥 杨志斌 肖 怀 巫秀美 张成桂*1.大理大学昆虫生物医药研究院云南省昆虫生物医药研发重点实验室,云南 大理 671000;2.中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心,云南 大理 671000;3.药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000
尼莫地平对MCAO/R模型大鼠不同时间点血流灌注量的影响
张枝雪1,3黄 茜1,3李 玥1,2,3杨志斌1,2,3肖 怀1,2,3巫秀美1,2,3张成桂1,2,3*
1.大理大学昆虫生物医药研究院云南省昆虫生物医药研发重点实验室,云南 大理 671000;2.中国西南药用昆虫及蛛形类资源开发利用2011协同创新中心,云南 大理 671000;3.药用特种昆虫开发国家地方联合工程研究中心,云南 大理 671000
目的:利用激光散斑血流成像技术观察尼莫地平对大鼠大脑中动脉栓塞模型脑血流灌注量的影响。方法:成年雄性SD大鼠,采用改良线栓法制备大脑中动脉梗塞/再灌注模型。利用激光散斑血流成像技术观测造模前,缺血再灌注0.5、1、2、24h后脑血流灌注量情况,并对选定区域血流进行分析,再灌注24h TTC染色观察脑梗死体积。结果:造模成功后大鼠右侧脑血流明显减少,灌胃给4mg/kg尼莫地平后,大鼠局部脑血流渐渐增加,脑梗死面积减少,脑组织含水量减少。结论:尼莫地平能显著增加MCAO/R模型大鼠血流量。
尼莫地平;脑缺血再灌注损伤;激光散斑血流成像;脑血流量
缺血性脑卒中(Ischemic Stroke,IS)指脑的供血主动脉发生狭窄或阻塞,脑的血液供应出现障碍,导致氧和营养物质的缺乏,从而引起脑的功能异常,脑局部组织坏死[1]。局灶性脑缺血后大脑损伤的进展取决于血流量减少的严重程度和缺血后再灌注的动力学变化。提高缺血区域血流量,改善缺血脑组织的血液循环,对于提高患者的治疗效率具有重要意义。大脑中动脉栓塞(Middle Cerebralartery Occlusion,MCAO)模型是目前运用最为广泛的脑缺血模型[2],但对MCAO模型的血流变化报道不多。尼莫地平对脑缺血引起的神经损伤具有保护作用,能减少缺血脑组织梗死面积,增加局部脑血流量[3],在临床前的研究效果显著,但抗自由基和抗氧化特性在临床患者中得不到体现。为进一步证实尼莫地平改善脑血液循环的作用,研究引用激光散斑血流成像技术(Laser Speckle Contrast Imaging,LSI)较直观的、实时的观察MCAO/R模型后的局部血流变化情况。
1 仪器与材料
1.1 仪器 HWS24电热恒温水浴锅(上海恒恒科技有限公司);PSI ZR瑞典帕瑞医学激光散斑血流监测视频系统(perimed)。
1.2 材料 水合氯醛(批号:20120827,天津市光复精细化工研究所);硫酸阿托品注射液(批号:03141205,上海禾丰制药有限公司);尼莫地平片(批号:BJ29770,拜耳医药保健有限公司);氯化三苯基四氮唑(Triphenyl tetrazolium chloride,TTC,批号:20141119,南京建成生物工程研究所);2636-100栓线(北京西浓科技有限公司)。
1.3 实验动物 SPF级成年健康雄性(Sprague-Dawley,SD)大鼠,体量220~250g,湖南斯莱克景达实验动物有限公司,许可证号:SYXK(湘)2011-0003。实验动物购置后在大理大学实验动物中心实验室适应性饲养3~5d后用于正式实验。饲养条件:清洁级,室温19~25℃,相对湿度40%~70%,12h明暗交替照明,自由进食、饮水。
2 方法
2.1 脑血流量的测定 大鼠用10%水合氯醛(300mg/kg)腹腔注射麻醉,肌内注射阿托品0.1mL/100g体重用于抑制呼吸道分泌物。大鼠固定于脑立体定位仪上,用剃毛器剃去大鼠头部的毛,从头部正中沿矢状缝剪开头皮及筋膜,用手术刀将颅骨表面的骨膜等结缔组织清理干净后,采用785nm波长的半导体激光源均匀照射到头骨上方约16cm处,设置采样频率为8帧/s,曝光时间为10ms,图像采集像素为1388×1038,连续成像10帧,通过系统将原始的散斑图像转换成血流图和血流信息。在每组实验中,在大鼠MCAO模型之前记录一组基线数据,手术后缺血2h,再灌注0.5、1、2、24h各监测一次脑血流并采集血流灌注图。整个实验过程中需要检测肛温,控制加热垫温度,保持大鼠体温恒定在(37.0±0.2)℃范围内,实验中时不时向监测部位滴加生理盐水,保持表面湿润。
2.2 大鼠MCAO模型的建立 参考Longa、Kugal等[4-5]方法,并加以改进,采用线栓法复制短暂性大鼠脑中动脉闭塞(MCAO)模型,复制方法如下:将已麻醉的大鼠仰卧固定在手术台上,用智能恒温仪使大鼠在手术过程中,肛温维持在37℃,颈部剃毛并进行常规消毒后颈正中偏左0.5cm处切口约1.5cm,分离右颈总动脉(Common Carotid ar Aery,CCA)至分叉处,分离颈外动脉(External Carotid Artery,ECA)和颈内动脉(Internal Carotid Artery,ICA)。结扎CCA近心端,用一个微动脉夹夹闭CCA远心端,在CCA上用缝合线扎一活结,眼科剪在距离分叉约1cm处剪一“V”形缺口,将线栓经缺口插入,松开CCA上动脉夹,调整线栓进入角度(向左侧倾斜约20°角),使线栓进入ICA再次调整进线角度(向右侧倾斜约15°角)并轻轻拉CCA,使栓线进入大脑,微遇阻力时停止,此时线栓插入深度为18~20mm (ECA与ICA分叉处为起点),线栓头端通过MCA起始处,到达较细的大脑前动脉。仔细关闭创口,缝合皮肤,此时完成大鼠MCAO模型的制备。
2.3 TTC染色及梗死体积计算 大鼠脑缺血再灌注24h断头处死取脑,去除嗅球及小脑,滤纸吸去脑表面水分,称湿重后,立即放入-20℃冰冻15min后取出,由前向后做连续冠状切片,共5片。将脑切片置于pH7.4,0.01mmol/L PBS配制的0.2% TTC溶液中,37℃避光孵育30min,期间不时摇晃烧杯,使脑切片与TTC溶液充分接触。数码相机拍照,计算脑梗死率。

2.4 脑组织含水量 TTC染色后将5片脑组织置于110℃烘箱中烘烤24h,在干燥器中冷却至室温后称干重。计算脑组织含水量=(脑组织湿重-脑组织干重)/脑组织湿重×100%。
2.5 大鼠神经病学评分 大鼠缺血2h,再灌注6h和24h进行神经功能缺损评分。参照Longa[4]并加以改进的5分制法进行评分,0分:无神经功能缺损症状;1分:轻度缺损,即提尾悬空不能伸展左侧前爪;2分:中度缺损,即行走向左侧转圈;3分:中度缺损,即行走困难,并向左侧倾倒;4分:重度缺损,不能自发行走,意识水平下降。
2.6 数据处理 对于每组记录的10帧散斑图像数据,选取每组中间的8帧进行分析;数据采用SPSS 21.0统计软件进行数据分析,以Mean±S表示,数据符合正态性且方差齐的,采用参数检验中的单因素方差分析(one-way ANOVA)比较,组间两两比较采用LSD(最小显著差检验),数据不符合正态性或方差不齐的采用非参数检验中的Mann-Whitney检验分析比较,以P<0.05表示差异有统计学意义。
3 实验结果
3.1 形态学观察 假手术组造模前后脑左右测红色区域变化不大,说明血流量无明显变化。模型组造模前后右侧脑可明显发生变化,造模后再灌注0.5h右侧脑红色区域明显减少,到24h时黄色区域面积相对于2h时明显增多,说明随时间延长模型越严重。尼莫地平组再灌注0h时开始灌胃给药,再灌注0.5h时明显看到右侧区域血流变化,24h时缺血侧(黄色区)面积相对于0.5h、1h和2h明显减少,说明尼莫地平能增加脑血流量。见图1。
3.2 不同时间点血流量 在缺血侧同一区域画相同大小的面积,如图1。计算所画区域的脑血流量。见表1。MCAO/R模型前,所有大鼠脑血流量差异无统计学意义(P>0.05)。假手术组造模前后脑血流变化不明显;与假手术组比较,模型组缺血2h,再灌注0.5、1、2、24h不同时间点脑血流呈现下降的显著下降,且24h脑血流量较前几个时间点血流量低,说明模型组脑组织随着时间的延长损伤越严重(由299.18±49.44下降到175.42±41.64);尼莫地平组缺血2h,再灌注后脑血流呈现先下降后上升的趋势,与模型组比较,在缺血2h再灌注24h时,其脑血流量显著上升,提示尼莫地平对脑组织可能具有保护作用。

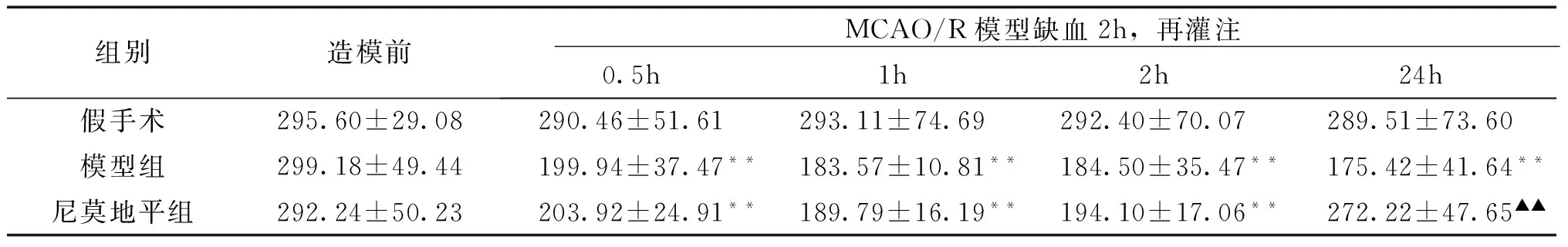
表1 尼莫地平对脑缺血再灌注损伤模型后大鼠不同再灌注时间点脑血流量的影响 (x±s)
注:与假手术组比较,**P<0.01;与模型组比较,▲▲P<0.01。
3.3 大鼠脑组织TTC染色 TTC染色后,正常组织染成红色,脑缺血组织成白色。假手术组大鼠左右脑半球无梗死,模型组大鼠右侧出现大面积梗死,尼莫地平组大鼠梗死面积减少。见图2。

3.4 大鼠脑梗死率及脑组织含水量的影响 MCAO模型组相对于假手术组脑梗死率显著及脑组织含水量显著增加,差异具有统计学意义(P<0.01);与模型组比较,尼莫地平组的梗死率和脑组织含水量都显著降低,差异具有统计学意义(P<0.01)。
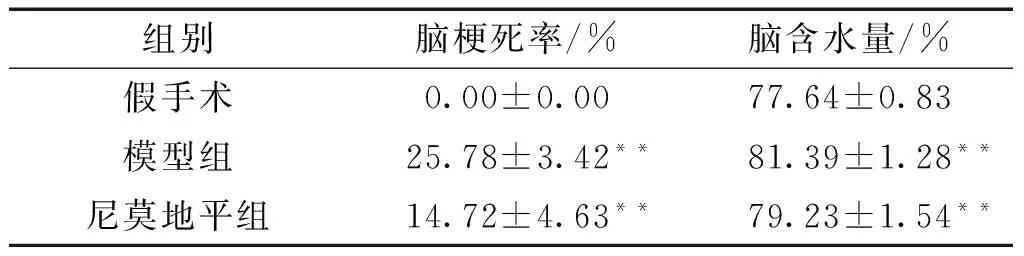
表2 尼莫地平对脑缺血再灌注损伤模型后大鼠脑组织含水量的影响 (分,x±s)
注:与模型组比较,**P<0.01。
3.5 尼莫地平对MCAO模型神经功能的影响 6h时,与假手术组比较,模型组神经功能评分显著增大,差异具有统计学意义(P<0.01),提示造模成功;与模型组比较,尼莫地平组评分显著降低差异有统计学意义(P<0.01)。横向比较,与6h时比较,24h时模型组评分明显增加,而尼莫地平组明显降低。提示尼莫地平可减轻MCAO模型大鼠神经功能评分。

表3 尼莫地平对脑缺血再灌注损伤模型后大鼠神经功能的影响 (分,x±s)
注:与模型组比较,**P<0.01。
4 讨论
脑缺血的动物模型虽然种类繁多,但都无法同时满足以下三个模拟临床的基本要求:创伤小、局部缺血、可再灌注。直到MCAO/R模型的出现,才出现了一个真正受广泛认可模拟临床中风的模型。MCAO模型是一种被广泛运用的脑缺血模型[2],但其也存在一定的局限性,如大鼠血管的差异导致模型的不稳定性等。在做 MCAO模型时利用激光散斑技术进行实验进行血流监测,实时监测血流情况能帮助较快发现造模失败和极端变异个体,提高实验效率,有助于控制实验质量。文献[6]所述,把MCAO前的脑血流定义为100%,缺血时局部脑血流降到25%以下,说明模型成功,继续进行下面的实验,否则剔除。当脑血流因各种原因下降时,就会导致脑的病理性改变,造成缺血性的脑损伤,此时,缺血区血流大幅减少,ATP迅速耗竭,缺血区域的中心组织细胞开始死亡[7]。因此,研究脑血流量变化不仅有助于研究疾病发生的病因病机,还可以作为一项指标进行药物的筛选。研究中,尼莫地平能够改善多个与脑缺血损伤有关的病理机制,如抑制血小板聚集,提高脑组织清除自由基的能力,拮抗5-HT,TXA2和前列腺素F2α(PGF2α)等多种血管活性物质引起的血管收缩[8]。尼莫地平不仅能舒张血管平滑肌,预防和解除脑血管痉挛,改善脑部微循环,亦能保护脑缺血时由于钙离子内流超载所致的脑细胞损害,对脑缺血引起的神经细胞损伤具有重要的保护作用[9]。评价梗死主要有两种方法,一种是使用HE染色法,另一种是TTC染色法,HE染色法的原理为缺血区细胞死亡,细胞核无法着色,染色显示为苍白。TTC染色的原理为TTC与细胞线粒体脱氢酶结合,线粒体失活便无法着色,染色显示为苍白,TTC染色方法比较简便快捷,是目前评价梗死的最主要方法。实验研究表明在栓塞大脑中动脉15min后,整脑冠状切面用TTC染色,就可出现肉眼可见的缺血灶,主要位于缺血半球侧边部分的大脑尾壳核区;栓塞2~3h后缺血灶的面积趋于一致;在视交叉前后约2~3mm范围内作冠状切面,缺血灶约占同侧脑冠状切面面积的60%~85%,缺血灶累及的结构有:大脑背外侧的皮质层、尾壳核、丘脑外侧部下丘脑的背外侧部[10]。结果显示,尼莫地平能明显降低皮层区的梗死灶,有助于大鼠脑缺血再灌注后脑组织损伤区半暗带的恢复,抑制脑梗死范围的进一步扩大。
脑水肿是缺血性脑血管病主要的临床并发症之一,在大鼠MCAO/R模型中主要存在细胞毒性脑水肿和血管源性脑水肿,两种水肿类型的机理依据出现时间不同,前者为在缺血时便出现并持续整个缺血再灌注过程,后者只在再灌注过程中出现,在再灌注过程中两者常同时存在。脑水肿与其引起的颅内压增高是脑梗死早期致死主要原因,而且脑水肿会引起脑血流进一步下降,加重脑缺血损伤。结果显示,尼莫地平组降低大鼠脑缺血再灌注损伤后脑组织内水分含量,能在一定程度上减轻脑缺血再灌注损伤。
综上,研究采用激光散斑成像技术测定尼莫地平对脑缺血再灌注损伤大鼠脑血流量的影响,并对选定区域血流进行分析,TTC染色观察脑梗死体积及脑组织含水量,初步阐明尼莫地平能增加脑血流灌注量,从而改善脑供血,对脑组织有保护作用。
[1]Glenn A Armitage, Kathryn G Todd, Ashfaq Shuaib, et al . Laser speckle contrast imaging of collateral blood flow during acute ischemic stroke [J]. Journal of Cerebral Blood Flow & Metabolism,2010,30: 1432-1436.
[2] Stoll G, Kleinschnitz C, Nieswandt B. Molecular mechanisms of thrombus formation in ischemic stroke: novel insights and targets for treatment[J]. Blood, 2008, 112(9): 3555-3562.
[3] 黄德斌,董 志. 尼莫地平对缺血性脑损伤大鼠神经细胞黏附分子表达的影响[J].中国药理学学报,2008,24(5):640-643.
[4] Longa E Z, Weinstein P R, Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats [J]. Stroke, 1989, 20(1): 84-91.
[5] Kuge Y, Minematsu K, Yamaguchi T, et al.Nylon monofilament for intraluminal middle cerebral artery occlusion in rats [J]. Stroke, 1995, 26(9):1655-1658.
[6] Li P, Murphy TH. Two-photon imaging during prolonged middle cerebral artery occlusion in mice reveals recovery of dendritic structure after reperfusion [J]. J Neurosci, 2008, 28(46):l1970-11979.
[7] Lust WD, Taylor C, Pundik S,et al.Ischemic cell death: dynamics of delayed secondary energy failure during reperfusion following focal ischemia [J]. Metab Brain Dis, 2002, 17(2): 113-121.
[8] Suman W, Martin G, Hair WM, et al. Effect of calcium antagonists on endothelin-induced contraction of isolated human resistance arteries: differences related to site of origin[J]. J Hum Hypertens,1993, 7(2):189-191.
[9] Takijawa S,Hogan MJ,Buchan AM,et al. In vivo binding of [3H] nimodipine in rat brain after transient forebrain ischemia[J]. J Cereb Blood Flow Metab,1994, 14(3): 397-405.
[10]Garcia JH, Yoshida Y, Chen H, et al Progression from ischemic injury to infarct following middle cerebral artery occlusion in the rat [J]. Am J Pathol, 1993, 142(2: 623-635.
Effect of Nimodipine on MCAO/R Rats Different Time Point Blood Perfusion
ZHANG Zhixue1,3HUANG Xi1,3LI Yue1,2,3YANG Zhibin1,2,3XIAO Huai1,2,3WU Xiumei1,2,3ZHANG Chenggui1,2,3*
1.Yunnan Provincial Key Laboratory of Entomological Biopharmaceutical R&D, Institute of Entomoceutics Research, Dali University, Dali 671000, China;2.Yunnan Provincial 2011 Collaborative Innovation Center for Entomoceutics, Dali University,Dali 671000, China;3.National-Local Joint Engineering Research Center of Entomoceutics,Dali 671000, China
Objective To study the effect of nimodipine on cerebral blood flow in MCAO/R rats by laser speckle imaging (LSI). Methods To establish the MCAO/R model in male SD rats by the modified intraluminal filament technique. Measuring the cerebral blood flow before modeling and after ischemia-reperfusion for 0.5 h, 1 h, 2 h, 24 h by LSI, meanwhile analysing the selected area blood flow, and observing the infarct size after perfusion for 24 h with TTC. Results The cerebral blood flow was decreased in right hemisphere after the models established successfully, and after the intragastric administration of nimodipine with 4 mg/kg, the regional cerebral blood flow of rats gradually increased, the cerebral infarction area reduced, and the brain water content was decreases. Conslusions Nimodipine significantly improve the cerebral blood flow of MCAO/R rats.
Nimodipine; Cerebral Ischemia-Reperfusion Injury; Laser Speckle Imaging; Cerebral Blood Flow
云南省应用基础研究计划重点项目(2014FA007);国家自然科学基金(81260475、81360679)。
张枝雪(1989-),女,汉族,硕士研究生在读,研究方向为昆虫药物经皮给药治疗脑血管疾病。E-mail:dlzhangzhixue@163.com
张成桂(1978-),男,博士,副教授,硕士生导师,研究方向为天然药物研究与开发。E-mail:chengguizcg@163.com
R965
A
1007-8517(2017)07-0042-04
2017-02-11 编辑:程鹏飞)
