工业用氢氧化钠中氯酸钠含量测定方法的探讨
2017-04-18潘宇婷李金枝李金凤
潘宇婷,李 霞,李金枝,李金凤
(中盐吉兰泰盐化集团有限公司,内蒙古 阿拉善 750336)
工业用氢氧化钠中氯酸钠含量测定方法的探讨
潘宇婷,李 霞,李金枝,李金凤
(中盐吉兰泰盐化集团有限公司,内蒙古 阿拉善 750336)
依据GB/T 11200.1—89和GB/T 11200.1—2006,针对盐酸用量、加蒸馏水量、反应温度、显色时间和比色皿选择等影响因素做了细化测试和摸索,改进测定条件后,标准曲线线性系数基本都在0.995以上,样品平行性得到了较大改善,达到了标准允许误差要求。
氢氧化钠;氯酸钠;显色时间
离子膜法固体氢氧化钠是中盐吉兰泰盐化公司的主要产品之一。在离子膜法电解生产氢氧化钠的过程中,不可避免地会发生副反应而生成氯酸钠。由于氯酸钠具有氧化性,能对生产装置产生腐蚀,同时,氯酸钠含量高低是离子渗透膜质量的重要指标。因此,准确测定氯酸钠含量对氯碱生产具有重要的指导意义。然而,在采用GB/T 11200.1—89测定氢氧化钠中氯酸钠含量时,出现了标准曲线线性差,样品平行测定误差较大等问题。最新版本的GB/T 11200.1—2006虽然作了大幅度的改动,但是由于反应温度和显色时间不明确、不具体,分析人员对标准的理解和执行有偏差,从而导致标准曲线线性差,线性相关系数基本都在0.990以下,样品平行测定误差较大,超出标准允许误差范围等现象。针对以上问题,结合GB/T 11200.1—89和GB/T 11200.1—2006,对盐酸用量、加蒸馏水量、反应温度、显色时间和比色皿选择等影响因素做了细化测试和摸索,改进测定条件,标准曲线线性系数基本都在0.995以上,样品平行性得到了较大改善,达到了标准允许误差要求。
1 实验部分
1.1 测定原理
在强酸介质中氯酸钠分解为氯气和二氧化氯,在pH值<1.3条件下,氯气和二氧化氯与邻联甲苯胺反应生成稳定的化合物,用分光光度计测定吸光度。
1.2 试剂
在分析中仅使用确认为分析纯的试剂和去离子水或相当纯度的水。本方法用于氯酸钠分析的容器,应避免与橡胶或其他有机物接触。
(1)盐酸:优级纯;
(2)氢氧化钠溶液:400 g/L;
(3)氯酸钠标准溶液:1 g/L。称取1.000 g氯酸钠,移入1 000 mL容量瓶中,稀释至刻度;
(4)氯酸钠标准溶液:10mg/L。量取以上5.00mL氯酸钠标准溶液,置于500 mL的容量瓶中,稀释至刻度。该溶液使用前配制;
(5)酚酞指示剂:10 g/L;
(6)邻—联甲苯胺指示液:1 g/L。
称取0.5 g邻—联甲苯胺,置于研钵中,加少量的50 mL盐酸与200 mL水的混合溶液进行研磨,连同剩余的混合溶液一起移入500 mL烧杯中,加150 mL水,一边搅拌一边加热。溶解后,将溶液全部移入500 mL棕色容量瓶中,用水稀释至刻度。此溶液保存在棕色瓶中置于暗处,有效期为3个月。
1.3 仪器
(1)一般的实验室仪器;(2)722分光光度计。
1.4 分析步骤
1.4.1 标准曲线绘制
取7只100 mL容量瓶,依次加入0、1.0、2.0、3.0、4.0、5.0、6.0 mL氯酸钠标准溶液(10 mg/L),然后依次加入10.0、9.0、8.0、7.0、6.0、5.0、4.0 mL蒸馏水,再加入3.0 mL氢氧化钠溶液(400 g/L),浸入约50℃的水浴中约0.5 min,取出,置于自来水中快速冷却。然后迅速加入8.0 mL盐酸,混匀,再加入2.0 mL邻—联甲苯胺显色液(1 g/L),摇动1 min,用水稀释至刻度,摇匀。
以水为参比,选用适宜的比色皿,在波长442 nm处,测定吸光度。
1.4.2 试样溶液
称取36 g试验样品(精确到0.000 1 g),移入1 000 mL容量瓶中,稀释至刻度。
2 存在问题
以100 mL标准比色溶液所含的氯酸钠质量(μg)为横坐标,扣除试剂空白后的吸光度为纵坐标,绘制标准曲线,并得出线性相关系数见表1。
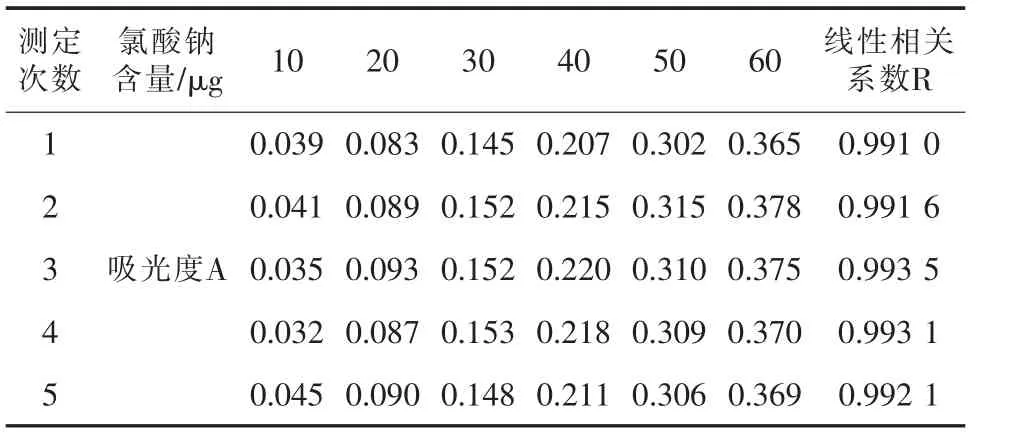
表1 标准曲线线性相关系数
量取3.0mL试料置于双口烧瓶中,再加入3.0mL水,以上述方法测定吸光度A,同时进行空白试验。5批样品进行平行测定,选取表1中线性相关系数最好的标准曲线,氯酸钠含量测定数据见表2。

表2 样品氯酸钠含量测定结果
从表1、表2测定数据可以看出,标准曲线线性相关系数基本都在0.995以下,线性较差,并且标准规定测定允许差为0.000 5%,而样品平行测定之差的绝对值为0.000 9%~0.001 3%,测定平行性较差。
3 影响因素
在显色反应中,温度和显色时间是影响吸光度的主要因素,但标准中对反应温度和显色时间等明确不具体,在测定过程中对反应温度和显色时间控制较难一致,导致分析结果产生偏差。因此,对盐酸用量、加蒸馏水量、反应温度、显色时间和比色皿选择进行了测试。
3.1 盐酸用量
吸取6.0 mL氯酸钠标准溶液(10 mg/L),加入3.0 mL氢氧化钠溶液(400 g/L),滴加两三滴酚酞指示剂,用盐酸(优级纯)中和,记录滴定消耗体积,反复滴定,确定中和反应消耗盐酸的量为3.00 mL。
取7支100 mL容量瓶,分别加入6.0 mL氯酸钠标准溶液(10 mg/L),3.0mL氢氧化钠溶液(400g/L),10.0 mL蒸馏水,再加入2.0 mL邻—联甲苯胺显色液(1 g/L);在0~10℃水浴中用吸量管加盐酸(优级纯)3.0 mL,边加边振荡,统一中和完毕后,再依次快速加入0、5.0、10.0、15.0、20.0、25.0、30.0 mL盐酸(优级纯),同时保持快速振荡(温度不要超过20℃),将容量瓶自水浴中移出后快速摇匀,静置5 min显色,然后用水稀释至刻度,摇匀,再静置,10 min内完成吸光度的测定。
用空白调节分光光度计零点,选用1 cm的比色皿,在波长 442 nm处,测定吸光度,测定结果见图1。
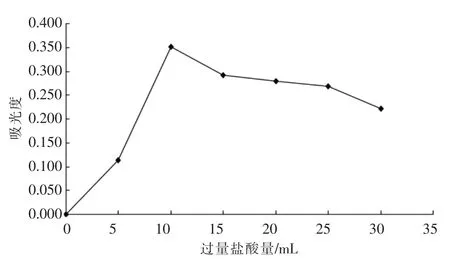
图1 不同量的盐酸测定的吸光度值
由图1可以看出,过量盐酸为10.0 mL时,吸光度值最大,大于10.0 mL后吸光度呈下降趋势。所以确定最佳过量盐酸的量为10.0 mL。
3.2 确定蒸馏水用量
取7支100 mL容量瓶,分别加入6.0 mL氯酸钠标准溶液(10mg/L),3.0mL氢氧化钠溶液(400g/L),再依次加入0、8.0、10.0、12.0、15.0 mL蒸馏水,再加入2.0 mL邻—联甲苯胺显色液(1 g/L);在0~10℃水浴中用吸量管加盐酸(优级纯)3.0 mL,边加边振荡,统一中和完毕后,再快速加入10.0 mL盐酸 (优级纯),同时保持快速振荡(温度不要超过20℃),将容量瓶自水浴中移出后快速摇匀,静置5 min显色,然后用水稀释至刻度,摇匀,再静置,10 min内完成吸光度的测定。
用空白调节分光光度计零点,选用1 cm的比色皿,在波长442 nm处,测定吸光度,测定结果见图2。
由图2可以看出,加入蒸馏水为10.0 mL时,吸光度值最大,大于10.0 mL后吸光度呈下降趋势。所以确定加入最佳蒸馏水的量为10.0 mL。
3.3 反应温度

图2 不同量的蒸馏水测定的吸光度值
一般情况下,显色反应大多在室温下进行。强酸强碱中和反应放出大量的反应热,使整个溶液温度升高,影响较大。
取6支100 mL容量瓶,分别加入6.0 mL氯酸钠标准溶液(10 mg/L),3.0mL氢氧化钠溶液(400 g/L),10.0 mL蒸馏水,再加入2.0 mL邻—联甲苯胺显色液(1 g/L);用吸量管加盐酸(优级纯)3.0 mL,边加边振荡,统一中和完毕后,再快速加入10.0 mL盐酸(优级纯),保持快速振荡摇匀,测定温度,温度分别为45℃、40℃、35℃、30℃、25℃、20℃时,用水稀释至刻度摇匀,10 min内完成吸光度的测定,测定结果见表3。

表3 溶液温度不同测定的吸光度值
由表3看出,显色反应受溶液温度影响较大,当室温、水温等不确定因素影响时,吸光度值波动较大,所以应控制环境和反应温度。
考虑到在实际操作中,较高和较低的温度都比较难控制,故选择在25℃常温环境中,按照方法在0~10℃水浴中加入盐酸冷却,控制溶液温度至常温(25℃),测定吸光度见表4。

表4 控制反应温度测定的吸光度值
由表4可以看出,在控制溶液温度的情况下,吸光度值相对稳定。因此,选择反应在0~10℃水浴中进行。
3.4 显色时间
取7支100 mL容量瓶,分别加入6.0 mL氯酸钠标准溶液(10 mg/L),3.0mL氢氧化钠溶液(400 g/L),10.0 mL蒸馏水,再加入2.0 mL邻—联甲苯胺显色液(1 g/L);在0~10℃水浴中用吸量管加盐酸(优级纯)3.0 mL,边加边振荡,统一中和完毕后,再快速加入10.0 mL盐酸(优级纯),同时,保持快速振荡(温度不要超过20℃),将容量瓶自水浴中移出后快速摇匀,分别静置0 min、5 min、10 min、15 min、20 min显色,然后用水稀释至刻度,摇匀,再静置,10 min内完成吸光度的测定。
用空白调节分光光度计零点,选用1 cm的比色皿,在波长442 nm处,测定吸光度,测定结果见表5。

表5 不同显色时间测定的吸光度值
由表5可看出,显色时间为5 min,此时吸光度的值最大,显色效果最好。在5 min之后,吸光度值呈下降趋势。
3.5 确定比色皿
取7支100 mL容量瓶,分别加入3.0 mL氢氧化钠溶液 (400 g/L),再依次加入氯酸钠标准溶液(10 mg/L)0、1.0、2.0、3.0、4.0、5.0、6.0 mL,然后依次加入10.0、9.0、8.0、7.0、6.0、5.0、4.0 mL蒸馏水,再各加入2.0 mL邻—联甲苯胺显色液(1 g/L);在0~10℃水浴中用吸量管加盐酸(优级纯)3.0 mL,边加边振荡,中和完毕后,再快速加入10.0 mL盐酸(优级纯),同时,保持快速振荡(温度不要超过20℃),将容量瓶自水浴中移出后快速摇匀,静置5 min显色,然后用水稀释至刻度,摇匀,再静置,10 min内完成吸光度的测定。
用空白调节分光光度计零点,分别选用1 cm、3 cm、5 cm的比色皿,在波长442 nm处测定吸光度,并以100 mL比色溶液所含的氯酸钠质量(μg)为横坐标,与其对应的吸光度为纵坐标,绘制标准曲线,结果见表6。

表6 不同比色皿测定的吸光度值
由表6可看出,选用5 cm的比色皿测定吸光度时,线性相关系数最佳,故选用5 cm比色皿测定吸光度。
4 结果与讨论
4.1 线性相关系数
根据实验确定的条件,进行标准曲线绘制得出线性相关系数,见表7。

表7 标准曲线线性相关系数
取5批样品,根据实验确定的条件,每批样品测定5次,测定数据见表8。

表8 样品氯酸钠含量测定结果
4.2 回收率试验
以样品5为底液,加入3.0 mL氯酸钠标准溶液(10 mg/L)进行回收率试验,测定结果见表9。
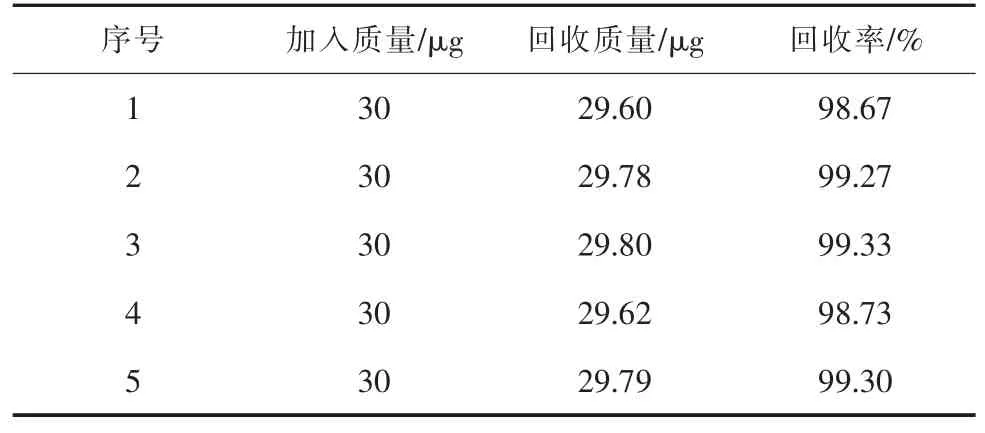
表9 样品5回收率试样结果
由表7、表8、表9可以看出,在盐酸用量、加蒸馏水量、反应温度、显色时间和比色皿确定的条件下,标准曲线线性系数全部都在0.995以上,样品测定都在标准允许误差范围内,标准曲线线性和样品测定平行性得到明显改善,回收率为98.675%~99.33%,符合测定要求。
5 结论
工业用氢氧化钠中氯酸钠的测定,受盐酸用量、加蒸馏水量、反应温度、显色时间和比色皿选择等因素影响,在确定上述影响因素的前提下测定氯酸钠含量,其标准曲线的线性相关系数和样品测定的平行性均得到了明显改善。
Study on the method for the determination of sodium chlorate industrial sodium hydroxide
PAN Yu-ting,LI Xia,LI Jin-zhi,LI Jin-feng
(China National Salt Industry Corporation Jilantai Salt Chemical Group Co.,Ltd.,Alxa 750336,China)
According to GB/T 11200.1-89 and GB/T 11200.1-2006,in view of the dosage of hydrochloric acid,distilled water,reaction temperature,color rendering time and color dish selection factors has made the detailed test and fumble,improved determination conditions,basic is above 0.995 linear coefficient of standard curve,parallelism and sample be improved,to meet the standard permissible error requirements.
sodium hydroxide;sodium chlorate;chromogenic time
TQ075+.3
B
1009-1785(2017)03-0030-04
2016-05-06
