多次食管酸灌注对哮喘小鼠气道TRPV1受体及炎症反应的影响
2017-04-17贾丽萍蔡梓滔罗高潮姚卫民
贾丽萍 蔡梓滔 罗高潮 姚卫民
多次食管酸灌注对哮喘小鼠气道TRPV1受体及炎症反应的影响
贾丽萍1,2蔡梓滔1罗高潮2姚卫民1
目的 观察多次食管酸灌注对哮喘小鼠气道瞬时感受器电位香草酸受体-1(Transient receptor potential vanilloid-1,TRPV1)受体的影响。 方法 60只雄性BALB/c小鼠随机分成6组(正常组、灌盐组、灌酸组、哮喘组、哮喘灌盐组、哮喘灌酸组),用OVA致敏和激发的方法建立哮喘模型,用食管下段盐酸灌注建立胃食管反流(gastroesophageal reflux,GER)模型,末次抗原激发后24小时处死小鼠,HE染色观察小鼠食道及肺组织病理改变;免疫组化及荧光定量PCR检测TRPV1受体蛋白及mRNA在小鼠肺组织中的表达及分布情况。 结果 与正常组与灌盐组比较,灌酸组、哮喘组小鼠肺部均表现出明显的炎症反应,气道上TRPV1表达上调,尤其是哮喘灌酸组表现明显,与其他组相比有显著差异性(P<0.001)。 结论 多次食管酸灌注可明显上调哮喘小鼠TRPV1受体的表达,推测TRPV1受体的激活可能参与了胃食管反流引起哮喘发生发展的发病机制。
BALB/c小鼠;哮喘;胃食管反流;TRPV1
GER(胃食管反流)在哮喘患者中比较常见,尤其是难以控制的哮喘,报导有32%至84%的患病率[1]。因此,《2007年全国哮喘教育和预防指南》建议难以控制的哮喘患者的评估和治疗应该考虑到GER,无论GER有无症状[2]。GER与哮喘夜间症状的发作的关系较大,而控制欠佳的哮喘患者常出现夜间症状,GER是引发呼吸道症状及病情加重的诱因[3],但发病机理并不明确。文献中提出TRPV1与哮喘、慢性阻塞性肺疾病等多种慢性肺部疾病相关。Butler CA等在研究中发现,哮喘患者的支气管上皮细胞TRPV1的表达明显上调,且与哮喘的严重程度密切相关,抑制TRPV1有助于减弱气道上皮损伤和哮喘的症状[4]。TRPV1基因的多态性已被证明与哮喘有关,TRPV1基因的缺失可引起哮喘症状减轻[5],故TRPV1可能在哮喘发病机理中起作用。
目前对GER引起肺部炎症的发病机制及GER与哮喘的关系仍相当缺乏了解,本实验通过建立GER及哮喘小鼠模型,观察在不同组小鼠肺部炎症反应的各异及TRPV1在不同组小鼠表达的差别,了解TRPV1是否参与GER诱发哮喘发作或引起哮喘症状加重的病理生理过程。
资料与方法
一、材料
鸡卵白蛋白(OVA,Grade V)(美国Sigma公司);氢氧化铝[AI(OH)3]凝胶(美国Sigma公司);猪胃蛋白酶(美国Sigma公司);胰酶(美国JRH公司);HCl(广州化学试剂公司);兔抗鼠TRPV1多克隆抗体(Abcam公司);PrimeScriptTM RT 试剂盒(大连宝生物有限公司);SYBR*Premix Ex TaqTM II (Tli RNaseH Plus)(大连宝生物有限公司);自制雾化箱(20cm×30cm×30cm,树脂箱) ;百瑞超声雾化器(德国百瑞公司);12号小鼠灌胃针;LightCycler 480ⅡDNA扩增仪(瑞士Roche公司);MasterCycler Gradient PCR仪(德国Eppendorf公司)。
二、动物分组及造模方法
1 动物分组:60只清洁级,雄性,BALB/c小鼠,8-9周龄,体重18-20g,购自广东省实验动物中心,随机分成6组,每组10只。A组(正常对照组):未予任何处理;B组(灌盐组):生理盐水灌注食管;C组(灌酸组):稀盐酸灌注食管;D组(哮喘组):鸡卵白蛋白OVA致敏和激发;E组(哮喘并灌盐组):哮喘造模同时,致敏第一天开始食管灌注生理盐水(灌注方法同B组);F组(哮喘并灌酸组):哮喘造模同时,致敏第一天开始食管灌注稀盐酸(灌注方法同C组)。
2 造模方法
(1) 建立哮喘小鼠模型及给药:参照文献[6-7]并加以改进,方法如下:① 致敏:哮喘小鼠,于第0天、第7天、第14天予腹腔注射20μg OVA(20mg A1(OH)3+200μL NS)致敏液0.2mL。② 抗原激发:哮喘小鼠,于实验流程的19天,配制含1%OVA的生理盐水雾化溶液,现配现用。将哮喘组、哮喘灌盐组及哮喘灌酸组小鼠,分批置于自制雾化箱(30cm×20cm×15cm)中,每批用10mL的雾化液,每天一次,每次雾化约40分钟,共雾化3天,以出现抓耳挠腮、点头呼吸、腹肌收缩、匍匐不起等症状表明诱喘成功。
(2) 建立胃食管反流小鼠模型及给药:参照文献[8]并加以改进,方法如下:单手固定小鼠,经口将12号灌胃针插入小鼠食管中下段,缓慢注入0.1N HCl(含0.5%胃蛋白酶)0.3mL ,2次/天,共21天。灌注完毕,小鼠无呕吐、抽搐等不适。灌盐组予同等剂量生理盐水代替,其时间和方式同灌酸组小鼠相同。
三、标本的制备及检测
一次抗原激发后48小时,小鼠摘眼球取血,缺血死亡。
1 食管标本的处理:暴露食管,切取中下段食管,放入福尔马林中固定,常规脱水,石蜡包埋,切片厚度为5μm,HE染色。
2 肺组织标本的处理:分离出肺组织,左肺组织福尔马林中固定,脱水、包埋后切片成5μm厚度,待用着HE染色及TRPV1免疫组化(显微镜下观察玻片可见:非特异染色较少,特异性强,TRPV1阳性区域显示棕褐色。每张切片取5个视野(400×)拍摄照片并测定上述蛋白阳性产物的平均光密度(mean density, MD)值,取平均值表示上述蛋白表达水平,MD值越大表示目的蛋白表达越强。取右肺组织保存于液氮中,取液氮中的肺组织100mg,据Trizol法中总RNA提取的试剂盒说明书进行操作,在冰上操作提取RNA,取1 μL上述总RNA进行逆转录合成cDNA,荧光定量PCR仪进行Real Time PCR反应,检测 TRPV1 mRNA 的表达,反应条件如下: 95℃ 预变性 30s ,95℃ 变性 30s 、55℃ 退火 30s、72℃ 延伸 20s,共40个循环,最后72℃ 延伸 5min。
TRPV1引物序列:F 5’- CACCACGGCTGCTTACT -3’,R 5’- TCCTTGCGATGGCTGA -3’;GAPDH引物序列:F 5’-GGTGAAGGTCGGTGTGAACG -3’,R 5’- CTCGCTCCTGGAAGATGGTG -3’。
四、统计方法
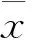
结 果
一、病理组织切片HE染色
1 肺组织切片(见图1)
正常对照组:肺组织黏膜上皮正常,气管、血管壁周围未见明显的炎症细胞浸润。肺泡的形态正常,气道的形态规则,气道上皮细胞结构完整,支气管腔内无异常分泌物。
食管灌盐组:病理组织改变图像与正常对照组无明显差异。
哮喘造模组:(包括哮喘组、哮喘灌盐组、哮喘灌酸组)支气管黏膜皱壁增多卷曲、管腔狭窄,气管和血管周围可见大量炎性细胞浸润,巨噬细胞、淋巴细胞、嗜酸性粒细胞增多,黏膜充血水肿。肺泡、气道结构破坏,气道上皮细胞脱落,气道内有粘液及脱落的黏膜上皮。其中,哮喘灌酸组的炎症表现最明显,哮喘组和哮喘灌盐组肺组织病理改变无明显差异。
胃食管反流模型小鼠:(包括单纯灌酸组、哮喘灌酸组)也表现出明显的炎症反应,食管灌酸组与哮喘造模组小鼠不同的是,血管、气管周围的炎症细胞主要是中性粒细胞、淋巴细胞。
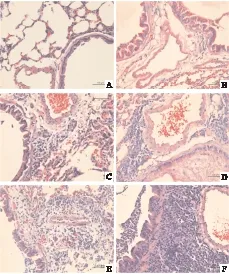
图1 肺组织HE染色图片(400×):正常组(A)、单纯灌盐组(B)单纯灌酸组(C)、哮喘组(D)、哮喘灌盐组(E)、哮喘灌酸组(F)
2 食管组织切片(见图2)
食管上段没有炎症表现;食管中下段黏膜层增生不明显,部分食管有鳞状上皮增生现象,固有层中性粒细胞等浸润,黏膜下层内可见血管扩张、充血,但未见明显的溃疡形成,符合食管炎病理表现。
二、免疫组化标记TRPV1在各组小鼠肺组织中的表达情况(见图3,4)
免疫组化图像分析结果显示光镜下观察,TRPV1在小鼠肺组织的气管上皮细胞胞浆及伴随血管内皮、血管肌纤维、炎症细胞上均有表达,着色为棕黄色或深棕色。与正常对照组相比,除灌盐组外,其余各组表达有所增加,灌酸组特别是哮喘灌酸组表达增加尤其突出(P<0.01)。
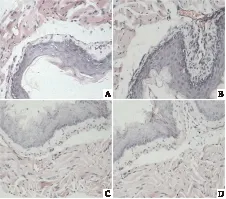
图2 食道下段组织HE染色图片(400×):正常组(A)及灌酸组(B)食道上段组织HE染色图片(400×):正常组(C)及灌酸组(D)

图3 肺组织TRPV1受体的免疫组化图片(400×):正常组(A)、灌盐组(B)灌酸组(C)、 哮喘组(D)、哮喘灌盐组(E)及哮喘灌酸组(F)
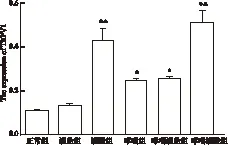
图4 免疫组化标记肺组织TRPV1蛋白表达的变化
注:与正常组比较:*P<0.01;与哮喘组比较:▲P<0.05
三、TRPV1 mRNA表达水平
PCR产物电泳证实扩增片段为目的基因片段 (见图5),与正常组相比,除灌盐组外,其余各组TRPV1 mRNA表达均有上调(P<0.05),灌酸组上调比哮喘组明显,而哮喘灌酸组上调最为明显(P<0.001);哮喘组与哮喘灌盐组之间无明显差异(P>0.05)(见表1及图6)。

图5 PCR扩增产物电泳显示扩增片段为目标基因片段
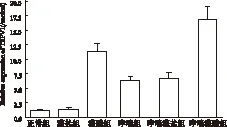
图6 6组小鼠肺组织TRPV1 mRNA的表达
注:与正常组比较:*P<0.001;与哮喘组比较:▲P<0.05
表1 各组小鼠肺组织内TRPV1 mRNA表达情况
注:与正常组比较:*P<0.001;与哮喘组比较:▲P<0.05
讨 论
国内BALB/c小鼠哮喘模型的建立已很成熟,本实验哮喘模型参考文献[6-7]制作。GER模型的制作,国内基本上都选用豚鼠作为实验动物[9],但豚鼠个体反应差异大,本实验参照文献[8]选用BALB/c小鼠,成本费用较低,且较易获得。在小鼠清醒状态下经口灌酸至食道下段的方式,用HCl浓度(0.1N)模拟胃酸;每日两次的频率,持续3周,较接近胃食管反流的发作特点。灌酸后未出现呛咳及呕吐胃内容物等症状,表明酸没有误入气道,不会引起化学性肺炎;食道病理组织切片结果示下段食管炎形成(见图2),上段食管没有炎症,说明盐酸没有达到食管上段,表明盐酸达到咽喉部的可能性很小。此种灌酸方式可达到建立小鼠胃食管反流模型的目的。
哮喘是一种常见的慢性气道炎症性疾病,2004年的全球哮喘防治倡议估计,全世界约有3亿人患有哮喘,随着国家变得更加城市化、环境污染加重等原因,预计到2025年这个数字将增加至4亿[10]。GER是哮喘患者最常见的合并症和导致病情加重的致病因素之一。Kiljander报道GER与控制欠佳的哮喘患者夜间症状有明显的关系,夜间食管远端的反流与咳嗽明显相关[11],也就是说夜间胃酸的反流可诱发了哮喘患者夜间的发作。
GER诱发哮喘的病理机制并不十分明确,我们先前的研究[9]认为气道和肺组织存在4种神经纤维,其中的非肾上腺素能非胆碱能神经在解剖上相当于无髓鞘感觉神经C纤维,其末梢几乎分布于整个呼吸系统,通过分泌神经递质参与气道炎症反应。食管与气管有共同的神经通路,都由迷走神经支配[12],多次盐酸灌注哮喘豚鼠食管,可能通过迷走神经介导的食管-支气管反射,引起气管NKA、NKB等神经肽的释放,参与气管的神经源性炎症,从而参与了GER相关哮喘的病理生理过程。
TRPV1是一种分布极其广泛的信号感受器,广泛分布于消化、呼吸和血管等器官以及平滑肌细胞、上皮细胞、血管内皮细胞、黏膜下腺及炎症细胞[13]。在呼吸系统也主要分布在感觉神经,包括无髓C神经纤维和小直径有髓δ神经纤维。尤其是C纤维,而C纤维几乎分布于整个呼吸系统,从上气道到下气道,直至肺实质(肺泡壁),其末梢位于气道上皮细胞间隙或在气道黏膜基底膜下直接形成网丛。TRPV1是机体的伤害感受器,酸、温度、辣椒素等多种理化因子及多种炎症介质,如缓激肽、P物质、前列腺素、三磷酸腺苷等都直接或间接激活TRPV1,TRPV1受体与某些感觉神经肽,如速激肽、降钙素基因相关肽、SP广泛的共表达[14]。在肺内TRPV1激活后,触发Ca2+内流和从感觉神经末梢释放速激肽、降钙素基因相关肽。这些感觉神经肽作用于呼吸道的一些效应细胞(例如平滑肌,胆碱能神经节,粘液腺,免疫细胞),引起细胞旁的“轴突反射”,从而致支气管收缩,蛋白渗出和炎症细胞的趋化。TRPV1活动已涉及到呼吸系统疾病的不同方面,如神经源性炎症,刺激物诱发的慢性咳嗽,气道高反应性,粘液的分泌,气道重塑等。而气道的高反应性(Airway hyper-responsiveness,AHR)、不同程度的“气道重塑”是哮喘特征性的表现[15]。
TRPV1在食管黏膜固有层及上皮细胞也有表达[16],酸刺激后,TRPV1被激活,致离子通道的开放。食管下段 TRPV1表达量与食管酸暴露时间显著相关, 研究表明TRPV1的表达量与胃食管的症状相关[17]。
本实验结果显示灌酸组和哮喘组小鼠肺部有明显的炎症反应,TRPV1在肺内表达均明显上调。在过敏原激发的哮喘小鼠,致敏原是激发因素,致肺内发生变态反应性炎症,炎症细胞分泌的炎症介质及细胞因子可致TRPV1兴奋性的增高及表达的增加,引发更灵敏的感觉及更强的神经反射,从而致气道高反应性。虽GER诱发或加重哮喘的激发因素尚不确切,但酸刺激是其最具特征性的特点,通过本实验推测多次酸刺激食管黏膜上皮及感觉神经纤维末梢,产生动作电位,通过“食管-支气管神经反射”,激活神经源性炎症从而激活支气管肺内TRPV1受体,从而导致炎症反应等的发生,引发一系列的病理生理过程。本实验哮喘组TRPV1较正常组表达增加,但通过多次食管酸灌注的小鼠气道炎症及TRPV1的表达更加明显,特别是灌酸哮喘组,可能哮喘小鼠神经反射的反应更加敏感,食管在受到酸刺激后引起了更加明显的炎症反应,所以认为TRPV1受体可能参与了GER相关哮喘的病理生理过程。
综上,多次盐酸灌注哮喘小鼠食管,可引起小鼠肺内炎症反应加重,可能通过激活TRPV1受体,再通过迷走神经介导的食管-支气管反射,引起气道的神经源性炎症,从而参与了GER相关哮喘的病理生理过程。
[1] Sontag S J,O’Connell S,et al. Asthmatics with gastroesophageal reflux: long term results of a randomized trial of medical and surgical antireflux therapies[J]. Am J Gastr, 2003, 98(5): 987-999.
[2] Prevention P. Expert Panel Report 3 (EPR-3): Guidelines for the Diagnosis and Management of Asthma-Summary Report 2007[J].J Allergy Clin Immunol, 2007, 120(5 ): 94-138.
[3] Irwin R S, Curley F J, French C L. Difficult-to-control asthma. Contributing factors and outcome of a systematic management protocol[J].Chest, 1993, 103(6): 1662-1669.
[4] McQuaid S, Warke T, Stevenson M, et al. The Sensory Receptor TRPV1 Is Expressed In Human Bronchial Epithelium And Upregulated In Refractory (Steroid Resistant) Asthma[J].Am J Respir Crit CareMed, 2010,181(1):A2490-A2490.
[5] 王强, 白雪涛, 徐东刚,等. TRPV1 UTR-3基因多态性与北京汉族儿童哮喘的易感性研究[J]. 卫生研究,2009,38(5):516-521.
[6] Nakae S, Komiyama Y, Nambu A, et al. Antigen-specific T cell sensitization is impaired in IL-17-deficient mice, causing suppression of allergic cellular and humoral responses[J]. Immunity, 2002, 17(3): 375-387.
[7] 强丽霞, 赵婷婷, 金寿德. 低分子肝素对哮喘小鼠气道黏液高分泌和炎症反应的影响[J]. 临床肺科杂志, 2015, 20(10): 1797-1801.
[8] Cui Y, Devillier P, Kuang X, et al. Tiotropium reduction of lung inflammation in a model of chronic gastro-oesophageal reflux[J]. Eur Respir J, 2010, 35(6): 1370-1376.
[9] 姚卫民, 赖克方, 刘春丽, 等. 多次食管酸灌注对哮喘豚鼠气管神经肽含量的影响[J]. 广东医学, 2009, 30(8): 1066-1069.
[10] Masoli M, Fabian D, Holt S, et al. The global burden of asthma: executive summary of the GINA Dissemination Committee report[J]. Allergy, 2004, 59(5): 469-478.
[11] Kiljander T O, Harding S M, Field S K, et al. Effects of esomeprazole 40 mg twice daily on asthma: a randomized placebo-controlled trial[J]. Am J Respir Crit Care Med, 2006, 173(10): 1091-1097.
[12] De Swert K O, Joos G F. Role of tachykinins in asthma and allergic disease[J]. New Ins Neur Biol, 2010, 5: 177-192.
[13] Watanabe N, Horie S, Michael G J, et al. Immunohistochemical co-localization of transient receptor potential vanilloid (TRPV) 1 and sensory neuropeptides in the guinea-pig respiratory system[J]. Neuroscience, 2006, 141(3): 1533-1543.
[14] Caterina M J, Schumacher M A, Tominaga M, et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway[J]. Nature, 1997, 389(6653): 816-824.
[15] De Swert K O, Joos G F. Extending the understanding of sensory neuropeptides[J]. Eur J Pharmacol, 2006, 533(1): 171-181.
[16] Matthews P J, Aziz Q, Facer P, et al. Increased capsaicin receptor TRPV1 nerve fibres in the inflamed human oesophagus[J]. Eur J Gastr Hep, 2004, 16(9): 897-902.
[17] Ma J, Harnett K M, Behar J, et al. Signaling in TRPV1-induced platelet activating factor (PAF) in human esophageal epithelial cells[J].Ajp Gastr Liv Phys,2010,298(2):233-240.
Effect of repeated esophageal acid infusion on TRPV1 receptors and the inflammatory response in airways of asthma mice
JIALi-ping,CAIZi-tao,LUOGao-chao,YAOWei-ming
DepartmentofRespiratoryMedicine,theAffiliatedHospitalofGuangdongMedicalUniversity,Zhanjiang,Guangdong524001,China
Objective To observe the influence of TRPV1 receptors in airway by repeating esophageal acid infusion in mice with asthma. Methods A total of 60 male BALB/c mice were randomly divided into six groups (the control group, the salt group, the HCl group, the asthma group, the asthma and salt group, and the asthma and HCl group). Asthma model was established by intraperitoneal injection and atomization chicken ovalbumin (ovalbumin, OVA). Mice were sacrificed in 24 hours after the last antigen stimulation. After centrifugation, HE staining was used to observe histopathological changes of lung tissues and esophagus. Immunohistochemistry was performed for detecting the expression and distribution of protein, while quantitative PCR was done for detecting mRNA of TRPV1 receptor in mouse lung tissue. Results Compared with the normal group and the salt group, the asthma and HCl group showed significant inflammation in lung and TRPV1 mRNA expression level was up-regulated, especially in the asthma and HCl group (P<0.001). Conclusion TRPV1 mRNA expression is significantly up-regulated in mice with asthma by repeating esophageal acid infusion. Presumably, the activation of TRPV1 receptors in lung and esophagus plays a role in the development of asthma caused with gastroesophageal reflux.
BALB/c mice; asthma; gastroesophageal reflux; TRPV1
10.3969/j.issn.1009-6663.2017.05.017
广东医学院博士启动项目(No.XB0816),广东医学院附属医院博士启动项目(No.10301B010012)
1. 524001 广东 湛江,广东医科大学附属医院呼吸内科
2. 438000 湖北 黄冈,黄冈市中心医院 呼吸内科
姚卫民,E-mail:490296443@qq.com
2016-08-16]
