响应面法优化微波辅助ESR-5树脂固定化胰蛋白酶
2017-04-14刘伟华姜子涛
刘伟华,李 荣,姜子涛
(天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津 300134)
响应面法优化微波辅助ESR-5树脂固定化胰蛋白酶
刘伟华,李 荣,姜子涛*
(天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津 300134)
研究了ESR-5伯氨树脂为固定化载体,微波辅助固定化胰蛋白酶的条件。通过单因素实验和响应面分析法确定了固定化胰蛋白酶的最佳条件是:微波温度35 ℃、加酶量1050 U、戊二醛质量分数0.53%、pH9.1,微波时间5 min,在此条件下制备的固定化胰蛋白酶的活力为390.77 U·g-1树脂。相比传统固定化方法需要几个小时,此固定化方法大大缩短了制备固定化酶的时间。制备的固定化胰蛋白酶在25~45 ℃的温度范围内、在pH8.5~10的碱性范围内都较稳定;重复使用11批次后,仍保留了86.7%的初始酶活力;在4 ℃储藏5周后仍保留了63.7%的初始酶活力,具有较好的稳定性。可见利用微波辅助固定化酶是一种值得尝试的高效方法。
胰蛋白酶,固定化酶,微波辅助,ESR-5伯氨树脂,响应面法
胰蛋白酶是一种碱性蛋白酶,被广泛用于食品业、制药业、皮革业、现代生物技术等领域。但由于液相胰蛋白酶易自溶、解折叠,限制了它的大规模应用。而酶固定化技术克服了这一不足,能够使酶的稳定性增加并可重复利用,并且Sun等[1]研究表明固定化胰蛋白酶相比液相胰蛋白酶能够大大缩短酶解所需的时间,酶解效率更高。然而固定化酶过程往往需要几个甚至十几个小时,比较费时。能够加速反应的方式有很多,如高温、超声、微波等。常规的加热升温虽然可以加速反应的进行,但相比微波加热所需的时间要长很多,且容易造成酶的失活。而酶在超声的作用下,其在极性的水溶液中稳定性较差。近年来,微波作为一种高效的辅助手段被广泛地应用到科学研究中,包括微波辅助合成反应、微波辅助提取、微波辅助酶解等[2-11]。
微波加热的原理是极性分子在交变电场中发生极化作用而产生分子热运动及相邻分子间摩擦,从而使电磁能转变成热能,能够加速反应缩短反应时间。由于蛋白质和多肽是强极性物质,所以可以在蛋白质和多肽参与的反应中引入微波,改变反应状态。因此,一些国内外学者对利用微波辅助制备固定化酶做了相关研究。例如在低温下采用微波辐射技术将醛缩酶、脂肪酶、木瓜蛋白酶和青霉素酰基转移酶固定化到功能化介孔泡沫硅(MCFS-NH2)载体上[12-15];Mihailovic等[16]利用微波辐射固定化脂肪酶于Eupergit(R)载体上;Van等[17]采用微波辐射固定化青霉素酰化酶、Chen等[18]在微波辐射条件下盐溶制备固定化嗜热菌蛋白酶,结果都表明微波辐射显著地缩短了固定化时间,仅需几分钟,制备得到的固定化酶活力高于游离酶且稳定性增强。另外还有利用微波辅助固定化漆酶和葡萄糖氧化酶[19]等,但对于利用微波辅助固定化胰蛋白酶尚未见报道。
树脂具有机械强度高、酶载量大等优点,被广泛用作固定化酶载体[20-21],而且以树脂为载体制备的固定化酶在装柱后可以进行连续化生产,如分解植物饼粕蛋白、鱼畜蛋白制备功能肽,饮料澄清等。
本文选用ESR-5伯氨基树脂为固定化载体,在微波辐射的条件下对胰蛋白酶进行固定化,并采用响应面分析法优化了固定化胰蛋白酶的制备工艺,为采用微波固定化胰蛋白酶提供依据。
1 材料与方法
1.1 材料与仪器
胰蛋白酶(1∶250) 上海阿拉丁生化科技股份有限公司;ESR-5伯氨基树脂 天津南开合成科技有限公司;50%戊二醛 天津市科密欧化学试剂有限公司;其余试剂 均为分析纯。
FA1104N 型电子天平 上海精密仪器有限公司;Multi SYNTH微波合成仪 意大利Milestone公司;Alpha-1500紫外可见分光光度计 上海谱元仪器有限公司;水浴恒温振荡器 天津市欧诺仪器仪表有限公司。
1.2 实验方法
1.2.1 微波辅助固定化胰蛋白酶
1.2.1.1 树脂的交联 称取ESR-5伯胺基树脂5 g于锥形瓶中,加入K2HPO4-KH2PO4缓冲液(0.2 mol/L,pH=8.0)及不同质量分数的戊二醛溶液,放入水浴恒温振荡器中振荡2 h,使树脂的伯胺基与戊二醛一端的醛基发生Schiff反应,而将戊二醛交联到载体的表面。用去离子水洗去树脂上残留的未交联的戊二醛,并将预处理过的树脂滤干备用。
1.2.1.2 酶的固定化 称取上述处理好的树脂0.5 g于60 mL磨口烧瓶中,加入用不同pH的缓冲溶液配制的胰蛋白酶溶液10 mL,置于微波合成仪中,反应一定时间后将其取出,用蒸馏水洗净树脂上未固定的胰蛋白酶(洗至洗涤液在280 nm波长处无吸收),将树脂滤干,即得固定化胰蛋白酶。
1.2.2 酶活力的测定方法 采用福林酚法[22]。在40 ℃、pH8.0的条件下,以1 min内水解酪蛋白产生1 μg酪氨酸所需的酶量为一个酶活力单位,用U表示。相对酶活力以各组实验的最高酶活力为100%进行折算。
1.2.3 单因素实验 进行单因素实验,考察各因素变量对固定化胰蛋白酶的酶活力的影响。
固定戊二醛质量分数为0.5%、微波温度30 ℃、pH8、微波时间3 min,考察不同加酶量(600~1200 U)对固定化胰蛋白酶活力的影响;
固定加酶量1000 U、微波温度30 ℃、pH8、微波时间3 min,考察不同戊二醛质量分数(0.1%~1.5%)对固定化胰蛋白酶活力的影响;
固定加酶量1000 U、戊二醛质量分数0.5%、pH8、微波时间3 min,考察不同微波温度(15~45 ℃)对固定化胰蛋白酶活力的影响;
固定加酶量1000 U、戊二醛质量分数0.5%、微波温度35 ℃、微波时间3 min,考察不同pH(7~10)对固定化胰蛋白酶活力的影响;
固定加酶量1000 U、戊二醛质量分数0.5%、pH9、考察不同微波时间(2.5~25.5 min)对固定化胰蛋白酶活力的影响。
1.2.4 响应面实验设计 在单因素实验的基础上,通过方差分析选取主要的影响因素并采用Box-Behnken的中心组合原理,设计实验方案,对实验数据进行响应面分析。响应面的因素编码及变量水平如表1所示。

表1 响应面因素编码及水平表
1.2.5 固定化胰蛋白酶的特性研究
1.2.5.1 温度稳定性 将固定化胰蛋白酶分别在25、35、45、55、65 ℃不同温度的水浴中放置3 h后测定其酶活力。
1.2.5.2 酸碱稳定性 将固定化胰蛋白酶分别置于pH为6、7、8、9、10的缓冲液中在室温下放置3 h后测定固定化酶的活力。
1.2.5.3 重复使用性 按照1.2.2的方法,重复使用固定化的胰蛋白酶,并测定使用完1次、3次、5次、7次、9次、11次后的固定化酶的活力,每次使用完将固定化酶用缓冲液清洗干净并将其置于新的底物中继续反应。
1.2.5.4 储藏稳定性 将固定化胰蛋白酶置于4 ℃冰箱密封保存,每隔一周测定其活力。
1.3 数据处理
采用SPSS软件处理单因素实验数据进行显著性分析,采用Design-Expert 8.0.5进行响应面实验设计及数据分析。
2 结果与讨论
2.1 单因素实验结果
分别测定了不同加酶量、戊二醛质量分数、微波温度、pH及固定化时间条件下固载的固定化胰蛋白酶的活力,结果见图1~图5。
如图1所示,随着酶添加量的增加,酶活力增大,当加酶量大于1000 U后固定化胰蛋白酶的活力不再增大,这是因为载体上交联的醛基是一定的,过多的酶分子在载体表面聚集会产生空间位阻,影响蛋白的最佳构象状态。
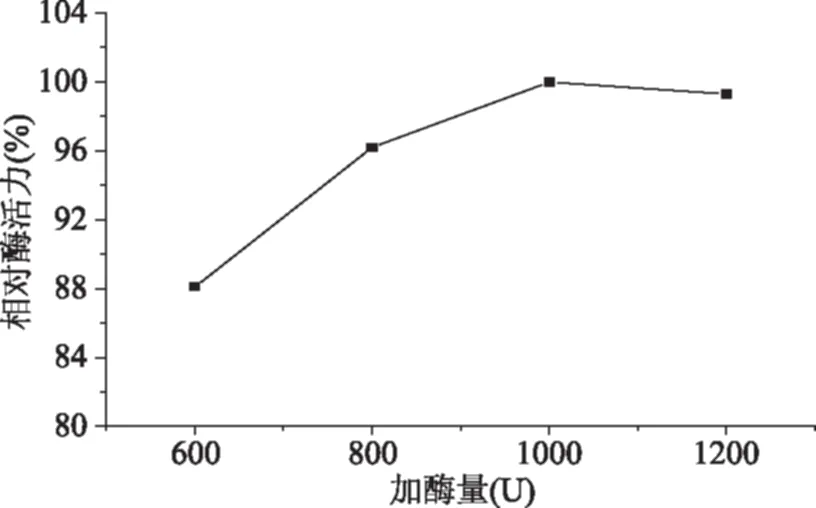
图1 加酶量对固定化胰蛋白酶相对活力的影响Fig.1 Effect of dosage of trypsin on relative activity of immobilized trypsin
如图2所示,当戊二醛质量分数为0.5%时,固定化胰蛋白酶的活力较大。因为当戊二醛浓度较低时,可与伯氨基树脂交联的醛基较少,固定化的胰蛋白酶少,因此单位质量的固定化酶活力较低;而戊二醛质量分数过高时,载体上的活性氨基充分发生交联反应,固载的酶量大。但是由于在固定化酶体系中,催化反应属于扩散控制,密集的排列会引起较大的立体障碍和扩散阻力,且造成酶的活性中心相互竞争底物,导致酶不能与底物有效地接触,从而影响酶的活力[23]。另外,戊二醛质量分数过高,载体上的氨基与戊二醛发生分子内或分子间交联,会导致载体与酶的结合能力降低[24]。
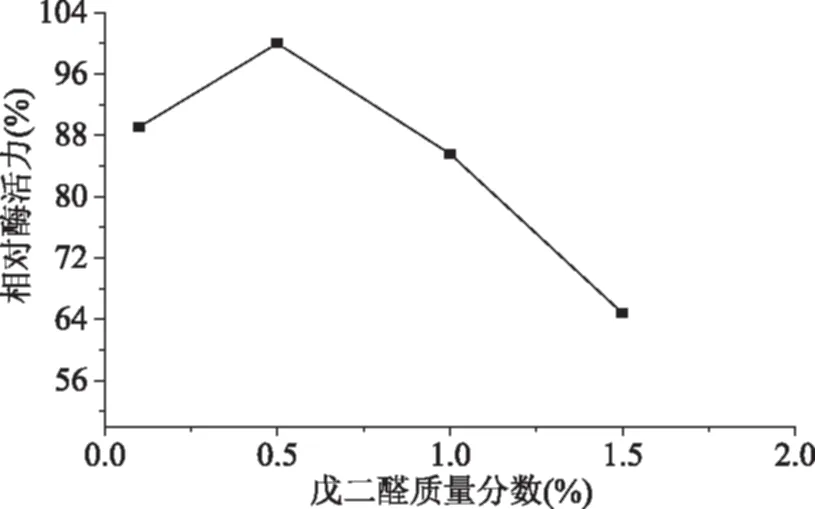
图2 戊二醛质量分数对固定化胰蛋白酶相对活力的影响Fig.2 Effect of glutaraldehyde concentration on relative activity of immobilized trypsin
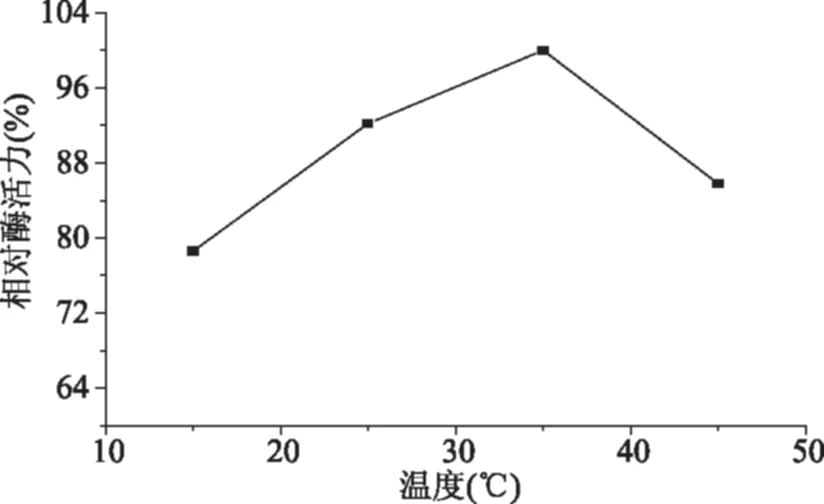
图3 微波温度对固定化胰蛋白酶相对活力的影响Fig.3 Effect of microwave temperature on relative activity of immobilized trypsin
本实验所用的微波合成仪的工作原理是自动选择适当的功率以达到并维持所设定的温度,在35 ℃时固定化酶活力较高,一方面是因为该温度接近胰蛋白酶的最适温度,另一方面可能是在此温度下所需的微波功率较为适宜。
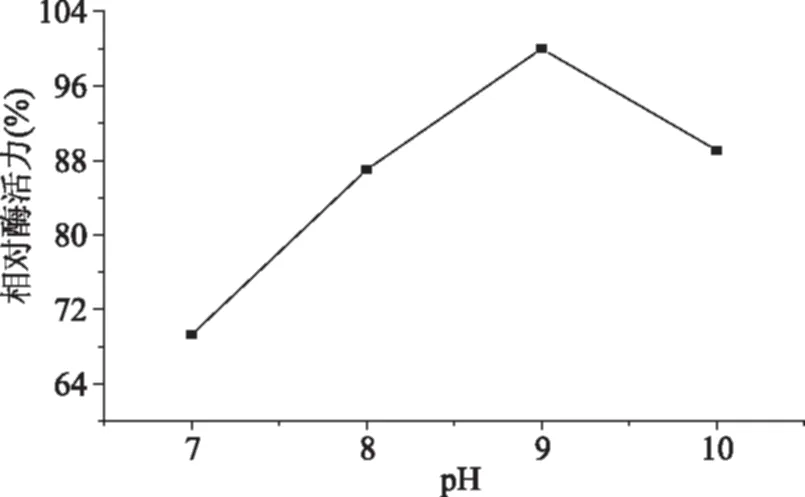
图4 pH对固定化胰蛋白酶相对活力的影响Fig.4 Effect of pH on relative activity of immobilized trypsin
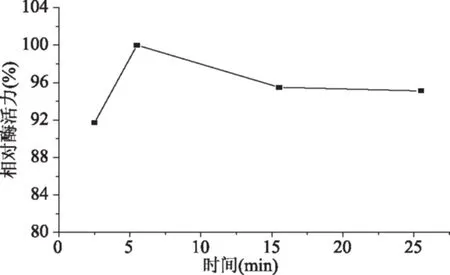
图5 固定化时间对固定化胰蛋白酶相对活力的影响Fig.5 Effect of immobilization time on relative activity of immobilized trypsin
固定化酶的载体本身会改变酶活性位点周围的pH,因为载体可以诱导溶液中分子与载体间的静电平衡和疏水相互作用,这些相互作用可以改变酶反应时的微环境[25]。pH9是制备的固定化胰蛋白酶的较适pH,此时固定化胰蛋白酶的活力较大。
随着固定化反应时间的增加固定化胰蛋白酶的活力先增大后减小,这是因为长时间的微波辐射会破坏酶的分子结构降低酶活力[26],固定化时间为5 min时固定化胰蛋白酶的活力较大。
2.2 响应面法优化固定化胰蛋白酶条件
通过SPSS处理单因素实验数据,确定影响固定化酶活力的各因素的大小关系为:加酶量>pH>微波温度>戊二醛质量分数>时间。其中微波时间对固定化酶活力影响的显著性远小于其他因素,故选取加酶量、pH、微波温度、戊二醛质量分数四个因素进行响应面实验设计,实验设计及结果见表2。
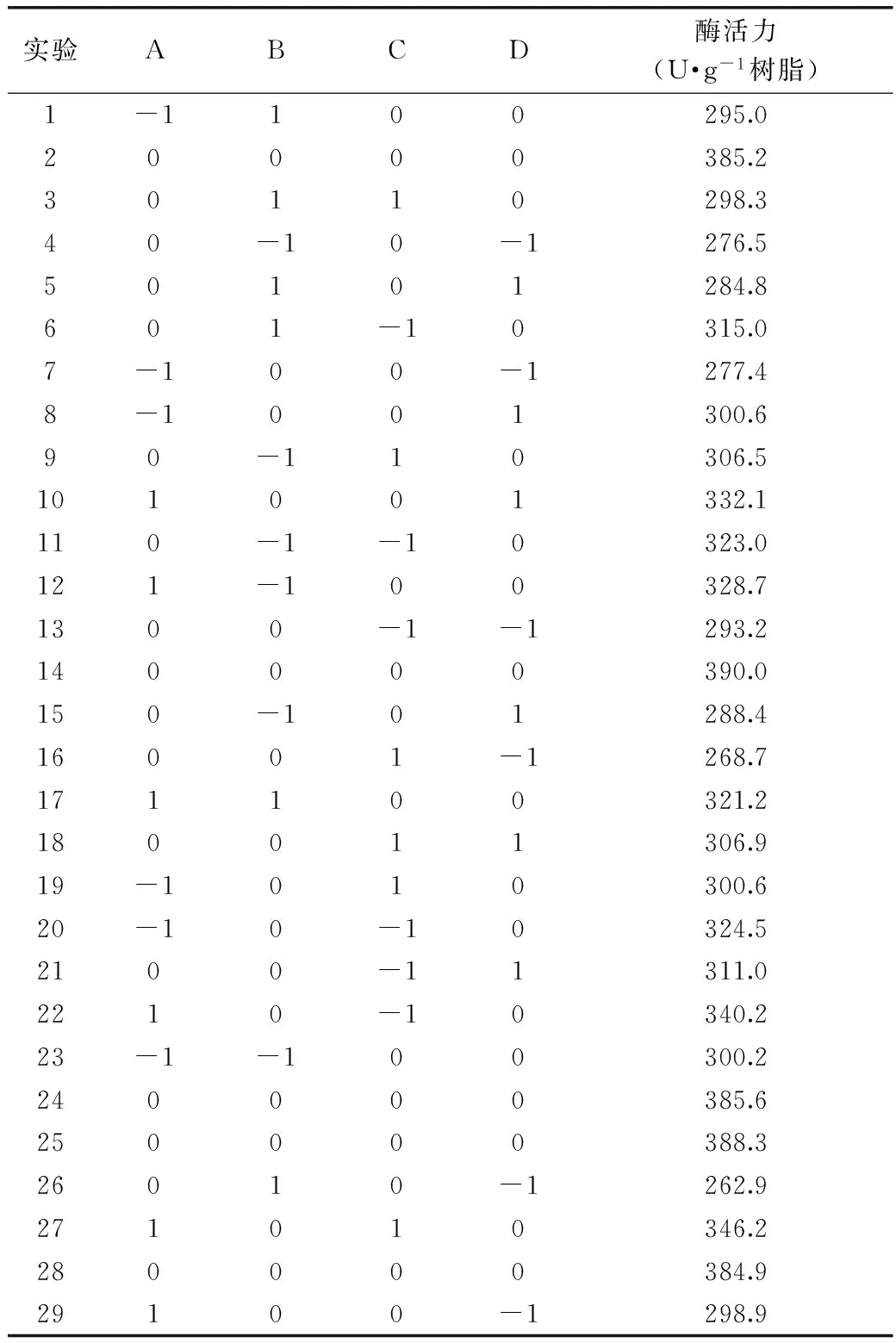
表2 响应面实验方案及结果
2.3 二次回归方程拟合和方差分析
利用Design-Expert 8.0.5对实验结果进行拟合,得到以酶活力y为响应值,对自变量加酶量A、戊二醛质量分数B、温度C和pH D四个因素的回归方程为:
y=-6131.5716+52.2402A+206.8580B+68.3739C+1039.5778D-0.3199AB+0.3738AC+0.6250AD-0.0222BC+5.5556BD+1.0200CD-1.6812A2-234.7531B2-1.2335C2-59.9250D2
由表3的数据可知,模型的p值<0.0001,说明模型变量与四个自变量之间的线性关系极其显著。失拟项p=0.1067>0.05,不显著。对回归方程各项的方差分析结果表明,方程的一次项、二次项及交互项AC的p值均<0.01,是极显著的,交互项CD(p<0.05)是显著的,而交互项AB、AD、BC、BD是不显著的。各因素对固定化酶活力的影响依次为:加酶量>pH>微波温度>戊二醛质量分数,与SPSS分析结果一致。
加酶量与微波温度及微波温度与pH对固定化酶活力交互影响的三维空间曲面图见图6~图7。
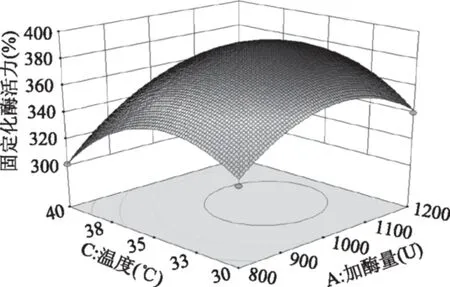
图6 加酶量和微波温度对固定化酶活力交互影响响应面图Fig.6 Response surface graph of added trypsin amount and microwave temperature vs immobilized enzyme activity
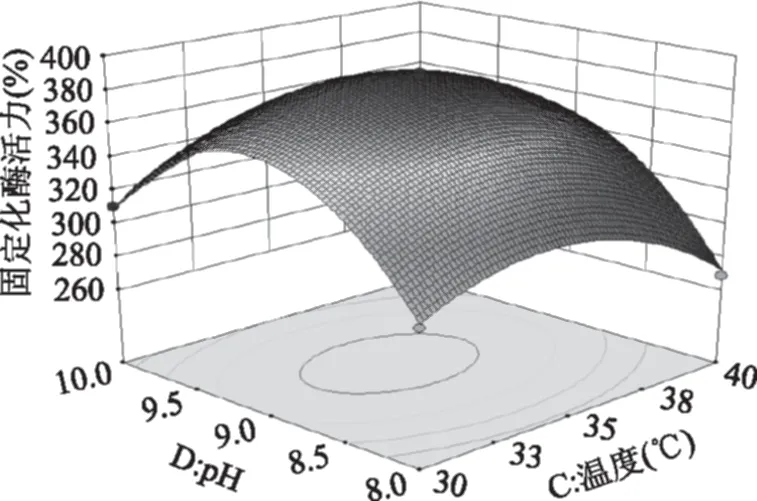
图7 微波温度和pH对固定化酶活力交互影响响应面图Fig.7 Response surface graph of microwave temperature and pH vs immobilized enzyme activity
加酶量A与微波温度C这两个因素对固定化酶活力的交互影响是极显著的,从图6可以看出,随着加酶量及微波温度的增加,固定化酶的活力先升高之后又下降,A、C对固定化酶交互作用的最大值在实验设计水平范围内,且加酶量对固定化酶活力的影响比微波温度更加显著。微波温度C与pH D这两个因素对固定化酶活力的交互影响是显著的,从图7可以看出,C、D对固定化酶交互作用的最大值在实验设计水平的范围内,且pH对固定化酶的影响比微波温度更加显著。
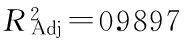
2.4 最优条件验证实验
调整后的回归模型预测固定化酶的最佳工艺条件为:加酶量1050 U、戊二醛质量分数0.53%、微波温度34.65 ℃、pH9.10,微波时间5 min,在此条件下酶活力的预测值为389.48 U·g-1树脂。考虑到实验的可操作性,修正最佳工艺条件为,加酶量1050 U、戊二醛质量分数0.53%、微波温度35 ℃、pH9.1,微波时间5 min。在此条件下进行三次平行验证实验,固定化胰蛋白酶的活力为390.77 U·g-1树脂,相对误差为0.33%,与预测值接近。
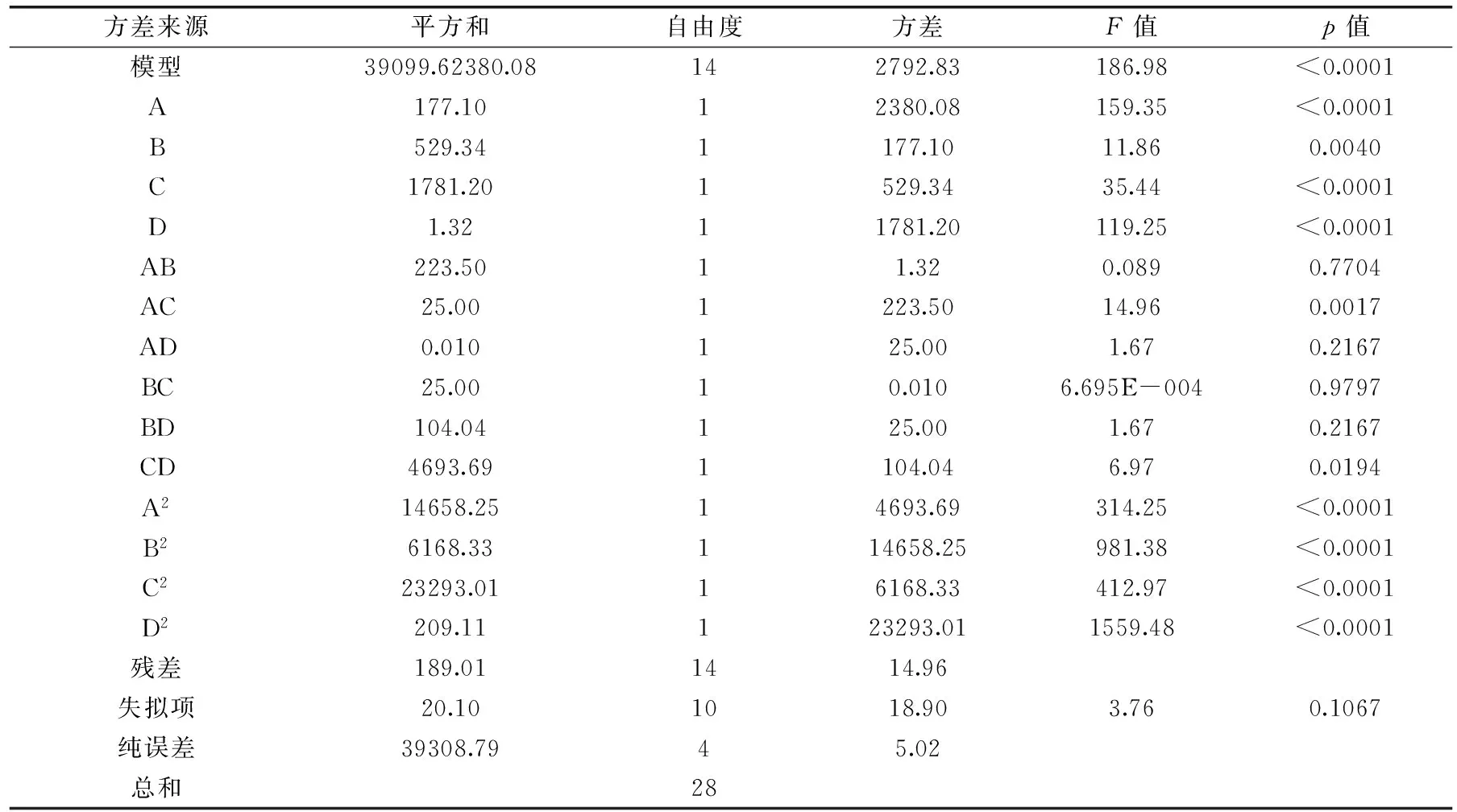
表3 回归方程的方差分析
2.5 固定化胰蛋白酶的特性
2.5.1 温度稳定性 将固定化胰蛋白酶分别在25、35、45、55、65 ℃不同温度的水浴中放置3 h后测定其酶活力,并换算出不同温度的水浴处理后的固定化酶的相对酶活力,结果如图8所示。

图8 固定化胰蛋白酶的温度稳定性Fig.8 Temperature stability of immobilized trypsin
由图8可知,固定化胰蛋白酶在25~45 ℃时比较稳定,当温度高于55 ℃固定化胰蛋白酶的活力迅速降低。
2.5.2 酸碱稳定性 将固定化胰蛋白酶分别置于pH为6、7、8、9、10的缓冲液中在室温下放置3 h,以最高酶活力为100%,换算出各pH条件下的相对酶活力,结果如图9所示。

图9 固定化胰蛋白酶的酸碱稳定性Fig.9 pH stability of immobilized trypsin
由于固定化后胰蛋白酶的分子构象发生变化,固定化胰蛋白酶在pH为9的缓冲液中最为稳定,酶活力最高,在pH10的缓冲液中活力次之,较为稳定。所以此固定化胰蛋白酶适合在碱性条件下进行酶解反应。
2.5.3 重复使用性 按照1.2.2的方法,重复使用固定化的胰蛋白酶,并测定使用完1次、3次、5次、7次、9次、11次后的固定化酶的活力,每次使用完将固定化酶用缓冲液清洗干净并将其置于新的底物中继续反应。以第一次的酶活力为100%,换算出不同使用次数后固定化酶的相对酶活力,结果如图10所示。
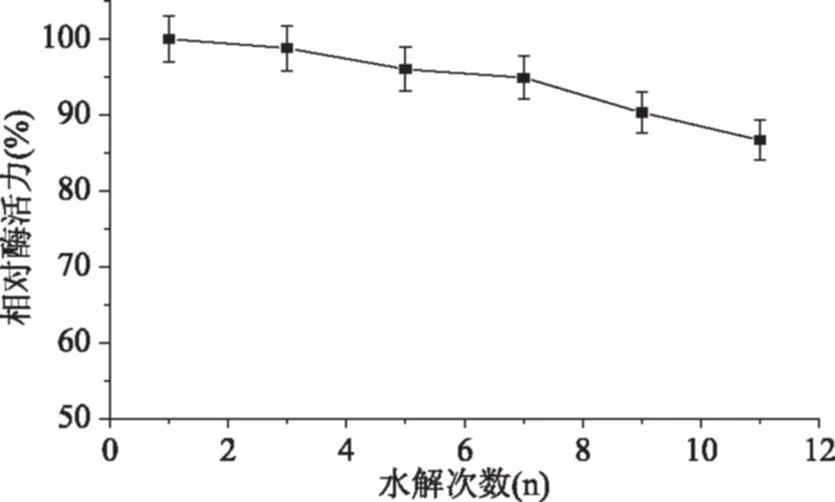
图10 固定化胰蛋白酶的重复使用性Fig.10 Reusability of immobilized trypsin
制备的固定化胰蛋白酶可以反复多次使用,重复使用11次后,仍保留了86.7%的初始酶活力,具有较好的操作稳定性。
2.5.4 储藏稳定性 将固定化胰蛋白酶置于4 ℃冰箱密封保存,每隔一周测定其活力,以最初酶活力为100%,换算出保存了不同时间的固定化酶的活力,结果如图11所示。
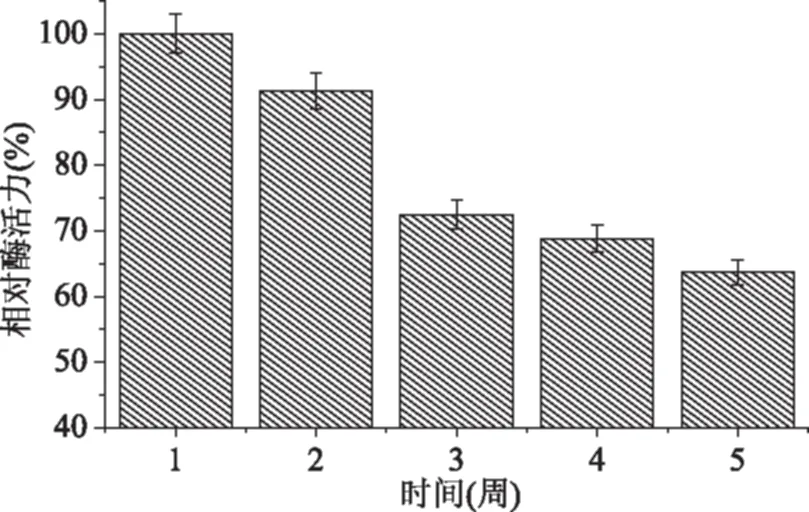
图11 固定化胰蛋白酶的储藏稳定性Fig.11 Storage stability of immobilized trypsin
固定化胰蛋白酶在前两周的活力几乎保持不变,随着储藏时间的延长酶活力发生不同程度的下降,储藏3周后酶活力下降幅度较大,随后下降幅度减小,不过在储藏5周后仍保留了63.7%的初始酶活力。
3 结论
在微波辅助的条件下,以ESR-5伯氨树脂为固定化载体制备出固定化胰蛋白酶。通过单因素实验和响应面分析法确定了在加酶量1050 U、戊二醛质量分数0.53%、pH9.1、微波温度35 ℃及微波时间5 min的最佳条件下制备得到的固定化胰蛋白酶活力为390.77 U·g-1树脂。此固定化胰蛋白酶在25~45 ℃的温度范围内、在pH8.5~10的碱性范围内都较稳定;重复使用11批次后,仍保留了86.7%的初始酶活力;在4 ℃储藏5周后仍保留了63.7%的初始酶活力,制备的固定化胰蛋白酶具有一定的稳定性,拓宽了胰蛋白酶的使用范围。这也证明,微波作为一种高效的辅助方法用来固定化酶是可行的。
[1]Sun LL,Zhu GJ,Yan XJ,et al. Uncovering immobilized trypsin digestion features from large-scale proteome data generated by high-resolution mass spectrometry[J]. Journal of Chromatography A,2014,1337:40-47.
[2]Li LQ,Yang JH,Li JJ,et al. Synthesis of high performance mordenite membranes from fluoride containing dilute solution under microwave-assisted heating[J]. Journal of Membrane Science,2016,512:83-92.
[3]Nahas MN,Jilani A,Salah N. Microwave synthesis of ultrathin,non-agglomerated CuO nanosheets and their evaluation as nanofillers for polymer nanocomposites[J]. Journal of Alloys and Compounds,2016,680:350-358.
[4]Fisher TJ,Wang MY,Ibrahim Y,et al. Effect of sodium nitrate on microwave-assisted synthesis of ceria nanocubes[J]. Materials Letters,2016,178:71-74.
[5]Medina AL,da Silva MAO,Barbosa HD,et al. Rapid microwave assisted extraction of meat lipids[J]. Food Research International,2015,78:124-130.
[6]Pan JY,Muppaneni T,Sun YQ,et al. Microwave-assisted extraction of lipids from microalgae using an ionic liquid solvent[BMIM][HSO4][J]. Fuel,2016,178:49-55.
[7]Tsubaki S,Oono K,Hiraoka M,et al. Microwave-assisted hydrothermal extraction of sulfated polysaccharides from Ulva spp. and Monostroma latissimum[J]. Food Chemistry,2016,210:311-316.
[8]Mamaeva A,Tahmasebi A,Tian L,et al. Microwave-assisted catalytic pyrolysis of lignocellulosic biomass for production of phenolic-rich bio-oil[J]. Bioresource Technology,2016,211:382-389.
[9]Serrano A,Siles JA,Martin MA,et al. Improvement of anaerobic digestion of sewage sludge through microwave pre-treatment[J]. Journal of Environmental Management,2016,177:231-239.
[10]Oliveira JSS,Picoloto RS,Bizzi CA,et al. Microwave-assisted ultraviolet digestion of petroleum coke for the simultaneous determination of nickel,vanadium and sulfur by ICP-OES[J]. Talanta,2015,144:1052-1058.
[11]Ruan GH,Chen ZY,Wei MP,et al. The study on microwave assisted enzymatic digestion of ginkgo protein[J]. Journal of Molecular Catalysis B:Enzymatic,2013,94:24-28.
[12]Wang AM,Wang MZ,Wang QY,et al. Stable and efficient immobilization technique of aldolase under consecutive microwave irradiation at low temperature[J]. Bioresource Technology,2011,102:469-474.
[13]Wang AM,Liu MQ,Wang H,et al. Improving enzyme immobilization in mesocellular siliceous foams by microwave irradiation[J]. Journal of Bioscience and Bioengineering,2008,106:286-291.
[14]Wang AM,Zhou C,Du ZQ,et al. Enhancement of microwave-assisted covalent immobilization of penicillin acylase using macromolecular crowding and glycine quenching[J]. Journal of Bioscience and Bioengineering,2009,107:219-224.
[15]Du ZQ,Wang AM,Zhou C,et al. Microwave-Assisted lipase covalent immobilization and improved its thermal stability using alcohols to quench excessive activated groups on support surface[J]. Journal of Chemical Engineering of Japan,2009,42:441-446.
[16]Mihailovic MD,Knezevic-Jugovic ZD,Mijin DZ,et al. Optimization of esterification activity of lipase from Candida rugosa immobilized using microwave irradiation[J]. Hemijska Industrija,2012,66(1):9-19.
[17]Van Langen LM,Janssen MHA,Oosthoek NHP,et al. Active site titration as a tool for the evaluation of immobilization procedures of penicillin acylase[J]. Biotechnology and Bioengineering,2002,79:224-228.
[18]Chen FF,Zhang FK,Du FC,et al. A novel and efficient method for the immobilization of thermolysin using sodium chloride salting-in and consecutive microwave irradiation[J]. Bioresource Technology,2012,115:158-163.
[19]Plagemann R,Von Langermann J,Kragl U. Microwave-assisted covalent immobilization of enzymes on inorganic surfaces[J]. Engineering in Life Science,2014,14(5):493-499.
[20]Datta S,Christena LR,Rajaram YRS. Enzyme immobilization:an overview on techniques and support materials[J]. 3 Biotech,2013,3(1):1-9.
[21]马驰宇,黄晓娟,黄丽洋,等. 氨基树脂固定胃蛋白酶的方法及性质研究[J]. 精细与专用化学品,2010,18(7):41-44.
[22]朱俭. 生物化学实验[M]. 上海:上海科学技术出版社,1981.
[23]张黎明,袁永俊,徐梦虬. 壳聚糖微球固定化胰蛋白酶条件初探[J]. 中国乳品工业,2009,5:16-18.
[24]师广波,马艳芳,郑明刚,等. 壳聚糖固定化风味蛋白酶的制备及其酶学特性[J]. 食品科学技术学报,2015,33(4):27-32.
[25]Martin AB,Picciolato M,Heras A. Coimmobilization of enzymes and cells on chitosan and derivatives[J]. Progress in Biotechnology,1998,15:679-684.
[26]Rejasse B,BessonEn T,Legoy MD,et al. Influence of microwave radiation on free Candida antarctica lipase B activity and stability[J]. Organic & Biomolecular Chemistry,2006,4(19):3703-3707.
[27]李莉,张赛,何强,等. 响应面法在实验设计与优化中的应用[J]. 实验室研究与探索,2015,34(8):41-45.
Optimization of microwave-assisted immobilization of trypsin on ESR-5 resin using response surface methodology
LIU Wei-hua,LI Rong,JIANG Zi-tao*
(Tianjin Key Laboratory of Food Biotechnology,College of Biotechnology and Food Science,Tianjin University of Commerce,Tianjin 300134,China)
With ESR-5 amino resin as immobilization carrier,the condition of microwave-assisted immobilization of trypsin was studied. Through single factor experiments and response surface methodology(RSM),the optimum conditions for immobilization were determined as follows:microwave temperature 35 ℃,addition of trypsin 1050 U,glutaraldehyde concentration 0.53%,pH9.1 and microwave time 5 min. On this condition,the activity of the immobilized trypsin was 390.77 U per gram resin. Compared with the traditional immobilization method needed a few hours,this method greatly shortened the time of preparation of immobilized trypsin. The immobilized trypsin had good stabilities. In 25~45 ℃ temperature range and in the range of pH8.5~10,the immobilized trypsin was stable. After reused for 11 batches and 5 weeks storage at 4 ℃,it respectively retained 86.7% and 63.7% of its initial activity. Thus,using microwave to immobilize enzyme is a worth trying and efficient method.
trypsin;immobilized enzyme;microwave-assisted;ESR-5 amino resin;RSM
2016-06-28
刘伟华(1990-),女,硕士研究生,研究方向:食品添加剂,E-mail:1059492293@qq.com。
*通讯作者:姜子涛(1956-),教授,博士,研究方向:食品添加剂,E-mail:ztjiang@tjcu.edu.cn。
天津市自然科学基金重点项目(12JCZDJC34100)。
TS201.2
A
1002-0306(2017)06-0217-07
10.13386/j.issn1002-0306.2017.06.033
