椰子SSR-PCR反应体系的优化
2017-04-14周丽霞
周丽霞
(中国热带农业科学院 椰子研究所/海南省热带油料作物生物学重点实验室,海南 文昌 571339)
椰子SSR-PCR反应体系的优化
周丽霞
(中国热带农业科学院 椰子研究所/海南省热带油料作物生物学重点实验室,海南 文昌 571339)
为进一步开发利用椰子种质资源和开展分子标记辅助幼苗早期筛选及遗传育种工作,采用L9(34)正交试验设计,探索了椰子SSR-PCR的最佳反应体系。通过对模板DNA、Mg2+、dNTPs、Taq酶、引物、退火温度的筛选优化,建立了椰子SSR-PCR最佳反应体系(10 μL)为:模板DNA 60 ng、Mg2+2.5 mmol/L、dNTP 250 μmol/L、Taq酶0.5 μmol、引物0.5 μmol/L、退火温度58 ℃,在该体系条件下,PCR扩增条带最为清晰,该反应体系的优化,为今后应用SSR标记技术为椰子群体结构分析、种质资源丰富度、基因定位和遗传育种等研究奠定工作基础。
椰子;正交设计;SSR-PCR;体系优化
椰子在我国海南、广东等热带地区都有一定规模的种植,其不仅是热带地区园林绿化的主要植物,也是典型的木本油料作物和食品能源作物,具有重要的社会经济价值[1-2]。据调查统计,我国椰子的种质资源相对丰富,为优良品种的选育奠定了遗传基础。常规的育种方法非常耗时,周期较长,随着高通量测序技术的发展,分子标记的开发和应用已越来越成熟,诸多研究小组已将该技术应用到分子辅助育种工作中,如:油茶、药用菊花和水稻等[3-5]。此外,通过对目标性状紧密连锁基因进行标记,可方便、准确和快捷地对早期幼苗进行筛选,这不仅缩短了大量的选择时间,还节约了劳动力成本和土地等资源。
常用的分子标记技术有RAPD、RFLP、AFLP、ISSR和SSR等。其中,SSR又称微卫星,是一段为1~5个核苷酸重复单元的简单串联重复序列。SSR普遍存在于动植物基因组中,主要根据特异性引物的PCR扩增,经聚丙烯酰胺垂直电泳并银染显色,来判断物种的多态性[6-7]。相对其他几种分子标记技术,SSR分子标记具有明显的优势:呈共显性、所需DNA样本量较少、重复性好等,因此,SSR分子标记技术是植物遗传研究领域中重要的手段之一。
目前,我国应用SSR分子标记技术对椰子种质资源、分子育种方面的研究相对有限,摸索SSR反应体系中各种因素的最佳条件,对SSR-PCR反应体系进行最优化,对SSR分子标记的挖掘十分关键,因此,本研究采用L9(34)正交设计试验[8],通过对SSR-PCR反应体系各种因素进行筛选和优化来建立SSR-PCR反应最佳体系,同时利用该体系完成多态性SSR引物的筛选工作。
1 材料与方法
1.1 材料和试剂
本地高种椰子材料均来自中国热带农业科学院椰子资源圃,取椰子嫩叶作为试验样本,完成DNA提取工作。
SSR-PCR反应中的Taq酶、dNTPs、Mg2+、PCR buffer、DNA提取所需试剂、琼脂糖电泳所需试剂均订购于海南省合辉实业有限公司,2000 bp Marker订购于天根生化科技有限公司。
根据Illumina高通量测序获得的椰子转录组数据,应用Primer 5软件设计SSR引物,SSR引物由深圳华大科技有限公司合成,引物1:Forward:5′-GGGAATAACAAAGCAGCAAAAC-3′,Reverse:5′-CCCCTACTAATGTCCACCAGAA-3′。
1.2 DNA提取
椰子基因组DNA提取采用CATB法,稍有改进[9]。称取0.3 g椰子叶片样本,液氮磨碎,转入2 mL离心管中,加入600~700 μL CTAB提取液,65 ℃水浴保温45~60 min后取出离心管,使其自然降至室温,加入500 μL氯仿∶异戊醇(24∶1),上下颠倒混匀后,静置10 min,10000 r/min离心8 min,吸取上清液,加入等体积(600 μL)冰冻的无水乙醇静置5 min,用枪头挑出DNA,用75%乙醇浸泡过夜,挑出DNA至1.5 mL离心管中使其干燥后,加入100 μL ddH2O溶解,-80 ℃保存。
1.3 PCR扩增反应和电泳检测
PCR反应扩增程序为:94 ℃预变性5 min,35个循环(94 ℃变性30 s,退火温度复性30 s,72 ℃延伸30 s),最后72 ℃延伸7 min,22 ℃保存。
1%琼脂糖凝胶电泳检测:取4 μL PCR扩增产物和2 μL 6×Loading Buffer混匀,点入含有1 mg/L溴化乙锭的1%琼脂糖凝胶中,用1×TAE buffer在恒压120 V下电泳约40 min,最后用紫外凝胶成像系统成像。
1.4 PCR反应体系的正交试验设计
应用L9(34)正交试验设计,首先对dNTPs、Mg2+、Taq DNA聚合酶和引物浓度进行优化,设计方案见表1和表2,找出最优组合后,再对DNA的用量进行优化,试验各组合均为10 μL反应体系。
1.5 退火温度(Tm)筛选
根据引物的理论Tm设计4个梯度温度,分别为:54、58、62、66 ℃,随机选取编号为714、1687、740和753的椰子样本进行SSR-PCR扩增,确定最佳退火温度。
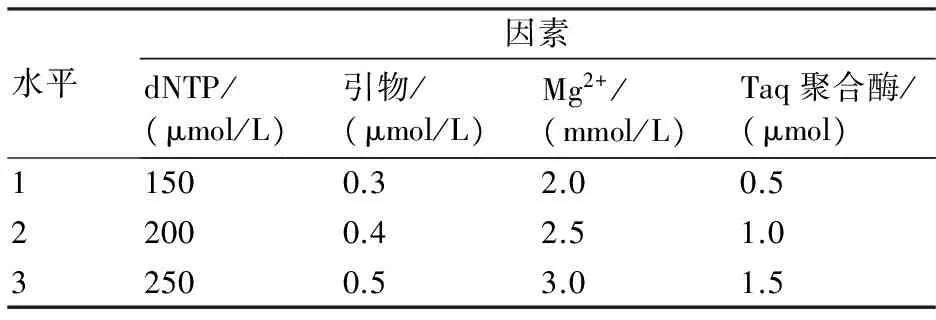
表1 SSR-PCR体系的因素

表2 SSR-PCR正交试验设计方案
1.6 体系稳定性检测
随机选取5对SSR引物,选用黄矮椰子品种的DNA对优化后的SSR-PCR体系及参数进行可靠性和稳定性考察,每对引物重复2次。
2 结果与分析
2.1 SSR-PCR反应体系的L9(34)正交优化
由图1可知,L9(34)正交设计9个组合的SSR-PCR反应体系扩增结果,4个影响因素不同浓度的组合使得扩增结果存在明显差异。第1、7和8组扩增条带明亮,条带大小与理论值相符,但出现了明显的引物二聚体,第2、3和4组条带亮度相对较弱,第5和6组扩增结果有轻微不稳定性,每组的亮度不一致,重复性不太理想。第9组扩增的条带明亮、清晰,切条带大小与理论值相符,重复性较好,亮度一致,无引物二聚体。
根据对各组合扩增结果的比较分析,第9组的各种因素组合为最佳选择,即10 μL反应体系中含2.5 mmol/L Mg2+、250 μmol/L dNTP、0.5 μmol Taq DNA聚合酶、0.5 μmol/L引物。
2.2 模板DNA浓度对SSR-PCR扩增结果的影响
在最佳组合条件下,为进一步考察样本DNA的用量,本试验分别选用30、40、50、60、70 ng/10 μL。由图2可知,DNA用量为30、40和50 ng/10 μL时,条带(1、2和3组)亮度较差,DNA用量为60和70 ng/10 μL时,条带(4和5)结果明亮清晰,扩增特异性较好,无条带弥散和引物二聚体出现,从节约DNA样本的角度考虑,笔者选用60 ng/10 μL为该体系的DNA模板的最佳浓度水平。
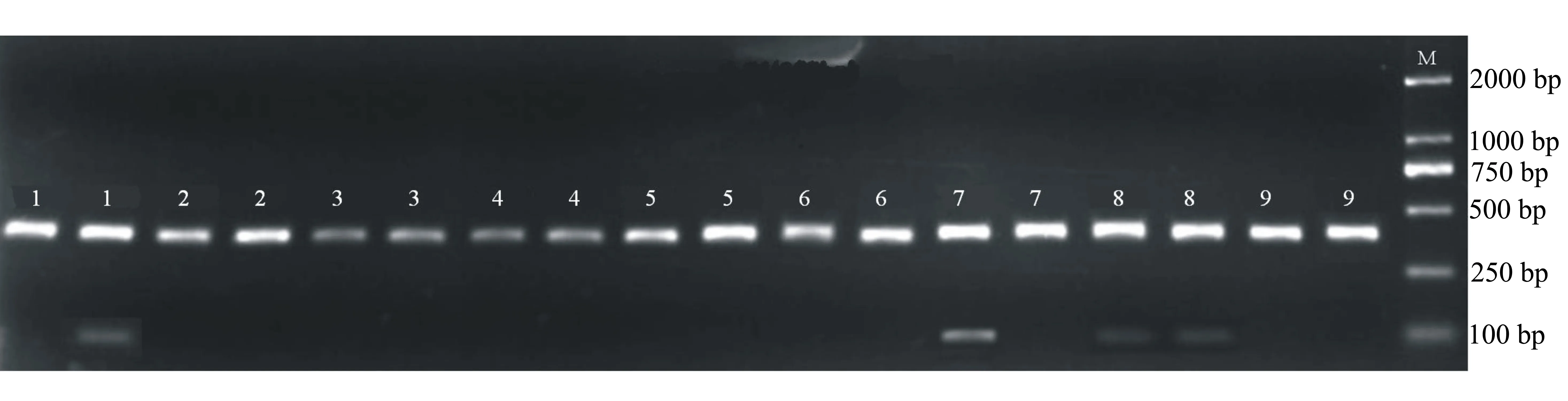
M:marker,1~9:组合编号,每个组合重复2次

图2 不同浓度模板DNA的SSR-PCR扩增结果
2.3 退火温度对SSR-PCR扩增结果的影响
退火温度在一定程度上决定了引物与模板的特
异性结合,从而影响了扩增结果。由图3可知,在58 ℃时扩增出的条带清晰明亮,而在54、62 ℃条件下,条带亮度较弱,66 ℃条件下无条带出现。因此,该体系的最佳退火温度为58 ℃。
2.4 SSR-PCR体系的稳定性考察
随机选取5对SSR引物,选用黄矮椰子品种的DNA对优化后的椰子SSR-PCR体系及参数进行可靠性和稳定性考察,每对引物重复2次。结果表明:5对引物的扩增结果均清晰明亮,特异性强,无弥散条带和引物二聚体的出现,每对引物的重复性均较好,该结果表明椰子SSR-PCR体系参数具有较好的可靠性和稳定性(图4)。
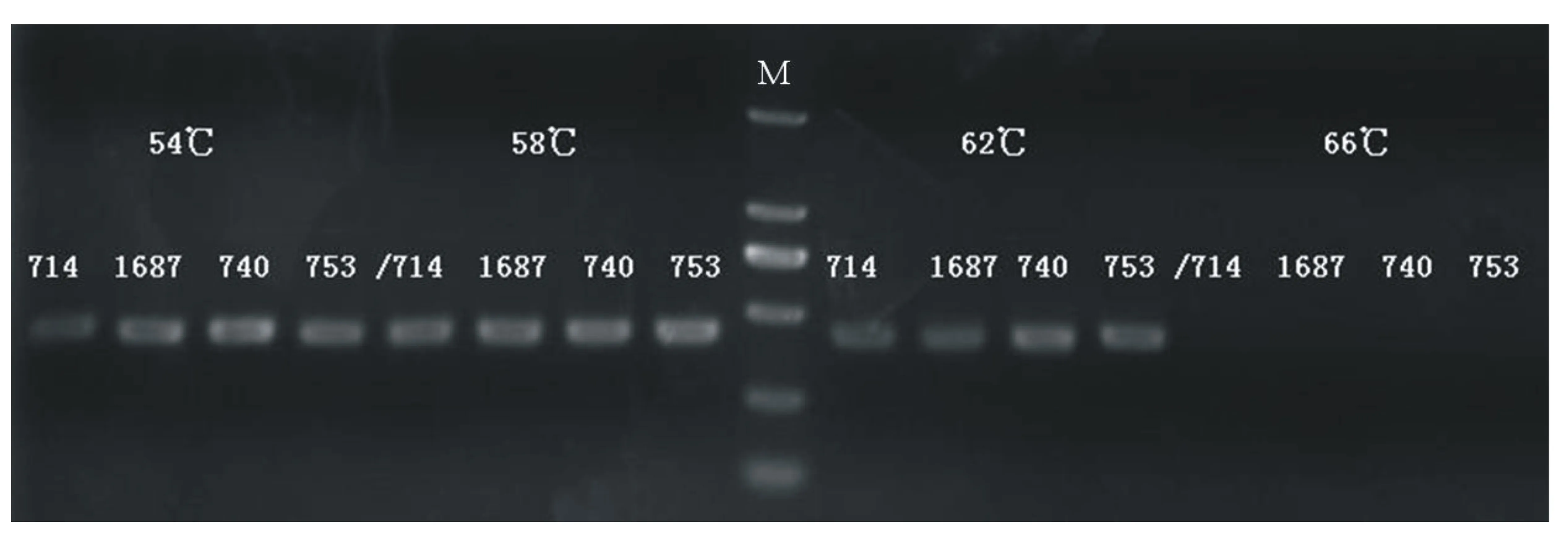
图3 不同退火温度的SSR-PCR扩增结果

图4 SSR-PCR体系的稳定性结果
3 讨论
在常用的分子标记技术(RAPD、RFLP、AFLP、ISSR、SSR)中,SSR分子标记具有显著的优势:呈共显性、重复性好、对样本DNA的纯度要求不高等,因此,SSR分子标记技术是植物遗传研究领域中重要的手段之一。
椰子作为我国海南地区的主要木本油料作物和食品能源作物之一,栽培历史悠久,其经过长期的自然选择和人工选择,已形成多个品种,为优良品种的选育奠定了遗传基础。诸多研究小组已将分子标记技术应用到分子辅助育种工作中,如油茶、药用菊花和水稻等,但应用SSR分子标记技术对椰子种质资源、分子育种方面的研究相对有限。
探索PCR反应体系中各种因素的最佳条件,对SSR-PCR反应体系进行最优化,对SSR分子标记的挖掘十分关键。本研究对椰子SSR-PCR反应体系中的dNTP、引物、Mg2+、Taq酶、退火温度、模板DNA等因素进行优化,通过L9(34)正交试验,发现不同的组合对扩增结果的影响较大。其中,Taq酶用量过大不仅造成试剂的浪费,而且会带来引物二聚体。而Mg2+作为Taq酶的辅酶,其浓度的高低会影响Taq酶的活性,浓度较低时会使得酶活性降低,而浓度过高后又会引起非特异性扩增。dNTP浓度的高低决定了扩增效率,但浓度过高时将会与Taq酶竞争Mg2+;退火温度决定引物和模板的结合,温度过低时会有非特异性扩增,过高时会造成无扩增条带;引物的浓度过高时会造成引物二聚体的出现,过低时目标条带会很弱。本试验采用L9(34)正交试验设计,使得各种影响因子充分组合,最终筛选出椰子SSR-PCR 10 μL反应体系为:模板DNA 60 ng、Mg2+2.5 mmol/L、dNTP 250 μmol/L、Taq酶0.5 μmol、引物0.5 μmol/L、退火温度58 ℃,在该体系条件下,PCR扩增条带最清晰,稳定性和重复性良好,这为我国椰子群体结构、遗传多样性分析及幼苗早期筛选等研究工作奠定了扎实的工作基础。
[1] 毛彧,傅国华.海南椰子种质资源研究综述[J].安徽农业科学,2011,39(1):439-442.
[2] Whitehead R A. Sample survey and collection of coconut germplasm in the Pacific islands (30 May-5 September 1964)[J]. London, UK: HMSO, Ministry of Overseas Development, 1966.
[3] 范小宁,林萍,张盛周.油茶SSR-PCR反应体系的优化研究[J].安徽农业科学,2011,39(23):14098-14102.
[4] 何仁锋,冯尚国,陈喆.药用菊花SSR-PCR反应体系优化及引物筛选[J].分子植物育种,2015,13(2):367-378.
[5] Salqotra R K, Gupta B B, Bhat J A. Genetic diversity and population structure of Basmati rice (OryzasativaL.) germplasm collected from North Western Himalayas using trait linked SSR markers[J]. Plos one, 2015, 10(7): e0131858.
[6] Qiu L J, Yang C Y, Tian B. Exploiting EST databases for the development and characterization of EST-SSR markers in castor bean (RicinuscommunisL.)[J]. BMC Plant Biology, 2010, 10(1): 1-10.
[7] 周静,张锡九,陈其兵.分子标记在椰子种质资源和遗传育种研究中的应用[J].四川林业科技,2007,28(6):39-43.
[8] 杨迪菲,秦智伟,王桂玲.黄瓜SSR-PCR反应体系的优化[J].东北农业大学学报,2006,37(5):619-623.
[8] Xiao Y, Zhou L X, Xia W, et al. Exploiting transcriptome data for the development and characterization of gene-based SSR markers related to cold tolerance in oil palm (Elaeisguineensis)[J]. BMC Plant Biology, 2014, 14(1): 384.
(责任编辑:曾小军)
Optimization of SSR-PCR Reaction System for Coconut (Cocosnucifera)
ZHOU Li-xia
(Coconut Research Institute, Chinese Academy of Tropical Agricultural Science /Hainan Provincial Key Laboratory of Tropical Oil Crop Biology, Wenchang 571339, China)
In order to further utilize coconut (Cocosnucifera) germplasm resources and to develop marker-assisted seedling screening and genetic breeding, we explored the optimum SSR-PCR reaction system for coconut by adopting L9(34) orthogonal test design. Through the screening and optimization of template DNA, Mg2+, dNTPs, Taq enzyme, primer and annealing temperature, the optimized SSR-PCR reaction system (10 μL) for coconut was constructed as follows: template DNA 60 ng, Mg2+2.5 mmol/L, dNTP 250 μmol/L, Taq enzyme 0.5 μmol, primer 0.5 μmol/L, and annealing temperature 58 ℃. Under the conditions of this system, the bands of PCR amplification were the clearest. Thus, the results of this study laid the foundation for the researches and analysis of coconut group structure, germplasm resource abundance, gene mapping and genetic breeding through SSR marker technique.
Coconut; Orthogonal design; SSR-PCR; System optimization
2016-11-25
国家自然科学基金(31607123)。
周丽霞(1982─),女,山东聊城人,助理研究员,硕士,研究方向:生物化学与分子生物学。
S667.4
A
1001-8581(2017)04-0036-04
