基于微环形阵列电极的细胞分离富集芯片的设计与实验研究*
2017-04-13曾一笑谭秋林
樊 磊,曾一笑,吴 菲,谭秋林,孙 东*
(1.中北大学电子测试技术重点实验室,太原030051;2.仪器科学与动态测试教育部重点实验室,太原030051)
基于微环形阵列电极的细胞分离富集芯片的设计与实验研究*
樊 磊1,2,曾一笑1,2,吴 菲1,2,谭秋林1,2,孙 东1,2*
(1.中北大学电子测试技术重点实验室,太原030051;2.仪器科学与动态测试教育部重点实验室,太原030051)
根据介电泳操作原理,设计了微环形阵列电极结构,建立了细胞分离富集芯片模型,采用COMSOL软件分析微环形阵列电极的电场分布和介电泳力方向并确定了最大和最小电场强度的位置,利用ITO玻璃和PDMS制备了细胞分离富集芯片。通过酵母菌细胞的介电泳富集实验和酵母菌细胞与聚苯乙烯小球的分离富集实验,明确了酵母菌细胞的临界频率,实现了酵母菌细胞和聚苯乙烯小球的分离富集。结果显示,在溶液电导率为60 μs/cm,交流信号电压为8 Vp-p时,酵母菌细胞在1 kHz~45 kHz频率范围内做负介电泳运动并富集在环形内部,45 kHz为酵母菌细胞的临界频率,在45 kHz~10 MHz频率范围内做正介电泳运动并富集在环形边缘;1.5 MHz时聚苯乙烯小球做负介电泳运动并富集在环形内部,富集倍数达到11.66。
生物芯片;细胞分离富集;介电泳;微环形电极;COMSOL
基于介电泳原理的微流控芯片作为一种新型微粒操作技术,其操作对象已从简单的中性粒子扩展到细菌、病毒、细胞等生物粒子,具有非侵入、免标记样本、快速、高效、样本需求少等优良特性,已可实现微粒的分离富集、排列、诱捕、定位以及生物特性的测试等[1-4]。在生物医学工程中,微流控分离富集芯片常用于癌症的早期诊断与治疗[5],相对正常细胞,癌细胞的浓度特别低,微流控富集芯片可以把癌细胞与正常细胞分离并富集,增大癌细胞的浓度后再进行下一步的检测分析[6-8]。微电极结构是决定芯片性能的关键,因此设计性能更好的新型微电极结构越来越受到研究人员的关注。Becker等[9]设计了城堡式电极结构,通过施加变频交流信号,实现了血清中乳腺癌细胞的分离富集;Cheng等[10]利用5×5阵列电极结构,在6 V、30 kHz的交流信号下实现了皮肤癌细胞与血细胞的分离富集;Li等[11]采用十字交叉的电极结构,根据活死细胞所受的介电泳力不同,分离富集了活的和死的李斯特菌。但是以上电极结构都不能在封闭的区域中实现目标细胞的分析测试。
本研究依据介电泳操作原理,以细胞分离富集为目的,设计并制备了一种基于4×4微环形阵列电极的细胞分离富集芯片。此芯片包含阵列式的封闭环形隔离区域,通过施加不同频率、不同幅值的交流信号,将目标细胞富集在环形内部,杂质细胞富集在环形边缘,使目标细胞与杂质细胞隔离,增大目标细胞浓度、减小杂质细胞影响后可实现封闭环形区域中目标细胞的分析测试,从而提高实验数据的精确度。相比以上电极结构,该环形阵列电极克服了三维电极和双层电极制作工艺复杂的问题,制作工艺简单;充分利用每个环形提供更强的电场进而产生更大的介电泳力,有利于目标细胞的富集;利用更接近实际细胞生存环境的高电导率溶液产生负介电泳效应分离富集细胞,有利于细胞活性的保持;具有可扩展性,增加环形结构的数量后可以得到更大的阵列,从而产生更多的封闭分析区域,有利于降低细胞测试时间。
1 实验部分
1.1 试剂与仪器
图1是微流控芯片实验测试平台,包括:计算机、LabSmith微流体控制系统、AFG-3081函数信号发生器(台湾GWIUSTEK公司)、CCD相机(德国Imaging Source公司)、电动变焦镜头(美国Navitar公司)、20X物镜(日本Nikon公司)、滤光片组合(包括发射滤光片、激发滤光片、二向色镜)(日本Nikon公司)、LED光源以及RollerBlock三轴位移调节台(美国THORLABS公司)。

图1 实验测试平台示意图
实验试剂包括:正光刻胶(RZJ304,苏州瑞红)、正胶显影液(RZX-3038,苏州瑞红)、正胶剥离液(RBL-3368,苏州瑞红)、负光刻胶(SU-8 2050,MICRO CHEM)、SU-8显影液(MICRO CHEM)、ITO刻蚀液(37.5%盐酸、65%硝酸、水的体积比为50∶3∶50,北京富宇精细化工有限公司)、聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)、固化剂(Sylgard 184 Kit,Dow Corning)、吐温-20 (Tween-20,Amresco)、磷酸盐缓冲液(PBS缓冲液,HyClone)、细胞缓冲液(8%蔗糖,0.3%葡萄糖溶液)、安琪酵母菌(安琪酵母股份有限公司)、聚苯乙烯小球(天津倍思乐色谱技术开发中心)、去离子水。
1.2 实验过程
1.2.1 酵母菌细胞介电泳富集实验步骤
进行实验时,首先将少量酵母放入5 mL的去离子水中,并置于30℃的恒温箱中培养3 h使酵母菌细胞复苏;后离心,吸掉上清液,加适量去离子水,放入超声清洗机震荡使细胞均匀悬浮,重复3次后离心吸掉上清液,加入细胞缓冲液,用PBS缓冲液调节溶液电导率至60 μs/cm并超声震荡制得酵母菌细胞悬浮液,测得其浓度为 8×106/mL;使用LabSmith微流体控制系统将其注入芯片,对电极施加交流信号,通过CCD相机观察并记录酵母菌细胞的运动富集情况。
1.2.2 酵母菌细胞与聚苯乙烯小球分离富集实验步骤
取50 μL聚苯乙烯小球溶液,用同样的方法处理得到浓度为7.6×105/mL的小球悬浮液后,以10∶1的体积比混合酵母菌细胞悬浮液和小球悬浮液,使用PBS缓冲液调节其电导率为60 μs/cm,超声震荡后制得酵母菌细胞与聚苯乙烯小球的混合液。取适量使用LabSmith微流体控制系统将其注入芯片,对电极施加交流信号,通过CCD相机观察并记录两种微粒的分离富集情况。
2 结果与讨论
2.1 介电泳操作原理
介电泳是指在空间非均匀电场中,悬浮在一定溶液中的微粒相对于溶液的诱导偶极距不同而产生的电迁移[12-14]。对于可以等效为球形的微粒,例如酵母菌、聚苯乙烯小球等,其所受介电泳力的表达式为[15-16]

式中:εm是溶液的介电常数,r是微粒的半径,fCM是Clausius-Mossotti因子,Re[fCM]是其实部,是梯度算子。fCM的表达式为[15-16]
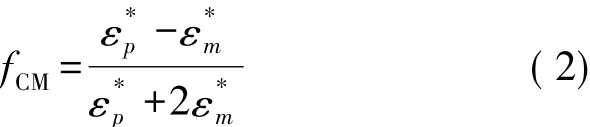
式中:ε*p和 ε*m分别是微粒和溶液的复杂介电常数,表达式分别为[15-16]
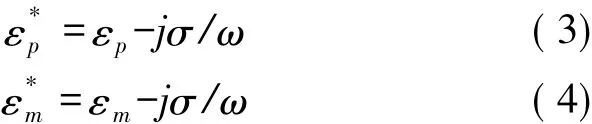
式中:σ是电导率,ω是所施加交流电场的频率,εp与εm分别是微粒的介电常数。
当Re[fCM]>0,即微粒比溶液容易极化时,微粒向高电场区域运动,称为正介电泳;当Re[fCM]<0,即溶液比微粒容易极化时,微粒向低电场区域运动,称为负介电泳[17]。图2是查阅酵母菌细胞相关参数[18]后利用MATLAB绘制的溶液电导率为60 μs/cm时酵母菌和聚苯乙烯小球的CM因子曲线,可以看出在1 kHz~10 MHz频率范围内酵母菌的Re[fCM]异号会表现出负正介电泳行为,而聚苯乙烯小球的Re[fCM]总为负只表现出负介电泳行为。根据介电泳操作原理,细胞的介电泳效应与细胞的半径、细胞和溶液的介电常数、电导率和所施加交流信号的频率有关[19],而特定细胞的半径、介电常数和电导率已经确定,特定溶液的介电常数变化不大,所以只用调节溶液的电导率和施加的交流信号的频率即可达到对酵母菌细胞和聚苯乙烯小球的分离富集。

图2 酵母菌细胞和聚苯乙烯小球在电导率为60 μs/cm的溶液中的CM因子实部与频率的关系
2.2 介电泳细胞分离富集芯片的设计与仿真
介电泳细胞分离富集芯片,如图3(a)和图3(b),由玻璃基片、PDMS微通道和ITO微电极构成。微通道是立方体上的凹槽,高80 μm,凹槽两端的两个通孔分别是溶液的入口和出口;如图3(c),ITO微电极包括一个4×4环形阵列电极和一个地电极,环形的内径是200 μm,外径是300 μm,地电极的弧形直径是400 μm。
图4(a)是利用Solidworks对微环形电极和地电极建立的模型,立方体为溶液,查阅资料后设置它的相对介电常数为78,电导率为60 μs/cm。将其导入COMSOL对微环形电极和地电极分别施加电压为8 Vp-p和-8 Vp-p,频率为1.5 MHz的交流信号。电极上表面电场强度的仿真结果如图4(b),结果显示环形边缘的电场强度最大,环形中心的电场强度最小,且电场强度由环边缘到地电极逐渐减小。
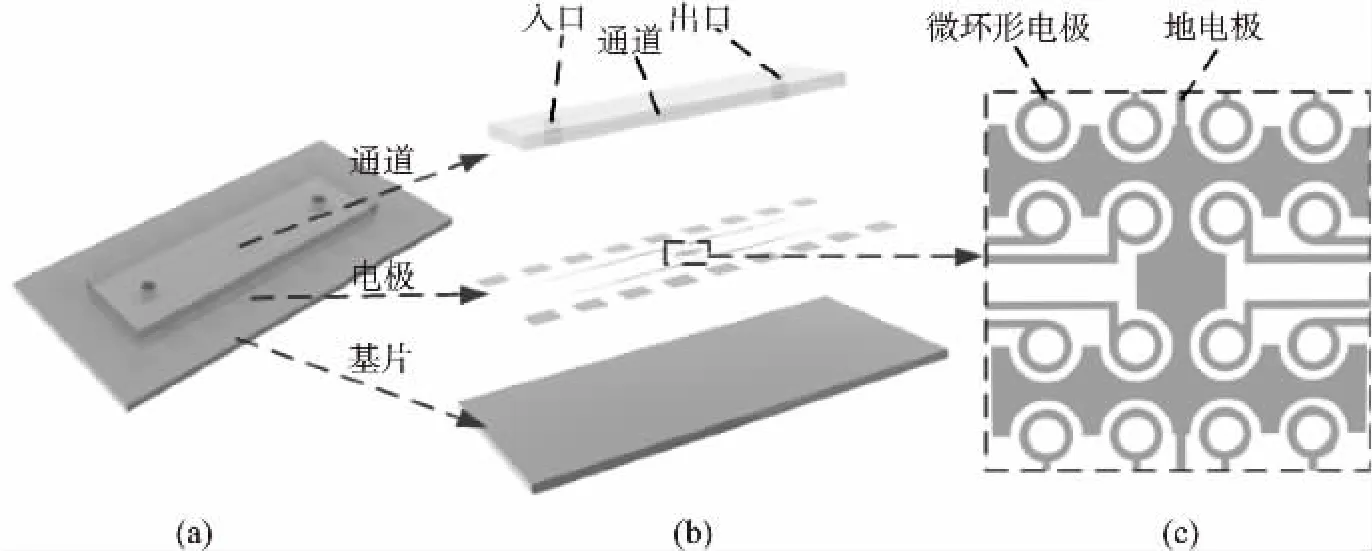
图3 芯片和电极结构原理图

图4 仿真模型和结果
介电泳力的仿真结果如图5所示,结果显示负介电泳力指向环形中心,正介电泳力指向环形边缘,所以可以预测细胞发生负介电泳时会汇聚在环形中心,发生正介电泳时汇聚在环形边缘。

图5 介电泳力仿真结果
2.3 介电泳细胞分离富集芯片的制备与测试
首先制备微环形阵列电极,在镀有ITO薄膜的玻璃上匀涂一层厚约2 μm的正光刻胶,100℃前烘90 s后进行曝光、显影、后烘,再利用45℃的ITO刻蚀液去除多余的金属,得到微环形阵列电极;接着制备PDMS微通道,在洗净吹干的硅片上匀涂一层厚约80 μm的负光刻胶,自65℃开始每隔5℃前烘3 min,温度升至95℃时烘6 min后进行曝光、显影、后烘得到阳模,将PDMS与固化剂按100∶1比例均匀混合并抽真空、静置后浇铸在阳模上,置于95℃环境中固化2 h,剥离得到PDMS微通道;最后将制成的PDMS微通道和微环形阵列电极放入真空度为26.6 Pa、射频功率为30 W的环境中进行等离子处理,在显微镜下对准后置于70℃的恒温箱中5 min进行键合,得到芯片主体。
利用MEMS工艺制作完成芯片主体后,连接LabSmith微流体控制系统向芯片注入去离子水测得芯片通水顺畅、密封良好,满足进一步实验的要求;并向芯片内注入吐温-20溶液,处理PDMS微通道和电极表面后用去离子水冲洗干净,以减小细胞的非特异性粘附。图6是通过测试、通道处理、清洗并进行电气连接后的介电泳细胞分离富集芯片及电极结构的显微图。

图6 制备的芯片及电极显微图
2.4 介电泳实验
2.4.1 酵母菌细胞的介电泳富集实验
使用LabSmith微流体控制系统向以上芯片注入适量60 μs/cm的酵母菌细胞悬浮液,对电极施加电压为8 Vp-p,频率从1 kHz递增到10 MHz、步长为5 kHz的交流信号,观察记录酵母菌细胞的运动情况。
图7是调节频率为5 kHz时0 min、1 min和2 min后酵母菌细胞的分布情况,蓝色箭头表示酵母菌细胞的迁移方向。结合电场强度和介电泳力仿真结果可以看出,在频率为5 kHz时,酵母菌做负介电泳运动,环形外部的酵母菌随着时间的推移逐渐向电场强度最小的环形中心迁移。

图7 频率为5 kHz时,不同时间酵母菌细胞的分布
图8(a)是频率递增到45 kHz时酵母菌细胞的分布情况,可以看出此时酵母菌细胞随机分布,既有正介电泳运动,又有负介电泳运动,处于正负介电泳的交界处;继续增大频率,图8(b)和图8(c)分别是频率增大到1.5 MHz时,经过1 min和2 min后酵母菌细胞的分布情况,蓝色箭头表示酵母菌细胞的迁移方向。结合电场强度和介电泳力仿真结果可以看出,此时酵母菌细胞做正介电泳运动,环形内部的酵母菌随着时间的推移逐渐向电场强度最大的环形电极边缘汇聚。

图8 不同频率,不同时间酵母菌细胞的分布
所以可得,该芯片能够操作生物细胞到不同电场区域,频率小于45 kHz时,酵母菌细胞做负介电泳运动;45 kHz处于正负介电泳的交界处,即为临界频率;大于45 kHz时,做正介电泳运动。
2.4.2 酵母菌细胞与聚苯乙烯小球的分离富集实验
基于以上酵母菌细胞的介电泳富集实验,利用配制的酵母菌与聚苯乙烯小球的混合液进行酵母菌细胞与小球的分离富集实验。根据如图2所示的曲线可以预测,溶液电导率为60 μs/cm,所加交流信号频率在1 kHz~10 MHz范围内时,聚苯乙烯小球只做负介电泳运动,而酵母菌细胞在大于45 kHz时做正介电泳运动且在1.5 MHz时Re[fCM]达到最大值,结合电场强度和介电泳力仿真结果可知,当频率为1.5 MHz时,聚苯乙烯小球会向电场强度最小的环形电极中心迁移,酵母菌细胞会向电场强度最大的环形电极边缘富集,以此就可以达到分离富集聚苯乙烯小球和酵母菌细胞的目的。图9是对电极施加电压为8 Vp-p、频率为1.5 MHz的交流信号后两种微粒的分离富集情况,实验结果与预测相一致,酵母菌细胞做正介电泳运动并富集在电场最强的环形电极边缘处,聚苯乙烯小球做负介电泳运动并富集在电场最弱的环形电极内部。

图9 溶液电导率为60 μs/cm时酵母菌细胞和聚苯乙烯小球的分离富集
实验过程中,个别酵母菌细胞和聚苯乙烯小球没有迁移是因为酵母菌细胞壁和小球外表面具有黏附性,有可能附着在玻璃基底或者ITO电极上,当所受附着力与液体阻力的合力大于所受的介电泳力时,就不会发生定向迁移。
2.5 富集倍数的计算
此芯片使目标细胞富集至环形电极内部增加目标细胞浓度后实现封闭区域中目标细胞的分析测试,因此定义富集倍数为施加交流信号后环形内部聚苯乙烯小球占环形内部微粒总数的百分比与施加交流信号前混合液中聚苯乙烯小球所占百分比的比值。未加电压为8 Vp-p、频率为1.5 MHz的交流信号时,聚苯乙烯小球与酵母菌细胞数目之比为0.94%;施加交流信号后环形内部聚苯乙烯小球数目为8、酵母菌细胞数目为65,小球酵母菌之比为10.96%。可得富集倍数为11.66。
3 结论
虽然基于介电泳的微流控技术已经得到了很大发展,但是仍有进一步研究的必要,设计更有效的电极结构则尤为重要。本研究表明,溶液电导率为60 μs/cm,所加交流信号电压为 8 Vp-p,频率小于45 kHz时,酵母菌细胞发生负介电泳运动并富集到环形电极内部;频率为45 kHz时,酵母菌细胞随机分布,既有正介电泳运动,又有负介电泳运动,为酵母菌细胞正负介电泳的临界状态;频率大于45 kHz小于10 MHz时,酵母菌细胞发生正介电泳运动并富集到环形电极边缘;1.5 MHz时聚苯乙烯小球发生负介电泳运动并富集到环形电极内部。所设计的微环形阵列电极芯片实现了酵母菌细胞的正负介电泳行为,达到了分离富集酵母菌细胞和聚苯乙烯小球的目的,富集倍数达到11.66,由此证明了该介电泳芯片分离富集生物细胞的可行性。
[1] Khoshmanesh K,Nahavandi S,Baratchi S,et al.Dielectrophoretic Platforms for Bio-Microfluidic Systems[J].Biosensors and Bioelectronics,2011,26(5):1800-1814.
[2] Guillotin B,Guillemot F.Cell Patterning Technologies for Organotypic Tissue Fabrication[J].Trends in Biotechnology,2011,29 (4):183-190.
[3] Kaji H,Camci-Unal G,Langer R,et al.Engineering Systems for the Generation of Patterned Co-Cultures for Controlling Cell-Cell Interactions[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2011,1810(3):239-250.
[4] 李远,胡帆,廖娟,等.一种基于感光干膜-铟锡氧化物电极的简易细胞阻抗传感器实现细胞形态学和阻抗信息同时检测[J].传感技术学报,2015,28(6):779-786.
[5] 窦福印,王鹏,邢蕊,等.基于SPR干涉成像传感法检测大蒜素刺激胃癌细胞的响应[J].传感技术学报,2014,27(4):432-437.
[6] Das D,Biswas K,Das S.A Microfluidic Device for Continuous Manipulation of Biological Cells Using Dielectrophoresis[J].Medical Engineering and Physics,2014,36(6):726-731.
[7] Chrimes A F,Kayani A A,Khoshmanesh K,et al.Dielectrophoresis-Raman Spectroscopy System for Analysing Suspended Nanoparticles[J].Lab on a Chip,2011,11(5):921-928.
[8] Chen N C,Chen C H,Chen M K,et al.Single-Cell Trapping and Impedance Measurement Utilizing Dielectrophoresis in a Parallel-Plate Microfluidic Device[J].Sensors and Actuators B:Chemical,2014,190:570-577.
[9] Becker F F,Wang X B,Huang Y,et al.Separation of Human Breast Cancer Cells from Blood By Differential Dielectric Affinity[J].Proceedings of the National Academy of Sciences,1995,92 (3):860-864.
[10]Cheng J,Sheldon E L,Wu L,et al.Isolation of Cultured Cervical Carcinoma Cells Mixed with Peripheral Blood Cells on a Bioelectronic Chip[J].Analytical Chemistry,1998,70(11):2321-2326.
[11] Li H,Bashir R.Dielectrophoretic Separation and Manipulation of Live and Heat-Treated Cells of Listeria on Microfabricated Devices with Interdigitated Electrodes[J].Sensors and Actuators B:Chemical,2002,86(2):215-221.
[12]Burgarella S,Merlo S,Dell’Anna B,et al.A Modular Micro-Fluidic Platform for Cells Handling by Dielectrophoresis[J].Microelectronic Engineering,2010,87(11):2124-2133.
[13]Van den DriescheS,RaoV,Puchberger-EnenglD,etal. Continuous Cell from Cell Separation by Traveling Wave Dielectrophoresis[J].Sensors and Actuators B:Chemical,2012,170:207-214.
[14]Dürr M,Kentsch J,Müller T,et al.Microdevices for Manipulation and Accumulation of Micro-and Nanoparticles by Dielectrophoresis[J].Electrophoresis,2003,24(4):722-731.
[15] Huang Y,Wang X B,Becker F F,et al.Introducing Dielectrophoresis as a New Force Field for Field-Flow Fractionation[J].Biophysical Journal,1997,73(2):1118-1129.
[16]Zhang X,Chu H K,Zhang Y,et al.Rapid Characterization of the Biomechanical Properties of Drug-Treated Cells in a Microfluidic Device[J].Journal of Micromechanics and Microengineering,2015,25(10):105004.
[17]Demierre N,Braschler T,Muller R,et al.Focusing and Continuous Separation of Cells in a Microfluidic Device Using Lateral Dielectrophoresis[J].Sensors and Actuators B:Chemical,2008,132(2): 388-396.
[18]Zhang C,Khoshmanesh K,Tovar-Lopez F J,et al.Dielectrophoretic Separation of Carbon Nanotubes and Polystyrene Microparticles[J].Microfluidics and Nanofluidics,2009,7(5):633-645.
[19]郝敦玲,徐溢,曾雪,等.阵列叉指式芯片研究细胞介电电泳富集过程[J].分析化学,2009,37(9):1253-1257.

樊 磊(1990-),男,山西运城人,中北大学仪器与电子学院,硕士研究生,研究方向为微纳技术与仪器及生物微流控芯片,18734912353@163.com;

孙 东(1967-),男,教授,中国香港人,博士研究生导师,研究方向为机器人及其自动化,微纳生物传感与控制,medsun@cityu.edu.hk。
Design and Experimental Study of Cells Isolation and Enrichment Chip-Based on Micro Annular Array Electrode*
FAN Lei1,2,ZENG Yixiao1,2,WU Fei1,2,TAN Qiulin1,2,SUN Dong1,2*
(1.National Key Laboratory for Electronic Measurement Technology,North University of China,Taiyuan 030051,China; 2.Key Laboratory of Instrumentation Science and Dynamic Measurement,Ministry of Education,North University of China,Taiyuan 030051,China)
According to the theory of dielectrophoresis,a kind of cells isolation and enrichment chip of micro annular array was designed and modeled.COMSOL software was used to discover the position of maximum and minimum strength of electric field via analysing the distribution of electric field and the direction of dielectrophoresis force.The chip was fabricated based on ITO glass and PDMS.The cross frequency of yeast cells was obtained after conducting a dielectrophoretic enrichment experiment of yeast cells.Isolation and enrichment of yeast cells and polystyrene particles were realized through carrying out an isolation and enrichment experiment with yeast cells and polystyrene particles.The results showed that yeast cells in solution conductivity of 60 μs/cm did negative DEP response and enriched in the ring inside under a voltage of 8 Vp-pand the frequency of 1 kHz to 45 kHz.The cross frequency of yeast cells was determined to be 45 kHz.Yeast cells did positive DEP response and enriched along the ring edge in the range of 45 kHz to 10 MHz.The polystyrene particles did negative DEP response and enriched in the ring inside under a frequency of 1.5 MHz.The multiple of enrichment reached about 11.66.
biological chip;cells isolation and enrichment;dielectrophoresis;micro annular electrode;COMSOL
TP212.3
A
1004-1699(2017)02-0218-06
C:2575
10.3969/j.issn.1004-1699.2017.02.009
项目来源:山西省百人计划;西省基础研究项目(2014011021-3)
2016-07-08 修改日期:2016-08-15
