丁香假单胞菌的分子生物学研究进展
2017-04-13王丹丹王清明
王丹丹,王清明
(1.辽东学院 农学院,辽宁丹东 118003;2.四川省广元市农业科学研究院,四川广元 628017)
丁香假单胞菌的分子生物学研究进展
王丹丹1,王清明2
(1.辽东学院 农学院,辽宁丹东 118003;2.四川省广元市农业科学研究院,四川广元 628017)
丁香假单胞菌是好氧、腐生性强的革兰氏阴性菌,所引起的植物病害发生率位居十大细菌性植物病害之首,尤其引发的疫病在各农业大国爆发并有在世界范围扩散的趋势,给各国农业生产造成巨大的经济损失。基于国内外学者最新的分子生物学研究报道,对丁香假单胞菌的致病变种、病原菌鉴定、植物检疫、早期快速检测技术、致病机制及生物防治等方面进行综述,并探讨现阶段该病害研究存在的问题以及未来的研究方向与防治方案。
丁香假单胞菌;检测;TTSS系统;Hrp基因;生物防治
丁香假单胞菌是一类盛行的植物病原细菌,其引发植物病害的发生率居十大细菌性植物病害之首;在2007年颁布的《中华人民共和国进境植物检疫性有害生物名录》中,假单包菌属(Pseudomonas)的6种植物病原菌均属于丁香假单胞菌(Pseudomonassyringae),包括菜豆晕疫病菌、核果树溃疡病菌、桃树溃疡病菌、豌豆细菌性疫病菌、十字花科黑斑病菌、番茄细菌性叶斑病菌。丁香假单胞菌可侵染豆科、十字花科、茄科、蔷薇科等300多种经济作物,给农业生产造成巨大损失,引起各国学者投入大量人力、物力对其开展细致深入的研究。目前,数个丁香假单胞菌的全基因组测序已完成[1],并在公共数据库发布,为学者从全基因水平了解该病菌与寄主的互作机制、传播途径(如根系、花粉是否带菌)、流行机制以及侵染部位等问题,以期从中挖掘用于早期快速检测病菌的技术,以及筛选高效、低毒、环保型防治药剂的技术等[2-3]。
本文对丁香假单胞菌致病变种、植物病原菌鉴定与快速检测、致病机制及防治措施等方面的研究进展进行综述,以期为开展相关研究提供参考。
1 植物丁香假单胞菌致病变种
丁香假单胞菌隶属于假单胞菌科假单胞菌属,为好氧、腐生性强的革兰氏阴性菌,多个致病型,广泛存在于自然界中,如大气、土壤、水体及植物叶面等,是一类生态适应性强、表型差异大的微生物群体。其疫病症状有褪绿、瘤肿、溃疡、萎蔫及坏死等。根据寄主及引发的病症不同而被分类,常见种类见表1[4-5]。
可见,由丁香假单胞菌引起的病害较广,如猕猴桃细菌性溃疡病(bacterial canker disease of kiwifruit)于1983年在美国加利福尼亚洲首次发现,是一种普遍发生的毁灭性植物病害,致病性强、传播快、防治难度大,短时间可造成大面积树体死亡,严重威胁猕猴桃产业的发展,已被列为中国森林植物检疫性病害;猕猴桃溃疡病菌从枝条分叉处、幼芽、皮孔及落叶痕部侵染,潮湿时产生褐色或锈红色菌脓,随后扩延整个枝蔓,造成枝蔓溃疡,阻断输送营养和水分的渠道,随之花蕾、幼芽和嫩枝感病枯萎,树势较弱。目前,已在美国、日本、法国、新西兰、韩国、智利、葡萄牙及中国等国家发生[6-8]。随着一系列危险性外来有害生物的侵入,给中国每年造成的总经济损失约在2 000亿以上,新的丁香假单胞菌致病疫情不断突发,正随着种子或苗木的远距离运输而逐渐扩大,尤其中国开通农副产品的绿色通道无形中也使疫情逐步扩散蔓延,因此笔者对该菌的最新研究状况进行综述,并探讨该病未来的研究方向与防治策略,以期降低该病对农业造成的损失。

表1 常见丁香假单胞菌致病变种、寄主植物及所引起的病害Table 1 Host plants of common Pseudomonas syringae and diseases caused by it
2 植物病原菌快速检测与鉴定
建立对丁香假单胞菌特异、快速的早期检测技术,有利于及时防治病害,控制蔓延。《GB/T28066-2011丁香假单胞菌豌豆致病型检疫鉴定方法》规定生物学、血清学及分子生物学的检测、鉴定方法;生物学检测能反映活菌的数量,但特异性差、周期长;血清学检测操作复杂,易造成假阳性;而分子生物学检测则无需对病原菌进行分离、纯培养,短时间即可检测到微量的病原菌,能满足快速、特异、灵敏检测病原菌的要求。
近年来,分子生物学检测法虽未完全取代传统检测手段,但其发展呈指数增长,对丁香假单胞菌的检测鉴定经历了DNA杂交、常规PCR、Rep-PCR、MLST分析、双重PCR、分子标记、实时荧光定量PCR以及转录组测序等方法(表2)。其中,核酸杂交是分子生物学领域常用技术,但耗时长、操作复杂且不稳定而逐渐被PCR技术取代,从常规PCR已发展到可定性定量分析的实时荧光定量PCR;分子标记除可快速检测鉴定外,也可对病原菌进行指纹图谱构建、聚类分析等;然而,进入21世纪基因组时代,随着转录组测序技术的不断完善与普及,使丁香假单胞菌的研究跨入一个全新阶段。目前,数个丁香假单胞菌的全基因组测序已完成,并在公共数据库发布,促进了生物信息学的快速发展,通过生物信息学对海量转录组数据的探索与挖掘,为传统的检测研究提供更准确的基因预测与筛选,并为分析疫病致病机制指明方向,为疫病的防治及病原菌与植物的互作机制提供可参考的空间。2009-2012年,新西兰、法国、葡萄牙、意大利及中国等国学者致力于对16S和16S~23S(ITS)rDNA序列进行比对分析、鉴定病原菌,但大量研究证实,因丁香假单胞菌核糖体基因高度保守,尤其16S rDNA序列在各变种间相似度高达98%,无法有效鉴定。目前,常用检测、鉴定方法包括分子标记、实时荧光定量PCR以及转录测序分析等,未来可通过上述方法建立一套可靠、灵敏、快速的分子检测手段,以期从源头协助控制病原菌的扩散,并应用于实际检疫工作中,为中国植物检疫提供技术支撑。
3 植物病原菌的致病机制
3.1 丁香假单胞菌的致病因子
丁香假单胞菌侵染植物,首先需分泌胞壁降解酶破坏细胞壁,因为植物细胞初生壁和胞壁的中间层为果胶质等物质,可阻挡病原菌侵染;其次,分泌毒素破坏细胞膜通透性、抑制酶活性等方式诱发植物产生病症。常见丁香假单胞菌毒素见表2[5,24-25]。
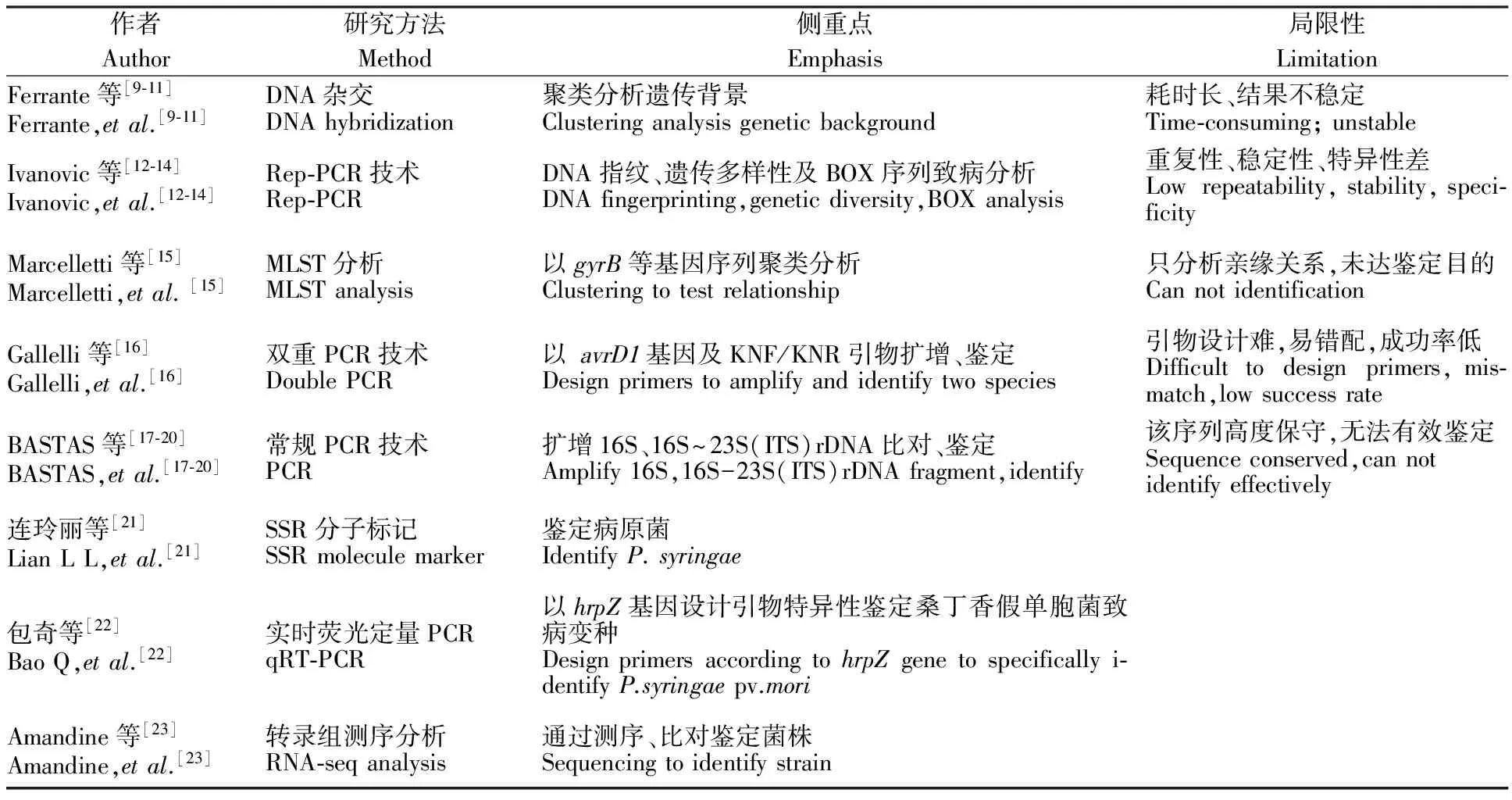
表2 丁香假单胞菌的检测、鉴定发展历程Table 2 Detection and identification development history of Pseudomonas syringae
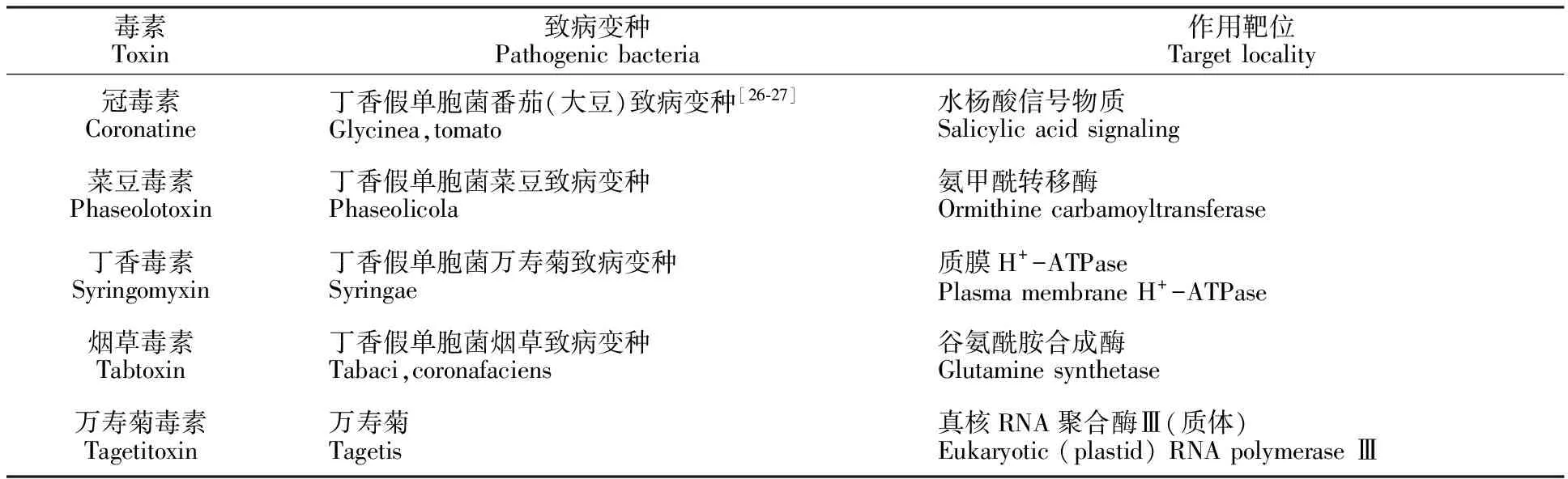
表3 常见丁香假单胞菌毒素Table 3 Bacterial toxins from Pseudomonas syringae
病原菌的毒力因子决定其致病性,由位于染色体上的毒力岛(Pathogenicity island,PAI)编码[28];Kim等[29]已证明丁香假单胞菌毒力岛基因簇中含有毒素合成基因。毒力岛可编码细菌的分泌系统、信号传导系统、异型物质降解以及对病原菌生长具有重要作用的蛋白泌出系统、毒性因子、粘着素、Harpins蛋白等,均对病原菌的致病潜能和病斑形成起辅助作用;此外,也可编码附属功能,如病原菌吸收营养、耐药性、抗性、酚类降解及固氮等功能;杨军等[30]发现毒力岛编码植物防卫反应增强剂脂多糖(Lipopolysaccharide,LPS),使病原菌在特殊环境中(如胁迫、暴露于抗生素、活体内)获得竞争优势,增强病原菌在小生态环境中的传播、生存和定殖能力,进而促进病原菌的进化。此外,丁香假单胞菌在较低温度下(-2 ℃~-5 ℃)下更容易形成冰核细胞群而诱发植物病害,孟姗等[31]研究丁香假单胞菌冰核基因inaQ变速箱启动子结构与活性发现冰核活性在寡营养状态下更高,且启动子受温度和营养条件的调控,为解释冰核蛋白的合成及调控机制提供了新的试验证据。
3.2 丁香假单胞菌的TTSS系统
丁香假单胞菌在寄主体内分泌的毒力因子、分泌蛋白或降解酶,通过蛋白泌出系统直接输送到寄主细胞,而至今已发现6种细菌蛋白分泌途径[23,32-34],丁香假单胞菌属于Ⅲ型分泌系统(type Ⅲ secretion system,TTSS),由hrp基因(hypersensitive reaction and pathogenicity gene)编码,TTSS在植物-病原互作中起重要作用,没有TTSS,病原菌不能克服植物的基础抗性而进入植物体内定殖,并诱发寄主产生抗病反应。Noel等[35]和He等[36]发现,TTSS可注射致病型因子、运输harpins、avr和Hop效应蛋白,且TTSS具有寄主依赖性,必须通过病原菌与寄主接触、发生相互作用才能被激活,而效应蛋白的泌出对TTSS亦有依赖性,只有通过TTSS将harpins和效应蛋白输送至植物组织或细胞内才能发挥其功能。丁香假单胞菌毒力岛编码的部分效应蛋白具有双重性[37],一方面为了克服TTSS对基础抗性的抑制作用,使植物产生R基因引发过敏性坏死反应,如丁香假单胞番茄致病变种的无毒蛋白AvrPto通过TTSS进入番茄植株内,与R基因互作引发抗病反应;一方面通过与寄主互作诱导寄主抗性表达[38];Xiao等[39]发现大部分效应因子能被寄主体内的酶修饰(蛋白水解、磷酸化和酰化等),如对无毒蛋白AvrPto、AvrRpm1和AvrB进行修饰能促进其在植物细胞膜上定位,对三者的毒力表达非常关键;已有研究[40-42]发现,TTSS分泌的效应因子进入植物细胞并不意味着它一定在寄主细胞内起作用,如丁香假单胞菌分泌的HrpW1进入植物细胞后,分析其果胶酸发现该蛋白作用于细胞壁。
3.3 丁香假单胞菌hrp基因的研究现状
植物hrp基因由Lindgren等[43]于1986年从菜豆晕斑病菌首次克隆得到,之后各国学者对hrp基因的分布、结构及功能等展开研究,并已证实丁香假单胞菌含有hrp基因[44],该基因编码harpin蛋白,可使病原菌在寄主中激发过敏或致病性反应;Wei等[45]首次成功表达harpin蛋白;Gough等[46]序列分析发现病原菌至少具有25个hrp基因,成簇存在,由多个转录单位组成,hrp基因在基因簇中起调控作用,如丁香假单胞菌丁香致病变种的hrp基因30 kb,13个转录单位,侵染寄主后,通过TTSS将约30种效应因子注入寄主体内,hrp基因具有27个开放阅读框(ORFs)。hrp基因簇至少有3种类型的hrp基因[47],Ⅰ类编码TTSS核心组分,其中包括与鞭毛存在序列相似性的8种hrc基因,存在于所有具有TTSS的病原菌中;Ⅱ类编码调节蛋白(hrpR、hrpH、hrpS和hrpV等)和所有与TTSS有密切关系的相关基因的表达,如hrpR、hrpH等参与TTSS在丁香假单胞菌中的转录调控;Ⅲ类编码分泌蛋白,如hrpA编码丁香假单胞菌的hrp极毛(Hrp pilus),病原菌侵染时,hrp基因簇中结构基因编码的蛋白质在菌体表面形成hrp极毛,病原菌的致病因子均通过极毛穿过细胞壁而释放到寄主体内。目前,已从丁香假单胞菌中成功克隆出hrpN、hrpM和hrpZ等基因[48-51]。Wengelnik等[52]发现环境因素和调节基因控制hrp基因的表达,环境因素主要包括碳源、氮源、pH、温度、渗透压和植物信号分子等。Rahme等[53]及Alexandra等[54]研究表明丁香假单胞菌至少有3个hrp基因可参与识别外植体的环境信号,即hrpL、hrpS和hrpR,而且该基因可被酸性环境(pH 5.5~5.7)诱导而大量表达;然而,病原菌hrp基因在基本培养基中培养或植物体中生长时大量表达,而在营养丰富的培养基中则不表达或表达水平很低,如丁香假单胞菌在基本培养基培养时hrp基因的表达水平高于营养丰富的培养基,说明植物外植体营养匮乏对诱导hrp基因的表达有利,综上所述,在农业生产中可通过控制环境因素与调节基因等来调控hrp基因的表达,从而调控TTSS及TTSS相关基因的表达;或通过噬菌体展示技术筛选特异性抗hrpA基因的单链抗体,以影响TTSS的功能,阻止hrp极毛的组装,从而降低或阻止丁香假单胞菌对植物体的侵害。
4 防治措施
丁香假单胞菌引发的疫病来势凶猛,为害猖獗,如1985年,猕猴桃溃疡病在湖南省石门县爆发,感病面积约13 hm2,造成猕猴桃植株大量死亡[55-57]。目前,对丁香假单胞菌的防治以化学防治为主,其杀菌谱广、见效快、成本低且操作简单,但长期大量使用化学药剂会造成大气、土壤等环境污染乃至生态平衡破坏。随着社会的发展,寻求高效、无害、无毒、无污染和不产生抗药性的生物防治措施已成为首要任务,不仅为农业可持续发展提供保障,也符合人们对绿色食品的需求;目前,生物防治仅处于萌芽阶段,对其防御机制还缺乏系统研究[58-60]。近些年,学者们一方面建立对病原菌准确、快速的早期检测技术;一方面,筛选对病原菌拮抗效果较好的生防菌菌株,如放线菌、枯草芽孢杆菌和链霉菌等菌株(表4)。可见,对丁香假单胞菌的防治经历了传统的化学药剂防治、植物源制剂、病原菌的拮抗作用以及分子生物学方法(基因组信息、生物信息学、转座突变和构建过表达载体技术)等几个阶段。随着后基因组时代的到来,基因功能研究越显重要,一方面侵染后,通过调节功能基因激活植物抗病防卫反应信号分子水杨酸(salicylic acid,SA),导致内源SA水平增加,激活抗病反应,加强寄主对病原菌的抵抗能力;另一方面通过调节细胞壁相关基因强烈表达使细胞壁显著增厚,以防御该病原菌的侵染;再者,人工合成或从植物中获得如咖啡酸之类衍生物的植物源制剂作为杀菌剂,其效果显著且对环境污染较小,甚至无污染。因此,可采用该类植物源制剂作为开发丁香假单胞菌防治专用抑菌剂成分。

表4 丁香假单胞菌防治研究Table 4 Research of Pseudomonas syringae prevention
5 问题与展望
综上所述,丁香假单胞菌的致病性严重影响农业的发展,应用生物防治控制植物病害已经越发受到世界各国学者的重视。目前,国内外学者对病原菌的分类、生物学特性、致病力和快速检测等方面的研究取得一定成果,但也存在一些问题。首先,栽培区零散,没有统一的管理机构,从业人员缺乏疫病防治知识;尤其未检疫种子或苗木的远距离输送,更加剧疫病的扩散;第二,盲目追求优势品种的经济价值,忽视品种抗病性差的缺点,致使园区感病风险较大;第三,科研力量薄弱,如抗病品种的选育、防治药剂的筛选、传播媒介昆虫的防治以及无病症带菌苗木的早期检疫技术不成熟等,加之,互作机制、流行机制等方面研究也有待完善,如病原菌的侵染途径(传播媒介昆虫、花粉、根系是否带菌等)、侵染过程、扩散等。目前,对丁香假单胞菌生物防治的研究较多,但能用到实际生产中的却少之又少,往往在实验室分离的具有较优生物防治效果的生防菌,田间测试时,效果却差强人意,可能是由于生防菌自身种群的繁殖或作用效果易受环境因素影响,以及对农药的敏感性,抗菌谱较窄,致使防治效果慢而不稳定,尤其生防菌对作物的有害性等都是生防菌筛选过程中关键问题;第四,中国是开展生物防治最早的国家,近年发展反而滞缓,主要是生物防治见效慢、费时费工,没有化学药剂立竿见影的效果,所以农民对生物防治新技术不轻易接受。
基于丁香假单胞菌的研究现状,笔者认为未来应从以下几方面开展工作,降低疫病发生率:第一,对新引进的种子及苗木实行严格的检验检疫,并建立标准的疫病隔离体系,严格划分疫病区,做好隔离防护,组织从业人员学习疫病相关知识;第二,加强科研力度,大力资助相关项目,以探究病原菌与寄主植物的互作体系,建立完善的早期检疫体系,分析病原菌的起源、分布、遗传结构及致病力差异等,并结合环境因素分析病原菌的发病及流行规律;并通过人工接种进行模拟活体检测来进一步验证方法的可靠性和实用性,以达到应用于实际检疫工作的目的。第三,重视生物防治药剂的筛选及田间推广的实用性,探究生防药剂的作用机制及对病原菌产生抗性的问题;加强生防菌生态适应性,降低生防菌对寄主的毒害,加快生防菌在植物病害防治的应用;第四,筛选抗病品种,一方面通过基因组测序分析,比对、查找抗病基因,采用图位克隆、mRNA差异显示等技术定位、扩增,开发分子标记抗病基因,进行抗病分子辅助育种;一方面,采用分子手段及诱变技术将拮抗基因、裂殖基因、耐杀菌剂基因等导入生防菌中,改良其遗传结构形成高抗逆性、广适应性和抗菌谱宽的遗传工程菌,若筛选的生防菌能促进植物的生长发育,便可达到防病增产的目的,这将是未来生防工作发展的重点;第五,抗病菌株与生防菌的拮抗基因为基因工程提供丰富的基因资源,为构建植物抗体文库和改良抗病转基因植物的特性奠定基础。如李梅云等[70]通过对香料烟品种细菌性斑点病的抗性鉴定,得到高抗品种包括‘巴斯玛1号’‘卡拉巴格拉’‘杰尼克’‘罗香1号’‘沙姆逊’‘巴斯玛14号’和‘基可纳巴斯玛’;拟南芥能抵抗丁香假单胞菌主要是由于自身 AZI1基因能促进木质素的合成,通过加厚细胞壁,提高拟南芥对丁香假单胞菌的抗性[71],未来可采用上述高抗品种或基因选育新品种;此外,可利用植物自身含有的活性抑菌成分,包括萜类、含氮含硫化合物、芳香族化合物、蛋白质类及脂肪类化合物等开发特异性分子标记,进行植物抗病分子辅助育种,以及通过转基因技术将上述杀菌、抑制病原菌生长发育的拮抗基因导入作物,培育具有抗病能力的新品种,但需保证对原品种的农艺性状无影响或影响较小,否则会因产品农艺性状不好而被淘汰。因此,未来可从上述5方面对疫病进行防治,从根本上降低丁香假单胞菌对农业生产带来的损失与风险。
Reference:
[1] EVERETT K R,TAYLOR R K,ROMBERG M K,etal.First report ofPseudomonassyringaepv.actinidiaecausing kiwifruit bacterial canker in New Zealand [J].AustralasianPlantDiseaseNotes,2011,6(1):67-71.
[2] VANNESTE J L,POLIAKOFF F,AUDUSSEAU C,etal.First report ofPseudomonassyringaepv.actinidiae,the causal agent of bacterial canker of kiwifruit in France [J].PlantDisease,2011,95(10):1311.
[3] BASTAS K K,KARAKAYA A.First report of bacterial canker of kiwifruit caused byPseudomonassyringaepv.actinidiaein Turkey[J].PlantDisease,2012,96(3):447-452.
[4] MARCELLETTI S,FERRANTE P,PETRICCIONE M,etal.Pseudomonassyringaepv.actinidiaedraft genomes comparison reveal strain-specific features involved in adaptation and virulence toActinidiaspecies[J].PublicLibraryofScienceOne,2011,6(11):1-17.
[5] 王金生.植物病源细菌学[M].北京:中国农业出版社,2000:352-484.
WANG J SH.Plant Pathogenic Bacteria [M].Beijing:China Agriculture Press,2000:352-484(in Chinese).
[6] REES-GEROGE J,VANNESTE J L,CORNISH D A,etal.Detection ofPseudomonassyringaepv.actinidiaeusing polymerase chain reaction ( PCR) primers based on the 16S-23S rDNA intertranscribed spacer region and comparison with PCR primers based on other gene regions[J].PlantPathology,2010,59:453-464.
[7] 朱海云,李 勃,李 燕,等.丁香假单胞菌猕猴桃致病变种的遗传多样性及进化关系[J].微生物学杂志,2013,33(4):66-71.
ZHU H Y,LI B,LI Y,etal.Relation of genetic diversity and evolution of kiwifruit pathogenPseudomonassyringaepv.actinidiae[J].JournalofMicrobiology,2013,33(4):66-71(in Chinese with English abstract).
[8] FERRANTE P,SCORTICHINI M.Molecular and phenotypic variability ofP.avellanae,P.syringaepv.actinidiaeandP.syringaepv.theae[J].JournalofPlantPathology,2011,93:659-666.
[9] KOH Y,NOU I.DNA markers for identification ofPseudomonassyringaepv.actinidiae[J].MoleculesandCell,2002,13:309-314.
[10] SAWADA H,KANAYA S,TSUDA M,etal.A phylogenomic study of the OCTase genes inPseudomonassyringaepathovars:the horizontal transfer of the argK-tox cluster and the evolutionary history of OCTase genes on their genomes [J].JournalofMolecularEvolution,2002,54:437-457.
[11] TEMPLETON M D,REINHARDT L A,COLLYER C A,etal.Kinetic analysis of the L-ornithine transcarbamoylase fromPseudomonassavastanoipv.phaseolicolathat is resistant to the transition state analogue (R) -N delta-(N′-Sulfodiaminophosphinyl) -L-ornithine [J].Biochemistry(Washington),2005,44:4408-4415.
[12] SCORTICHINI M,MARCHESI U,DI PROSPERO P.Genetic relatedness amongP.avellanae,P.syringaepv.theaeandP.syringaepv.actinidiae,and their identification [J].EuropeanJournalofPlantPathology,2002,108:269-278.
[13] MANCEAU C,BRIN C.Pathovars ofPseudomonassyringaeAre Structured in Genetic Populations Allowing the Selection of Specific Markers for Their Detection in Plant Samples [M].Dordrecht:Kluwer Academic Publishers,2003,503-512.
[14] IVANOVIC Z,GAVRILOVIC V.REP-PCR as a method for determining diversity amongPseudomonassyringaestrains from fruit trees [J].ArchivesofBiologicalSciences,2009,46:264-268.
[15] MARCELLETTI S,SCORTICHINI M.Clonal outbreaks of bacterial canker caused byPseudomonassyringaepv.actinidiaeonActinidiachinensisandActinidiadeliciosain Italy [J].JournalofPlantPathology,2011,93:479-483.
[16] GALLELLI A,LAERORA A,LORETI S.Gene sequence analysis for the molecular detection ofPseudomonassyringaepv.actinidiae:developing diagnostic protocols [J].JournalofPlantPathology,2011,93:425-435.
[17] BALESTRA G M,RENZI M,MAZZAGLIA A.First report of bacterial canker ofActinidiadeliciosacaused byPseudomonassyringaepv.actinidiaein Portugal [J].NewDiseaseReports,2010,22:3-10.
[18] FERRANTE P,SCORTICHINI M.Identification ofPseudomonassyringaepv.actinidiaeas causal agent of bacterial canker of yellow kiwifruit (ActinidiachinensisPlanchon) in central Italy [J].JournalofPhytopathology-PhytopathologischeZeitschrift,2009,157:768-770.
[19] BASTAS K K,KARAKAYA A.First report of bacterial canker of kiwifruit caused byPseudomonassyringaepv.actinidiaein Turkey [J].PlantDisease,2012,96:441-452.
[20] 张立新,李莎莎,檀根甲.猕猴桃溃疡病菌的鉴定及其对不同猕猴桃品种的致病力分析[G]//中国植物保护学会2011年学术年会论文集.北京:中国农业科学技术出版社,2011:241-243.
ZHANG L X,LI SH SH,TAN G J.Identification of the pathogen of the bacterial pathogen of the fruit of the kiwifruit and analysis of the pathogenicity of different varieties of the kiwifruit [G]// China Society of Plant Protection,Proceedings of the 2011 Academic Year.Beijing:The Science and Technology of China’s Agriculture,2011:241-243(in Chinese with English abstract).
[21] 连玲丽,洪旭鸿,郑璐平,等.丁香假单胞菌基因组内简单重复序列的比较分析[J].四川农业大学学报,2012,30(2):150-155.
LIAN L L,HONG X H,ZHENG L P,etal.Comparative analysis of SSR inPseudomonassyringaegenomes [J].JournalofSichuanAgriculturalUniversity,2012,30(2):150-155(in Chinese with English abstract).
[22] 包 奇,曹梦琪,周 雨,等.基于实时荧光定量PCR技术检测桑丁香假单胞菌[J].蚕业科学,2016,42(2):210-218.
BAO Q,CAO M Q,ZHOU Y,etal.Detection ofPseudomonassyringaepv.moribased on real-time quantitative PCR technology [J].ScienceofSericulture,2016,42(2):210-218(in Chinese with English abstract).
[23] AMANDINE C,SOPHIE C,MARTIAL B,etal.Draft genome sequences of fivePseudomonassyringaepv.actinidifoliorumstrain isolated in France [J].BrazilianJournalofMicrobiology,2016,43(2):336-347.
[24] ZHANG Z B,GAO X N,YANG D H,etal.Field detection of canker-causing bacteria on kiwifruit trees:Pseudomonassyringaepv.actinidiaeis the major causal agent [J].CropProtection,2015,75:55-62.
[25] IRINA A M,VERA K B,EUGENIA V M,etal.Intragenomic heterogeneity of the 16S rRNA-23S rRNA internal transcribed spacer amongPseudomonassyringaeandPseudomonasfluorescensstrains [J].FEMSMicrobiologyLetters,2004,239:17-23.
[26] LI W,XU Y P,JEAN P M,etal.Functional identification of phenazine biosynthesis genes in plant pathogenic bacteriaPseudomonassyringaepv.tomatoandXanthomonasoryzaepv.oryzae[J].JournalofIntegrativeAgriculture,2016,15(4):812-821.
[27] SIMONA P,LUCA N,GRAZIANO V,etal.Effect of bacterial canker caused byPseudomonassyringaepv.actinidiaeon postharvest quality and rots of kiwifruit “Hayward” [J].PostharvestBiologyandTechnology,2016,113:119-124.
[28] HACKER J,CAMIEL E.Ecological fitness,genomic islands and bacterial pathogenicity [J].EMBOReports,2001,2(5):376-381.
[29] KIM J F,ALFNAO J R.Pathogenicity islands and virulence plasmids of bacterial plant pathogens [J].CurrenttopicsinMicrobiologyandImmunology,2002,264(2):127-147.
[30] 杨 军,尹启生,宋纪真,等.植物病原细菌的hrp基因 [J].遗传,2005,27(5):852-858.
YANG J,YIN Q SH,SONG J ZH,etal.hrpgene of plant pathogenic bacteria [J].Genetics,2005,27(5):852-858(in Chinese with English abstract).
[31] 孟 姗,何 彦,张中娜,等.丁香假单胞菌基因inaQ变速箱启动子结构与活性分析 [J].氨基酸和生物资源,2014,36(4):47-53.
MENG SH,HE Y,ZHANG ZH N,etal.Structure and activity characterization of a gearbox-type promoter fromPseudomonassyringaeice-nucleating geneinaQ[J].AminoAcidandBioticResources,2014,36(4):47-53(in Chinese with English abstract).
[32] KOEBNIK R.The role of bacterial pili in protein and DNA translocation [J].TrendsMicrobio,2001,9(12):586-590.
[33] HAAPALAINEN M,DAUPHIN A,LI C M,etal.HrpZ harpins from differentPseudomonassyringaepathovars differ in molecular interactions and in induction of anion channel responses inArabidopsisthalianasuspension cells [J].PlantPhysiologyandBiochemistry,2012,51:168-174.
[34] LEE Y H,KOLADE O O,NOMURA K,etal.Use of dominant-negative HrpA mutants to dissecthrppilus assembly and type Ⅲ secretion inPseudomonassyringaepv.tomato[J].JournalofBiologicalChemistry,2005,280(22):21409-21417.
[35] NOEL L,THIEME F,NENNSTIEL D,etal.Two novel type Ⅲ-secreted proteins ofXanthomonascampestrispv.vesicatoriaare encoded within thehrppathogenicity island [J].JournalofBacteriol,2002,184(5):1340-1348.
[36] HE S Y,HUANG H C,COLLMAR A.Pseudomonassyringaepv.syringaeharpin:a protein that is secreted via thehrppathway and elicits the hypersensitive response in plant [J].Cell,1993,73(7):1255-1266.
[37] ANGOT A,VERGUNST A,GENIN S,etal.Exploitation of eukaryotic u-biquitin signaling pathways by effectors translocated by bacterial type Ⅲand type Ⅳ secretion systems[J].PlosPathogens,2007,3(1):1-3.
[38] ALFANO J R,COLLMER A.Type Ⅲ secretion system effectors proteins:double agents in bacterial disease and plant defense [J].Annualreviewofphytopathology,2004,42:385-414.
[39] XIAO F M,GIAVALISCO P,GREGORY B M.PseudomonassyringaeType Ⅲ Effector AvrPtoB is phosphorylated in plant cells on Serine 258 promoting its virulence activity [J].JournalofBiologicalChemistry,2007,282(42):30737-30744.
[40] SHAN L,THANA V K,MARTIN G B,etal.ThePseudomonassyringaeAvrPto protein is differentially recognized by tomato and tobacco and is localized to the plant plasma membrane[J].PlantCell,2000,12(12):2323-2338.
[41] ZACHARY N,ERIC M,SUSANNE K,etal.Eukaryotic fatty acylation drives plasma membrane targeting and enhances function of several type Ⅲ effectors proteins fromPseudomonassyringae[J].Cell,2000,101(4):353-363.
[42] GUTTMAN D S,VINATZER B A,SARKAR S F,etal.A functional screen for the type Ⅲ (hrp) secretome of the plant pathogenPseudomonassyringae[J].Science,2002,295:1722-1726.
[43 ] LINDGREN P B,PEET R C,PANOPOULOS N J.Gene cluster ofPseudomouassyringaepv.phaseolicolacontrols pathogenmicity of bean plants and hypersensitivity of non-host plants[J].JournalofBacteriol,1986,168(2):512-522.
[44] ROMAN G G,MICHAEL H.Protein secretion systems and adhesions:the molecular armory of gram-negative pathogens [J].InternationalJournalofMedicalMicrobiology,2007,297(6):401-415.
[45] WEI W,LABY R J,ZUMNOFF C H,etal.Harpin,elicitor of the hypersensitive response produced by the plant pathogenErwiniaamylovora[J].Science,1992,257(5066):85-88.
[46] GOUGH C L,GENIN S,ZISCHEK C A.Thehrpgenes ofPseudomonassolanacearumare homologous to pathogenicity determinants of animal pathogenic bacteria and are conserved among plant pathogenic bacterial [J].MolecularPlant-MicrobeInteractions,1992,5(5):384-389.
[47] MUDGETT M B.New insights to the function of phytopathogenic bacterial type Ⅲ effectors in plants [J].TheAnnualReviewofPlantBiology,2005,56:509-31.
[48] JIN Q,HE S Y.Role of thehrppilus in type Ⅲ protein secretion inPseudomonassyringae[J].Science,2001,294(5551):2556-2558.
[49] LORANG J M,KEEN N T.Characterization of avrE formPseudomonassyringaepv.tomato:ahrp-linked virulence locus consisting of at least two transcriptional units [J].MolecularPlant-MicrobeInteractions,1995,8(1):49-57.
[50] 丁 玲,孟小林,徐进平,等.HrpZ基因在大肠杆菌中的高效表达与活性检测[J].西北植物学报,2005,25 (12):2391-2394.
DING L,MENG X L,XU J P,etal.High expression and activity detection ofHrpZgene inEscherichiacoli[J].ActaBotanicaBoreali-OccidentaliaSinica,2005,25 (12):2391-2394(in Chinese with English abstract).
[51] 袁 军,刘海荣,庄振宏,等.丁香假单胞菌极毛蛋白hrpA基因克隆与表达[J].福建农林大学学报(自然科学版),2012,41(5):518-522.
YUAN J,LIU H R,ZHUANG ZH H,etal.Cloning and expression of hrpA gene ofPseudomonassyringae[J].JournalofFujianAgricultureandForestryUniversity(NaturalScienceEdition),2012,41(5):518-522(in Chinese with English abstract).
[52] WENGELNIK K,ROSSIER O,BONAS U.Mutations in the regulatory gene hrpG ofXanthomonascampestrispv.vesicatoriaresult in constitutive expression of allhrpGenes[J].JournalofBacterial,1999,181(21):6828-6831.
[53] RAHME L G,MINDRINOS M N,PANOPOULOS N J.Plant and environmental sensory signals control the expression ofhrpgenes inPseudomonassyrqngaepv.phaseolicola[J].JournalofBacterial,1992,174(11):3499-3507.
[54] ALEXANDRA C,CHRISTIAN L,ERICH G.Expression of antimicrobial peptides under control of a camalexin-biosynthetic promoter confers enhanced resistance againstPseudomonassyringae[J].Phytochemistry,2016,122:76-80.
[55] HEATH E O,DARRELL D,DAVID S G.Next-generation genomics ofPseudomonassyringae[J].Microbiology,2011,14(24):24-30.
[56] SUSANA D T,SELENE A,ENRIQUE I L,etal.Gene expression ofPhtcluster genes and putative non-ribosomal peptide systhetase required for phaseolotoxin production is regulated by CacS/CacA inPseudomonassyringaepv.phaseolicola[J].ResearchinMicrobiologys,2011,162:488-498.
[57] CHA J Y,LEE D G,LEE J S,etal.CacA directly regulated expression of several virulence genes inPseudomonassyringaepv.tabaci11528 [J].BiochemicalandBiophysicalResearchCommunications,2012,417:665-672.
[58] HARDIAN S A,WIWIEK S W.Nucleic acid and protein profile of bacteriophages that infectPseudomonassyringaepv.glycinebacterial blight on soybean [J].Procedia,2016 (9):475-481.
[59] ALEXANDRA C,CHRISTIAN L,ERICH G.Expression of antimicrobial peptides under control of a camalexin-biosynthetic promoter confers enhanced resistance againstPseudomonassyringae[J].Phytochemistry,2016,122:76-80.
[60] LENZ O,BERAN P,FOUSEK J,etal.A microarray for screening the variability of 16S-23S rRNA internal transcribed spacer inPseudomonassyringae[J].JournalofMicrobiologicalMethods,2010,82:90-94.
[61] 魏海娟,刘 萍,杨 燕,等.多羟基双萘醛提取物对猕猴桃溃疡病菌的抑制作用[J].西北农林科技大学学报(自然科学版),2011,39(1):126-130.
WEI H J,LIU P,YANG Y,etal.Antimicrobial inhibition of polyhydroxy dinaphthaldehyde extracts (WCT) onPseudomonassyringaepv.actinidiaein kiwifruit [J].JournalofNorthwestSci-TechUniversityofAgricultureandForestry(NaturalSciencesEdition),2011,39(1):126-130(in Chinese with English abstract).
[62] 宋红志,王芳芹,王 俊,等.几种咖啡酸酯类衍生物对桑丁香假单胞菌的抑制活性鉴定[J].蚕业科学,2016,42(1):53-60.
SONG H ZH,WANG F Q,WANG J,etal.Identification on inhibition activity of several caffeic acid alkyl ester derivatives againstPseudomonassyringaepv.mori[J].ScienceofSericulture,2016,42(1):53-60(in Chinese with English abstract).
[63] YOUNG J M.Pseudomonassyringaepv.actinidiaein New Zealand [J].JournalofPlantPathology,2012,94 (S1):5-10.
[64] 苏 品,刘 勇,谭新球,等.沼泽红假单包菌PSB06对拟南芥抗丁香假单胞菌DC3000的诱导作用[J].生态文明建设与绿色植保,2014,1(1):21-29.
SU P,LIU Y,TAN X Q,etal.Effect ofPseudomonasaeruginosaPSB06 on the induction ofPseudomonassyringaepv.tomatoDC3000 inArabidopsisthaliana[J].TheEcologicalCivilizationandGreenPlantProtection,2014,1(1):21-29(in Chinese with English abstract).
[65] MELLGREN E M,KLOEK A P,KUNKEL B N.Mqo,a tricarboxylic acid cycle enzyme,is required for virulence ofPseudomonassyringaepv.tomatostrain DC 3000 onArabidopsisthaliana[J].JournalofBacteriology,2009,191(9):3132-3141.
[66] 万东莉.CBP60g正调控拟南芥对丁香假单胞菌、脱落酸和干旱的响应[D].呼和浩特:内蒙古农业大学,2012:1-86.
WAN D L.CBP60g positively regulates the responses ofArabidopsisthalianatoPseudomonassyringae,abscisic acid and drought [D].Hohhot:Inner Mongolia Agricultural University,2012:1-86(in Chinese with English abstract).
[67] FU L W,YU X CH,AN CH C.Overexpression of constitutively active OsCPK10 increasesAravidopsisresistance againstPseudomonassyringaepv.tomatoand rice resistance againstMagnaporthegrisea[J].PlantPhysiologyandBiochemistry,2013,73:202-2810.
[68] ZHANG M,KANG H H,CHEN Y H,etal.Overexpression of TaUb2 enhances disease resistance toPseudomonassyringaepv.tomatoDC3000 in tobacco [J].PhysiologicalandMolecularPlantPathology,2015,13(1):1-7.
[69] 张 倩,鲍依群,谭小云.拟南芥果胶甲酯化酶基因 PME17 在抵御丁香假单胞杆菌番茄致病变种DC3000株中的功能[J].植物生理学报,2015,51(7):1061-1066.
ZHANG Q,BAO Y Q,TAN X Y.Functional analysis ofArabidopsisthalianapectin methylesterase gene PME17 in immunity againstPseudomonassyringaepv.tomatoDC 3000 [J].PlantPhysiologyJournal,2015,51(7):1061-1066(in Chinese with English abstract).
[70] 李梅云,张辰东,苏泽春,等.香料烟品种细菌性斑点病的抗性鉴定[J].中国农学通报,2010,26(18):301-305.
LI M Y,ZHANG CH D,SU Z CH,etal.Resistance determination of oriental tobacco varieties to bacterial leaf spot disease[J].ChineseAgriculturalScienceBulletin,2010,26(18):301-305(in Chinese with English abstract).
[71] 高 航,杜改亮,麻 力,等.拟南芥抵抗丁香假单胞杆菌过程中 AZI1 基因功能研究[J].西北植物学报,2013,33(3):429-436.
GAO H,DU G L,MA L,etal.Function of AZI1 gene inArabidopsisresistance againstPseudomonassyringae[J].ActaBotanicaBoreali-OccidentaliaSinica,2013,33(3):429-436(in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Research Advancement of Molecular Biology inPseudomonassyringae
WANG Dandan1and WANG Qingming2
(1.College of Agriculture,Eastern Liaoning University,Dandong Liaoning 118003,China; 2.Guangyuan Research Institute of Agricultural Sciences,Guangyuan Sichuan 628017,China)
Pseudomonassyringaeis an aerobic and strong saprophytic Gram-negative bacteria,the occurrence rate of its plant disease rankes first in the ten major bacterial plant diseases,the blight outbreaks in large-agricultural countries,there is a tendency to spread across the world,and it caused huge economic losses to agriculture country. Based on the latest research on molecular biology,this study summarized pathogenic variants ofPseudomonassyringae,pathogenic bacteria identification,early rapid detection technology,pathogenic molecular mechanism and biological control,etc. ofPseudomonassyringae,and discussed the problems existing at the recent research, research directions and prevention in the future as well as control programs of the blight.
Pseudomonassyringae; Testing; TTSS system;Hrpgene; Biological control
WANG Dandan,female,lecturer. Research area:biochemistry and molecular biology.E-mail:wangdandansq@sina.com
日期:2017-03-30
2016-12-25
2017-02-20
国家自然科学基金(31370400);丹东市2016科技攻关(2016KJ001);辽东学院青年基金(2015QN006)。
王丹丹,女,讲师,从事生物化学与分子生物学研究。E-mail:wangdandansq@sina.com
Q663.4
A
1004-1389(2017)04-0487-10
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170330.1508.002.html
Received 2016-12-25 Returned 2017-02-20
Foundation item The National Natural Science Foundation of China(No.31370400); Dandong Key Project of Science and Technology in 2016(No.2016KJ001); Youth Fund of Eastern Liaoning University Foundation (No.2015QN006).
