2个绵羊群体BMPR-IB基因多态性与绵羊产羔数的关系
2017-04-13康晓龙刘佳龙刘亚清王述宇冯登侦
康晓龙,刘佳龙,刘亚清,王述宇,冯登侦
(1.宁夏大学 农学院,银川 750021 2.宁夏宇泊科技有限公司,银川 750021)
2个绵羊群体BMPR-IB基因多态性与绵羊产羔数的关系
康晓龙1,刘佳龙1,刘亚清1,王述宇2,冯登侦1
(1.宁夏大学 农学院,银川 750021 2.宁夏宇泊科技有限公司,银川 750021)
旨在探讨BMPR-IB基因在不同绵羊群体中的遗传变异及其与产羔数的关系,利用RFLP技术分析杜泊及滩寒杂交羊群体中BMPR-IB的基因型和基因频率,以及不同基因型对母羊产羔数的影响。结果显示:杜泊羊群体均为野生型,未检测到突变纯合或杂合基因型个体。滩寒杂交群体中突变纯合子(BB型)、杂合子(B+型)和野生型(++型)个体数分别为13、48和120。在滩寒杂交羊群体中,BB、B+及++基因型母羊的多羔率分别为63.64%、47.06%和32.08%;BB型经产个体平均产羔数比杂合型(B+)及野生型(++)个体产羔数分别高出0.5和0.59,而杂合子母羊产羔数高于野生型个体,但差异不显著。表明BMPR-IB基因FecB突变位点对滩寒杂交群体产羔数有显著影响,因此可通过杂交手段提高后代群体FecB基因频率来增加产羔数,但BMPR-IB基因是否为调控杜泊羊产羔数的主效基因有待进一步探讨。
BMPR-IB基因;产羔数;杂交羊;滩羊;小尾寒羊;杜泊羊
绵羊的繁殖性能是一个重要的经济性状,在群体内表现连续变异,是由一系列主基因或数量性状基因座(Quantitative trait locus,QTL)决定的。骨形态发生蛋白受体IB(Bone morphogenetic protein receptor IB,BMPR-IB)是多种骨形态发生蛋白的膜受体,广泛存在于机体各种组织中,其在调控成骨分化、细胞扩散以及卵巢卵泡发育等过程中起重要作用,并直接影响如绵羊等动物的繁殖性状。早期在对Booroola羊高繁殖力原因进行研究时发现一个常染色体突变位点[1-2],该突变基因于1989年被绵、山羊遗传命名委员会正式定名为FecB基因(即Fec=fecundity,B=Booroola)。随后的研究证实,该突变是由碱基的点突变引起,即A746G碱基突变导致编码蛋白的第 249 位谷氨酰胺突变为精氨酸(Q→R)[3],这种变化可能导致卵巢对激素的敏感性[4],或引起高繁个体体内激素分泌的增加[5],并进一步引起绵羊排卵数和产羔数的增加。
杜泊羊(Dorper sheep)是南非成功杂交选育而成的著名肉用绵羊品种。杜泊母羊全年发情,不同胎次产羔率差异较大。其中头胎羊的产羔率为 132%,二胎为167%,三胎为220%,前3胎的平均产羔率为177%[6]。目前,对杜泊羊产羔数相关的基因或位点研究报道较少。滩羊是宁夏本地绵羊品种,产羔率较低。以高繁殖力小尾寒羊与滩羊杂交形成的滩寒杂交群体(F1代)可部分提高滩羊产羔数,但影响产羔数的关键基因在后代群体中的基因频率数据未见报道。自2015年开始,宁夏地区开展高产肉用绵羊新品种(品系)的培育工作,以BMPR-IB基因作为分子标记,在杂交群体及核心群选育中选择含有突变位点的羊留种,以便提高母羊产羔数。本研究以纯种杜泊羊及滩寒杂交群体为材料,应用限制性片段长度多态性(Restriction fragment length polymorphism,RFLP)对BMPR-IB基因在2个绵羊群体中的遗传多态性及其与绵羊产羔数的关系进行分析,为进一步在高繁殖力肉用绵羊群体中进行BMPR-IB基因的标记辅助选择提供依据。
1 材料与方法
1.1 试验动物及DNA提取
选择宇泊种羊场纯种杜泊 14 只,滩寒杂交群体F1代 181 只,收集整理产羔记录。所有试验羊均采用常规饲养管理,体况健康。每只羊通过颈静脉采集血液 5 mL,装在预先加有1.5 mL ACD抗凝剂的采血管中,盖严,快速振荡混匀,低温下带回实验室,备用。采用常规的酚-氯仿抽提法提取基因组DNA,-20 ℃保存,备用。
1.2 引物合成
根据GenBank数据库中绵羊BMPR-IB基因序列(登录号:AF357007),利用Primer5 .0软件设计1 对引物,由上海生工生物工程公司合成。引物序列为:
F:5′-GTCGCTATGGGGAAGTTTGGAT- G-3′;R:5′-CAAGATGTTTTCATGCCTCATCAACACGGTC-3′。
1.3 PCR-RFLP检测
反应体系:PCR Mixture 12.5 μL,上、下游引物(10 pmol/μL)各1 μL,DNA模板(50 ng/μL)1 μL,补充ddH2O至25 μL。充分混匀,瞬时离心后进行PCR反应。反应条件为:94 ℃预变性5 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s, 33 个循环;最后72 ℃延伸7 min后4 ℃保存。
1.4 酶切反应
反应总体积为10 μL,其中PCR产物为4.5 μL,限制性内切酶AvaⅡ 0.25 μL,10×Buffer 1 μL,补ddH2O至10 μL。反应液混匀后,经37 ℃水浴消化4 h,终产物用3 g/L的琼脂糖凝胶电泳检测。
1.5 统计分析
利用Excel整理和统计生产数据,并进行基因频率和基因型频率分析。使用SPSS 22.0 软件进行BMPR-IB不同基因型与杜泊羊及滩寒杂交群体产羔数关联分析,数据采用“最小二乘均值±标准误”表示。
2 结果与分析
2.1 BMPR-IB 基因多态位点的 PCR 扩增
利用特异引物对 2 个绵羊群体基因组 DNA 进行扩增,产物经 3 g/L 的琼脂糖凝胶电泳检测,得到长度为 140 bp 的特异性条带(图 1),目的条带清晰,特异性好,可直接进行酶切分析。
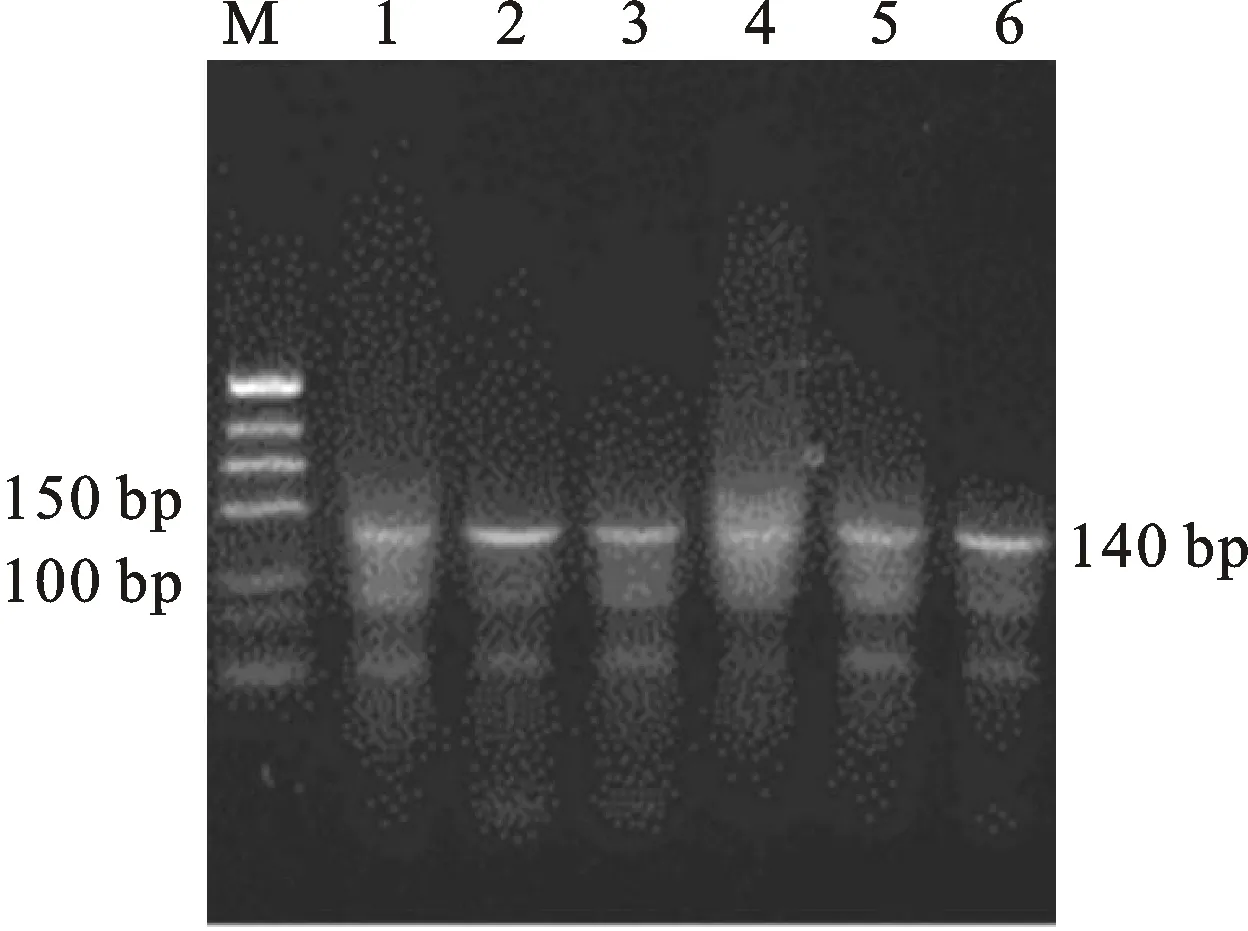
M.50 bp Marker; 1~6.PCR扩增产物 PCR products ofBMPR-IB
图1BMPR-IB基因的PCR扩增
Fig.1 Amplification ofBMPR-IBgene
AvaⅡ 限制性内切酶消化 PCR 产物后,出现 3 种带型(图 2):野生型为 1 条140 bp的条带(++型),纯合突变型为 110 和 30 bp 2 条带(BB基因型),有以上3 种条带的为杂合型,记作“B+”,其中30 bp的条带均迁移到末端,不易辨认。
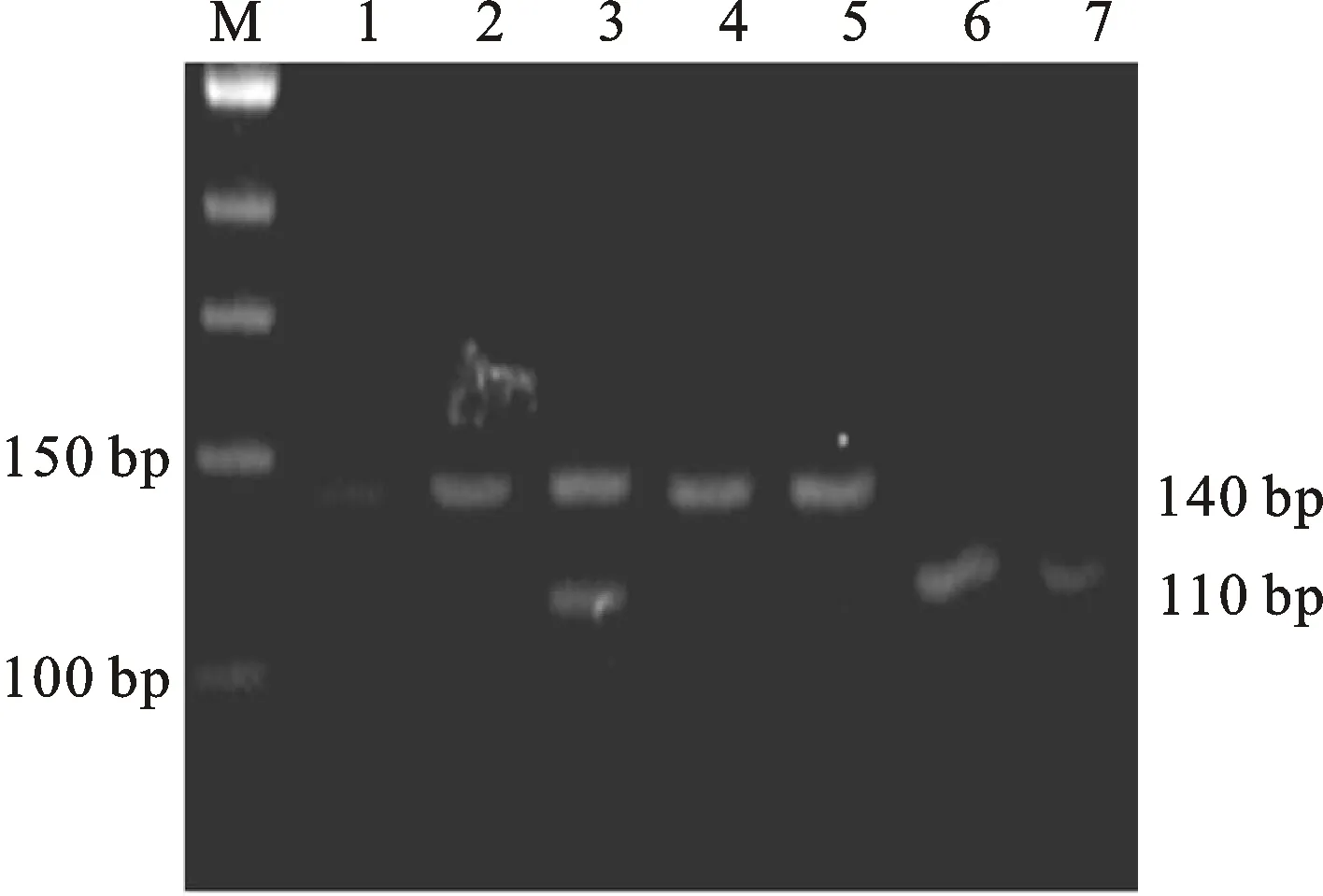
M. 50 bp Marker;1、2、4、5. ++基因型 ++ genotype; 3. B+基因型 B+ genotype; 6、7. BB基因型 BB genotype
图2BMPR-IB基因AvaⅡ酶切
Fig.2 The enzyme-digested products ofBMPR-IBbyAvaⅡ
2.2 BMPR-IB基因多态位点的等位基因频率和基因型频率
对杜泊羊及滩寒杂交羊共 195 只个体进行BMPR-IB基因FecB突变的多态性检测。杜泊羊群体均为野生型,未检测到突变纯合或杂合基因型个体。滩寒杂交羊中突变纯合子(BB型)13 只、突变杂合子(B+型)48 只、未发生突变(++型)个体120 只(表 1),表明小尾寒羊与滩羊的杂交后代个体中B等位基因频率有所增加。
2.3 BMPR-IB 基因型与不同群体绵羊产羔数的关系
经统计分析不同基因型个体与产羔数的相关性,结果表明,在所分析的杜泊羊群体中,++型母羊双羔率为 35.71%,平均产羔数为1.36(表 2),未检测到FecB位点突变型的纯合或杂合个体。一方面可能是样本量较少的缘故,另一方面也表明杜泊羊可能不存在BMPR-IB的FecB突变位点。
在滩寒杂交群体中经产母羊 151 只,其中BB基因型母羊双羔率为 63.64%,B+基因型母羊双羔率为 47.06%,++型个体双羔率为 32.08%;滩寒杂交群体母羊BMPR-IB基因的突变纯合子(BB型)平均产羔数比杂合型(B+)及野生型(++)个体分别高出 0.5 和 0.59 (P<0.01),而B+与++型差异不显著,说明BMPR-IB基因对滩寒杂交群体产羔数有显著影响。
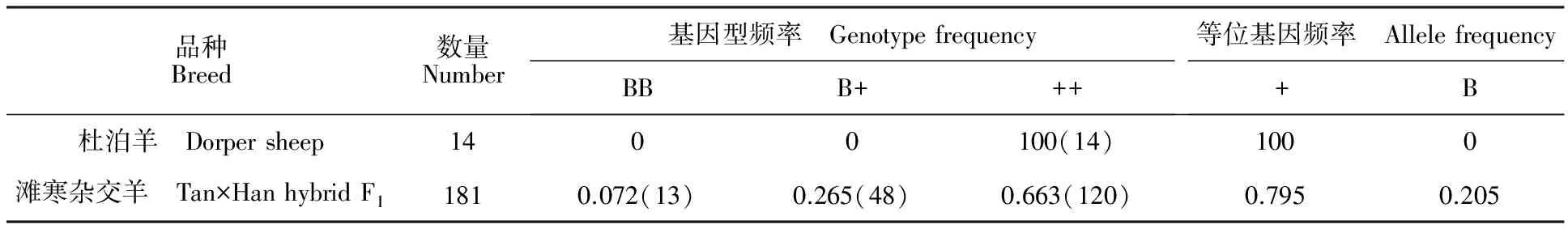
表1 不同绵羊群体BMPR-IB基因型及基因频率Table 1 Distribution of BMPR-IB genotype and allele frequency in different sheep

表2 基因型与不同群体母羊的关系产羔数Table 2 The relationship of BMPR-IB genotypes and the litter size in different sheep
注:同列数据后不同大写字母表示平均值间差异极显著(P<0.01) 。
Note:Data in same column with different uppercase letters is significant difference atP<0.01.
3 讨 论
绵羊的多胎(羔)性状是重要的经济性状,备受关注。BMPR-IB基因是TGF2β受体超家族的成员之一。绵羊BMPR-IB基因已被定位到 6q23~31,全长 20 kb,包含 10 个外显子,编码区长1 509 bp,编码 502 个氨基酸。已经报道BMPR-IB基因编码区A746G突变导致其受体激酶结构域的第 249 位氨基酸由谷氨酰胺突变为精氨酸,造成受体部分失活,影响与之识别的配体GDF-5和BMP-4对类固醇生成作用的反应,结果使携带BMPR-IB突变基因的母羊颗粒细胞分化加快,进而加速卵泡成熟,使排卵数增多[3,7-8]。BMPR-IB基因的FecB突变位点对排卵数具有加性效应,对产羔数则部分显性。携带1个FecB拷贝(B+型) 的母羊产羔数增加 0.9~1.2,携带 2 个FecB拷贝(BB型) 的母羊产羔数增加1.1~1.7[9-10]。针对BMPR-IB基因在动物排卵及产仔数方面发挥的重要作用,国内外许多研究者分别在绵羊[11-13]、山羊[14-15]、猪[16]及鸡[17]中开展此项研究。如对脂尾羊产羔数的研究表明,BMPR-IB基因的不同基因型间绵羊个体平均产羔数差异显著(P<0.01),BB 基因型个体平均产羔数最高,达到1.685[18]。利用BMPR-IB基因的 A287G SNP 位点与鸡排卵数进行相关性分析显示,不同基因型间个体排卵数无显著差异[17]。除对候选基因的特定位点进行分析外,也有学者在绵羊繁殖性能方面开展全基因组关联分析[19-21],如对挪威白羊开展的全基因组关联分析结果显示,生长分化因子基因 GDF9(Growth differentiation factor 9)的一个错义突变(c.1111G>A)与该绵羊群体的产羔数呈显著相关[19], BMP15基因的FecXGr和FecXO2个突变位点与Grivette和Olkuska绵羊的高繁殖性能有关[20]。但全基因组关联分析的相关结果均未发现BMPR-IB基因在产仔数与排卵率方面所发挥的作用,可能与绵羊品种及群体数量有关。
本试验采用PCR-RFLP技术分别对滩寒杂交羊及杜泊羊群体进行检测,在滩寒杂交群体中BB型个体平均产羔数比杂合型(B+)及野生型(++)个体分别高0.5和0.59,而杂合型个体平均产羔数高于野生型个体,但差异不显著,因此通过导入具有FecB突变的外血可有效提高杂交后代群体中B 等位基因频率,利用该基因在新品种培育中作为分子标记提高产羔数是可行的。
滩羊是中国著名的裘皮用绵羊品种,但产羔率较低。为提高滩羊产羔率,许多研究者开展滩羊多羔品系研究。杜立新[22]在较早研究报道中称,在滩羊群体中发现多羔家系,经性激素测定及初步杂交分析,发现滩羊多羔性状表现与布鲁拉美利奴羊的BMPR-IB突变(FecB)接近,平均每只产羔1.9,而同一地区其他滩羊的产羔数仅为0.8左右。表明尽管滩羊产羔率较低,但其具有FecB突变位点(c.746A>G)。最新研究结果表明[23],滩羊FecB突变中的BB基因型个体平均产羔数较B+和++基因型分别多 0.076和 0.159,差异均不显著(P>0.05)。滩羊群体中B基因对产羔数的提高未能较好发挥,也可能与滩羊的饲养管理有关。小尾寒羊属于高产绵羊品种,携带FecB突变。Chu等[24]研究发现,BB基因型小尾寒羊平均产羔数比++基因型多1.40(P<0.01),B+基因型小尾寒羊平均产羔数比++基因型多1.11(P<0.01),小尾寒羊FecB基因B等位基因与其产羔数呈显著正相关。滩羊产羔率较低,一般只有103%,小尾寒羊属于高产绵羊品种。本研究结果表明,滩寒杂交群体,BB个体产羔数达1.91,显著高于其他2种基因型;B+基因型个体产羔数高于++基因型,但差异不显著。因此,通过小尾寒羊与滩羊杂交,可定向增加特定基因型频率。通过不同性状个体杂交,对所生后代进行基因型鉴定,选择FecB突变中含有B基因的BB和B+基因型羊留种,以期提高后代产羔数。
杜泊羊平均产羔率达177%,在本试验群体中,杜泊羊只检测到++基因型,未检测到FecB突变型,与王公金等[25]研究结果吻合。对于杜泊羊产羔性能的其他研究[26]显示,促卵泡素受体(FSHR)基因CC基因型的杜泊羊个体产羔数显著高于TT型(P<0.01);同时对绵羊排卵数或产羔数有显著影响的生长分化因子基因( GDF9)的G1(c.260G>A)突变位点,在杜泊羊群体中也具有2种基因型,AA型和AB型[27],而在该基因的G7(c.1111G>A)突变位点和FecGV突变位点(c.943C>T)则对杜泊多羔性状无显著影响[28]。因此,对于杜泊羊,后续研究可在扩大样本量的基础上对 GDF9基因等或BMPR-IB基因的其他突变位点开展研究。
4 结 论
杜泊羊双羔个体中未检测到BMPR-IB基因FecB突变位点,需要进一步开展其他基因或BMPR-IB基因其他位点与杜泊羊双羔性能的相关性。同时,BMPR-IB基因的FecB位点与滩寒杂交群体产羔数呈显著相关,因此,可通过杂交导入FecB突变位点的措施提高后代群体FecB基因频率来增加产羔数。本研究为BMPR-IB基因在宁夏地区高产肉用绵羊新品种(品系)选育中的应用提供依据。
Reference:
[1] DAVIS G H,MONTGOMERY G W,ALLISON A J,etal.Segregation of a major gene influencing fecundity in progeny of Booroola sheep[J].NewZealandJournalofAgriculturalResearch,1982,25(4):525-529.
[2] PIPER L R,BINDON B M.The Booroola Merino and the performance of medium non-Peppin crosses at Armidale [J].WoolTechnologyandSheepBreeding,1983,31(1):9-19.
[3] MULSANT P,LECERF F,FABRE S,etal.Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Merino ewes [J].ProceedingsoftheNationalAcademyofSciencesUSA,2001,98(9):5104-5109.
[4] MONTGOMERY G,MCNATTY K,DAVIS G.Physiology and molecular genetics of mutations that increase ovulation rate in sheep [J].EndocrineReviews,1992,13(2):309-328.
[5] MONTGOMERY G W,GALLOWAY S M,DAVIS G H,etal.Genes controlling ovulation rate in sheep [J].Reproduction,2001,121(6):843-852.
[6] 王建刚.杜泊羊种质特性初步研究[D].陕西杨凌:西北农林科技大学,2006.
WANG J G.A primary study on trait of Dorper sheep[D].Yangling Shaanxi:Northwest A&F University,2006(in Chinese with English abstract).
[7] WILSON T,WU X Y,JUENGEL J L,etal.Highly prolific Booroola sheep have a mu tat ion in the intracellular kinase domain of bone morphogenetic protein IB receptor(ALK-6) that is expressed in both oocytes and granulosa cells [J].BiologyReproduction,2001,64(4):1225-1235.
[8] SOUZA C J,MACDOUGALL C,CAMPBELL B K,etal.The Booroola(FecB) phenotype is as sociated with a mutation in the bone morphogenetic receptor type IB(BMPR-IB) gene[J].Endocrinol,2001,169(2):1-6.
[9] 储明星,张宝云,王凭青,等.绵羊微卫星 OarJL36和FecB基因的多态及连锁分析[J].中国农业科学,2009,42(6):2133-2141.
CHU M X,ZHANG B Y,WANG P Q,etal.Polymorphic and linkage analysis of microsatellite OarJL36 andFecBgene in sheep[J].ScientiaAgriculturaSinica,2009,42(6):2133-2141(in Chinese with English abstract).
[10] DAVIS G H,BALAKRISHNAN L,ROSS I K,etal.Investigation of the Booroola(FecB) and Inverdale(FecXI) mutations in 21 prolific breeds and strains of sheep sampled in 13 countries [J].AnimalReproductionScience,2006,92(1/2):87-96.
[11] WANG W,LIU S,LI F,etal.Polymorphisms of the ovineBMPR-IB,BMP-15 andFSHRand their associations with litter size in two Chinese indigenous sheep breeds[J].InternationalJournalofMolecularSciences,2015,16(5):11385-11397.
[12] MAHDAVI M,NANEKARANI S,HOSSEINI S D.Mutation inBMPR-IBgene is associated with litter size in Iranian Kalehkoohi sheep[J].AnimalReproductionScience,2014,147(3):93-98.
[13] ABDOLI R,ZAMANI P,DELJOU A,etal.Association of BMPR-1B and GDF9 genes polymorphisms and secondary protein structure changes with reproduction traits in Mehraban ewes[J].Gene,2013,524(2):296-303.
[14] HELAL M A Y,MAHBOUB H D H,HEMEDA S A,etal.Polymorphism of bone morphogenetic protein receptor-IB(BMPR-IB) gene with litter size and kids growth of some goat breeds in Egypt[J].AlexandriaJournalofVeterinarySciences,2014,41(1):28-34.
[15] MEHDIZADEH GAZOOEI Y,NIAZI A,ZAMIRI M J.Single nucleotide polymorphism analysis of the bone morphogenetic protein receptor IB and growth and differentiation factor 9 genes in Rayini goats(Caprahircus)[J].JournalofLivestockScienceandTechnologies,2013,1(2):45-50.
[16] ZHAO X Y,YANG Q,ZHAO K W,etal.Production of transgenic pigs with an introduced missense mutation of the bone morphogenetic protein receptor type IB gene related to prolificacy[J].AsianAustralasJournalAnimalScience,2016,29(7):925-937.
[17] NIKNAFS S,JAVAREMI A N,SADEGHI M.Single nucleotide polymorphisms inBMPR-IBand STAT5B genes and their association with growth and reproductive traits in chicken[J].SongklanakarinJournalScienceTechnology,2014,36(2):137-142.
[18] MASKUR M,TAPAUL R,KASIP L.Genetic polymorphism of bone morphogenetic protein receptor 1B( BMPR-1B ) gene and its association with litter size in Indonesian fat-tailed sheep[J].AfricanJournalofBiotechnology,2016,15(25):1315-1319.
[19] VÅGE D I,HUSDAL M,KENT M P,etal.A missense mutation in growth differentiation factor 9( GDF9) is strongly associated with litter size in sheep[J].BMCGenetics,2013,14:1.
[20] DEMARS J,FABRE S,SARRY J,etal.Genome-wide association studies identify two novel BMP15 mutations responsible for an atypical hyper prolificacy phenotype in sheep[J].PLoSGenetics,2013,9(4):e1003482.
[21] GHOLIZADEH M,RAHIMI-MIANJI G,NEJATI-JAVAREMI A,etal.Genome wide association study to detect QTL for twinning rate in Baluchi sheep[J].JournalofGenetics,2014,93(2):489-493.
[22] 杜立新.滩羊多胎基因突变生化遗传标记的研究[C].北京:第九次全国动物遗传育种学术讨论论文集,1997:126-129.
DU L X.Study of biochemical genetic markers on genes related to litter size in Tan Sheep [C].Beijing:The 9th National Animal Breeding and Genetic Bulletin,1997:126-129(in Chinese).
[23] 田秀娥,孙红霞,王永军.3个绵羊群体BMPR-IB基因的遗传多态性及其对产羔数的影响[J].西北农林科技大学学报(自然科学版),2007,37(11):31-36.
TIAN X E,SUN H X,WANG Y J.Genetic polymorphism ofBMPR-IBgene and effect on litter size in three sheep breeds[J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2007,37(11):31-36(in Chinese with English abstract).
[24] CHU M X,LIU Z H,JIAO C L,etal.Mutations inBMPR-IBand BMP-15 genes are associated with litter size in Small Tailed Han sheep(Ovisaries) [J].JournalofAnimalScience,2007,85(3):598-603.
[25] 王公金,窦德宇,花卫华,等.5个绵羊群体的BMPR-IB基因多态性分析[J].江苏农业学报,2007,23(5):447-450.
WANG G J,DOU D Y,HUA W H,etal.Analysis of polymorphism ofBMPR-IBgene in five sheep populations[J].JiangsuJournalofAgriculturalScience,2007,23(5):447-450(in Chinese with English abstract).
[26] PAN X,LIU S,LI F,etal.Molecular characterization,expression profiles of the ovineFSHRgene and its association with litter size [J].MolecularBiologyReports,2014,41(12):7749-7754.
[27] 古丽格娜,艾买提·买买提,於建国,等.7 种绵羊和4种山羊 GDF9基因G1突变检测[J].中国草食动物科学,2015,35(4):1-4.
GULIGENA,AIMAITI M·AIMAITI,YU J G,etal.Detection of G1 mutation of the GDF9 gene in seven sheep and four goat breeds[J].ChinaHerbivoreScience,2015,35(4):1-4(in Chinese with English abstract).
[28] 金慧慧,储明星,潘章源,等.16种山羊和6种绵羊 GDF9基因G7和FecGV突变检测[J].安徽农业大学学报,2015,42(1):104-109.
JIN H H,CHU M X,PAN ZH Y,etal.Detection of the G7 andFecGVmutations of the GDF9 gene in sixteen goat and six sheep breeds[J].JournalofAnhuiAgriculturalUniversity,2015,42(1):104-109(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Association betweenBMPR-IBPolymorphism and Litter Size in Two Sheep Groups
KANG Xiaolong1,LIU Jialong1,LIU Yaqing1,WANG Shuyu2and FENG Dengzhen1
(1.School of Agriculture,Ningxia University,Yinchuan 750021,China;2.Ningxia Yubo Technology Co.LTD,Yinchuan 750021,China)
In order to make certain the genetic variation ofBMPR-IBand its relationship with sheep litter size,we analyzed the genotypic and genic frequency ofBMPR-IBgene,and the effects of genotypes on litter size of Dorper and hybrid sheep (Tan crossed with Small Tail Han sheep) by RFLP technology. The results showed that there were no individuals of BB and B+ genotypes appeared in Dorper sheep. In the hybrid sheep group,there were 13,48 and 120 individuals of BB,B+ and ++ genotypes. And the percentage of prolificacy of BB,B+ and ++ genotype in hybrid group was 63.64%,47.06% and 32.08%,respectively. The average litter size of individual with BB genotype was significant higher than individual of B+ (0.5) and ++ (0.59) genotype,and there was no significance between B+ ewe and ++ ewe. The above results demonstrated that the mutation ofFecBofBMPR-IBgene has significant effects on litter size of hybrid sheep. The litter size of sheep could be increased with the risingFecBgenic frequency in a group by hybridization. Further studies are needed to determine ifBMPR-IBcould be the major gene in fecundity of Dorper sheep.
BMPR-IBgene; Litter size; Hybrid sheep of Tan and Han sheep; Dorper sheep
KANG Xiaolong,male,associate professor. Research area:animal genetics and breeding.E-mail:kangxl@nxu.edu.cn
FENG Dengzhen,male,professor. Research area:animal genetics and breeding.E-mail:fdzh126@sohu.com
日期:2017-03-30
2016-11-21
2016-12-25
宁夏回族自治区肉羊育种专项(NXNYYZ20150101);宁夏自然科学基金(NZ15030);宁夏大学自然科学基金(ZR1433)。
康晓龙,男,副教授,从事动物分子遗传育种研究。E-mail:kangxl@nxu.edu.cn
冯登侦,男,教授,主要从事动物遗传繁育研究。E-mail:fdzh126@sohu.com
S813.3
A
1004-1389(2017)04-0497-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170330.1508.004.html
Received 2016-11-21 Returned 2016-12-25
Foundation item Specific Project for Mutton Sheep Breeding of Ningxia Hui Autonomous Region(No. NXNYYZ20150101); Natural Science Foundation of Ningxia Hui Autonomous Region(No.NZ15030);Natural Science Foundation of Ningxia University(No. ZR1433).
