果蝇钠通道 DmNav22在双氧木脂素A作用机理研究中的应用
2017-04-13闫秀芳郄杏桃吴文君胡兆农
闫秀芳,郄杏桃,吴文君,胡兆农
(1. 西北农林科技大学 植物保护学院 农药研究所,陕西杨凌 712100; 2. 西北农林科技大学 陕西省植物源农药研究与开发重点实验室,陕西杨凌 712100)
果蝇钠通道 DmNav22在双氧木脂素A作用机理研究中的应用
闫秀芳,郄杏桃,吴文君,胡兆农
(1. 西北农林科技大学 植物保护学院 农药研究所,陕西杨凌 712100; 2. 西北农林科技大学 陕西省植物源农药研究与开发重点实验室,陕西杨凌 712100)
建立以爪蟾卵母细胞为载体的果蝇钠通道表达系统,研究双氧木脂素A的杀虫分子机理。将果蝇钠通道 DmNav22与TipE亚基基因分别进行体外转录,获得 DmNav22与TipE亚基基因的cRNA,将 DmNav22与TipE的cRNA等质量混合,显微注射至新鲜的非洲爪蟾卵母细胞,在ND96溶液、18 ℃培养12~18 h后采用双电极电压钳技术记录其电流,测定双氧木脂素A对钠电流的影响。结果表明,注射cRNA的非洲爪蟾卵母细胞,可记录到明显的果蝇钠通道电压门控内向电流,未注射的对照组细胞则未记录到钠电流;双氧木脂素A使钠通道失活电压依赖性向超极化方向移动。说明,果蝇钠通道在非洲爪蟾卵母细胞中成功表达,为进一步研究双氧木脂素A的作用机理奠定基础。
果蝇钠通道;双电极电压钳;非洲爪蟾卵母细胞;双氧木脂素A
电压门控钠通道在电信号传递中起着关键作用,是许多天然神经毒素的靶标[1]。昆虫钠通道结构和哺乳动物相似,也由4个高度同源的结构域(DI-DIV)组成,每个结构域均含有6个跨膜α-螺旋片段(S1-S6)[2-3]。昆虫第1个钠通道基因是从果蝇的温度敏感突变体克隆的para基因(命名为DmNav)[4]。TipE是昆虫钠通道的一个调节亚基基因,将para与TipE共同表达在爪蟾卵母细胞中不仅增强了表达的丰度,而且发现在不影响钠电流的时间和电压依赖性下,锋电流增大,失活加快[5-6]。
非洲爪蟾卵母细胞被广泛用于各型离子通道和受体的异源表达,用以研究受体及离子通道的生理学和药理学特性,或探讨药物的作用机制和作用靶标[7]。迄今,已有4种DmNav同源基因在非洲爪蟾卵母细胞中功能性表达,即家蝇的Vssc1[8]、德国小蠊的BgNav[9-10]、瓦螨的VmNav[11]和黄热病蚊伊蚊的aNav[12]基因。但在国内,爪蟾卵母细胞表达体系在昆虫钠通道研究方面的应用较少。
双氧木脂素A(haedoxan A,HA)是日本学者Taniguchi等[13]从草本植物透骨草(PhrymaleptostachyaL.)中分离鉴定的一个二氧双环辛烷木脂素类化合物。Taniguchi等[13]和肖新敏等[14-16]的杀虫活性测定表明,HA具有超高的杀虫活性,与合成拟除虫菊酯类杀虫剂的杀虫活性处于同一水平。关于HA的杀虫作用机理,Hu等[17]初步研究表明,HA能引起钠通道失活曲线显著地向超极化方向移动,推测其作用于电压门控钠通道。然而,HA作用钠通道的机理及其作用位点如何,尚需进一步的研究。因此,本试验建立以非洲爪蟾卵母细胞为载体的果蝇钠通道表达系统,初步探讨HA对昆虫钠通道作用的浓度效应,旨在为进一步研究HA的杀虫作用机理奠定基础。
1 材料与方法
1.1 供试材料
双氧木脂素A(HA):从透骨草中分离获得,纯度(质量百分数)≥98%。其分子式C33H34O14,相对分子质量654,结构如图1[13]。将HA溶于DMSO中制备成30 mmol/L的母液,4 ℃储存备用,试验时将其溶解于相应的ND96溶液中稀释得到所需药物终浓度。
菌种、质粒、试验动物及培养基:大肠杆菌Stbl3购自广州易锦生物技术有限公司;携带 DmNav22、TipE编码序列的质粒由美国密歇根州立大学Dong Ke教授惠赠,表达载体为pGH19;性成熟的雌性非洲爪蟾购自中科院上海生命科学院生化细胞所干细胞技术平台;大肠杆菌的培养基为LB液体或固体培养基。
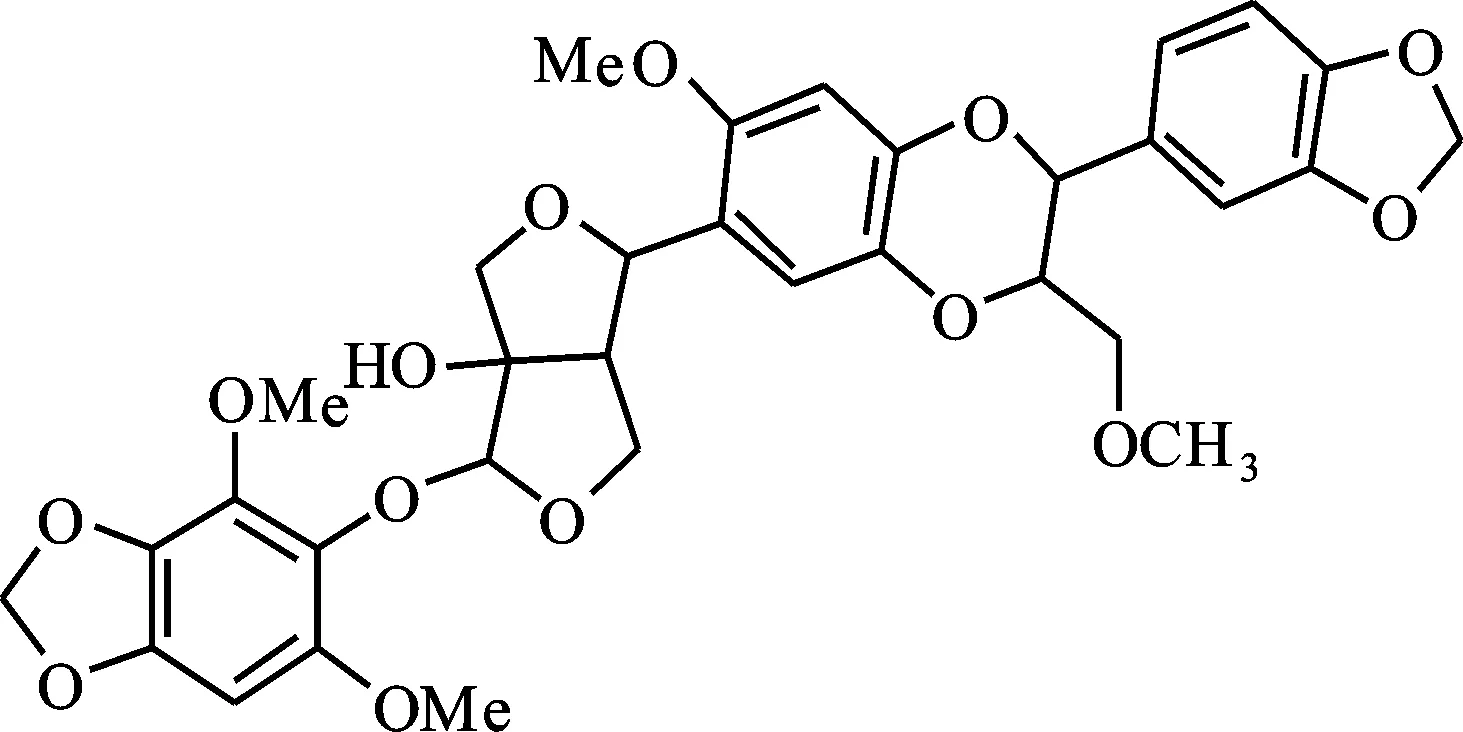
图1 双氧木脂素A结构Fig.1 Structure of haedoxan A
1.2 主要试剂及仪器
质粒小量抽提试剂盒、IA型胶原酶、限制性内切酶NotⅠ等常规分子生物学试剂购自Sigma公司;cRNA合成试剂盒mMESSAGE mMACHINE T7 Kit购自美国Ambion公司;检测电流的电生理仪器为双电极电压钳(Molecular Devices Corporation,型号:AXOCLAMP900A);微电极拉制仪(美国Sutter公司,P-97);体视显微镜(重庆重光实验有限公司,型号:ZSA300);显微注射仪(美国Sutter公司,Nanoliter2000)等。
1.3 记录及培养液的配制
细胞浴液(ND96)成分:96 mmol/L NaCl,2 mmol/L KCl,1.8 mmol/L CaCl2,1 mmol/L MgCl2及5 mmol/L HEPES,用NaOH调节pH至7.5。
卵母细胞洗涤液:去除CaCl2的ND96液,用于洗涤及消化细胞。
卵母细胞培养液:加入2.5 mmol/L丙酮酸钠、0.5 mmol/L茶碱以及50 μg/mL庆大霉素的ND96液,用于培养卵母细胞。
卵母细胞记录液:ND96液作为电流记录时的记录液。
1.4 质粒转化、提取及线性化
将含有 DmNav22、TipE基因的表达载体pGH19转化大肠杆菌Stbl3,涂于含有氨苄(100 μg/mL)的固体LB培养基平板上,倒置平板,37 ℃培养箱中培养17~24 h,挑选单克隆置于液体LB培养基中,250 r/min振荡培养12~16 h,提取质粒,经双酶切鉴定正确后,送上海立菲生物测序有限公司鉴定,测序结果与已知数据比对正确。取 DmNav22和TipE的cDNA用NotⅠ限制性内切酶线性化2 h,线性化质粒电泳检测并纯化后,用作体外转录合成cRNA的模板。酶切反应体系参照说明书进行设定。
1.5 cRNA的制备及纯化
纯化过的线性化 DmNav22、TipE质粒,用T7体外转录试剂盒合成cRNA,操作步骤参照说明书进行,37 ℃反应2 h。转录后的 DmNav22、TipEcRNA用氯化锂沉淀法进行纯化。用分光光度计测定纯化后cRNA的质量浓度和A260/A280,然后分装,于-80 ℃保存。
1.6 非洲爪蟾卵母细胞的分离及cRNA的显微注射
将6个月以上未进行试验的性成熟雌性非洲爪蟾浸在2 g/L的三卡因溶液中10~30 min使之麻醉,在麻醉状态下,于下腹部正中偏外0.5 cm左右纵向切开一约1 cm的小口,剪下3~5个卵巢瓣。在含1 mg/mL IA型胶原酶的卵母细胞洗涤液中18 ℃下消化40 min。用卵母细胞洗涤液反复清洗后置于卵母细胞培养液中。在解剖显微镜下挑出黑白半球界限分明、发育阶段处于Ⅴ~Ⅵ期且表面光滑、颗粒饱满的卵母细胞备用。用微量注射器将等质量混合的 DmNav22、TipE的cRNA,注入挑选好的卵母细胞内。注射后的卵母细胞置于细胞培养液中,18 ℃恒温培养12~18 h后用于电流检测。试验过程中所有器具需要预先进行灭菌处理,卵母细胞培养液每12 h 更换1次,且需及时在解剖显微镜下将不健康或死去的细胞挑出丢弃。
1.7 电流记录
电流记录及数据分析参照Du等[18]的方法。利用双电极电压钳系统测定果蝇钠通道电流。使用微电极拉制仪拉制玻璃微电极,灌充含琼脂粉(5 g/L)的3 mol/L KCl溶液,电极电阻小于0.5 MΩ。将卵母细胞置于容积约1 mL底部正中粘有一小片网状薄膜的记录槽中,使用微操动仪分别将电流电极与电压电极同时插入细胞中,设置钳制电压为-120 mV,给予细胞去极化刺激,室温下记录果蝇钠通道电流,同时以没有注射cRNA的卵母细胞为对照。
HA母液(30 mmol/L)用ND96记录液稀释成终浓度为0.3和3 μmol/L测试溶液。φ(DMSO)<0.5%,这样试验时不影响钠通道功能特征。药剂应用参照Tan等[19]所描述的方法。HA加入10 min后开始记录。
稳态激活电压依赖性测定,卵母细胞钳置在-120 mV,从-80 mV去极化至65 mV,阶跃电压是5 mV。以经过标准化的电导G/Gmax来反映通道激活情况。G=I/(U-Urev),其中I是电流值,U是膜电压(也就是记录到I时的测试电压),Urev是钠电流的反转电压。通道激活数据拟合两元Boltzmann方程G/Gmax=[1+exp(U-U1/2)/K]-1,其中U是膜电压,U1/2是半激活电压,K是斜率。
稳态失活电压依赖性测定,卵母细胞先施予一组从-120 mV至40 mV的预前刺激,时间200 ms,阶跃电压是5 mV,接着再给予一组到-10 mV的测试刺激,时间20 ms。以经过标准化的电流值I/Imax来反应通道失活情况。通道失活数据拟合两元Boltzmann方程I/Imax=[1+exp(U-U1/2)/K]-1,其中I是电流值,Imax是最大电流值,U是失活电压,U1/2是半失活电压,K是斜率[17]。
1.8 数据采集和分析
数据分析采用SPSS 12.0(version 12.0,SPSS Inc.,Chicago,IL,USA,2003)和Origin 8.0(Origin Lab Corp,Northampton,MA,USA,2013);所有数据均以“平均数±标准差”表示。配对样本t-test法进行显著性差异分析,P≤0.05认为差异性显著。
2 结果与分析
2.1 DmNav22、TipE质粒的酶切线性化
对所提质粒 DmNav22、TipE用NotⅠ进行酶切线性化。酶切2 h,分别取2 μL酶切液于10 g/L的琼脂糖凝胶电泳。如图2所示,酶切后DNA为1条带,说明酶切完全。
2.2 DmNav22、TipE cRNA质量浓度测定
以纯化的线性化 DmNav22、TipE质粒为模板,进行体外转录合成 DmNav22、TipE的cRNA。取1 μL纯化后的cRNA用紫外分光光度计测定其质量浓度及A260/A280, DmNav22、TipEcRNA的质量浓度分别为645 ng/μL和1 712 ng/μL,本试验中A260/A280测值均在2.0附近,表明cRNA无蛋白质污染(表1)。符合后续卵母细胞注射对cRNA的要求。

M为DNA marker,1和2分别代表TipE和 DmNav22的线性化质粒 M is DNA marker,1 and 2 respectively reprent linearized plasmids ofTipEand DmNav22
图2 DmNav22和TipE的线性化质粒
Fig.2 Linearized plasmids of DmNav22 andTipE
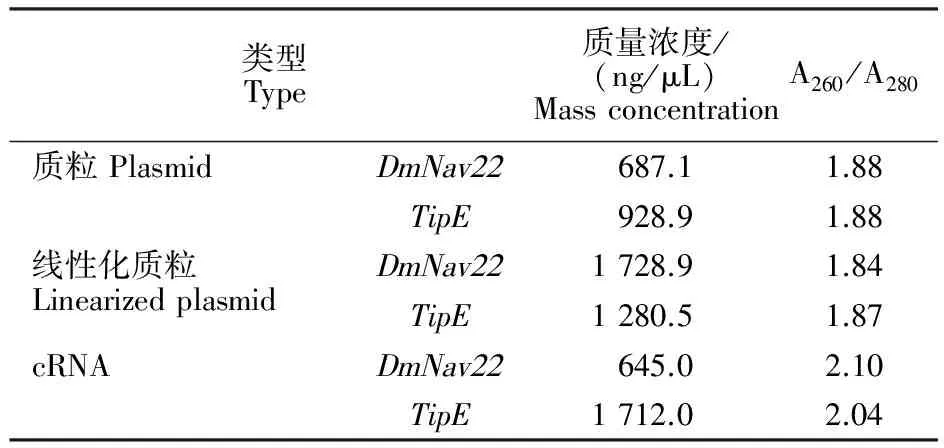
表1 DmNav22和TipE的质粒、线性化质粒及cRNA的质量浓度和A260/A280Table 1 Mass concentration and A260/A280 of DmNav22 and TipE plasmids,linearized DNAs and cRNAs
2.3 果蝇钠通道在非洲爪蟾卵母细胞中的功能性表达
经双电极电压钳系统测定果蝇钠通道电压门控电流发现,未注射空白对照组的卵母细胞,进行脉冲激活时,没有记录到钠电流,而注射cRNA的卵母细胞进行脉冲激活时,产生明显的内向电流(图3-A)。大约在-50 mV时检测到果蝇钠通道电流,-15 mV左右达到最大值(图3-B)。稳态激活电压依赖性测定,卵母细胞钳置在-120 mV,从-80 mV去极化至65 mV,阶跃电压是5 mV。稳态激活电压依赖性数据拟合曲线如图3-C。半激活电压(U1/2)是(-31.6±2.0) mV,斜率(K)是(5.0±0.6) mV(表2)。稳态失活电压依赖性测定,卵母细胞先施予一组从-120 mV至40 mV的预前刺激,时间200 ms,阶跃电压是5 mV,接着再给予一组到-10 mV的测试刺激,时间20 ms。稳态失活电压依赖性数据拟合曲线如图3-D。半失活电压(U1/2)是(-47.5±1.3) mV,斜率(K)是(5.2±0.3) mV(表2)。
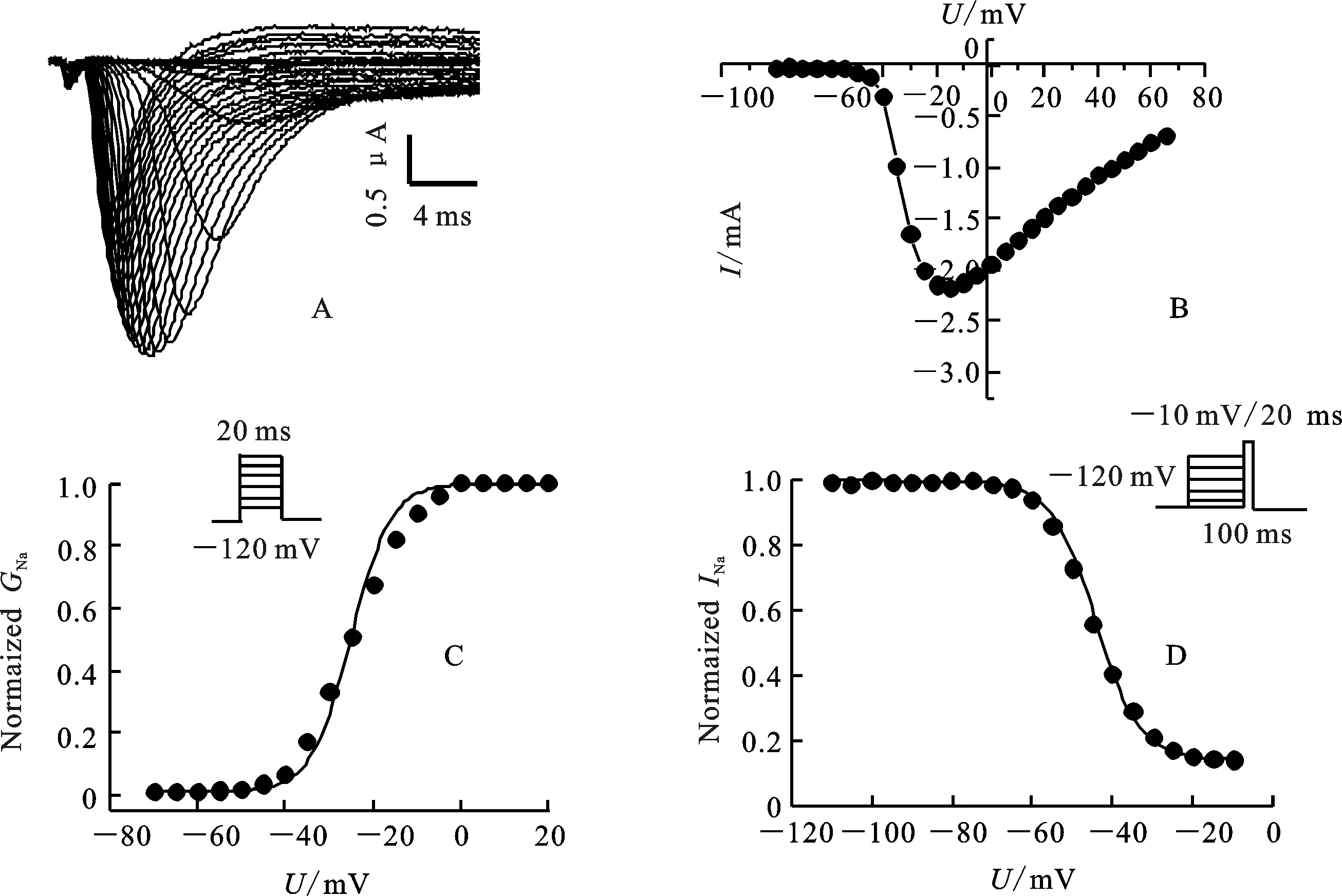
A:钠电流曲线。钠电流测定,卵母细胞钳置在-120 mV,从-80 mV去极化至65 mV,阶跃电压5 mV;B:电流电压曲线(I-U),电流由图3-A记录,峰值电流对应去极化电压作图,细胞数n=5;C:果蝇钠通道活化电压依赖性,细胞数n=3;D:果蝇钠通道失活电压依赖性,细胞数n=3。
A:Sodium current traces. Sodium currents were recorded from a holding potential of -120 mV during depolarizations from -80 to 65 mV in 5 mV increments.B:Sodium current-voltage relation (I-Ucurve). Current were recorded as described for Fig.3-A,and the peak current amplitude is plotted versus the depolarization potential. The number of oocytes was 5.The voltage-dependence of activation C and inactivation D ofDrosophilasodium channels. The number of oocytes was 3.
图3 果蝇钠通道在爪蟾卵母细胞中的功能性表达
Fig.3 Functional expression ofDrosophilasodium channels in Xenopus oocytes
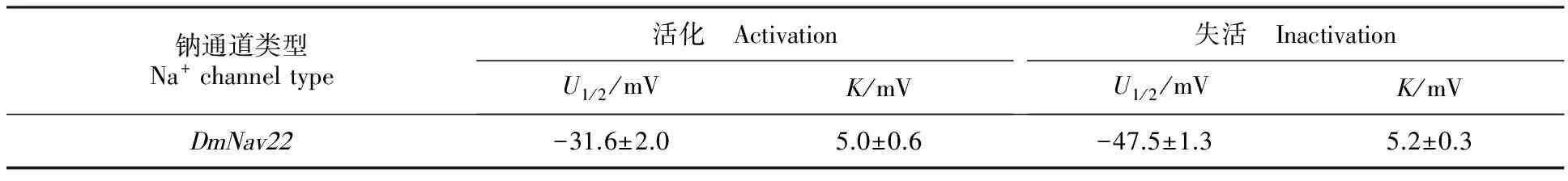
表2 果蝇钠通道 DmNav22活化、失活电压依赖性参数Table 2 Parameters of voltage dependence of activation and inactivation of Drosophila DmNav22 sodium channels
注:U1/2为活化或失活半最大电压,K为活化或失活斜率,细胞数n=5。
Note:U1/2is the half-maximal voltage for activation or inactivation andKis the slope factor for activation or inactivation.Five oocytes.
2.4 HA对钠通道失活电压依赖性的影响
稳态失活电压依赖性测定,卵母细胞先施予一组从-120 mV至40 mV的预前刺激,时间200 ms,阶跃电压是5 mV,接着再给予一组到-10 mV的测试刺激,时间20 ms。结果表明,0.3 μmol/L和3 μmol/L HA均使钠通道失活电压向超极化方向移动(图4)。0.3 μmol/L和3 μmol/L 药剂分别使钠通道失活半最大电压向超极化方向移动1.1 mV(0.3 μmol/L)和2.9 mV(3 μmol/L)(表3)。
3 讨 论
本试验成功建立以非洲爪蟾卵母细胞为载体的果蝇钠通道体外表达系统,并利用此系统测定HA对钠通道失活门控特性的影响。未注射空白对照组的卵母细胞,进行脉冲激活时,没有记录到钠电流,注射cRNA的卵母细胞进行脉冲激活时,产生明显的内向电流。试验测得的通道活化半最大电压(U1/2)、斜率(K)及通道失活半最大电压(U1/2)、斜率(K)与文献报到的基本一致[17],证明以非洲爪蟾卵母细胞为载体的果蝇钠通道体外表达系统成功建立。
HA对钠通道失活门控测定结果表明,0.3 μmol/L和3 μmol/L HA均可以使钠通道失活电压向超极化方向移动,其趋势与文献报道[17]一致。失活电压移动幅度随药剂浓度的增加而增大,表明HA对钠通道失活门控的影响具有浓度依赖性。
国内外新农药研究与开发的实践证明,从植物中提取、分离杀虫活性成分,并以这些活性成分为探针发现新靶标是新农药创制的重要途径[20]。HA是从透骨草中分离鉴定出的一种具有二氧双环辛烷新骨架的木脂素类化合物,杀虫活性高,试虫摄毒后的主要中毒症状为拒食,肌肉松弛,最终死亡[13]。鉴于其较高的杀虫活性、新颖的结构、独特的作用症状,对HA杀虫作用机理的探讨有助于推动中国新型生物合理杀虫剂的创制。
以非洲爪蟾卵母细胞为载体的果蝇钠通道体外表达系统的建立,为从分子水平探讨HA在钠通道上的受体位点奠定基础,不仅有利于进一步获得钠通道的一些结构特征,而且有利于阐明HA可能的分子作用机理,从而可在对HA进行三维定量构效关系研究的基础上,设计出新的高效杀虫剂。
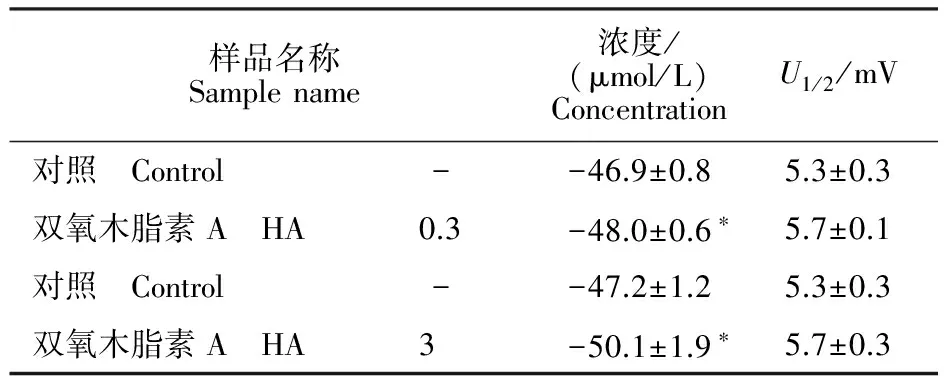
表3 HA对果蝇钠通道稳态失活参数的影响Table 3 Effects of HA on steady-state inactivation parameters for Drosophila sodium channels
注:U1/2为半最大失活电压,K为失活斜率,细胞数n=3。*表示对照组与处理组差异显著(P≤0.05)。
Note:U1/2is the half-maximal voltage for inactivation andKis the slope factor for inactivation.Each value represents the mean ± SEM for three oocytes. Asterisks indicate significant differences between control and treatment(P≤0.05).
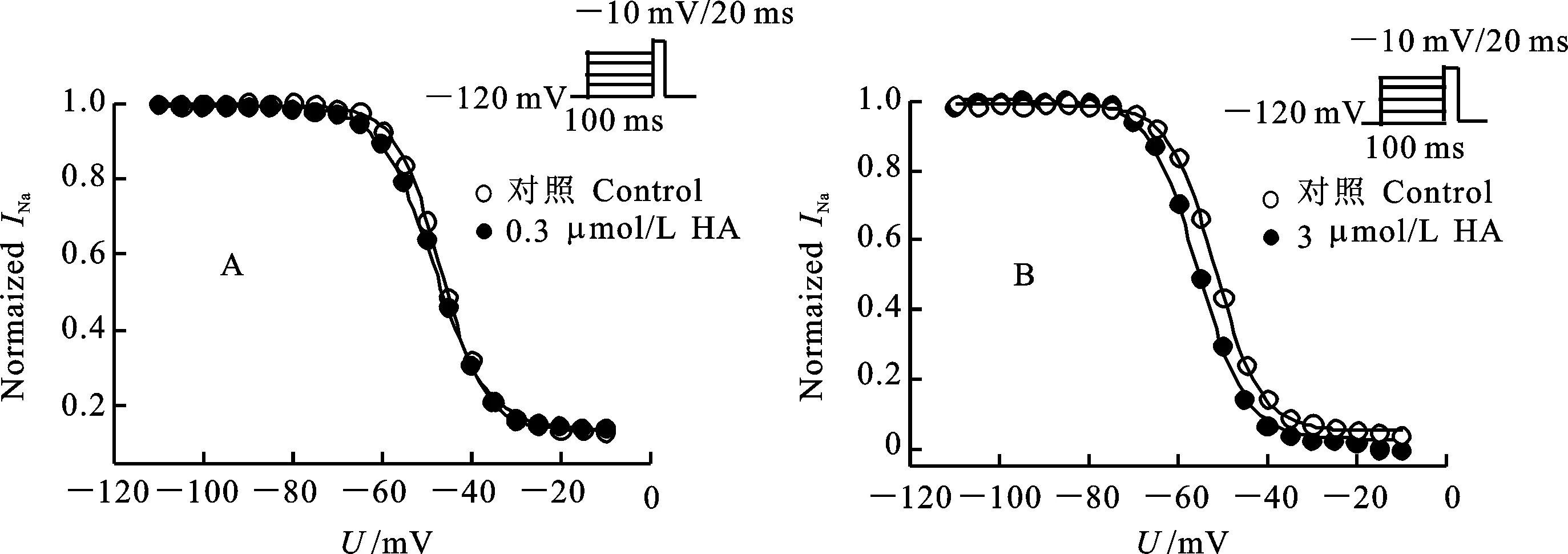
A:0.3 μmol/L HA加药前后果蝇钠通道失活电压依赖性;B:3 μmol/L HA加药前后果蝇钠通道失活电压依赖性,失活曲线拟合两元Boltzmann方程,细胞数n=3。
A and B:the voltage dependence of inactivation ofDrosophilasodium channels before and after the application of 0.3 μmol/L (A) and 3 μmol/L (B) of HA. The inactivation curves were fitted with two-state Boltzmann equation. The number of oocytes was 3.
图4 HA引起果蝇钠通道失活电压依赖性向超极化方向移动
Fig.4 HA induced a hyperpolarization direction shift of the voltage dependence of inactivation ofDrosophilasodium channels
Reference:
[1] 王洪跃,魏树源.昆虫钠通道的研究及其应用[J].中国医学装备,2009,6(3):13-16.
WANG H Y,WEI SH Y.Researches of sodium channels in insects[J].ChinaMedicalEquipment,2009,6(3):13-16 (in Chinese with English abstract).
[2] DONG K,DU Y Z,RINKEVINCH F,etal.Molecular biology of insect sodium channels and pyrethroid resistance[J].InsectBiochemistry&MolecularBiology,2014,50:1-17.
[3] RINKEVINCH F D,DU Y Z,DONG K.Diversity and convergence of sodium channel mutations involved in resistance to pyrethroids[J].PesticideBiochemistry&Physiology,2013,106(3):93-100.
[4] LOUGHNEY K,KREBER R,GANETZKY B.Molecular analysis of the para locus,a sodium channel gene inDrosophila[J].Cell,1989,58(6):1143-1154.
[5] WARMKE J W,REENAN R A,WANG P,etal.Functional expression ofDrosophilapara sodium channels.Modulation by the membrane protein TipE and toxin pharmacology[J].JournalofGeneralPhysiology,1997,110(2):119-133.
[6] FENG G,DEAK P,CHOPRA M,etal.Cloning and functional analysis ofTipE,a novel membrane protein that enhancesDrosophilapara sodium channel function[J].Cell,1995,82(6):1001-1011.
[7] 刘晓燕,郑建全,艾 平,等.爪蟾卵母细胞双电极电压钳记录技术及其内源性外向电流的研究[J].军事医学科学院院刊,2005,29(5):460-463.
LIU X Y,ZHENG J Q,AI P,etal.Two-electrode voltage clamp recording technique forXenopuslaevisoocytes and its endogenous outward currents[J].BulletinoftheAcademyofMilitaryMedicalSciences,2005,29(5):460-463 (in Chinese with English abstract).
[8] SMITH T J,SODERLUND D M.Action of the pyrethroid insecticide cypermethrin on rat brain IIa sodium channels expressed inXenopusoocytes[J].Neurotoxicology,1998,19(6):823-832.
[9] LIU Z,VALLES S M,DONG K.Novel point mutations in theGermancockroachpara sodium channel gene are associated with knockdown resistance (kdr) to pyrethroid insecticides[J].InsectBiochemistryandMolecularBiology,2000,30(10):991-997.
[10] TAN J,LIU Z Q,TSAI T D,etal.Novel sodium channel gene mutations inBlattellagermanicareduce the sensitivity of expressed channels to deltamethrin.[J].InsectBiochemistry&MolecularBiology,2002,32(4):445-454.
[11] DU Y Z,NOMURA Y,LIU Z Q,etal.Functional expression of an arachnid sodium channel reveals residues responsible for tetrodotoxin resistance in invertebrate sodium channels[J].JournalofBiologicalChemistry,2009,284(49):33869-33875.
[12] DU Y Z,NOMURA Y,STAR G,etal.Molecular evidence for dual pyrethroid-receptor sites on a mosquito sodium channel[J].ProceedingsoftheNationalAcademyofSciences,2013,110(29):11785-11790.
[13] TANIGUCHI E,IMAMURA K,ISHIBASHI F,etal.Structure of the novel insecticidal sesquilignan,haedoxan A[J].Agricultural&BiologicalChemistry,1989,53(3):631-643.
[14] XIAO X M,HU ZH N,SHI B J,etal.Larvicidal activity of lignans fromPhrymaleptostachyaL.againstCulexpipienspallens[J].ParasitologyResearch,2012,110(3):1079-1084.
[15] XIAO X M,JI Z Q,ZHANG J W,etal.A new lignan fromPhrymaleptostachya[J].ChemistryofNaturalCompounds,2013,49(1):21-23.
[16] 肖新敏,胡兆农,姬志勤,等.透骨草杀虫活性成分分离鉴定及其生物活性研究[J].农药学学报,2012,14(5):583-586.
XIAO X M,HU ZH N,JI ZH Q,etal.Isolation,structure identification and bioactivity of active ingredients fromPhrymaleptostachya[J].ChineseJournalofPesticideScience,2012,14(5):583-586 (in Chinese with English abstract).
[17] HU ZH N,DU Y Z,XIAO X M,etal.Insight into the mode of action of Haedoxan A fromPhrymaleptostachya[J].Toxins,2016,8(2):53.
[18] DU Y Z,NOMURA Y,LUO N,etal.Molecular determinants on the insect sodium channel for the specific action of type Ⅱ pyrethroid insecticides[J].Toxicology&AppliedPharmacology,2009,234(2):266-272.
[19] TAN J G,LIU Z Q,WANG R W,etal.Identification of amino acid residues in the insect sodium channel critical for pyrethroid binding[J].MolecularPharmacology,2005,67(2):513-522.
[20] 肖新敏.透骨草杀虫活性成分及其作用机理研究[D].陕西杨凌:西北农林科技大学,2014.
XIAO X M.Studies on insecticidal activity components and reaction mechanisms ofPhrymaleptostachyaL.[D].Yangling Shaanxi:Northwest A&F University,2014 (in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Application ofDrosophilaSodium Channel DmNav22 in Investigating the Action Mode of Haedoxan A
YAN Xiufang,QIE Xingtao,WU Wenjun and HU Zhaonong
(1.Institute of Pesticide Science,College of Plant Protection,Northwest A&F University,Yangling Shaanxi 712100,China; 2.Shaanxi Province Key Laboratory of Botanical Pesticide Research and Development,Northwest A&F University,Yangling Shaanxi 712100,China)
To investigate the molecular mechanism of haedoxan A (HA) against insect pests,gene expression system ofDrosophilasodium channel inXenopuslaevisoocytes was established. cRNAs ofDrosophilasodium channel subunits DmNav22 andTipEwere obtained by transcription in vitro,which were mixed with equal amount of substance and then microinjected in the freshX.laevisoocytes. The oocytes were incubated in ND96 buffer at 18 ℃ for 12-18 hours after microinjection and the sodium channel current was detected by two-electrode voltage clamp (TEVC). The results showed that the voltage-gated inward current was recorded in the oocytes injected cRNA,while no current was recorded in the blank oocytes. HA shifted the voltage dependence ofDrosophilasodium channels inactivation to the hyperpolarizing direction. These results demonstrated that theDrosophilasodium channel was expressed inX.laevisoocytes successfully and can be used to further study the insecticidal mechanism of HA.
Drosophilasodium channel; Two-electrode voltage clamp;Xenopuslaevisoocytes; Haedoxan A (HA)
YAN Xiufang,female,master student. Research area:pesticide toxicology. E-mail:xiufangyan@163.com
HU Zhaonong,male,Ph.D,professor,doctoral supervisor. Research area:pesticide toxicology. E-mail:huzhaonong@nwsuaf.edu.cn
日期:2017-03-30
2016-03-16
2016-05-08
国家自然科学基金(31672055);陕西省农业科技创新与攻关(2015NY033)。
闫秀芳,女,硕士研究生,从事农药毒理学研究。E-mail:xiufangyan@163.com
胡兆农,男,博士,教授,博士生导师,主要从事农药毒理学研究。E-mail:huzhaonong@nwsuaf.edu.cn
S481
A
1004-1389(2017)04-0635-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170330.1509.040.html
Received 2016-03-16 Returned 2016-05-08
Foundation item The National Natural Science Foundation of China (No.31672055); Agricultural Science and Technology Key Project of Shaanxi Province(No.2015NY033).
