防治向日葵菌核病种子包衣药剂的室内筛选
2017-04-13刘红亮张春娥肖恩时王树星贾海丽龙书生
刘红亮,张春娥,赵 娜,肖恩时,王树星,贾海丽,龙书生
(1.西北农林科技大学 植物保护学院,旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.陕西省商洛市商州区农业技术推广中心,陕西商洛 726000;3.西北农林科技大学 农学院,陕西杨凌 712100;4.陕西省渭南市农业科学研究所,陕西渭南 715501)
防治向日葵菌核病种子包衣药剂的室内筛选
刘红亮1,张春娥1,赵 娜2,肖恩时3,王树星4,贾海丽4,龙书生1
(1.西北农林科技大学 植物保护学院,旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.陕西省商洛市商州区农业技术推广中心,陕西商洛 726000;3.西北农林科技大学 农学院,陕西杨凌 712100;4.陕西省渭南市农业科学研究所,陕西渭南 715501)
从当前市场上常见的杀菌剂中筛选防治向日葵菌核病种子包衣药剂。采用生长速率法,对市售的18种常用杀菌剂进行向日葵菌核病菌的室内毒力测定。药剂对向日葵种子萌发的抑制试验同时进行。结果表明,φ=20%苯醚甲环唑水乳剂和φ=25%戊唑醇水乳剂2种药剂对向日葵菌核病菌具有极好的抑制作用。而包括φ=20%松脂酸铜微乳油、w=70%甲基硫菌灵可湿性粉剂、w=15%三唑酮可湿性粉剂、φ=50%己唑醇微乳剂、φ=10%氟硅唑水分散颗粒剂、φ=12.5%腈菌唑微乳剂、φ=40%嘧霉胺悬浮剂和w=50%异菌脲可湿性粉剂等8种药剂,对向日葵菌核病菌也有良好的抑制作用。供试药剂质量浓度低于2.5 μg/mL时对向日葵种子的萌发没有抑制作用,该质量浓度对向日葵种子安全。
向日葵菌核病;防治;种衣剂;杀菌剂
向日葵是中国重要四大油料作物之一。相对于油菜、花生及芝麻等油料作物具有耐干旱、低温、盐碱和瘠薄等特性,同时还具有播期宽泛、省劳力、成本低及效益高等优势。尤其是其他作物难以种植的盐碱、低洼、瘠薄和河滩地,房前屋后,均可种植向日葵。因此,向日葵可谓是干旱和山区等地区的优势油料作物[1]。
向日葵菌核病(sunflower sclerotinia stalk/head rot)属世界性向日葵土传病害[2-3],能引起减产和降低品质。近年来,在内蒙古、辽宁和新疆等向日葵主产区每年都有不同程度的发生,发病率一般都在10%~20%[4-7],雨水多年份发病率在50%以上,部分田块可造成绝收[5,7-10]。种植抗病品种和种子药剂处理是控制土传病害最有效的措施。抗菌核病的向日葵种质资源的缺少[1],使种子的药剂处理对向日葵菌核病的防治尤为重要。中国自20世纪80年代开始使用以多菌灵为主的苯并咪唑类杀菌剂来防治油菜和向日葵菌核病[11]。这类药剂的作用机理是药剂与菌体的微管蛋白结合,从而影响菌体内与微管蛋白有关的代谢与功能,如纺锤体的形成、细胞核的分裂、细胞器的运动等,进而阻止菌丝的正常形成[12-13],但因此类杀菌剂的作用位点单一,加之长期连续使用,从而加速病原菌对其抗药性的产生,最终导致防效下降甚至失败,对农业生产及生态环境构成很大的威胁[14]。因此,筛选出对向日葵菌核病菌具有良好作用效果的药剂,用于防治向日葵菌核病种衣剂的开发及利用,同时为指导向日葵菌核病科学防治提供依据,具有十分重要的意义。为此,进行防治向日葵菌核病种子包衣药剂筛选研究。
1 材料与方法
1.1 供试菌种
供试菌种为核盘菌(Sclerotiniasclerotiorum),由内蒙古农业大学国家向日葵产业体系植保功能室提供。
1.2 供试药剂
供试药剂的选择是以市场上普遍销售和生产上广泛应用,且杀菌机理或药剂结构尽可能不同的原则,自购于农药市场。药剂种类如下。
有机硫类:w=80%代森锰锌可湿性粉剂(四川福达农用化工有限公司生产)、w=80%代森锌可湿性粉剂(四川福达农用化工有限公司生产)、w=70%丙森锌可湿性粉剂(江苏剑牌农药化工有限公司生产)。
有机磷类:w=90%三乙膦酸铝可溶粉剂(天津绿亨化工有限公司生产)。
有机铜类:φ=20%松脂酸铜微乳油(青岛百禾源生物工程有限公司生产)。
咪唑类:w=3%抑霉唑膏剂(陕西农大德立邦科技股份有限公司生产)。
取代苯类:w=70%甲基硫菌灵可湿性粉剂(江苏省江阴市福达农化有限公司生产)。
唑类:w=15%三唑酮可湿性粉剂(四川迪美特生物科技有限公司生产)、φ=50%丙环唑微乳剂(海南正业中农高科股份有限公司生产)、φ=25%戊唑醇水乳剂(江苏省南通市如东众意化工有限公司生产)、φ=50%己唑醇微乳剂(昆明云大科技农化有限公司生产)、φ=10%氟硅唑水分散颗粒剂(陕西恒润化学工业有限公司生产)、φ=20%苯醚甲环唑水乳剂(海南正业中农高科股份有限公司生产)、φ=12.5%腈菌唑微乳剂(海南正业中农高科股份有限公司生产)。
胺类:φ=40%嘧霉胺悬浮剂(滨州威克化工有限责任公司生产)、w=50%异菌脲可湿性粉剂(海南正业中农高科股份有限公司生产)。
甲氧基丙烯酸酯类:250 g/L嘧菌酯悬浮剂(英国先正达有限公司生产)。
吗啉类:φ=50%烯酰吗啉水分散颗粒剂(山东省邹平县德兴精细化工有限公司生产)。
标准对照药剂:w=80%多菌灵可湿性粉剂(浙江美丰农化有限公司生产)。
1.3 试验方法
1.3.1 供试药剂对供试菌种的室内毒力测定 采用生长速率法进行[15]。每处理药剂设7个浓度级。在保证最高质量浓度下菌丝生长不被完全抑制,最低质量浓度下菌丝生长与空白对照有差异为准的预备试验基础上,确定标准药剂多菌灵对向日葵菌核病菌的7个质量浓度分别为200、100、50、25、20、10和5 μg/mL外,其他处理的7个质量浓度分别为20、10、5、2.5、1.25、0.625和0.312 5 μg/mL。另设1个无药对照。每处理重复3次。
接菌平板在28 ℃恒温培养箱培养48 h和96 h 后,用游标卡尺十字交叉法测量菌落直径,计算不同药剂不同质量浓度下的抑制率。抑制率=[(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)]×100%。将药剂质量浓度转化为质量浓度对数值,抑制率换算成抑制机率值[15]。以药剂质量浓度的对数值为自变量(x),抑制率的机率值为依变量(y),求得毒力回归方程和相关系数r,计算有效中质量浓度(Median effective mass concentration 50,EC50),并按Yun-peisun毒力指数公式计算供试药剂的毒力指数[15]:
毒力指数=标准对照药剂EC50/供试药剂EC50×100%
1.3.2 供试药剂对种子萌发的影响 种子萌发试验每处理药剂设5个质量浓度等级,分别为:1 000、500、50、25和12.5 μg/mL。另设1个无药对照。
将30粒健康饱满向日葵种子置于放有双层滤纸培养皿中,加不同质量浓度药剂,室温下放置4 d。待空白对照50%萌发后进行发芽率调查。每处理重复3次。
各处理的发芽率与对照之比的百分率低于95%,视为药剂对种子萌发有影响。
1.4 药剂评价
首先以各药剂的EC50为依据,参照石志琦等[11]和Anon[16]病原菌对药剂抗药性划分标准,即EC50值为1.21~12.05 μg/mL的为低抗表型,EC50值为12.05~120.50 μg/mL的为中抗表型,EC50值在120.50 μg/mL以上的为高抗表型,从中筛选敏感型药剂。然后以这些被选药剂的相对毒力指数为依据,按国内普遍接受的观点,即相对毒力指数≥200时,供试药剂比对照药剂具有更好的抑制作用,筛选出对向日葵菌核病具有良好作用效果的药剂。最后,结合这些药剂对种子萌发的影响,确定可用于防治向日葵菌核病拌种和包衣的杀菌剂,并提出适宜的拌种或包衣质量浓度。
2 结果与分析
2.1 室内毒力测定
标准对照杀菌剂(多菌灵)对向日葵菌核病菌的室内毒力测定结果见表1。
从表1可见,标准对照杀菌剂多菌灵对向日葵菌核病菌的EC50为13.07 μg/mL,说明该杀菌剂对向日葵菌核病菌具有中等抗药性。这和多菌灵对向日葵菌核病防效低的生产实际情况一致,同时也说明以它做标准对照杀菌剂是有科学依据的。
生产上常见的18种供试药剂对向日葵菌核病菌的室内毒力测定结果见表2。
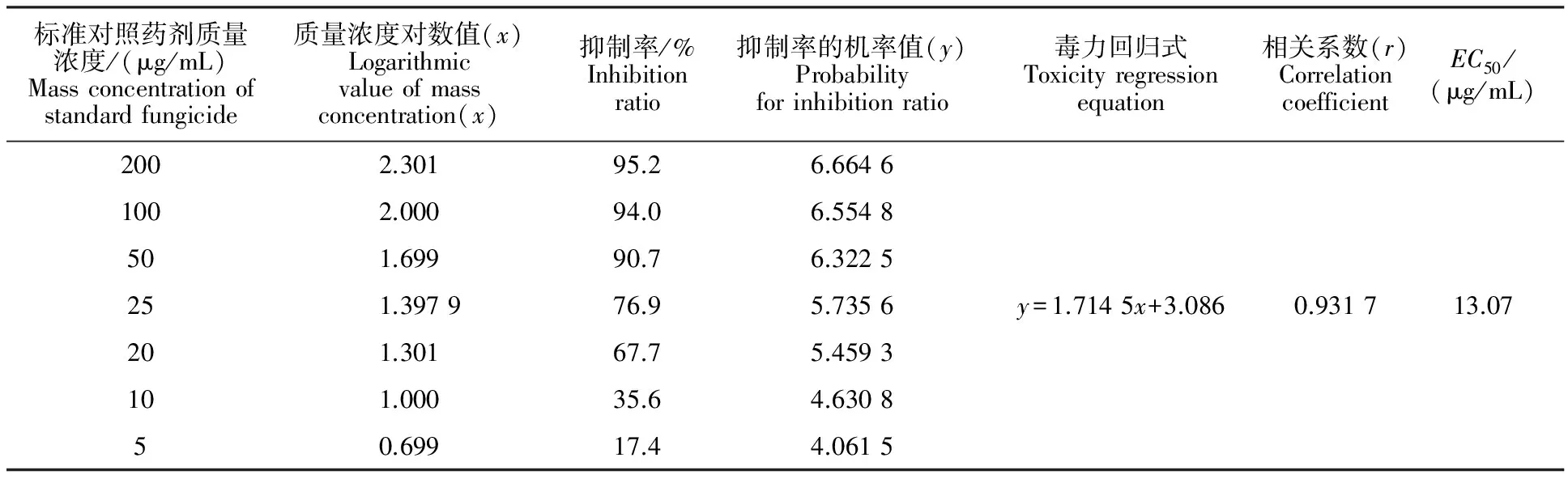
表1 标准对照杀菌剂(多菌灵)对向日葵菌核病菌的室内毒力测定Table 1 Laboratory toxicity test of standard fungicide(Carbendazim) to Sclerotinia sclerotiorum
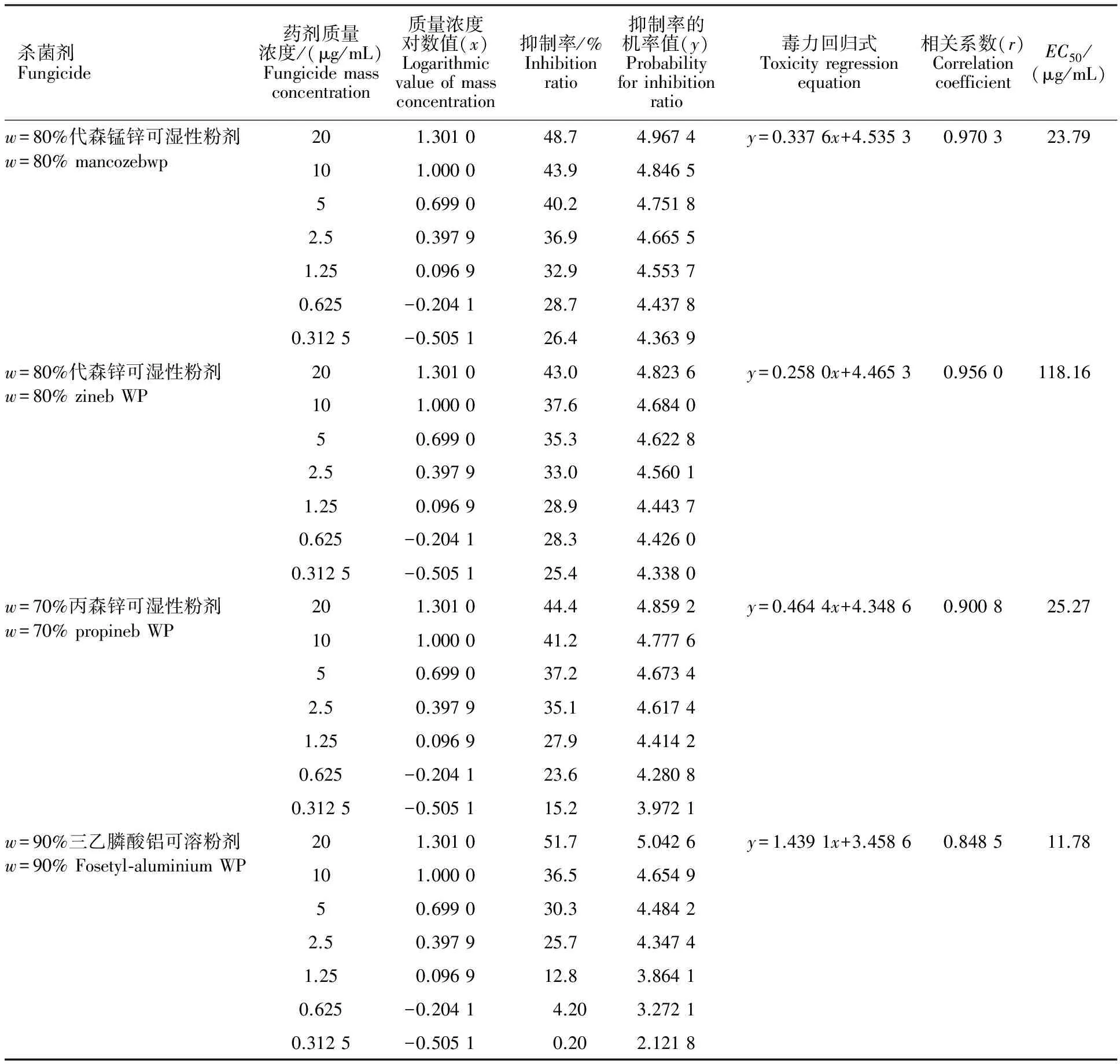
表2 18种杀菌剂对向日葵菌核病菌的室内毒力测定Table 2 Laboratory toxicity test of eighteen fungicides to Sclerotinia sclerotiorum
(续表2 Continued table 2)
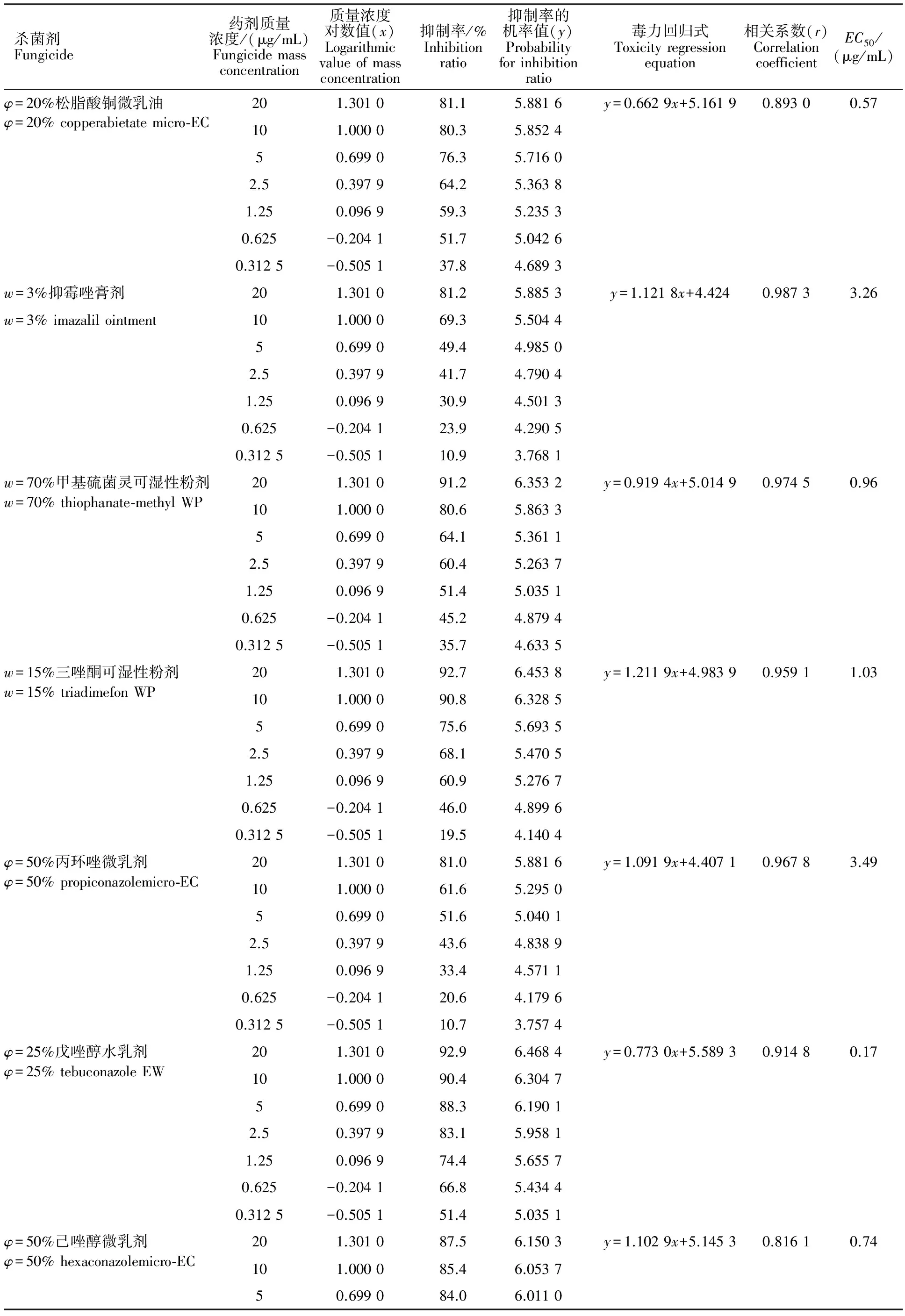
杀菌剂Fungicide药剂质量浓度/(μg/mL)Fungicidemassconcentration质量浓度对数值(x)Logarithmicvalueofmassconcentration抑制率/%Inhibitionratio抑制率的机率值(y)Probabilityforinhibitionratio毒力回归式Toxicityregressionequation相关系数(r)CorrelationcoefficientEC50/(μg/mL)φ=20%松脂酸铜微乳油201.301081.15.8816y=0.6629x+5.16190.89300.57φ=20%copperabietatemicro⁃EC101.000080.35.852450.699076.35.71602.50.397964.25.36381.250.096959.35.23530.625-0.204151.75.04260.3125-0.505137.84.6893w=3%抑霉唑膏剂201.301081.25.8853y=1.1218x+4.4240.98733.26w=3%imazalilointment101.000069.35.504450.699049.44.98502.50.397941.74.79041.250.096930.94.50130.625-0.204123.94.29050.3125-0.505110.93.7681w=70%甲基硫菌灵可湿性粉剂201.301091.26.3532y=0.9194x+5.01490.97450.96w=70%thiophanate⁃methylWP101.000080.65.863350.699064.15.36112.50.397960.45.26371.250.096951.45.03510.625-0.204145.24.87940.3125-0.505135.74.6335w=15%三唑酮可湿性粉剂201.301092.76.4538y=1.2119x+4.98390.95911.03w=15%triadimefonWP101.000090.86.328550.699075.65.69352.50.397968.15.47051.250.096960.95.27670.625-0.204146.04.89960.3125-0.505119.54.1404φ=50%丙环唑微乳剂201.301081.05.8816y=1.0919x+4.40710.96783.49φ=50%propiconazolemicro⁃EC101.000061.65.295050.699051.65.04012.50.397943.64.83891.250.096933.44.57110.625-0.204120.64.17960.3125-0.505110.73.7574φ=25%戊唑醇水乳剂201.301092.96.4684y=0.7730x+5.58930.91480.17φ=25%tebuconazoleEW101.000090.46.304750.699088.36.19012.50.397983.15.95811.250.096974.45.65570.625-0.204166.85.43440.3125-0.505151.45.0351φ=50%己唑醇微乳剂201.301087.56.1503y=1.1029x+5.14530.81610.74φ=50%hexaconazolemicro⁃EC101.000085.46.053750.699084.06.0110
(续表2 Continued table 2)
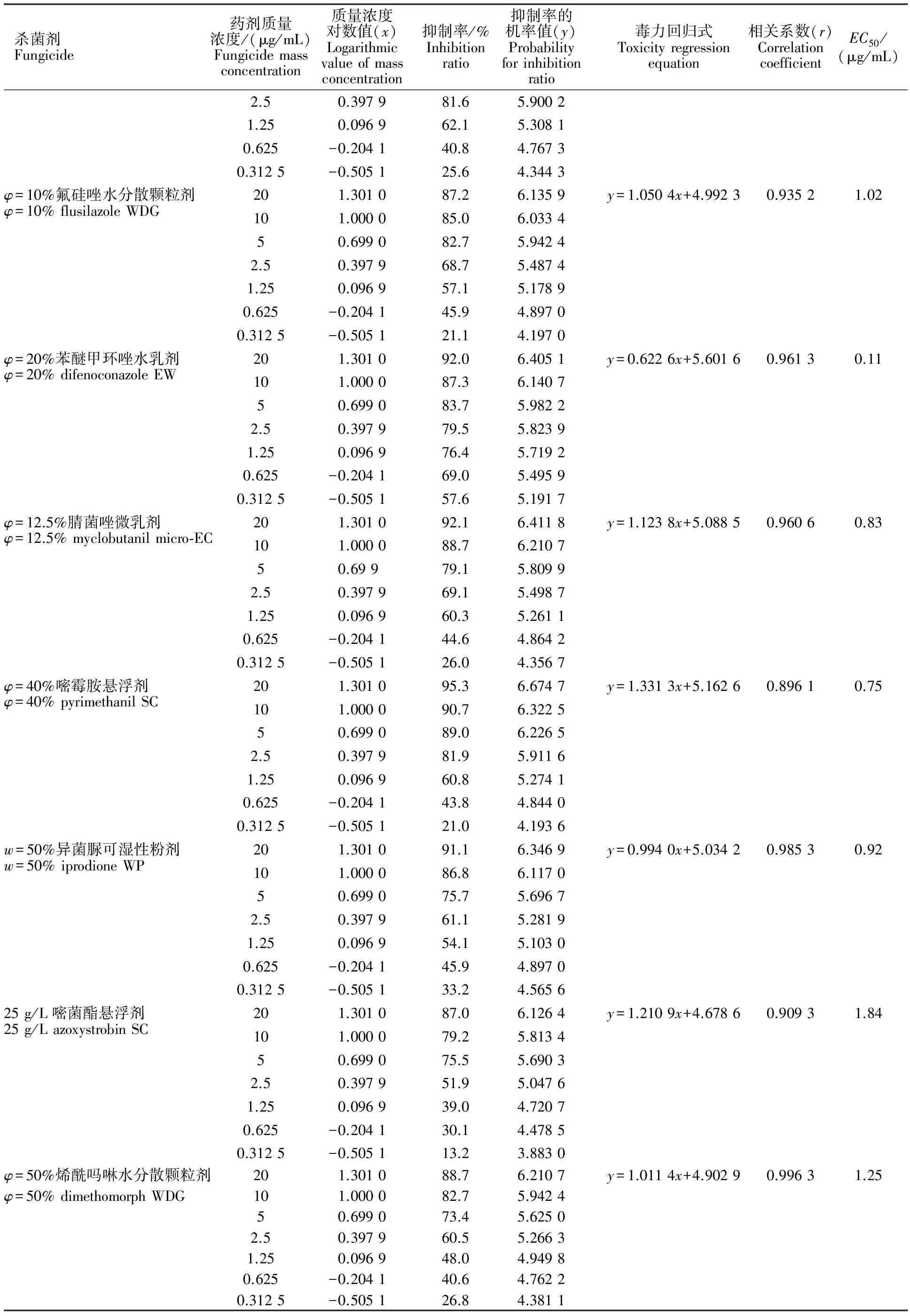
杀菌剂Fungicide药剂质量浓度/(μg/mL)Fungicidemassconcentration质量浓度对数值(x)Logarithmicvalueofmassconcentration抑制率/%Inhibitionratio抑制率的机率值(y)Probabilityforinhibitionratio毒力回归式Toxicityregressionequation相关系数(r)CorrelationcoefficientEC50/(μg/mL)2.50.397981.65.90021.250.096962.15.30810.625-0.204140.84.76730.3125-0.505125.64.3443φ=10%氟硅唑水分散颗粒剂201.301087.26.1359y=1.0504x+4.99230.93521.02φ=10%flusilazoleWDG101.000085.06.033450.699082.75.94242.50.397968.75.48741.250.096957.15.17890.625-0.204145.94.89700.3125-0.505121.14.1970φ=20%苯醚甲环唑水乳剂201.301092.06.4051y=0.6226x+5.60160.96130.11φ=20%difenoconazoleEW101.000087.36.140750.699083.75.98222.50.397979.55.82391.250.096976.45.71920.625-0.204169.05.49590.3125-0.505157.65.1917φ=12.5%腈菌唑微乳剂201.301092.16.4118y=1.1238x+5.08850.96060.83φ=12.5%myclobutanilmicro⁃EC101.000088.76.210750.69979.15.80992.50.397969.15.49871.250.096960.35.26110.625-0.204144.64.86420.3125-0.505126.04.3567φ=40%嘧霉胺悬浮剂201.301095.36.6747y=1.3313x+5.16260.89610.75φ=40%pyrimethanilSC101.000090.76.322550.699089.06.22652.50.397981.95.91161.250.096960.85.27410.625-0.204143.84.84400.3125-0.505121.04.1936w=50%异菌脲可湿性粉剂201.301091.16.3469y=0.9940x+5.03420.98530.92w=50%iprodioneWP101.000086.86.117050.699075.75.69672.50.397961.15.28191.250.096954.15.10300.625-0.204145.94.89700.3125-0.505133.24.565625g/L嘧菌酯悬浮剂201.301087.06.1264y=1.2109x+4.67860.90931.8425g/LazoxystrobinSC101.000079.25.813450.699075.55.69032.50.397951.95.04761.250.096939.04.72070.625-0.204130.14.47850.3125-0.505113.23.8830φ=50%烯酰吗啉水分散颗粒剂201.301088.76.2107y=1.0114x+4.90290.99631.25φ=50%dimethomorphWDG101.000082.75.942450.699073.45.62502.50.397960.55.26631.250.096948.04.94980.625-0.204140.64.76220.3125-0.505126.84.3811
从表3看出,10种对向日葵菌核病有良好作用的供试药剂,其对菌核病菌的抑制作用都超过标准药剂多菌灵。以φ=20%苯醚甲环唑水乳剂和φ=25%戊唑醇水乳剂2种药剂的作用最好,其作用是标准药剂多菌灵的百倍以上,表明φ=20%苯醚甲环唑水乳剂和φ=25%戊唑醇水乳剂是目前防治向日葵菌核病的首选药剂。该试验结果也表明φ=20%松脂酸铜微乳油、w=70%甲基硫菌灵可湿性粉剂、w=15%三唑酮可湿性粉剂、φ=50%己唑醇微乳剂、φ=10%氟硅唑水分散颗粒剂、φ=12.5%腈菌唑微乳剂、φ=40%嘧霉胺悬浮剂和w=50%异菌脲可湿性粉剂8种药剂对向日葵菌核病的抑制作用也是标准对照药剂多菌灵的10倍以上。
2.2 药剂质量浓度对种子萌发的影响
10种供试药剂对向日葵种子萌发的抑制试验结果见表4(表中种子萌发率均为3次重复的平均值)。
表4表明,当药剂的质量浓度大于50 μg/mL时,所有供试药剂都对向日葵种子的萌发具有抑制作用。随着药剂质量浓度的降低,其对向日葵种子萌发的抑制作用减弱。当供试药剂的质量浓度为5 μg/mL时,除φ=50%己唑醇微乳剂和φ=12.5%腈菌唑微乳剂依然对向日葵种子的萌发有抑制作用外,其他供试药剂对种子的萌发都无抑制作用。而当供试药剂的质量浓度为2.5 μg/mL时,所有供试药剂对种子的萌发都没有抑制作用,该质量浓度对向日葵种子是安全的,可用作防治向日葵菌核病拌种或包衣的使用剂量。
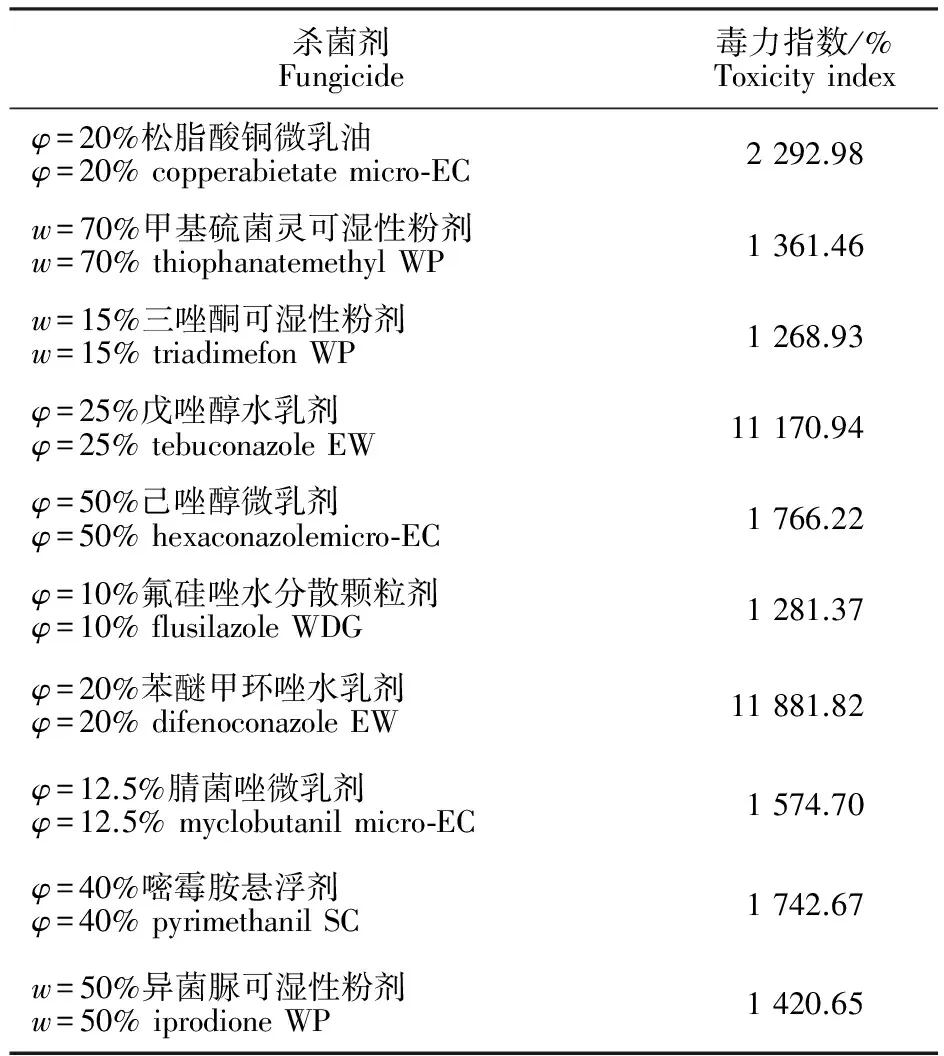
表3 10种杀菌剂与标准对照药剂多菌灵的毒力指数Table 3 Toxicity index of ten fungicides against standard fungicide(Carbendazim)
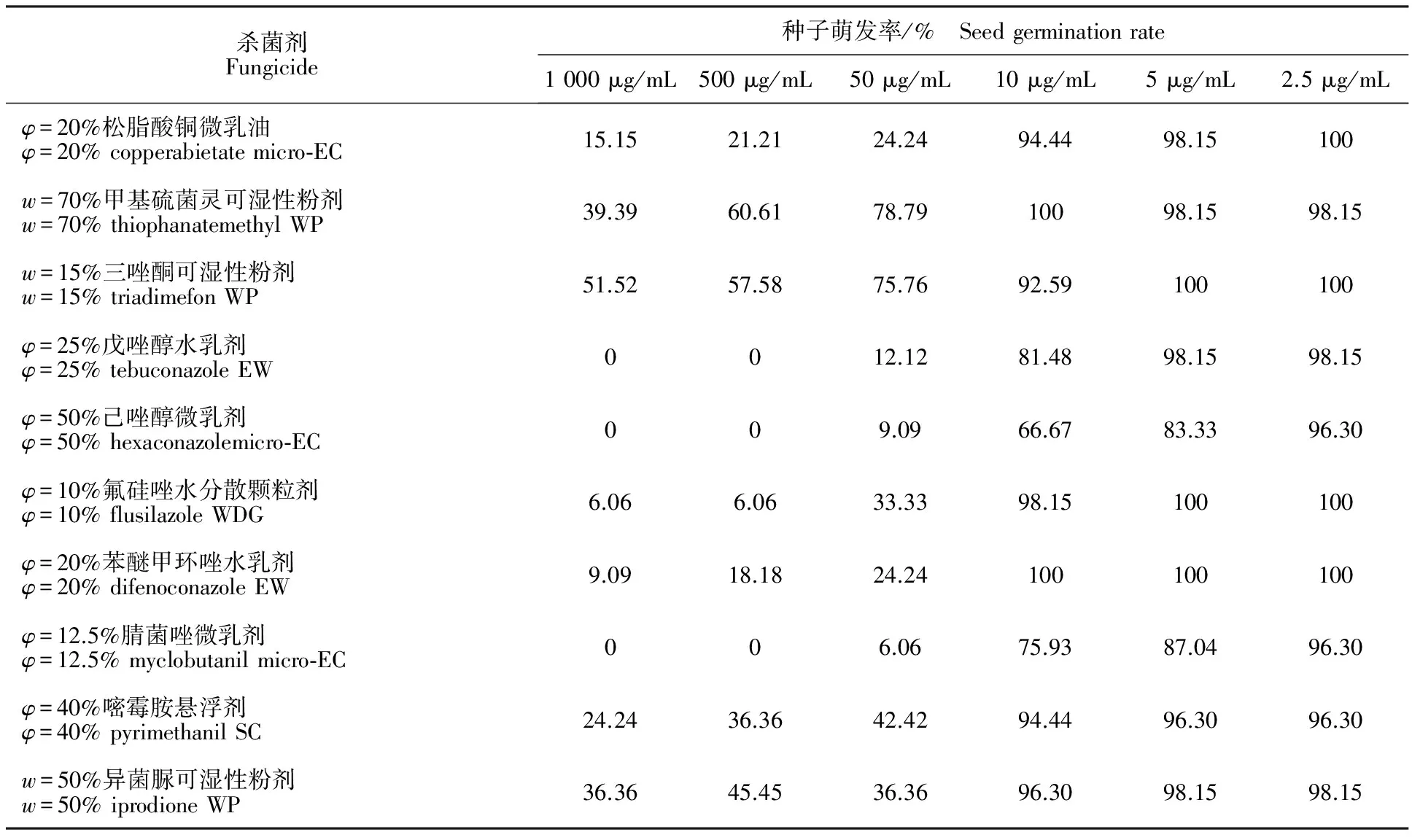
表4 10种杀菌剂处理后向日葵种子的萌发率Table 4 Germination rate of sunflower seed treated with fungicides
3 结论与讨论
对市售的18种常规农药通过生长速率法进行向日葵菌核病菌室内毒力测定及其对向日葵种子萌发的抑制试验,旨在筛选出能够用于拌种或种衣剂的防治向日葵菌核病菌的杀菌剂,应用于向日葵种子包衣。室内毒力测定试验结果表明,φ=20%苯醚甲环唑水乳剂和φ=25%戊唑醇水乳剂2种药剂的作用最好,其EC50极低,分别为0.11和0.17 μg/mL,对向日葵菌核病菌的作用是标准药剂多菌灵的百倍以上,表明φ=20%苯醚甲环唑水乳剂和φ=25%戊唑醇水乳剂是目前防治向日葵菌核病的首选药剂。试验结果也表明φ=20%松脂酸铜微乳油、w=70%甲基硫菌灵可湿性粉剂、w=15%三唑酮可湿性粉剂、φ=50%己唑醇微乳剂、φ=10%氟硅唑水分散颗粒剂、φ=12.5%腈菌唑微乳剂、φ=40%嘧霉胺悬浮剂和w=50%异菌脲可湿性粉剂8种药剂对向日葵菌核病菌的EC50均小于1.21 μg/mL,符合联合国粮农组织(FAO)[16]推荐的标准,属于敏感型杀菌剂,对向日葵菌核病菌具有良好的作用效果,可用于向日葵菌核病的防治。供试药剂对向日葵种子的萌发试验结果表明,当供试药剂的质量浓度低于2.5 μg/mL时,所有供试药剂对种子的萌发都没有抑制作用,2.5 μg/mL可用作防治向日葵菌核病拌种或包衣的使用剂量。
向日葵菌核病属于世界性的病害,可导致严重减产,品质和食用性也下降[2-3]。降雨较多的年份田间发病率和严重度均很高,可导致绝收[5,7-10]。控制该病害最有效的措施是种植抗病品种[1,5]。然而,由于抗菌核病的向日葵种质资源少,生产上抗向日葵菌核病的品种不多[1]。除种植抗病品种,控制该病害较为有效的措施是用杀菌剂拌种和种子包衣[5,7-10]。
以多菌灵为代表的苯并咪唑类杀菌剂是20世纪60年代由国外开发的一类重要杀菌剂[17]。此类杀菌剂为内吸性杀菌剂,对许多病原菌均具有较高的活性,但因其作用位点单一,在国外很早就有关于病原菌对此类杀菌剂产生抗药性的报道,如灰霉病菌[18]、小麦赤霉病菌[19]、大麦云纹病菌[20]、黄瓜霜霉病菌[21]、苹果黑星病菌[22]等。中国自20世纪80年代开始长期连续使用以多菌灵为主的苯并咪唑类杀菌剂来防治包括油菜和向日葵菌核病等诸多作物病害,加速了病原菌对其抗药性的产生,最终导致防效下降甚至失败[11,13-14]。因此,筛选出对向日葵菌核病菌具有良好作用效果的药剂,用于防治向日葵菌核病种衣剂的开发及利用,同时为指导向日葵菌核病科学合理使用提供依据,具有十分重要的现实意义。
本研究通过在室内对向日葵菌核病菌的药剂筛选,初步明确苯醚甲环唑和戊唑醇2种首选药剂;松脂酸、甲基硫菌灵、三唑酮、己唑醇、氟硅唑、腈菌唑、嘧霉胺和异菌脲等8种可选药剂,用于防治向日葵菌核病种衣剂的开发及利用。这与一些类似的研究结果有异同。张鑫等[23]2015年报道,异菌脲对月季黑斑病菌蔷薇盘二孢(Marssoninarosae)具有较好的抑制效果,多菌灵对其的抑制效果最差,其EC50高达501.19 μg/mL。高浩等[24]认为,苯醚甲环唑和己唑醇马铃薯早疫病病菌(Alternariasolani)有好的抑制作用。付余波等[25]认为氟硅唑、苯醚甲环唑、异菌脲等梨炭疽病菌(Colletotrichumgloeosporioides)、梨轮纹病菌(Botryosphaeriaberengeriana)、梨黑斑病菌(Alternariaalternata)具有较高的毒杀作用。张斌等[26]报道氟硅唑、甲基硫菌灵、己唑醇、腈菌唑、异菌脲等能有效地抑制番茄枯萎病菌(Fusariumoxysporum)的生长。王文桥等[27]研究表明,己唑醇和戊唑醇对小麦纹枯病菌(Rhizoctoniacerealis)制作用最强,EC50为0.02 μg/mL。韩敏等[28]研究表明,苯醚甲环唑、丙环唑和异菌脲对核桃叶斑病病原菌(Alternariaalternata)菌丝生长和孢子的萌发抑菌效果较好。但张云霞等[29]认为,多菌灵对大叶伞干腐病病原菌可可毛色二孢菌(Lasiodiplodiatheobromae)抑菌效果最好,EC50为0.02 μg/mL,其次为戊唑醇和苯醚甲环唑,EC50均小于1 μg/mL。多菌灵对大叶伞干腐病病原菌的作用效果最好,可能是因为多菌灵很少用于观赏常绿木本植物,引起其干腐病的病原菌还没有对多菌灵产生抗药性。王志宏等[30]的研究也表明,异菌脲、多菌灵杀菌剂对枇杷花腐病的2种病原菌拟盘多毛孢(Pestalotiopsiseriobotrifolia)和灰葡萄孢(Botrytiscinerea)的菌丝生长和孢子萌发都具有强烈的抑制作用;嘧霉胺对2种病原菌也有较好的抑制作用。多菌灵对枇杷花腐病菌的作用效果好是因为多菌灵对木本植物上的病菌还未产生抗药性。
杀菌剂的室内毒力测定与田间防效之间存在一定的内在联系,但药剂的实际防治效果受多种因素影响。因此,本研究通过室内测定筛选出对向日葵菌核病有很好抑菌作用的φ=20%苯醚甲环唑水乳剂和φ=25%戊唑醇水乳剂2种药剂,以及对向日葵菌核病有较好抑菌作用的φ=20%松脂酸铜微乳油、w=70%甲基硫菌灵可湿性粉剂、w=15%三唑酮可湿性粉剂、φ=50%己唑醇微乳剂、φ=10%氟硅唑水分散颗粒剂、φ=12.5%腈菌唑微乳剂、φ=40%嘧霉胺悬浮剂和w=50%异菌脲可湿性粉剂8种杀菌剂,需要进行系统的田间防效试验,检验其实际应用效果,确保可有效防控向日葵菌核病。
Reference:
[1] 金梦阳,危文亮,严新初.我国向日葵育种研究现状及发展对策[J].内蒙古农业大学学报,2008,29(3):232-236.
JIN M Y,WEI W L ,YAN X CH.Recent progress and the development strategy of sunflower(HelianthusanuusL.) breeding in China[J].JournalofInnerMongoliaAgriculturalUniversity,2008,29(3):232-236(in Chinese with English abstract).
[2] MUKHTAR I.Sunflowerdisease and insectpestsin Pakistan: a review[J].AfricanCropScienceJournal,2009,17(2):109-118.
[3] KHAN S N.Macrophominaphaseolinaas causal agent for charcoal rot of sunflower[J].Mycopath,2007,5(2):111-118.
[4] 杨 涛,李汉华,段 维,等.向日葵菌核病的防治现状及前景[J].现代农业,2014(10):24-25.
YANG T,LI H H,DAN W,etal.Recent progress and development for sunflower sclerotinia stalk/head rot control[J].ModernAgriculture,2014(10):24-25(in Chinese).
[5] 张 捷,杨新元,贾爱红,等.向日葵菌核病、黄萎病的发生及综合防治技术[J].安徽农学通报,2014,20(21):60-61.
ZHANG J,YANG X Y,JIA A H,etal.Occurrence and integrated control technique for sunflower sclerotinia stalk/head rot and sunflowerVerticilliumwilt[J].AnhuiAgriculturalScienceBulletin,2014,20(21):60-61(in Chinese).
[6] 曹丽霞,徐利敏,云晓鹏,等.内蒙古地区向日葵主要病虫害发生现状及研究建议[J].内蒙古农业科技,2009(6):83-85.
CAO L X,XU L M,YUN X P,etal.Occurrence of main diseases and pests on sunflower in Inner Mongoliaand some suggestion for future research[J].InnerMongoliaAgriculturalScienceandTechnology,2009(6):83-85(in Chinese with English abstract).
[7] 王 鹏,李万云,刘胜利,等.向日葵菌核病致病机理及其防治方法对比分析[J].陕西农业科学,2014,60(1):4-9.
WANG P,LI W Y,LIU SH L,etal.Pathogenesis and control of sunflower sclerotinia stalk/head rot[J].ShaanxiJournalofAgriculturalSciences,2014,60(1):4-9(in Chinese with English abstract).
[8] 马立功,孟庆林,张匀华,等.向日葵盘腐型菌核病发病规律研究[J].安徽农业科学,2015,43(6):107-110.
MA L G,MENG Q L,ZHANG Y H,etal.Studies on the occurrence regularity of sunflower head rot bySclerotiniasclerotiorum[J].JournalofAnhuiAgriculturalSciences,2015,43(6):107-110(in Chinese with English abstract).
[9] 纪武鹏,于 琳,戴志铖,等.佳木斯地区向日葵菌核病发病规律初步研究[J].现代化农业,2013(2):13-14.
JI W P,YU L,DAI ZH CH,etal.Primary study on the occurrence regularity of sunflower sclerotinia stalk/head rot in Jiamusi area[J].ModernizingAgriculture,2013(2):13-14(in Chinese).
[10] 孔德胤,高飞翔,李建军,等.河套灌区向日葵菌核病发生的气象条件分析[J].中国农学通报,2012,28(7):287-291.
KONG D Y,GAO F X,LI J J,etal.Analysis of meteorological conditions on occurring of sunflowerSclerotiniasclerotiorumin Hetao irrigation[J].ChineseAgriculturalScienceBulletin,2012,28(7):287-291(in Chinese with English abstract).
[11] 石志琦,周明国,叶钟英,等.油菜菌核病菌对多菌灵的抗药性监测[J].江苏农业学报,2000,16(4):226-229.
SHI ZH Q,ZHOU M G,YE ZH Y,etal.Resistance monitoring ofSclerotiniasclerotiorumto Carbendazim[J].JiangsuJournalofAgriculturalSciences,2000,16(4):226-229(in Chinese with English abstract).
[12] 李红霞,陆悦健,周明国,等.油菜菌核病菌β-微管蛋白基因与多菌灵抗药性相关突变的研究[J].中国油料作物学报,2003,25(2):56-60.
LI H X,LU Y J,ZHOU M G,etal.Mutation in β-tubulin ofSclerotiniasclerotiorumconferring resistanceto carbendazim in rape seed field isolates[J].ChineseJournalofOilCropSciences,2003,25(2):56-60(in Chinese with English abstract).
[13] 张建忠,邵兴华,肖红艳.油菜菌核病的发生与防治研究进展[J].南方农业学报,2012,43(4):467-471.
ZHANG J ZH,SHAO X H,XIAO H Y.Progresses in causes ofSclerotiniasclerotiorumoccurrence in rape and its control[J].JournalofSouthernAgriculture,2012,43(4):467-471(in Chinese with English abstract).
[14] 马 琳,占绣萍,平新亮.杀菌剂抗性监测研究进展[J].农药科学与管理,2010,31(8):24-28.
MA L,ZHAN X P,PING X L.The research progress of fungicide resistance monitoring[J].PesticideScienceandAdministration,2010,31(8):24-28(in Chinese).
[15] 慕立义.植物化学保护研究方法[M].北京:中国农业出版社,1997:79,122,244.
MU L Y.Research Methods for Plant Chemical Protection [M].Beijing:Chinese Agriculture Press,1997:79,122,244(in Chinese).
[16] ANON.Recommended methods for the detection and measurement of resistance of agricultural pests to pestcides[J].FAOPlantProtectionBulletin,1982,30(2): 30-36.
[17] VONK J W,SIJPESTEIJN A K.Methyl benzimidazole-2-ylcarbamate,the fungi toxic principle of thiophanate-methyl[J].PesticideScience,1971,2:160-164.
[18] BOLLEN G J,SCHOLTEN G.Acquiredresistanceto benomyl and some other systemic fungicides in a strain ofBotrytiscinemahacyclamen[J].NetherlandsJournalofPlanPathology,1971,77:83-90.
[19] KENDALL S,HOLLOMON D W,ISHII H,etal.Characterisation of benzimidazole resistance trains ofRhynchosporiumsecalis[J].PesticideScience,1993,40:175-181.
[20] LOCKE T.Current incidence in the United Kingdom of fungicide resistance in pathogens of cereals[J].ProceedingsoftheBritishCropProtectionConference,1986,2:781-786.
[21] SCHROEDER W T,PROVVIDENTI R.Resistance to benomyl in powdery milder of cucurbits[J].PlantDiseaseReporter,1969,53:271-275.
[22] WICKS T.Tolerance of the apple scab fungus to benzimidazole fungicides[J].PlantDiseaseReporter,1974,58:886-889.
[23] 张 鑫,冒浩宇,李 禹,等.月季黑斑病病原鉴定及室内药剂筛选[J].中国园艺文摘,2015(9):46-49.
ZHANG X,MAO H Y,LI Y,etal.Identification of the pathogen and fungicides screening of the rose black spot[J].ChineseHorticultureAbstracts,2015(9):46-49(in Chinese with English abstract).
[24] 高 浩,郭能伟,项兰斌,等.10 种杀菌剂对马铃薯早疫病病菌的室内毒力测定[J].长江大学学报(自然科学版),2014,11(29):1-3.
GAO H,GUO N W,XIANG L B,etal.Laboratory toxicity test for ten fungicides toAlternariasolani[J].JournalofYangtzeUniversity(NaturalScienceEdition),2014,11(29):1-3(in Chinese).
[25] 付余波,钱国良,胡白石,等.21种杀菌剂对梨炭疽病菌、轮纹病菌、黑斑病菌的室内毒力测定[J].江苏农业科学,2011,39(2):178-180.
FU Y B,QIAN G L,HU B SH,etal.Laboratory toxicity test for twenty-one fungicides toColletotrichumgloeosporioides,BotryosphaeriaberengerianaandAlternariaalternate[J].JiangsuAgriculturalSciences,2011,39(2):178-180(in Chinese).
[26] 张 斌,梁雪杰,乔俊卿,等.29种常用杀菌剂对番茄枯萎病菌和青枯病菌的室内毒力测定[J].江苏农业科学,2014,42(9):106-109.
ZHANG B,LIANG X J,QIAO J Q,etal.Laboratory toxicity test for twenty-nine fungicides toFusariumoxysporumandRalstoniasolanacearum[J].JiangsuAgriculturalSciences,2014,42(9):106-109(in Chinese).
[27] 王文桥,韩秀英,张小风,等.防治小麦纹枯病的杀菌剂筛选[J].华北农学报,2007,22(增刊): 230-234.
WANG W Q,HAN X Y,ZHANG X F,etal.Slection of fungicides in controlling wheat sharp eyespot causedbyRhizoctoniacerealis[J].ActaAgriculturaeBoreali-Sinica,2007,22(Supplement):230-234(in Chinese with English abstract).
[28] 韩 敏,闫 军,陈九方,等.新疆核桃叶斑病病原菌的室内杀菌剂筛选及田间试验[J].新疆农业大学学报,2014,37(1):60-64.
HAN M,YAN J,CHEN J F,etal.Screening of laboratory fungicide and field trials forAlternariaalternataleaf spot pathogen of walnut in Xinjiang[J].JournalofXinjiangAgriculturalUniversity,2014,37(1):60-64(in Chinese with English abstract).
[29] 张云霞,郭嘉铭,施祖荣,等.大叶伞干腐病病原菌的鉴定及杀菌剂毒力测定[J].中国农学通报,2012,28(22):227-230.
ZHANG Y X,GUO J M,SHI Z R,etal.Pathogen identification and fungicide-screening of the dry rot onScheffleraactinophylla[J].ChineseAgriculturalScienceBulletin,2012,28(22):227-230(in Chinese with English abstract).
[30] 王志宏,董国菊,窦彦霞,等.防治枇杷花腐病室内药剂筛选[J].西南师范大学学报(自然科学版),2011,36(1):88-91.
WANG ZH H,DONG G J,DOU Y X,etal.Screening for fungicides of flower rot disease of loquat[J].JournalofSouthwestChinaNormalUniversity(NaturalScienceEdition),2011,36(1):88-91(in Chinese with English abstract).
(责任编辑:郭柏寿 Responsible editor:GUO Baishou)
Screening for Seed Coating Fungicides to Control Sunflower Sclerotinia Stalk/Head Rot
LIU Hongliang1,ZHANG Chun’e1,ZHAO Na2,XIAO Enshi3,WANG Shuxing4,JIA Haili4and LONG Shusheng1
(1.State Key Laboratory of Crop Stress Biology for Arid Areas,College of Plant Protection,Northwest A&F University,Yangling Shannxi 712100,China; 2.Agricultural Technology Extension Station of Shangzhou District,Shangluo Shannxi 726000; 3.College of Agronomy,Northwest A&F University,Yangling Shannxi 712100,China; 4.Weinan Institute of Agriculture Sciences,Weinan Shaanxi 715501,China)
Seed coating fungicides screening for sunflower sclerotinia stalk/head rot control was carried out with laboratory toxicity tests toSclerotiniasclerotiorum(pathogen of sunflower sclerotinia stalk/head rot).Eighteen fungicides bought from market were used for the toxicity test through growth rate method and seed germinating inhibition tests of fungicides to sunflower seed were conducted simultaneously.The results showed that two fungicides,φ=20% difenoconazole EW andφ=25% Tebuconazole EW,had excellent inhibiting effects toSclerotiniasclerotiorum,while eight other fungicides,includingφ=20% copper abietate micro-EC,w=70% thiophanatemethyl WP,w=15% triadimefon WP,φ=50% hexaconazolemicro-EC,φ=10% flusilazole WDG,φ=12.5% myclobutanil micro-EC,φ=40% pyrimethanil SC andw=50% iprodione WP,showed good inhibiting effects toSclerotiniasclerotiorum.All trial fungicides were safe for sunflower seed germination under 2.5 μg/mL mass concentration.
Sunflower sclerotinia stalk/head rot; Disease control; Seed coating agent;Fungicide
LIU Hongliang,male,master student.Research area:corn and sunflower diseases control.E-mail: 1070802807@qq.com
LONG Shusheng,male,Ph.D,associate research fellow.Research area:corn and sunflower diseases control.E-mail: longss@163.com
日期:2017-03-30
2016-03-14
2016-07-19
国家向日葵产业技术(CARS-16)。
刘红亮,男,硕士研究生,从事玉米和向日葵病害研究。E-mail:1070802807@qq.com
龙书生,男,博士,副研究员,主要从事玉米和向日葵病害研究。E-mail: longss@163.com
S435.655
A
1004-1389(2017)04-0625-10
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170330.1509.038.html
Received 2016-03-14 Returned 2016-07-19
Foundation item The National Sunflower Industry Technology System(No.CARS-16).
