纳米氧化锌对湿地植物种子萌发的影响
2017-04-12闫春妮
曹 冲 黄 娟 王 宁 闫春妮 彭 程
(东南大学土木工程学院, 南京 210096)
纳米氧化锌对湿地植物种子萌发的影响
曹 冲 黄 娟 王 宁 闫春妮 彭 程
(东南大学土木工程学院, 南京 210096)
为了分析纳米氧化锌(ZnO NPs)对湿地植物的影响,探究了不同浓度ZnO NPs对黑麦草、水葱、花叶芦竹种子萌发的影响.实验结果表明,当ZnO NPs浓度为 0.1,1.0 mg/L时,黑麦草、水葱、花叶芦竹的发芽率与对照组无显著差异;当ZnO NPs浓度达到10.0, 100.0 mg/L时,水葱的种子发芽率显著低于对照组.当ZnO NPs浓度为100.0 mg/L时,黑麦草、水葱、花叶芦竹种子发芽率相对于对照组分别减少了6.38%,44.71%,1.41%.在不同ZnO NPs浓度下,花叶芦竹种子萌发均与对照组无差异,但ZnO NPs对花叶芦竹种子萌发后幼苗根茎长度产生一定的影响,ZnO NPs浓度为0.1 mg/L时会促进花叶芦竹幼苗根茎的生长,而浓度为100.0 mg/L时会抑制花叶芦竹根茎的生长.可见,不同种类的湿地植物对ZnO NPs的响应不同.
纳米氧化锌(ZnO NPs);湿地植物;种子发芽;幼苗生长
纳米氧化锌(zinc oxide nanoparticles, ZnO NPs)作为一种典型的纳米材料,广泛应用于陶瓷、化工、生物、光学、电子等许多领域[1-2],但也因此通过各种途径进入到自然环境中,对生态系统产生不利影响.然而,由于分离和分析方法的局限性,迄今为止国内外对于纳米颗粒在环境中的背景浓度、污染状况的资料仍十分匮乏.Gottschalk等[3]运用概率建模方法模拟采样区域内水环境中的ZnO NPs浓度,发现在欧洲和美国ZnO NPs浓度分别高达0.432和0.3 mg/L,已达到对水体生物造成损害的阀值.Maurer-Jones等[4]使用风险评估的方法预测了环境中纳米颗粒浓度,预测结果发现ZnO NPs在地表水中的浓度为1~10 000 ng/L,而污水厂剩余污泥为13.6~64.7 mg/kg.
植物作为生态系统中至关重要的组成部分,纳米颗粒对植物的生态效应尚未明确[5].有些金属氧化物纳米颗粒能促进菠菜的光合作用和氮代谢,从而促进菠菜的生长[6],而大部分的纳米颗粒都会对植物生长造成不同程度的抑制[7].由于锌是植物必需的营养元素之一,因此ZnO NPs不同于一般的金属和金属氧化物纳米颗粒,它对植物的影响作用也更加复杂.纳米颗粒通常会对植物的萌发和生长2个阶段产生影响.种子萌发是植物生命周期的一个关键时期,也是对外界环境因子最敏感的时期之一[8].测试种子萌发和生长状况是对植物毒性测试的一种试验方法.Mahajan 等[9]对绿豆的研究表明,ZnO NPs浓度较高时,对其生长产生抑制,而浓度较低时则对其生长有促进作用.而有研究者对拟南芥[10]、洋葱[11]、黑麦草[12]的研究发现,ZnO NPs会抑制种子萌发以及根的伸长.
目前,关于ZnO NPs对多种湿地植物种子发芽率的研究相对较少.因此,本文选择3种常见的湿地植物黑麦草(LoliumperenneLinn.)、水葱(ScirpusvalidusVahl)、花叶芦竹(Arundodonaxvar. versicolor)种子为研究对象,研究不同浓度的ZnO NPs对这3种湿地植物种子的萌发影响,初步探讨ZnO NPs对湿地植物的毒性效应.
1 材料与方法
1.1 纳米材料与植物种子
试验使用的ZnO NPs溶液购自南京天行新材料有限公司,pH值为6~8,分散后的粒径为80~200 nm.ZnO NPs溶液采用纳米分散工艺,将ZnO NPs粉体在水体中充分稳定分散.利用透射电子显微镜对ZnO NPs溶液进行观测,如图1所示,绝大部分ZnO NP粒径小于等于200 nm,呈杆状或小颗粒状,部分形成了团聚体.
试验使用的黑麦草购自江苏宿迁青伊湖种业合作社,水葱和花叶芦竹的种子购于江苏宿迁新时代花卉公司,各种类种子均为同一批次.本试验中湿地植物种子的子叶或者幼根伸出种皮则记为萌发.

图1 ZnO NPs溶液的TEM照片
1.2 种子培养与ZnO NPs处理
分别将3种湿地植物黑麦草、水葱、花叶芦竹种子用30%的双氧水消毒8 min,用超纯水浸泡并各冲洗5次.将种子分别在0.1,1.0,10.0,100.0 mg/L ZnO NPs 溶液及超纯水中各浸泡2 h.浸泡后,选取大小形状一致的100粒种子均匀分布在直径100 mm、高15 mm、垫有滤纸的培养皿中.以购买的ZnO NPs溶液为原液,用超纯水配制试验浓度为0.1,1.0,10.0,100.0 mg/L ZnO NPs处理液,每个培养皿中加入4 mL处理液,每种处理方法重复3次.将培养皿用透气不透水的薄膜(PM 996, Parafilm M®, US)包裹,放入温室培养箱中培养10 d,白天温度25~30 ℃培养16 h,夜晚15~20 ℃培养8 h[13].
1.3 发芽率、根长和苗高的测定
在ZnO NPs溶液处理后的第7 d测定发芽率,发芽率按以下公式计算:
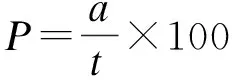
式中,P为种子发芽率;a为7 d已发芽种子数;t为供试种子数. 第10 d从培养皿随机挑取幼苗,测量其根长、苗高,并取平均值[14].
1.4 数据统计分析
试验数据统计使用SPSS 22.0分析软件,采用ANOVA进行显著性差异分析;使用Origin 8.0软件进行绘制图形.
2 结果与讨论
2.1 不同ZnO NPs浓度对植物种子萌发的影响
试验考察了不同ZnO NPs浓度对3种湿地植物种子萌发的影响,结果如图2所示.
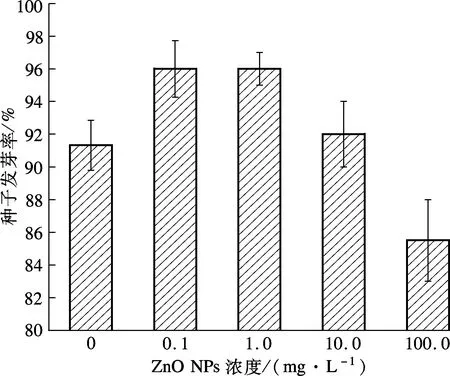
(a) 黑麦草

(b) 水葱
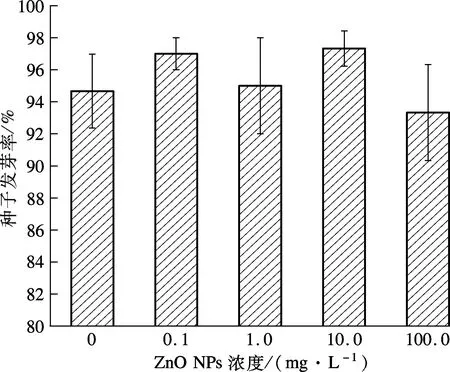
(c) 花叶芦竹
由图2(a)可知,在低浓度(0.1, 1.0 mg/L)ZnO NPs处理下,黑麦草种子发芽率随着ZnO NPs浓度升高呈小幅度升高.低浓度ZnO NPs溶解产生Zn2+,促进了黑麦草的生长.随着ZnO NPs浓度进一步升高,黑麦草发芽率出现明显下降,100.0 mg/L试验组与对照组相比,其发芽率减少了6.38%.从图2(b)可看出,在ZnO NPs浓度为0.1, 1.0 mg/L的试验组中,水葱发芽率与对照组无明显差异性;在浓度为10.0, 100.0 mg/L试验组中,水葱种子发芽率随着ZnO NPs浓度的升高呈降低的趋势;当ZnO NPs浓度达到100.0 mg/L时,水葱、花叶芦竹种子的发芽率与对照组相比,减少了44.71%和1.41%.可见,高浓度ZnO NPs抑制了黑麦草、水葱种子的萌发.而由图2(c)可见,在不同ZnO NPs浓度处理下,花叶芦竹种子发芽率呈不规则变化.
对3种湿地植物种子在不同ZnO NPs浓度处理的发芽率进行差异性分析,结果如表1所示.
表1 3种植物种子发芽率受ZnO NPs影响的差异性 %

植物种类ZnONPs浓度/(mg·L-1)对照组0.11.010.0100.0黑麦草91.3396.0096.0092.0085.50*水葱56.6759.0059.3344.67*31.33*花叶芦竹94.6797.0095.0097.3393.33注:*表示概率p<0.05.
由表1可见,低浓度(0.1,1.0,10.0 mg/L)ZnO NPs处理下,黑麦草种子发芽率与对照组之间无明显差异(p>0.05);当ZnO NPs浓度达到100.0 mg/L时,黑麦草种子发芽率与对照组相比产生显著性差异(p<0.05),说明高浓度ZnO NPs对黑麦草种子萌发产生了抑制作用.同样,ZnO NPs浓度为0.1,1.0 mg/L 试验组的水葱种子发芽率与对照组相比无显著性差异(p>0.05),但浓度为10.0,100.0 mg/L时试验组与对照组存在显著性差异(p<0.05),说明ZnO NPs浓度达到10.0 mg/L 时,ZnO NPs开始对水葱种子的萌发产生明显的抑制作用.但对于花叶芦竹而言,各处理浓度的ZnO NPs试验组种子发芽率与对照组均无显著差异(p>0.05).可见,不同浓度的ZnO NPs对不同湿地植物种子的影响存在差异性.
2.2 ZnO NPs对不同植物种子发芽率的影响
为了进一步考察ZnO NPs对植物种子发芽率的影响,将不同ZnO NPs浓度处理下植物发芽率的相对值(不同浓度下种子发芽率与对照组的比值)做差异性分析,进而将ZnO NPs对不同植物种子萌发的影响作用进行对比分析,结果如表2所示.
表2 ZnO NPs处理下3种植物种子发芽率相对值差异性
由表2可知,ZnO NPs浓度为0.1,1.0 mg/L时,黑麦草与水葱、黑麦草与花叶芦竹、水葱与花叶芦竹各组植物之间的种子发芽率相对值无显著性差异(p>0.05),说明ZnO NPs浓度较低时未对黑麦草、水葱、花叶芦竹种子发芽率造成显著性影响,这与前文的研究分析基本一致.但当ZnO NPs浓度达到10.0,100.0 mg/L时,黑麦草与水葱、水葱与花叶芦竹种子发芽率差异显著(p<0.05),较高浓度的ZnO NPs对植物造成不同程度的毒害效应.不同植物对纳米颗粒的吸收能力不同,导致不同植物对ZnO NPs响应存在一定差异.
2.3 ZnO NPs对种子萌发后根茎长度的影响
种子萌发后根茎叶失去了种皮保护,纳米颗粒可直接作用于幼根、幼茎,进而对其生长产生影响.试验进一步考察不同ZnO NPs浓度对花叶芦竹种子萌发后根茎长度的影响,结果如图3和表3所示.
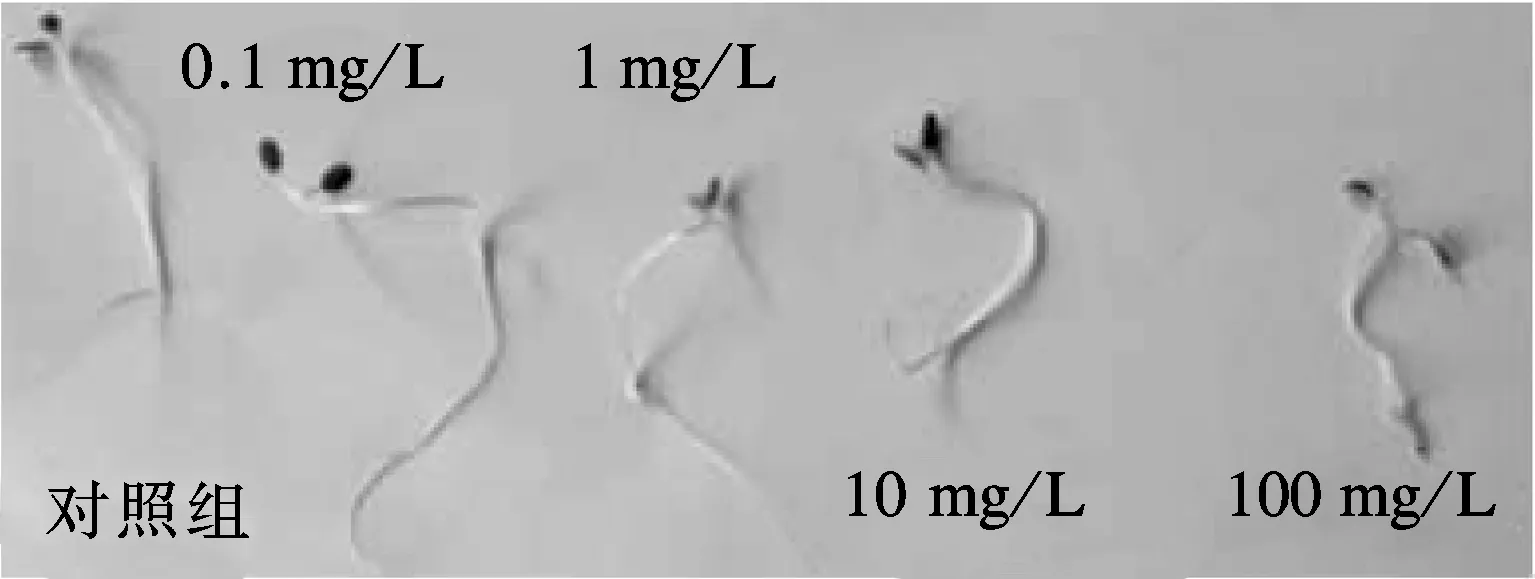
图3 ZnO NPs处理下花叶芦竹根茎长度
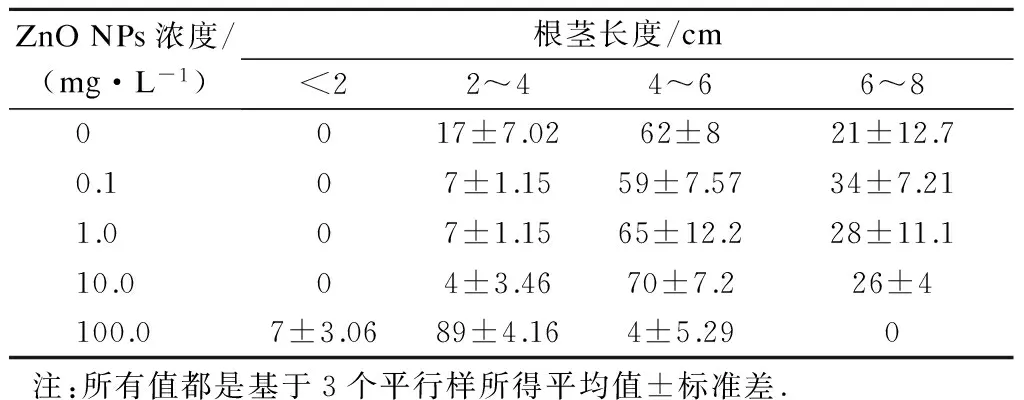
表3 花叶芦竹种子萌发后根茎长度分布 %
从图3可直观地看出,不同浓度ZnO NPs处理下花叶芦竹茎叶伸长的差异性.由表3可见,ZnO NPs浓度为0.1 mg/L时,根茎长度在6~8 cm区间分布比例大于对照组;当ZnO NPs浓度为1.0,10.0 mg/L 时,根茎长度分布与对照组一致,根茎长度小于2 cm的比例均为0;当ZnO NPs 浓度为0.1,1.0,10.0 mg/L时,试验组的根茎长度在2~4 cm 区间的分布比例低于对照组,而在4~8 cm区间的分布比例大于对照组,表明该浓度ZnO NPs有助于花叶芦竹种子根茎生长,当种子萌发后,根茎叶伸出种皮,更容易吸收部分氧化锌溶解产生的Zn2+.当ZnO NPs浓度达到100.0 mg/L时,茎叶长度在6~8 cm区间无分布,在4~6 cm区间也只有极少的分布,主要分布在小于2和2~4 cm区间.花叶芦竹种子发芽后根茎叶没有了种皮的保护,直接与ZnO NPs接触,高浓度ZnO NPs可以直接接触幼根茎叶,使其生长受到抑制[15-16],这与Lin等[12]的研究结果一致.可见,低浓度ZnO NPs产生的Zn2+有助于茎叶的生长,而高浓度ZnO NPs对花叶芦竹种子萌发后的茎叶生长产生明显抑制.
对不同浓度ZnO NPs处理下各试验组花叶芦竹根茎长度进行差异性分析,结果如表4所示.
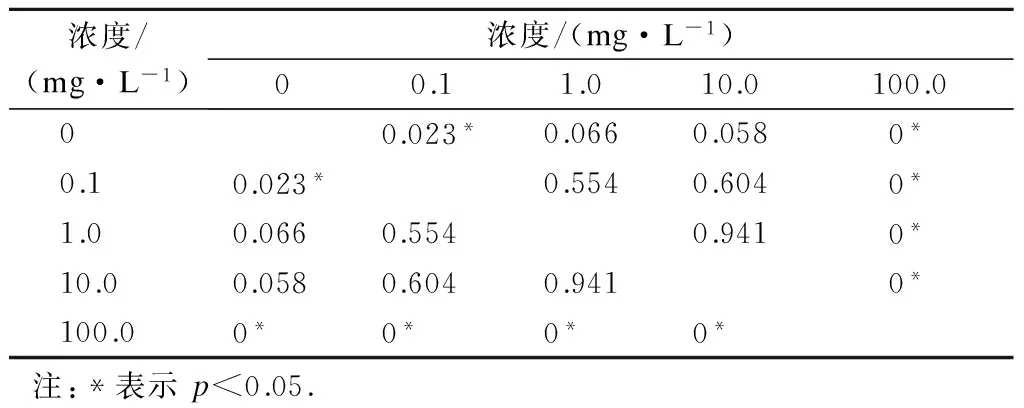
表4 不同ZnO NPs浓度下花叶芦竹根茎长度差异性
由表4可知,当ZnO NPs浓度为0.1 mg/L时,花叶芦竹种子萌发后根茎长度与对照组相比呈显著差异(p<0.05),这是由于低浓度ZnO NPs对花叶芦竹根茎生长起到促进作用,与ZnO NPs浓度为0.1 mg/L处理组花叶芦竹根茎长度在6~8 cm 分布比例大于对照组一致;当ZnO NPs浓度为1.0,10.0 mg/L时,根茎长度与对照组相比差异性不明显;但当ZnO NPs浓度达到100.0 mg/L时,试验组与对照组相比差异显著(p<0.05),结合表3可知,高浓度(100.0 mg/L)ZnO NPs对花叶芦竹的根茎生长产生了抑制作用.
ZnO NPs浓度为0.1,1.0,10.0 mg/L的试验组之间差异不显著.但ZnO NPs浓度为100.0 mg/L试验组与浓度为0.1,1.0,10.0 mg/L各试验组之间均呈显著性差异(p<0.05),ZnO NPs浓度为100.0 mg/L的处理达到对花叶芦竹根茎生长的毒性阈值,产生了显著的抑制作用.
3 结论
1) 当ZnO NPs浓度为0.1,1.0 mg/L,黑麦草、水葱种子发芽率与对照组相比无显著差异.但高浓度ZnO NPs处理下,黑麦草(ZnO NPs浓度达到100.0 mg/L)和水葱(ZnO NPs浓度达到10.0 mg/L)的种子发芽率相比对照组显著降低.
2) 当ZnO NPs浓度达到100.0 mg/L时,黑麦草、水葱、花叶芦竹种子发芽率分别减少了6.38%,44.71%,1.41%;但在不同浓度ZnO NPs处理下,花叶芦竹种子发芽率与对照组均无显著差异,表明由于不同植物种子生理特性的不同,对不同浓度ZnO NPs处理的响应存在差异.
3) 不同浓度ZnO NPs处理下,花叶芦竹种子萌发后根茎生长受到一定程度的影响.当ZnO NPs为低浓度(0.1 mg/L)时促进了花叶芦竹种子萌发后根茎生长;但当ZnO NPs浓度达到100.0 mg/L时,会抑制花叶芦竹根茎生长.
References)
[1]Thandavan T M K, Gani S M A, Wong S C, et al. Enhanced photoluminescence and raman properties of Al-doped ZnO nanostructures prepared using thermal chemical vapor deposition of methanol assisted with heated brass[J].PlosOne, 2015, 10(3): e0121756-1-e0121756-18. e0121756. DOI:10.1371/journal.pone. 0121756.
[2]Abdolmaleki A, Mallakpour S, Borandeh S. Effect of silane-modified ZnO on morphology and properties of bionanocomposites based on poly(ester-amide) containing tyrosine linkages[J].PolymerBulletin, 2012, 69(1): 15-28. DOI:10.1007/s00289-011-0685-7.
[3]Gottschalk F, Sonderer T, Scholz R W, et al. Modeled environmental concentrations of engineered nanomaterials (TiO2, ZnO, Ag, CNT, fullerenes) for different regions[J].EnvironmentalScience&Technology, 2009, 43(24): 9216-9222. DOI:10.1021/es9015553.
[4]Maurer-Jones M A, Gunsolus I L, Murphy C J, et al. Toxicity of engineered nanoparticles in the environment[J].AnalyticalChemistry, 2013, 85(6): 3036-3049. DOI:10.1021/ac303636s.
[5]Ma X, Geiser-Lee J, Deng Y, et al. Interactions between engineered nanoparticles (ENPs) and plants: Phytotoxicity, uptake and accumulation[J].ScienceoftheTotalEnvironment, 2010, 408(16): 3053-3061. DOI:10.1016/j.scitotenv.2010.03.031.
[6]Watson J, Fang T, Dimkpa C O, et al. The phytotoxicity of ZnO nanoparticles on wheat varies with soil properties[J].Biometals, 2015, 28(1): 101-112. DOI:10.1007/s10534-014-9806-8.
[7]Yang F, Hong F S, You W J, et al. Influences of nano-anatase TiO2on the nitrogen metabolism of growing spinach[J].BiologicalTraceElementResearch, 2006, 110(2): 179-190. DOI:10.1385/bter:110:2:179.
[8]罗珊,康玉凡,夏祖灵. 种子萌发及幼苗生长的调节效应研究进展[J]. 中国农学通报, 2009, 25(2): 28-32. Luo Shan, Kang Yufan, Xia Zhuling. Study advances of regulating effect for seed germination and sprout growing[J].ChineseAgriculturalScienceBulletin, 2009, 25(2): 28-32. (in Chinese)
[9]Mahajan P, Dhoke S K, Khanna A S. Effect of nano-ZnO particle suspension on growth of mung (Vignaradiata) and gram (Cicerarietinum) seedlings using plant agar method[J].JournalofNanotechnology,2011, 2011: 696535-1-696535-7. DOI:10.1155/2011/696535.
[10]Lee C W, Mahendra S, Zodrow K, et al. Developmental phytotoxicity of metal oxide nanoparticles toArabidopsisthaliana.[J].EnvironmentalToxicologyandChemistry, 2010, 29(3): 669-675. DOI:10.1002/etc.58.
[11]Ghodake G, Seo Y D, Lee D S. Hazardous phytotoxic nature of cobalt and zinc oxide nanoparticles assessed usingAlliumcepa[J].JournalofHazardousMaterials, 2011, 186(1): 952-955. DOI:10.1016/j.jhazmat.2010.11.018.
[12]Lin D, Xing B. Root uptake and phytotoxicity of ZnO nanoparticles[J].EnvironmentalScience&Technology, 2008, 42(15): 5580-5585. DOI:10.1021/es800422x.
[13]Yin L, Cheng Y, Espinasse B, et al. More than the ions: The effects of silver nanoparticles onLoliummultiflorum[J].EnvironmentalScience&Technology, 2011, 45(6): 2360-2367. DOI:10.1021/es103995x.
[14]国际种子检验协会(ISTA). 1996国际种子检验规程[M]. 北京: 中国农业出版社,1999.
[15]Ma Y, Kuang L, He X, et al. Effects of rare earth oxide nanoparticles on root elongation of plants[J].Chemosphere, 2010, 78(3): 273-279. DOI:10.1016/j.chemosphere.2009.10.050.
[16]Liu Q, Zhao Y, Wan Y, et al. Study of the inhibitory effect of water-soluble fullerenes on plant growth at the cellular level[J].ACSNano, 2010, 4(10): 5743-5748. DOI:10.1021/nn101430g.
Impact of zinc oxide nanoparticles on seed germination of wetland plant
Cao Chong Huang Juan Wang Ning Yan Chunni Peng Cheng
(School of Civil Engineering, Southeast University, Nanjing 210096, China)
To study the impact of ZnO nanoparticles (ZnO NPs) on wetland plants, the effects of different concentration ZnO NPs on seed germination ofLoliumperenneLinn.,ScirpusvalidusVahl, andArundodonaxvar. versicolor were investigated in the this study. The obtained results show that under the concentrations of ZnO NPs at 0.1, 1.0 mg/L, the germination rate of three kinds of wetland plant (LoliumperenneLinn.,ScirpusvalidusVahl,Arundodonaxvar. versicolor) has no significant difference compared with the control group. The seed germination rate ofScirpusvalidusVahl is significantly lower than the control group when the concentrations of ZnO NPs reach to 10.0 and 100.0 mg/L. Compared with the control group, the seed germination rates ofLoliumperenneLinn.,ScirpusvalidusVahl,Arundodonaxvar. versicolor decreases by 6.38%, 44.71% and 1.41%, respectively. But forArundodonaxvar. versicolor, there is no difference with control group in the seed germination under the different concentrations of ZnO NPs. However, the length of rootstock suffers to a certain impact after the seed germination ofArundodonaxvar. versicolor under the treatment of ZnO NP stress. The concentration of ZnO NPs at 0.1 mg/L can promote the growth of rootstocks while the concentration at 100.0 mg/L inhibits the elongation of rootstocks ofArundodonaxvar. versicolor. Therefore, wetland plants with different species have different behaviors in response to the treatment of ZnO NPs.
zinc oxide nanoparticles (ZnO NPs); wetland plants; seed germination; seedling growth
10.3969/j.issn.1001-0505.2017.02.035
2016-09-06. 作者简介:曹冲(1991—),男,博士生;黄娟(联系人),女,博士,副教授,博士生导师,seu070303@163.com.
国家自然科学基金资助项目(51479034,5151101102)、中央高校基本科研业务费专项资金资助项目.
曹冲,黄娟,王宁,等.纳米氧化锌对湿地植物种子萌发的影响[J].东南大学学报(自然科学版),2017,47(2):416-420.
10.3969/j.issn.1001-0505.2017.02.035.
X503.23
A
1001-0505(2017)02-0416-05
