遗鸥舌头微观结构研究
2017-04-08刘利张乐孙艳苗春林张刚刘晓光
刘利, 张乐, 孙艳, 苗春林, 张刚, 刘晓光*
(1.包头师范学院生物科学与技术学院,内蒙古包头014030; 2. 包头南海子湿地保护区管理处,内蒙古包头014040;3. 鄂尔多斯市乌审旗林业局,内蒙古鄂尔多斯017300)
遗鸥舌头微观结构研究
刘利1, 张乐1, 孙艳1, 苗春林2, 张刚3, 刘晓光1*
(1.包头师范学院生物科学与技术学院,内蒙古包头014030; 2. 包头南海子湿地保护区管理处,内蒙古包头014040;3. 鄂尔多斯市乌审旗林业局,内蒙古鄂尔多斯017300)
采用光学显微镜及电子扫描显微镜对遗鸥Larusrelictus舌头微观结构进行研究。结果显示:遗鸥的舌头呈细长三角形,由舌尖、舌体、舌根3部分构成。舌尖分叉先端特化为角质的舌突起,舌尖表面有大量脱落的上皮细胞,细胞表面为指纹状;舌体表面光滑,上皮细胞为细长形,表面呈微嵴状;舌根表面有少量的唾液腺开口分布。从功能上分类,遗鸥舌头符合采集食物型舌头结构特征。舌乳突发育不完善,仅锥状乳突在舌体和舌根分界处及上颌表面呈列状分布,乳突末端指向口腔内部。舌黏膜内未见味蕾分布。遗鸥口腔结构的特点与部分鸥科Laridae鸟类区别明显,这可能与遗鸥栖息环境不断恶化、食物种类和数量匮乏有关。
遗鸥;栖息环境;舌头;微观结构
遗鸥Larusrelictus隶属于鸻形目Charadriiformes鸥科Laridae,是国家Ⅰ级重点保护野生动物,被列入濒危野生动植物种国际贸易公约(CITES)和迁徙物种公约(MSC)附录Ⅰ,在IUCN发布的红皮书中一直被列为受威胁鸟种。作为蒙古高原荒漠型代表鸥科鸟种,遗鸥栖息繁殖于沙漠湖心岛,主要在湖岸滩或水面上啄食水生昆虫,其食性为以动物性食物为主的杂食性(张荫荪等,1993)。近年来,由于栖息环境不断恶化,食物链断裂,遗鸥繁殖种群不断辗转迁移,在21世纪初期由桃力庙-阿拉善湾海子迁移至红碱淖尔,2010年前后红碱淖尔的生境质量下降,导致较小规模的遗鸥繁殖种群出现在河北康保县、内蒙古呼和浩特市近郊、陕西定边县等地,直至2015年遗鸥在乌审旗境内浩通音查干淖尔另辟繁殖地(任永奇,何芬奇,2015)。目前我国科研人员已在遗鸥的繁殖生态(汪青雄等,2015)、种群分布(吴渊等,2016)、分子进化(Yangetal.,2016)等方面开展了广泛研究,但关于其舌头微观结构的研究未见报道,本研究通过光学显微镜和扫描电子显微镜对遗鸥舌头微观结构进行了研究,为阐明食物种类变化对其舌头微观结构的影响提供依据,为保护遗鸥提供预警机制,为保护生物学及解剖学提供科学材料。
1 材料与方法
1.1 样品采集
2015年7月24日在内蒙古鄂尔多斯市乌审旗浩通音查干淖尔镇南侧咸湖(39°11′21.92″E,109°0′30.27″N)进行野外调查时,采集到自然死亡的新鲜遗鸥雌性成体样本2只,另外1只为被野生动物采食后剩下的成鸟头部组织。样本放入采样箱冰冻带回实验室,简单处理后置入10%甲醛溶液中充分固定。
1.2 研究方法
1.2.1 光学显微镜观察 取固定好的遗鸥头部,从嘴角处剪开上下颌,用生理盐水洗去口咽腔部位黏膜表面的黏液和污物。首先大体解剖观察其结构特点,然后取舌、上下颌、咽等部位的组织,常规石蜡切片,切片厚度5~8 μm,苏木精-伊红染色,在显微镜(Olympus,FX-35WA,Japan)下观察并拍照。
1.2.2 扫描电子显微镜观察 将舌、上下颌、咽等部位的组织切成约1 cm×1 cm×1 cm的组织块,2.0%戊二醛溶液前固定24 h(4 ℃)后,用磷酸缓冲液(pH7.2)冲洗,然后置于1%锇酸中后固定2 h,双蒸水冲洗后系列酒精脱水,真空干燥喷金后扫描电镜观察(Hitachi S-4800,Japan)。
2 结果
2.1 肉眼观察
遗鸥的上颌长约6.0 cm,由硬腭、腭缝、锥状乳突及内鼻孔构成(图1:A)。上颌前表面光滑,长度约占上颌表面的2/3;颚缝位于上颌后表面,长约2.0 cm,锥状乳突在颚缝两侧前后呈列状分布,乳突末端指向口腔内侧;硬腭的末端特化为锥状乳突列,内鼻孔开口于腭缝。舌头填满下口腔,为细长三角形,由舌尖、舌体和舌根组成。舌尖分叉,高度角质化;舌体平滑,末端特化为锥状乳突,乳突末端指向食道,从舌尖到锥状乳突的末端长度约3.8 cm,最大宽度约0.7 cm;舌根较短,长约1.2 cm,舌根后侧与隆起的喉头相连,前部为声门,后侧表面锥状乳突呈列状分布(图1:B)。
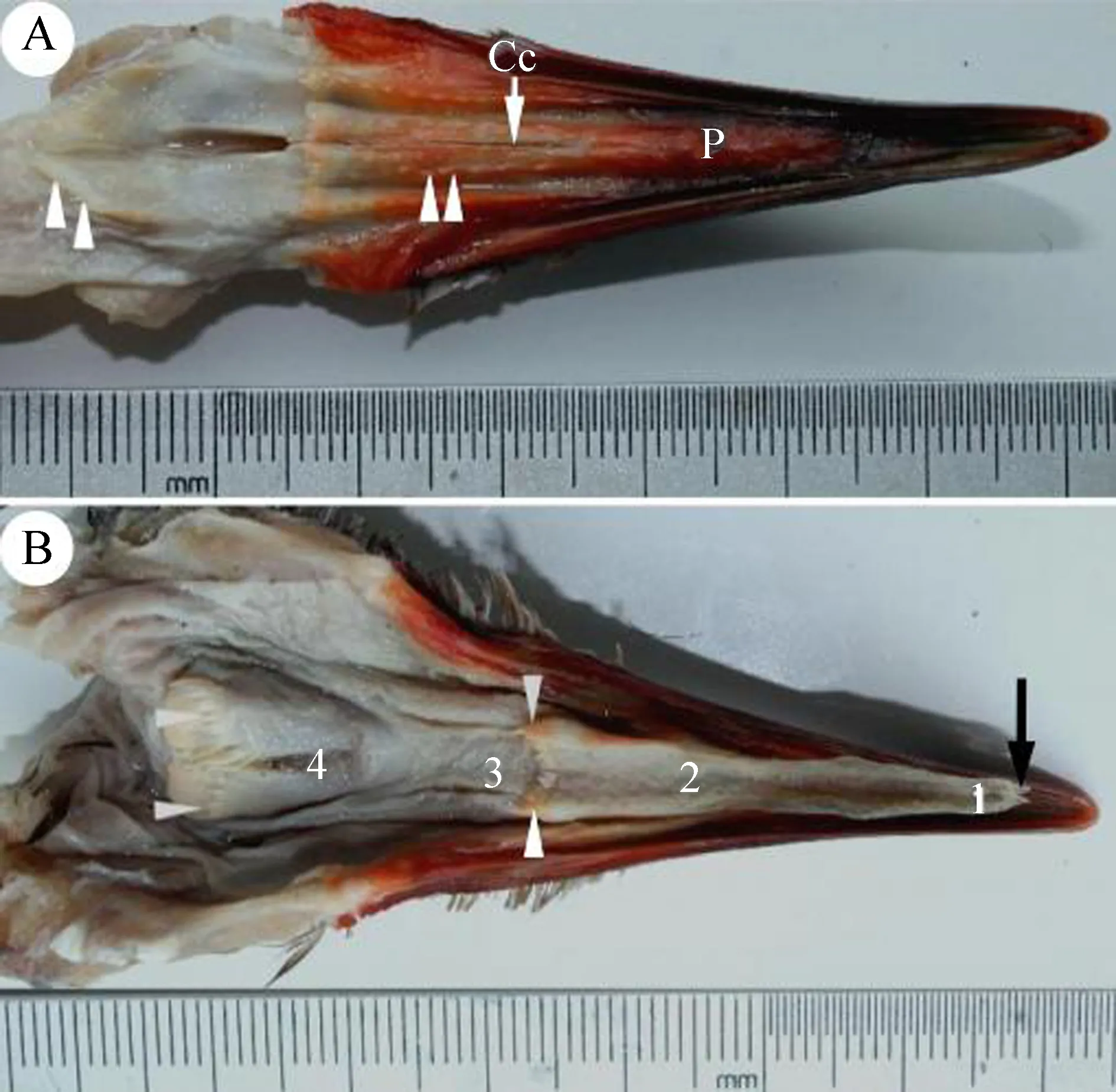
图1 遗鸥口腔表面
A.上口腔表面: 硬腭(P), 腭缝(Cc), 锥状乳突(白箭头); B. 下口腔表面: 舌尖(1), 舌体(2), 舌根(3), 声门(4), 舌尖分叉(黑箭头)。
A. upper mandible: hard palate (P),choanal cleft (Cc), and conical papilla (white arrowheads); B. lower mandible: lingual apex (1), lingual body (2), lingual root (3), glottis (4), and bifurcation of the apex (black arrow).
2.2 显微镜观察
遗鸥舌尖分叉,尖端特化为角质的舌突起,突起表面由多角形的上皮细胞覆盖(图2:A)。放大观察,细胞表面呈指纹状(图2:B)。舌突起后方的舌尖表面有大量脱落的上皮细胞分布,细胞表面为较细的绒毛状(图2:C,D)。光学显微镜观察,舌尖黏膜上皮为角质复层扁平上皮,表面脱落的上皮细胞清晰可见,上皮深部为固有层,固有层的结缔组织伸向上皮形成许多突起,黏膜间无腺体分布(图2:G)。
舌体表面平滑,上皮细胞呈细长形,表面为微嵴状(图2:E,F)。舌体中部有背黏膜层和腹黏膜层,黏膜表面高度角质化,舌体中后部除背黏膜层和腹黏膜层外,还有基层和软骨层,固有层结缔组织伸向上皮形成许多突起,纤维间有散在的血管分布,未见舌腺及舌乳突分布(图2:H)。
舌体末端特化为圆锥状舌乳突,乳突在舌根与舌体的连接处呈列状分布,外侧主乳突较大,长约1.5 mm,在主乳突前面分布有3~4个副乳突,乳突末端指向消化道(图3:A)。
舌根表面有较多皱襞,皱襞表面分布少量舌腺开口,开口部呈不规则状(图3:B),声门前端的舌腺开口较大,呈圆形,直径约30 μm(图3:C)。背面黏膜上皮为复层扁平上皮,无角化层(图3:D)。固有层内有舌腺分布,舌腺由腺泡和导管组成,腺体间分布有丰富的淋巴组织、毛细血管和神经末梢。腺泡由单层柱状黏液性上皮细胞构成,细胞核小,位于细胞基底部,胞质呈空泡状,嗜弱碱性。导管开口于黏膜上皮表面(图3:D),肉眼可见舌表面分布的舌腺孔。喉头尾侧锥状乳突呈列状排列(图3:E)。
遗鸥上口腔内表面光滑,质地较硬,表面分布4~6列锥状乳突,靠近口腔后部乳突逐渐增大,扫描电子显微镜观察,无舌腺开口(图3:F)。组织学研究显示,口腔黏膜间未见味觉感受器味蕾分布。
3 讨论
3.1 遗鸥舌头结构特征

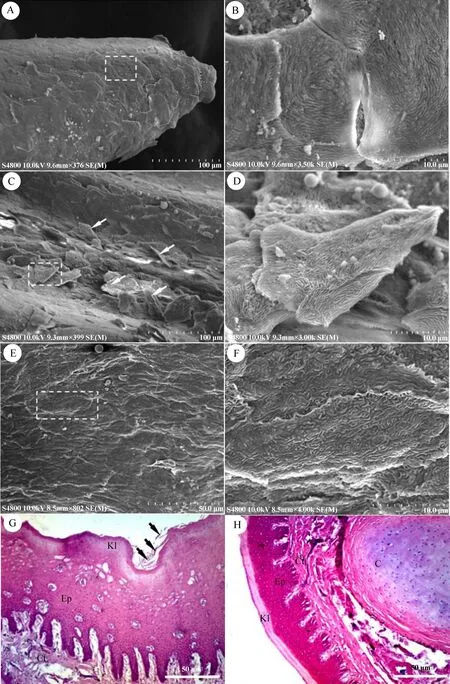
图2 舌尖及舌体表面的电子扫描显微照片(A~F)和光学显微照片(G、H)
Fig. 2 Scanning electron micrograph (A-F) and light micrograph (G, H) of the lingual apex and lingual body ofLarusrelictus
A.舌突起, 上皮细胞(白色虚线框); B. 舌突起上皮细胞; C. 舌尖表面, 上皮细胞(箭头); D. 舌尖上皮细胞; E. 舌体表面; F. 舌体上皮细胞; G. 舌尖横断面, 角质层(Kl), 重层扁平上皮(Ep), 结缔组织层(Ct), 上皮细胞(箭头); H. 舌体横断面, 舌软骨组织(C)。
A. the protrusions and the epithelial cells (white rectangle); B. the surface of the epithelial cells of protrusions; C. the surface of the lingual apex and epithelial cells (arrowheads); D. the surface of the epithelial cells of the lingual apex; E. the surface of the lingual body; F. the surface of the epithelial cells of the lingual body; G. vertical section of the lingual apex; keratinized layer (Kl), stratified squamous epithelium (Ep), connective tissue (Ct), epithelial cells (arrowheads); H. vertical section of the lingual body, cartilage (C).
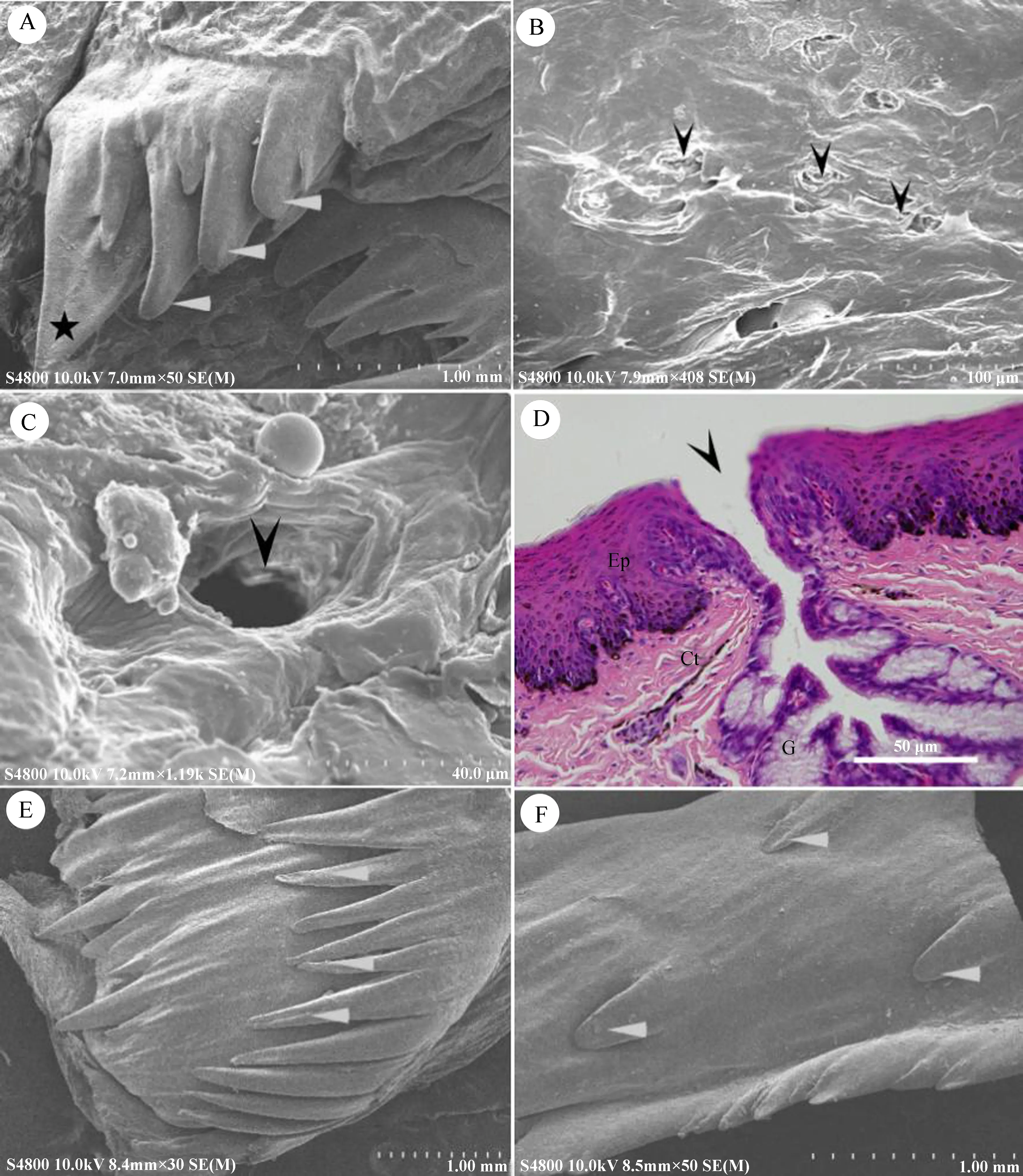
图3 舌根及锥状乳突的电子扫描显微照片(A~C、 E、 F)和光学显微照片(D)
A.锥状乳突, 主乳突(五角星), 副乳突(白箭头); B. 舌根表面, 舌腺开口(黑箭头); C. 声门前部的舌腺开口; D. 舌根的横断面, 舌腺开口(黑箭头), 重层扁平上皮(Ep), 结缔组织层(Ct), 舌腺(G); E. 喉头后部的锥状乳突; F. 硬腭表面。A. the conical papillae; main papillae (pentagram) and secondary papillae (white arrowheads); B. the surface of the lingual root, with the lingual gland openings (black arrowheads); C. the lingual gland opening of the glottis; D. vertical section of the lingual root, lingual gland opening (black arrowhead), stratified squamous epithelium (Ep), connective tissue (Ct), lingual gland (G); E. the conical papillae of the larynx; F. the hard palate surface.
3.2 采食习性及栖息环境对舌头微观结构的影响
据报道,遗鸥主要栖息在pH>8.5的沙漠咸水湖泊中,在湖心岛上营巢繁殖,主要摄食摇蚊科Chitonomidae幼虫和成虫、豆娘Caenagrionidue稚虫、虎岬科Cicindellidae、步行虫科Carabidae等昆虫(张荫荪等,1993;刘文盈等,2008),以及淤泥中的甲壳类和线形动物Nemathelminthes等,有时也会采食少量植物性食物(田梠等,1998)。本实验结果显示,遗鸥舌尖与舌体的上皮细胞微观结构有所不同,分别呈指纹状和微嵴状,这种结构与白额燕鸥的一致(Iwasaki,1992),这可能因为2种鸟类分类地位或者采食习性相近。另外,遗鸥以各种水生昆虫及少量植物性食物为食,说明其对食物的选择性较弱,研究中未在遗鸥口腔黏膜内发现味蕾,可能因为其味觉器官已经发生了退化。
另一方面,遗鸥舌尖表面存在大量脱落的上皮细胞,这与小黑背银鸥、白额燕鸥的舌尖结构特征有所不同。据记载,白额燕鸥主要以小鱼、虾等甲壳类、软体动物及昆虫为食,未见采食植物(王岐山等,2006)。本研究在调查过程中发现,遗鸥采食(撕扯)沙漠湖边的丝藻Ulothrix类植物,其中包裹着细沙,这可能是其舌尖黏膜角质化、上皮细胞大量脱落的原因。另外,以动物性食物为主的遗鸥采食湖边的藻类可能预示着其生存环境不断恶化,可选择的食物种类相对匮乏。
致谢:感谢鄂尔多斯市森林公安局任永琪站长、张刚局长、乌审旗森林公安局工作人员,以及内蒙古大学化工学院胡瑞升院长在研究过程中提供的帮助!
刘文盈, 张秋良, 邢小军, 等. 2008. 鄂尔多斯高原盐沼湿地底栖动物多样性特征与遗鸥繁殖期觅食的相关性研究[J]. 干旱区资源与环境, 22(4): 185-192.
任永奇, 何芬奇. 2015. 遗鸥鄂尔多斯亚群主体另辟繁殖地[J]. 湿地科学与管理, 11(3): 63.
田梠, 薛文, 马俊, 等. 1998. 遗鸥繁殖群在内蒙古东部的新发现[J]. 内蒙古大学学报(自然科学版), 29(5): 694-696.
汪青雄, 肖红, 杨超, 等. 2015. 陕西红碱淖棕头鸥孵卵行为[J]. 生态学杂志, 34(3): 760-764.
王岐山, 马鸣, 高玉仁. 2006. 中国动物志 鸟纲 第五卷[M]. 北京: 科学出版社.
吴渊, 张海, 张有强, 等. 2016. 河北张家口康巴诺尔湖国家湿地公园遗鸥繁殖群新发现[J]. 动物学杂志, 51(4): 668-670.
张荫荪, 丁文宁, 陈容伯, 等. 1993. 遗鸥(Larusrelictus)繁殖生态研究[J]. 动物学报, 39(2): 154-159.
郑光美. 2012. 鸟类学(第2版)[M]. 北京: 北京师范大学出版社.
Ahlam EB, Iwasaki S. 2014. Ultrastructure and histochemical study of the lingual salivary glands of some bird species[J]. Pakistan Journal of Zoology, 46(2): 553-559.
Burcu O, Serife T, Murat K,etal. 2015. Macroanatomic,light microscopic, and scanning electron microscopic studies of the tongue in the seagull (Larusfuscus) and common buzzard (Buteobuteo)[J]. Acta Zoologica (Stockholm), 96: 60-66.
Crole MR, Soley JT. 2010. Surface morphology of the emu (Dromaiusnovaehollandiae) tongue[J]. Anatomia Histologia Embryologia, 39(4): 355-365.
Crole MR, Soley JT. 2014. Comparative distribution and arrangement of Herbst corpuscles in the oropharynx of the ostrich (Struthiocamelus) and emu (Dromaiusnovaehollandiae)[J]. Anatomical Record (Hoboken), 297(7): 1338-1348.
Emura S, Okumura T, Chen H. 2008. Scanning electron microscopic study of the tongue in the peregrine falcon and common kestrel[J]. Okajimas Folia Anatomica Japonica, 85(1): 11-15.
Emura S, Okumura T, Chen H. 2009. Scanning electron microscopic study of the tongue in the Japanese pygmy woodpecker (Dendrocoposkizuki)[J]. Okajimas Folia Anatomica Japonica, 86: 31-35.
Erdogan S, Alan A. 2012. Gross anatomical and scanning electron microscopic studies of the oropharyngeal cavity in the European magpie (Picapica) and the common raven (Corvuscorax)[J]. Microscopy Research and Technique, 75(3): 379-387.
Farouk SM, Hassan SA. 2015. Tongue of laughing dove (Stigmatopeliasenegalensis): histochemical and ultrastructural characteristics[J]. Journal of Cytology & Histology, 6(6): 1-6.
Hakan S, Serkan E, Mehmet A. 2012. Histomorphological structure of the palate andhistochemical proles of the salivary palatine glands in the Chukar partridge (Alectorischukar, Gray 1830)[J].Acta Zoologica (Stockholm), 94(4): 382-391.
Hanna J, Kinga S, Zbigniew K,etal. 2014. Light microscopy and scanning electron microscopy studies on the reduction of the tongue microstructures in the white stork (Ciconiaciconia, Aves)[J].Acta Zoologica (Stockholm), 96(4): 436-441.
Harrison JG. 1964. Tongue[M]// Thompson AL. A new dictionary of birds. London: Nelson-Hall: 825-827.
Igwebuike UM, Anagor TA. 2013. The morphology of the oropharynx and tongue of the muscovy duck (Cairinamoschata)[J]. Veterinarski Arhiv, 83(6): 685-693.
Iwasaki S. 1992. Fine structure of the dorsal lingual epithelium of the little tern,SternaalbifronsPalas (Aves, Lari)[J]. Journal of Morphology, 212: 13-26.
Jackowiak H, Andrzejewski W, Godynicki S. 2006. Light and scanning electron microscopic study of the tongue in the cormorantPhalacrocoraxcarbo(Phalacrocoracidae, Aves)[J]. Zoological Science, 23(2): 161-167.
Jackowiak H, Godynicki S. 2005. Light and scanning electron microscopic study of the tongue in the white tailed eagle (Haliaeetusalbicilla, Accipitridae, Aves)[J]. Annals of Anatomy, 187(3): 251-259.
Jackowiak H, Ludwig M. 2008. Light and scanning electron microscopic study of the structure of the ostrich (Strutiocamelus) tongue[J]. Zoological Science, 25(2): 188-194.
Kobayashi K, Kumakura M, Yoshimura K,etal. 1998. Fine structure of the tongue and lingual papillae of the penguin[J]. Archives of Histology and Cytology, 61(1): 37-46.Liu L, Naoki K, Sugita S. 2012. Ultrastructural study of the tongue of the Japanese jungle crow[J]. Japanese Journal of Ornithology, 61: 77-83.
Neveen ES, Reda EB. 2015. Morphology of the oropharyngeal cavity of northern pintail (Anasacuta)[J]. Global Veterinaria, 14(4): 459-464.
Pourlis AF. 2014. Morphological features of the tongue in the quail (Coturnixcoturnixjaponica)[J]. Journal of Morphological Science, 31(3): 177-181.
Skieresz-Szewczyk K, Jackowiak H, Ratajczak M. 2014. LM and TEM study of the orthokeratinized and parakeratinized epithelium of the tongue in the domestic duck (Anasplatyrhynchosf.domestica)[J]. Micron, 67: 117-124.
Yang C, Lian T, Wang QX,etal. 2016. Structural characteristics of the relict gull (Larusrelictus) mitochondrial DNA control region and its comparison to other Laridae[J]. Mitochondrial DNA, Part A, DNA Mapping, Sequencing, and Analysis, 27(4): 2487-2491.
Ultrastructural Study of the Tongue ofLarusrelictus
LIU Li1, ZHANG Le1, SUN Yan1, MIAO Chunlin2, ZHANG Gang3, LIU Xiaoguang1*
(1. Faculty of Biological Science and Technology, Baotou Teachers’ College, Baotou, Inner Mongolia Autonomous Region 014030, China; 2. Nanhai Wetland Scenic Area Management Office of Baotou, Baotou, Inner Mongolia Autonomous Region 014040, China; 3. Forestry Bureau of Wushenqi, Ordos, Inner Mongolia Autonomous Region 017300, China)
In this study, the ultrastructure of the tongue ofLarusrelictuswas observed using light and scanning electron microscopy. The tongue ofL.relictuswas triangular in shape, and comprised 3 different parts: the lingual apex, lingual body, and lingual root. The tongue fork had keratinized processes at the lingual apex; the lingual apex had a large number of epithelial cells, and the cell surfaces appear to form a fingerprint. The surface of the lingual body was smooth, and the epithelial cells were elongated with cell surface microridges. The surface of the lingual root had a small number of salivary gland openings. These results indicated that the structure of the tongue ofL.relictuswas adapted to collecting food. Moreover, the papillae on the lingual mucosa were not perfectly developed and had a cone-shaped appearance, with a row-like distribution on the maxillary surface and at the boundary between the body and root, and the papillae ends point toward the intra-oral cavity. Taste buds in the lingual mucosa were also underdeveloped. Obvious differences existed in the characteristics of the oral structure betweenL.relictusand other members of the Laridae family, which may be related to habitat deterioration, changes in food type, or food scarcity.
Larusrelictus; habitat; tongue; ultrastructure
2016-10-12 接受日期:2016-12-12
国家自然科学基金项目(31560598); 内蒙古自治区自然科学基金项目(2015MS0321); 教育部留学回国人员科研启动基金项目(2014-1685); 内蒙古留学回区人员科研启动基金项目(2015-339)
刘利(1978—), 男, 博士, 讲师, 研究方向:动物生态学, E-mail:liuli4304842@126.com
*通信作者Corresponding author, E-mail:lxg63121@163.com
10.11984/j.issn.1000-7083.20160276
Q959.7
A
1000-7083(2017)02-0181-06
