家蚕黑化突变体分子机制研究进展
2017-04-08童晓琪黄德辉
张 彦 秦 凤 石 凉 童晓琪 黄 浩 黄德辉
(安徽省农业科学院蚕桑研究所,安徽合肥 230061)
家蚕黑化突变体分子机制研究进展
张 彦 秦 凤 石 凉 童晓琪 黄 浩 黄德辉
(安徽省农业科学院蚕桑研究所,安徽合肥 230061)
黑化现象在昆虫中时有发生,其分子机制和对昆虫生理特性的影响一直是昆虫学研究的热点。家蚕作为重要的经济昆虫和鳞翅目的模式生物,拥有的20余种黑化突变品种是研究昆虫黑化的重要实验材料。总结了家蚕黑色素合成代谢途径与相关功能基因,综述了家蚕褐头尾斑(bts)突变、第二褐头尾斑(bts2)突变、黑蛹(bp)突变、煤色(so)突变、暗化型(mln)突变、颊尾斑(cts)突变等几种主要家蚕黑化突变品种及产生机制的研究成果,并结合其他昆虫黑化的相关研究成果进行分析比较,对未来家蚕黑化突变的研究发展方向进行了展望。
家蚕;黑化突变;突变机制;基因调控;黑色素代谢
黑化是指某个物种内出现体色较黑或完全黑化的个体,是生物体体色发生变异最为显著的现象,广泛发生于哺乳动物和无脊椎动物中[1-3]。自19世纪英国的EDLESTON首次报道黑化桦尺蠖以来,在全球范围内发现的具有黑化现象的昆虫种类已超过200种[4]。黑化突变的发生不仅使黑化个体体色发生改变,还引起了其求偶、体温调节、免疫等重要生理功能发生改变[5]。鉴于此,黑化昆虫的发生和分类、遗传机制及黑化个体生物学特性变异等方面的研究,一直是研究者关注的焦点。
家蚕(Bombyxmori)是一种重要的经济昆虫,也是研究鳞翅目昆虫的模式生物,经过5 000多年的人类驯化,在自然和诱发突变下积累了非常丰富的遗传突变材料。仅中国各地区发现和保存的家蚕突变体就超过了600种[6],其中黑化突变就有20多种,如幼虫期黑化突变主要有淡墨、墨暗色斑、黑缟(PS)、褐头尾斑(bts)、杲蚕、不洁蚕(Di)等品系,蛹期黑化突变有黑蛹(bp)、浓黑蛹、煤色蛹(so)等品系,蛾期黑化突变有黑蛾(Bm)、从性黑蛾(sml)、黑腹蛾等品系,以及在家蚕全龄期都有黑化表现的突变品系暗化型家蚕(mln)。探索家蚕黑化的遗传机制,重点是研究突变基因,目前通过定位克隆等手段已经鉴定了一些与黑化相关的基因。同时,以家蚕黑化突变体为突破口来解析家蚕的黑色素合成代谢途径及其表达调控机制的研究也越来越受到重视,并取得了突破性进展[7-9]。
虽然关于家蚕黑化突变和调控机制的研究已有许多发现,但仍有不少黑化突变的形成原因没有完全解析清楚,部分已鉴定出的黑化相关基因突变,其机理也有许多不明之处。为此,本文系统阐述了近几年来家蚕黑色素合成代谢途径以及家蚕黑化突变体产生机制的研究成果,比较了几种家蚕黑化突变模式及调控机制的异同,以期为家蚕黑化突变机制的研究及黑色素代谢功能基因的利用提供参考。
1 家蚕黑色素合成代谢途径与相关功能基因
黑色素合成代谢途径一直是科学家研究昆虫进化的热门课题,该途径的异常代谢是多种昆虫发生黑化的主要原因。黑色素的生物合成以酪氨酸为底物,在酪氨酸羟化酶(TH)作用下生成多巴(dopa),多巴再经多巴脱羧酶(DDC)的作用生成多巴胺(dopamine)[10]。目前认为昆虫中多巴胺是合成黑色素的主要前体物质,其在黑色素合成代谢途径上主要有3个去向:一是在N-β-丙酰多巴胺合成酶(NBAD synthase)作用下与β-丙氨酸形成N-β-丙酰多巴胺(NBAD),最后合成黄褐色的色素[11];二是在芳香烷基胺N-乙酰基转移酶(AANATs)的作用下转化为N-乙酰基多巴胺(NADA),NADA继续合成无色或透明的色素[12];三是在一系列酶的催化作用下生成深棕色的多巴胺黑色素。其中,多巴胺与NBAD之间的反应是可逆的,NBAD在酶的水解作用下分解成多巴胺和β-丙氨酸(图1)。
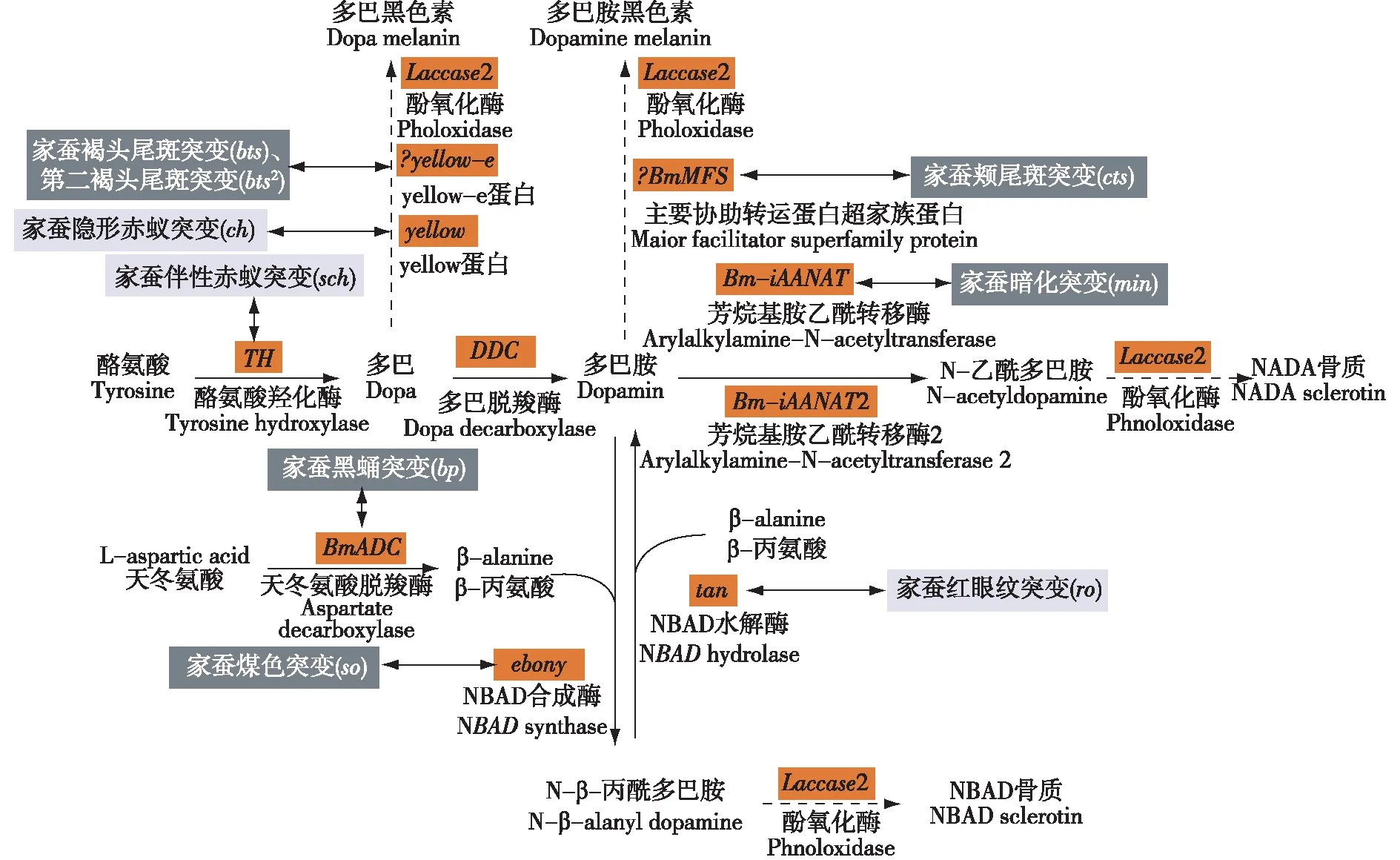
橙色矩形框标示家蚕黑色素合成代谢关键酶编码基因,黑色矩形框标示家蚕黑化突变,灰色矩形框标示家蚕非黑化突变;图中资料源于文献[9][13]。图1 家蚕黑色素合成代谢途径示意图
家蚕科技工作者以各种家蚕黑化突变体为材料,结合基因克隆和定位技术,已经解析了黑色素合成代谢途径上的大部分基因。TH基因位于黑色素合成代谢途径的上游,编码的酪氨酸羟化酶是合成黑色素的限速酶,能催化酪氨酸形成多巴,在昆虫表皮骨化和着色过程中起着重要的作用[14]。家蚕伴性赤蚁突变就是由于转座子插入BmTH序列使其表达量降低导致黑色素合成效率降低而产生的。DDC编码的多巴脱羧酶是一种芳香族L-氨基酸脱羧酶,能使多巴脱羧生成多巴胺[15-16]。目前在家蚕中还没有发现因DDC变异形成的突变,而果蝇中却有多种该基因的等位突变,且果蝇中突变品种大多都有表皮硬化不完全、躯体不着色、活动力低下、记忆减退等表型[17-18]。
yellow基因和NBAD合成酶基因ebony空间上的相互作用和特异表达很大程度上决定了昆虫表皮的着色和斑纹的形成[19]。XIA等[20]在家蚕中共鉴定出了7个编码yellow蛋白的基因,但这7个不同类型的基因影响家蚕表型的分子机制还未得到明确阐明。研究表明yellow基因能促进黑化[21],FUTAHASHI等[7]在研究家蚕体色突变体赤蚁(ch)形成的分子机制时发现,与野生型相比,家蚕ch的yellow基因第4外显子发生了14 bp的缺失,导致翻译移码和提前终止,yellow蛋白功能丢失,从而产生赤蚁的表型。ebony基因编码的NBAD合成酶可以催化多巴胺与β-丙氨酸结合生成NBAD,抑制黑化的发生。果蝇ebony突变体由于该基因功能的缺失,多巴胺不能转为NBAD而大量累积,产生过量的黑色素,使其成虫全身黑化[22]。NBAD水解酶基因Tan的作用过程与ebony相反,其编码的酶能以NBAD为底物生成多巴胺和β-丙氨酸。家蚕红眼纹(ro)突变体就是由BmTan突变导致的[8]。
在黑色素合成代谢通道中,多巴胺的最后一条消耗途径是在AANATs编码的芳烷基乙酰转移酶催化下进行的,代谢产物NADA对表皮的鞣化起着重要的作用[23]。果蝇的AANATs可参与儿茶酚胺代谢,该基因突变后,并不会影响果蝇体色的改变,只是对果蝇的睡眠与苏醒等生理行为造成影响。AANATs是一个基因家族的总称,目前在家蚕中共鉴定出Bm-iAANAT和Bm-iAANAT2等2个AANATs基因,其中Bm-iAANAT与家蚕mln突变有关[9,24]。
2 几种主要家蚕黑化突变品系的研究
2.1 家蚕bts与第二褐头尾斑(bts2)突变体
家蚕bts和bts2突变体表现为幼虫头部和尾板呈深棕褐色,且bts2较bts的颜色更深,这2种突变均由位于家蚕第17染色体上的yellow-e基因变异造成。ITO等[25]研究发现,yellow-e基因包含8个外显子和7个内含子,编码的yellow-e蛋白有完整的王浆主蛋白(MRJP)功能域,yellow-e基因在家蚕的蛹期有很高的表达量,并和yellow基因一起受蜕皮激素的调控,从而影响家蚕幼虫的着色;bts中yellow-e基因第5外显子缺失,并表现出移码、提前终止翻译等现象;bts2中yellow-e基因第6外显子比野生型多出385 bp,但缺失包括第7、8外显子在内的近6 kb的片段。yellow-e基因在家蚕幼虫的头和尾板处表皮的表达量要远高于其他位置表皮的表达量,这也就是bts和bts2突变体中只有头和尾板变成深棕色的原因。在bts突变体中yellow-e蛋白的MRJP功能域只有135个氨基酸序列,比bts2突变体中的MRJP功能域更短,这种差异可能是引起二者着色深浅不同的原因[25]。至于yellow-e蛋白在家蚕中的具体功能,以及正常型家蚕体色为白色而具有不完整yellow-e蛋白结构的突变体家蚕体色却是黑色的原因,尚需要进一步的研究。
2.2 家蚕bp突变体
家蚕bp突变品系的黑化表型只发生在蛹期,相较于普通型家蚕蛹表皮的琥珀色,家蚕bp突变体蛹表皮为黑色并表现出着色深浅程度受温度影响的特点。位于家蚕第11染色体上的天冬氨酸脱羧酶(BmADC)基因变异是引起bp突变的主要原因,BmADC基因包含4个外显子,编码511个氨基酸。DAI等[26]通过序列比对研究发现,bp突变个体中BmADC基因的ORF序列与正常型家蚕相比只有26个碱基不同,编码的氨基酸仅有2个不同,而且通过分析发现这些差异并不会影响BmADC蛋白的功能,断定造成家蚕bp突变的原因是,BmADC基因起始位点上游约2.2 kb处的调控序列插入了493 bp的转座子,进而显著降低了BmADC基因的表达。
BmADC催化天冬氨酸生成的β-丙氨酸,能与多巴胺结合在酶促作用下合成NBAD。BmADC基因调控序列插入转座子片段后,BmADC基因表达水平显著下调,进而影响多巴胺转化为NBAD的效率,使家蚕体内多巴胺过量累积最终导致黑蛹表型产生。在家蚕中存在2条合成β-丙氨酸的途径:一条是由BmADC催化的天冬氨酸脱羧途径;另一条是由二氢嘧啶脱氢酶(DPYD)基因介导的尿嘧啶水解途径。后者在家蚕幼虫期高水平表达,在蛹期低水平表达,而BmADC基因在幼虫期表达水平较低,在蛹期表达水平很高,这就是bp突变体只在蛹期产生黑化表型的原因。此外,由于受到调控区域内的11个热休克因子结合位点的影响,BmADC基因的表达还对温度比较敏感,高温时表达水平高,蛹的颜色就浅一点[26]。
2.3 家蚕so突变体
家蚕so突变个体幼虫期皮肤为污灰色,与正常型家蚕体色区分不明显,蛹期为黑色。so突变由位于家蚕第26染色体末端的ebony基因突变引起。ebony基因包含17个外显子和16个内含子,编码853个氨基酸。so突变体ebony基因缺失了从第14外显子中段到第16内含子前段约4.5 kb的片段,造成第14外显子结构变异并使对应的mRNA形成异常的多聚腺苷酸尾(poly A)位点,进而使编码的蛋白质C-末端出现严重错误,失去作为酶的催化功能[7]。
在昆虫中ebony基因具有减轻黑化的功能,可催化多巴胺与β-丙氨酸结合生成NBAD。β-丙氨酸是参与昆虫表皮鞣化的重要物质,能增加昆虫表皮的韧性,而NBAD是合成黄色和红褐色等鲜亮色素的前体物质[27]。家蚕so突变体因ebony基因功能的缺失,多巴胺不能与β-丙氨酸结合生成NBAD,累积的多巴胺生成过量黑色素,从而使突变体表现出黑化表型,即使在蛹鞘中也检测不到β-丙氨酸[19]。
2.4 家蚕mln突变体
家蚕mln突变体是家蚕体色突变中少见的全龄期都表现黑化的体色突变:幼虫期突变体头部、胸足、肛板等骨化的部位均呈现黑化,蛹后期为灰黑色,成虫期全身明显黑化[28]。家蚕育种工作者利用暗化型家蚕成虫体色灰黑的特点,培育黑白分明的双亲,把家蚕一代杂交种杂交率提高到99%以上[29-30]。家蚕mln突变由位于第18染色体上的Bm-iAANAT基因突变造成,Bm-iAANAT基因包含5个外显子和4个内含子,编码261个氨基酸,具有完整的乙酰基转移酶结构域[31]。在家蚕mln突变体中Bm-iAANAT基因有2种突变类型:突变类型1缺失几乎整个第4外显子,并导致蛋白质翻译移码和提前终止;突变类型2缺失了第4外显子的后67 bp,另外在内含子序列中插入了15 bp的序列。2种突变类型都导致了编码的蛋白质异常,乙酰转移酶结构域均被破坏[23-24]。
Bm-iAANAT基因编码的芳烷基乙酰转移酶可以催化多巴胺生成N-乙酰多巴胺,进而氧化成醌类物质参与昆虫表皮的硬化[32]。由于mln突变体内Bm-iAANAT突变基因编码的蛋白质失去了芳烷基乙酰转移酶的功能,使mln突变体多巴胺过量累积,从而表现出黑化表型。和果蝇中含有2条AANAT基因一样,LONG等[9]在家蚕中也鉴定出了另一条AANAT基因,并将其命名为Bm-iAANAT2,通过基因敲除技术,证实该基因也具有催化多巴胺的功能。这可能是mln突变体在Bm-iAANAT基因失去功能的情况下,表皮仍能鞣化的原因。
2.5 家蚕颊尾斑(cts)突变体
家蚕cts突变体个体幼虫头部两侧和尾脚外侧有黑褐色斑纹。ITO等[33]通过研究发现,位于家蚕第16染色体上的家蚕主要协助转运蛋白基因(BmMFS)突变是形成cts突变的直接原因,该基因包含11个外显子和10个内含子,cDNA序列长度为2 596 bp,并编码508个氨基酸;BmMFS基因在头部和尾板处的表达量很高,蜕皮时其表达量进一步调高;cts突变体内的BmMFS基因缺失了包括第7外显子在内的约6 kb的片段,使其编码的蛋白质只有10个跨膜结构域而比正常的蛋白质少了1个跨膜结构域,运输能力有所减弱从而导致cts突变体表现出黑化表型。
BmMFS蛋白所在的主要协助转运蛋白超家族是一个很大的蛋白家族,具有多种转运功能且转运的底物众多[34]。在印度跳蚁体内与BmMFS高度同源的蛋白具有运输维生素C的能力,而维生素C可以分解O-多巴醌形成多巴进而抑制黑色素的形成[35]。家蚕中BmMFS蛋白是否也具有运输维生素C的能力还不能确定,而且在家蚕中多巴胺形成的黑色素是引起黑化的主要物质。这些问题都表明BmMFS基因突变形成cts突变体的分子机制还需进一步研究。
2.6 其他家蚕黑化突变品种的研究
除了上述几种家蚕黑化突变,其他黑化突变的研究也一直在进行着,并取得了一定的成果。CHIKUSHI[36]利用家蚕Bm突变与家蚕油蚕(ow)突变、bts突变的形态连锁,把Bm突变基因定位到第17染色体0.0 cM处;DOIRA等[37]通过野蚕翅斑(Ws)突变和bts突变的连锁交换,把Ws突变基因定位到第17染色体的14.7 cM处。目前,ITO等[38]通过定位克隆和荧光原位杂交技术把Bm和Ws突变基因精细定位到家蚕第17染色体上位于Bm_scaf33的序列长度分别为2 Mb和100 kb片段内。代方银等[39]采用家蚕连锁群的形态标记和简单序列重复(SSR)分子标记对家蚕sml突变基因(雄蛾体色为灰黑色,而雌蛾为白色)进行连锁分析,发现sml突变基因位于家蚕第17染色体上。刘丽丽等[40]用分子标记和高分辨率熔解曲线(HRM)结合的基因型分析技术对家蚕PS基因进行精细定位,通过转录组高通量测序(RNA-Seq)差异表达基因分析筛查与色素合成相关的基因,将PS基因精细定位于家蚕第2连锁群nscaf2623:97 113~222 422之间,并发现黑缟斑纹形成主要是通过提高酪氨酸向多巴的转化速度来实现黑色素合成量的增加。
3 家蚕黑化突变对家蚕生物特性的影响
目前解析的几种家蚕黑化突变,都引起了突变个体体内黑色素合成代谢途径中各相关基因表达量和代谢中间产物含量的改变,最终使黑色素过量累积表现出黑化表型。而黑色素、合成黑色素过程中各中间产物以及一些代谢相关的基因和酶不仅与昆虫表皮的着色相关,还在昆虫择偶、体温调节及免疫等生物特性方面起着重要作用,如昆虫的先天性免疫中的黑化免疫就是基于黑色素的合成代谢途径形成的[41-42]。黑色素本身是昆虫表皮的重要组成成分,具有抵抗紫外线、吸收热量、适应环境等多种生理功能,在伤口愈合和抵御病原物入侵方面也发挥着重要作用[43-44]。果蝇幼虫被刺伤后,10 min左右就会有大量的黑色素在伤口处聚集并结疤堵住伤口,减少血淋巴的流失和防止伤口感染[45]。黑色素合成的本质是一连串的氧化作用,有多个中间产物,研究发现其中一些由二酚衍生成的醌类物质具有细胞毒性[46-47]。李黎等[48]通过家蚕黑化免疫的研究,发现BmTH、BmADC,BmDDC、Bmyellow等基因在大肠杆菌和枯草杆菌注射攻击家蚕后,表达量均显著调高;抑菌试验发现,多巴和多巴胺都能抑制大肠杆菌的生长,并且多巴和多巴胺抑菌试验的培养基也有明显变黑的现象。
暗化型家蚕突变体因Bm-iAANAT基因功能的缺失,使得多巴胺过量累积,也使得多巴、NBAD的含量显著提高,NADA的含量大幅减少。这些变化不仅改变了家蚕表皮的着色,一定程度上也影响了家蚕表皮和外骨骼的结构和机械性能。通过扫描电镜和机械性能分析,QIAO等[49]研究了mln突变对家蚕成虫背板和翅膀的影响,发现mln突变体的背板因NADA缺乏而出现明显分层现象,mln突变体成虫的翅膀弹性模量显著高于普通型家蚕,而阻尼性模量则明显降低;同时还发现,mln突变体的行为也有一定的改变,特别是蛾期,mln突变体蚕蛾易受惊且在交配方面也比野生型困难,并推测可能与mln颜色更深并且交配器官更硬有关。HE等[50]发现sml中表现出黑化表型的雄蛾拥有更长的寿命,并推测由黑化引起的抗氧化防御系统能力增强和胰岛素代谢效率降低是产生这种现象的原因。
DAI等[26]在研究家蚕bp突变时,发现bp突变体在低温时着色会更深一些,而在高温时着色浅一些,他们认为这种现象是家蚕对环境适应的一种表现,即暗色表皮更容易吸收热量从而适应低温,这也暗示了家蚕黑蛹品种可能具有更强的低温适应性。紫外线照射5龄黑色蚕(pB,幼虫全身为黑色,纯合体致死)不同时间后,调查其正常化蛹率的研究发现,pB突变体外角质层的黑色素物质可以抵御紫外线的辐射,而且血液中黑色素物质具有防止氧化的功能,从而使化蛹率有所提高[43,51]。但这些关于黑化家蚕生物特性的研究还比较分散也不够深入,有待进一步加强。
4 讨论和展望
家蚕丰富而多样的体色突变,是其在长期驯化的过程中经过自然突变和人工选择产生的性状表型多样性结果之一,吸引了大批科学家为解析其形成机制和调控机理而努力。经过不懈的研究,人们在家蚕体色突变的分子机制方面取得了诸多成果。比如MENG等[52]以柠檬蚕(lem)为材料,研究其突变原因和家蚕的蝶啶类色素合成代谢通路,并以此探究帕金森综合症的治疗方法;也有许多以家蚕ow突变体为实验样品来探索家蚕中尿酸的代谢模式和人类风湿类疾病的研究[53]。作为家蚕体色突变中的一大类——黑化突变,目前发现的突变品种就超过了20种。通过对这些突变体的研究,可以为昆虫特别是鳞翅目昆虫的黑色素着色的研究提供重要的参考,也可以为昆虫个体发育和群体进化的研究提供借鉴,甚至可以为人类黑色素相关疾病的研究提供帮助。家蚕中与黑化突变相关的基因ebony和Bm-iAANTA等因为能形成易辨认的表型,已作为转基因标记用于瓢虫、果蝇等昆虫的研究中[13]。YU等[54]通过家蚕与野蚕黑色素合成代谢相关基因之间核酸多样性的比较,分析了长期人工驯化对家蚕核酸多样性的影响,发现TH基因内含子上的一个增强子在驯化过程中的丢失是导致形成当前家蚕表型的原因之一。人体中存在不少与黑色素合成代谢相关的疾病,如雀斑、白化病等,而这些疾病在家蚕中均有对应的突变体。以这些突变体为模型,可以进行疾病相关基因的解析和药物的筛选[13,55]。
虽然关于黑化家蚕的研究已经取得了不小进展,但总体来说我们对于黑化家蚕的认识还很肤浅。家蚕中有不少黑化突变品种的研究仍处于起始阶段,如家蚕PS、Bm、sml等突变,目前均未定位到突变基因,其发生机制、调控模式等问题也需进一步深入研究;还有一些黑化突变家蚕的研究依然处于空白状态,如白带黑翅(wb)、野蚕黑蛾(Wm)、Di等突变品种。这些突变体是研究黑化突变机制和完善家蚕黑色素合成代谢途径的基石,对它们的详细解析还需要做大量而艰苦的工作。
昆虫体色发生黑化后,其生活特性、适应性和抗性方面的改变一直是人们研究的重点。有研究表明黑化突变能提高昆虫机体的免疫功能和适应能力[56],如海灰翅夜蛾的黑化幼虫与其正常型相比,具有明显的抗白僵菌特性[42];东方粘虫黑化幼虫对核型多角体病毒和昆虫病原真菌的抗性分别是其正常型的2倍和5倍[57]。另外,MA等[58]通过对黑化棉铃虫生活周期的调查,发现黑化的棉铃虫存在生活周期长、质量轻、配对率低和产卵数少等问题,并指出这些不良性状的产生可能与机体平衡黑化带来的免疫功能提高有关;DUBOVSKIY等[59]在对黑化大蜡螟的研究中也发现了类似的情况,黑化大蜡螟拥有更厚的角质层,血细胞的数量和免疫相关基因表达量都有所提升,从而增强了对白僵菌的抵抗力;但付出的代价是寿命减少和繁殖力降低。探索黑化突变对昆虫生理特性的影响,能加深对黑化昆虫的认识,为全面解析黑化突变的分子机制提供帮助,也能为更好地开发利用昆虫黑化资源提供参考。然而,相比甜菜夜蛾、粘虫、果蝇等昆虫中黑化突变品种适应度和抗性的研究,黑化家蚕在这方面的研究还少有报道。
家蚕是一种重要的经济昆虫,同时也作为模式昆虫被越来越多地应用于生物学各个方面的研究。对家蚕黑化品种的全面解析和深度研究,能从根本上揭示各种黑化品种的形成原因,完善家蚕的色素代谢模式,为家蚕的育种工作提供参考,并将有力地促进昆虫进化、遗传和种群多样性等学科的进一步发展。
[1] WITTKOPP P J,BELDADE P.Development and evolution of insect pigmentation:genetic mechanisms and the potential consequences of pleiotropy[J].Semin Cell Dev Biol,2009,20(1):65-71.
[2] WITTKOPP P J,CARROLL S B,KOPP A.Evolution in black and white:genetic control of pigment patterns in Drosophila[J].Trends Genet,2003,19(9):495-504.
[3] EIZIRIK E,YUHKI N,JOHNSON W E,et al.Molecular genetics and evolution of melanism in the cat family[J].Curr Biol,2003,13(5):448-453.
[4] COOK L M,SACCHERI I J.The peppered moth and industrial melanism:evolution of a natural selection case study[J].Heredity,2013,110(3):207-212.
[5] BARNES A I,SIVAJOTHY M T. Density-dependent prophylaxis in the mealworm beetleTenebriomolitorL.(Coleoptera:Tenebrionidae):cuticular melanization is an indicator of investment in immunity[J].P Roy Soc Lond B Bio,2000(267):177-182.
[6] 鲁成,代方银,向仲怀.家蚕基因库突变系统的研究[J].中国农业科学,2003,36(8):968-975.
[7] FUTAHASHI R,SATO J,MENG Y,et al.yellowandebonyare the responsible genes for the larval color mutants of the silkwormBombyxmori[J].Genetics,2008,180(4):1 995-2 005.
[8] FUTAHASHI R,BANNO Y,FUJIWARA H.Caterpillar color patterns are determined by a two-phase melanin gene prepatterning process:new evidence from tan and laccase2[J].Evol Dev,2010,12(2):157-167.
[9] LONG Y,LI J,ZHAO T,et al.A new arylalkylamine N-acetyltransferase in silkworm (Bombyxmori) affects integument pigmentation[J].Appl Biochem Biotechnol,2015,175(7):3 447-3 457.
[10]GORMAN M J,AN C,KANOST M R.Characterization of tyrosine hydroxylase fromManducasexta[J].Insect Biochem Mol Biol,2007,37(12):1 327-1 337.
[11]PE’REZ M M,SCHACHTER J,BERNI J,et al. The enzyme NBAD-synthase plays diverse roles during the life cycle ofDrosophilamelanogaster[J].J Insect Physiol,2010,56(1):8-13.
[12]YATSU J,ASANO T.Cuticle laccase of the silkworm,Bombyxmori:Purification,gene identification and presence of its inactive precursor in the cuticle[J].Insect Biochem Mol Biol,2009,39(4):254-262.
[13]彭晨星,吴松原,代方银.家蚕着色模式相关的分子遗传学研究[J].蚕业科学,2016,42(3):373-385.
[14]ARAKANE M J,ARAKANE Y.Tyrosine hydroxylase is required for cuticle sclerotization and pigmentation inTriboliumcastaneum[J].Insect Biochem Mol Biol,2010,40(3):267-273.
[15]HODGETTS R B,O'KEEFE S L.Dopa decarboxylase:a model gene-enzyme system for studying development,behavior,and systematics[J].Annu Rev Entomol,2006(51):259-284.
[16]ARAKANE Y,LOMAKIN J,BEEMAN R W,et al.Molecular and functional analyses of amino acid decarboxylases involved in cuticle tanning inTriboliumcastaneum[J]. J Biol Chem,2009,284(24):16 584-16 594.
[17]WRIGHT T R.Phenotypic analysis of the Dopa decarboxylase gene cluster mutants inDrosophilamelanogaster[J].J Hered,1996,87(3):175-190.
[18]WRIGHT T R,BEWLEY G C,SHERALD A F. The genetics of dopa decarboxylase in Drosophila melanogaster.II.Isolation and characterization of dopa-decarboxylase-deficient mutants and their relationship to the a-methyl-dopa-hypersensitive mutants[J].Genetics,1976,84(2):287-310.
[19]WITTKOPP P J,TRUE J R,CARROLL S B.Reciprocal functions of the Drosophila yellow and ebony proteins in the development and evolution of pigment patterns[J].Development,2002,129(8):1 849-1 858.
[20]XIA A H,ZHOU Q X,YU L L,et al.Identification and analysis of yellow protein family genes in the silkworm,Bombyxmori[J].BMC Genomics,2006,7(1):195.
[21]FUTAHASHI R,FUJIWARA H.Regulation of 20-hydroxyecdysone on the larval pigmentation and the expression of melanin synthesisenzymesandyellowgene of the swallowtail butterfly,Papilioxuthus[J].Insect Biochem Mol Biol,2007,37(8):855-864.
[22]WRIGHT T R.The genetics of biogenic amine metabolism,sclerotization,and melanization inDrosophilamelanogaster[J].Adv Genet,1987(24):127-222.
[23]ZHAN S,GUO Q,LI M,et al.Disruption of an N-acetyltransferase gene in the silkworm reveals a novel role in pigmentation[J].Development,2010,137(23):4 083-4 090.
[24]DAI F Y,QIAO L,TONG X L,et al.Mutations of an arylalkylamine-N-acetyltransferase,Bm-iAANAT,are responsible for silkworm melanism mutant[J]. J Biol Chem,2010,285(25):19 553-19 560.
[25]ITO K,KATSUMA S,YAMAMOTO K,et al.Yellow-e determines the color pattern of larval head and tail spots of the silkwormBombyxmori[J]. J Biol Chem,2010,285(8):5 624-5 629.
[26]DAI F Y, QIAO L, CAO C,et al.Aspartate decarboxylase is required for a normal pupa pigmentation pattern in the silkworm,Bombyxmori[J]. Sci Rep,2015(5):10 885.
[27]TAKAHASHI A,TAKAHASHI K,UEDA R,et al.Natural variation ofebonygene controlling thoracic pigmentation inDrosophilamelanogaster[J].Genetics,2007,177(2):1 233-1 237.
[28]HARUO H.Genetika studo pri melanismo ce morusa silkraupo,Bombyxmori[J].J Insect Biotechnol Sericol,1961,30(5):389-391.
[29]孙家羿,李圣,黄德辉.家蚕暗化型基因(mln)遗传及利用研究[J].安徽农业科学,2006,34(7):1 378-1 379.
[30]黄德辉,李圣,孙家羿.应用家蚕暗化型基因提高杂交率[J].中国蚕业,2003,24(3):97.
[31]TSUGEHARA T,IWAI S,FUJIWARA Y,et al.Cloning and characterization of insect arylalkylamine N-acetyltransferase fromBombyxmori[J].Comp Biochem Physiol B,2007,147(3):358-366.
[32]TSUGEHARA T,IMAI T,TAKEDA M.Characterization of arylalkylamine N-acetyltransferase from silkmoth (Antheraeapernyi) and pesticidal drug design based on the baculovirus-expressed enzyme[J].Comp Biochem Physiol,2013,157(1):93-102.
[33]ITO K,KIDOKORO K,KATSUMA S,et al.Positional cloning of a gene responsible for the cts mutation of the silkworm,Bombyxmori[J].Genome,2012,55(7):493-504.
[34]REDDY V S,SHLYKOV M A,CASTILLO R,et al.The major facilitator superfamily (MFS) revisited[J].J Mol Microbiol Biotechnol,1999,1(2):2 022-2 035.
[35]SOLANO F,BRIGANTI S,PICARDO M,et al.Hypopigmenting agents:an updated review on biological,chemical and clinical aspects[J]. Pigment Cell Res, 2006,19(6):550-571.
[36]CHIKUSHI H.A new linkage group of the silkworm,Bombyxmori[J].J Seric Sci Jpn,1960(29):278.
[37]DIORA K,MASUDA S.Linkage analysis of the ‘Wild wing spot’gene in the silkworm[J].Proc Sericult Sci Kyushu,1981(12):64-72.
[38]ITO K,KATSUMA S,KUWAZAKI S,et al.Mapping and recombination analysis of two moth colour mutations,black moth and wild wing spot,in the silkwormBombyxmori[J].Heredity,2016,116(1):52-59.
[39]代方银,胡海,何松真,等.结合形态标记和分子标记对家蚕从性黑蛾(sml) 的连锁分析[J].蚕业科学,2013,39(3):442-447.
[40]刘丽丽,刘晓晓,余俊杰,等.家蚕黑缟基因(PS)的精细定位及色素合成相关基因分析[J].蚕业科学,2014,40(5):811-817.
[41]KRAMS I,BURGHARDT G M,KRAMS R,et al.A dark cuticle allows higher investment in immunity,longevity and fecundity in a beetle upon a simulated parasite attack[J].Oecologia,2016(1):1-11.
[42]WILSON K,COTTER S C,REESON A F,et al.Melanism and disease resistance in insects[J]. Ecol Lett,2001,4(6):637-649.
[43]HU Y G,SHEN Y H,ZHANG Z,et al.Melanin and urate act to prevent ultraviolet damage in the integument of the silkworm,Bombyxmori[J]. Arch Insect Biochem Physiol, 2013,83(1):41-55.
[44]GALKO M J,KRASNOW M A.Cellular and genetic analysis of wound healing in Drosophila larvae[J].PLoS Biology,2004,2(8):e239.
[45]TANG H.Regulation and function of the melanization reaction in Drosophila[J].Fly,2009,3(1):105-111.
[46]FUJITA K,ITO S,INOUE S,et al.Selective toxicity of 5-S-cysteinyldopa,a melanin precursor,to tumor cells in vitro and in vivo[J].Cancer Res,1980,40(7):2 543-2 546.
[47]GRAHAM D G,TIFFANY S M,VOGEL F S.The toxicity of melanin precursors[J].J Invest Dermatol,1978,70(2):113-116.
[48]李黎,陈萍.家蚕黑化免疫初探[D].重庆:西南大学,2013.
[49]QIAO L,LI Y H,XIONG G,et al.Effects of altered catecholamine metabolism on pigmentation and physical properties of sclerotized regions in the silkworm melanism mutant[J].PLoS ONE,2012,7(8):175-198.
[50]HE S Z,TONG X L,LU K P, et al.Comparative analysis of transcriptomes amongBombyxmoristrains and sexes reveals the genes regulating melanic morph and the related phenotypes[J].PLOS ONE,2016,11(5):e0155061.
[51]苏陶俊枫,夏川林,李艳君,等.家蚕表皮斑纹黑色素形成过程的解剖学观察[J].蚕业科学,2014,40(3):445-451.
[52]HU Y G,SHEN Y H,ZHANG Z,et al.Melanin and urate act to prevent ultraviolet damage in the integument of the silkworm,Bombyxmori[J]. Arch Insect Biochem Physiol,2013,83(1):41-55.
[53]MENG Y,KATSUMA S S,TAKAAKI D,et al. The silkworm mutant lemon (lemon lethal) is a potential insect model for human sepiapterin reductase deficiency [J]. J Biol Chem,2009,284(17):11 698-11 705.
[54]YU H S,SHEN Y H,YUAN G X,et al.Evidence of selection at melanin synthesis pathway loci during silkwormdomestication[J]. Mol Biol Evol, 2011,28(6):1 785-1 799.
[55]TSUGURU F J,HIROAKI A,MUNETAKA K,et al.Albino (al) is a tetrahydrobiopterin (BH4)-de cient mutant of the silkwormBombyxmori[J]. Insect Biochem Mol Biol, 2013,43(7):594-600.
[56]WITTKOPP P J,BELDADE P.Development and evolution of insect pigmentation:Genetic mechanisms and the potential consequences of pleiotropy[J].Semin Cell Dev Biol,2009(20):65-71.
[57]KUNIMI Y,YAMADA E. Relationship of larval phase and susceptibility of the armyworm,PseudaletiaseparataWalker(Lepidoptera,Noctuidae) to a nuclear polyhedrosis-virus and a granulosis-virus [J].Appl Entomol Zool,1990,25(2):289-297.
[58]MA W H,CHEN L,WANG M O,et al. Trade-offs between melanisation and life-history traits inHelicoverpaarmigera[J]. Ecol Entomol,2008,33(1):37-44.
[59]DUBOVSKIY I M,WHITTEN M M A,KRYUKOV V Y,et al. More than a colour change:Insect melanism,disease resistance and fecundity[J].Proc Biol Sci,2013(280):584-592.
10.16839 /j.cnki.zgcy.2017.01.014
2016-12-13;接受日期:2016-12-30
安徽省农业科学院院长青年创新基金项目(编号 15B0629);现代农业产业技术体系建设专项(编号 CARS-22);安徽省现代农业产业技术体系[编号 皖农科(2016)84号];安徽省农业科学院科技创新团队项目(编号 12C0602);安徽省农业科学院院长青年创新基金项目(编号 16B0611)。
信息:张彦(1987—),男,安徽阜阳,硕士,研究实习员。 Tel:0551-62826576,E-mail:526535833@qq.com
S881.2
B
1007-0982(2017)01-0058-08
ISSN 1007-0982; CN 32-1421 /S
