混剂中毒死蜱在水稻及稻田中的残留消解动态研究
2017-04-06王红军
王红军,陈 妍
(商丘职业技术学院,河南 商丘 476000)
混剂中毒死蜱在水稻及稻田中的残留消解动态研究
王红军,陈 妍
(商丘职业技术学院,河南 商丘 476000)
为探讨25%异丙威·毒死蜱乳油中毒死蜱在水稻及稻田中的残留消解动态,采用气相色谱-氮磷检测器(GC-NPD)法对水稻及稻田中的毒死蜱残留量进行测定,旨在为该药在水稻上的合理使用提供科学依据。结果表明:毒死蜱在稻田水、土壤和植株中的残留消解动态规律均符合一级动力学方程,消解半衰期分别为1.45~3.48 d、3.16~6.36 d和2.05~2.98 d。毒死蜱在稻田土壤、糙米、谷壳和植株中的最终残留量随施药剂量、次数的增加而增加,随采样时间延长而降低。按推荐剂量1 800 g/hm2和1.5倍推荐剂量2 700 g/hm2各施25%异丙威·毒死蜱乳油3~4次,距末次施药33 d,土壤中毒死蜱的最大残留量分别为0.044 7 mg/kg和0.081 2 mg/kg,植株中毒死蜱的最大残留量分别为0.047 9 mg/kg和0.063 2 mg/kg,收获的糙米中毒死蜱的最大残留量分别为0.045 4 mg/kg和0.076 5 mg/kg,谷壳中毒死蜱的最大残留量分别为0.084 3 mg/kg和0.093 6 mg/kg,均低于我国规定的毒死蜱在稻谷中的最大残留限量(0.5 mg/kg),此时收获的稻谷食用安全。
毒死蜱; 水稻; 稻田; 残留消解动态
二化螟是我国水稻上危害最为严重的常发性虫害之一,会造成水稻枯梢、枯心苗,严重时致使水稻减产30%以上。毒死蜱是一种高效、广谱的有机磷类杀虫剂,不仅广泛用于水稻螟虫、飞虱等害虫的防治,还用于防治家庭卫生害虫[1]。然而,研究发现,毒死蜱对人体健康和生态环境具有潜在危害[2-3],且毒死蜱在不同地域、不同介质中的降解动态受多种因素的影响[4]。因此,研究毒死蜱在作物及土壤中的残留情况至关重要。目前,国内对毒死蜱单剂在水果、蔬菜和植物中的残留研究已有一些报道[5-8],混剂中毒死蜱在水、土壤、蔬菜、水果中的残留研究也有一些报道[9-11],但对混剂中毒死蜱在水稻中的残留和消解研究较少[12]。为此,研究了贵阳、长沙、天津三地25%异丙威·毒死蜱乳油中毒死蜱在水稻及稻田中的消解动态,旨在为该药在水稻上的合理使用提供科学依据。
1 材料和方法
1.1 供试材料
药品与试剂:25%异丙威·毒死蜱乳油(含异丙威10%、毒死蜱15%),由海南正业中农高科股份有限公司提供。毒死蜱标准品(纯度98.5%),购自Dr.Ehrenstorfer GmbH公司。其他药品均为分析纯等。
仪器与设备:Agilent 6890N气相色谱仪(配NPD)、19091J-413 HP-5色谱柱(30.0 m×320 μm×0.25 μm)、AKJY-10型艾柯超纯水机购自成都唐氏康宁科技发展有限公司;QL-901涡旋混合器,购自海门市其林贝尔仪器制造有限公司;BUCHI R-210型旋转蒸发仪购自瑞士BUCHI公司;DC-12型氮吹仪购自上海安谱科学仪器有限公司。
供试水稻品种为黔优942。
1.2 试验设计
参照《农药残留试验准则》(NY/T 788—2004)[13],分别在贵州省贵阳市花溪区养牛村、湖南省长沙市宁乡县龙田村、天津市宁河区小李乡三地开展25%异丙威·毒死蜱乳油中毒死蜱在水稻及稻田中的残留消解动态和最终残留量试验。
1.2.1 毒死蜱在植株中的残留消解动态试验 选择未施用过异丙威和毒死蜱的水稻种植田,设3个重复小区,小区面积为5 m×6 m,小区间设保护行,同时设置空白对照区。于水稻分蘖中后期,在稻田中施用1次25%异丙威·毒死蜱乳油,施药剂量为推荐剂量的1.5倍即2 700 g/hm2(制剂量,下同),空白对照区不施药。分别于施药后1/24、1、3、5、7、10、14、21、30、45、60 d,在每个小区内随机选10点取植株(水上部分全株)约1 kg,于-20 ℃保存。
1.2.2 毒死蜱在稻田水和土壤中的残留消解动态试验 选择未施用过异丙威和毒死蜱的水稻种植田(不插秧),设3个重复小区,小区面积为5 m×6 m,小区间设保护行,同时设置空白对照区。于水稻分蘖中后期,在稻田中施用1次25%异丙威·毒死蜱乳油,施药剂量为2倍推荐剂量即3 600 g/hm2,空白对照区不施药。分别于施药后1/24、1、3、5、7、10、14、21、30、45、60 d,在每个小区内随机选10点取稻田水约2 L,随机选10点取0~10 cm的表层土约2 kg,样品于-20 ℃保存。
1.2.3 毒死蜱的最终残留量试验 选择未施用过异丙威和毒死蜱的水稻种植田,于水稻分蘖中后期,在稻田中施用25%异丙威·毒死蜱乳油,分别按照推荐剂量1 800 g/hm2和1.5倍推荐剂量2 700 g/hm2对水喷雾施药3~4次,施药间隔期为11 d,每个处理重复3次,小区面积为5 m×6 m,小区间设立保护行,同时设置空白对照区(不施药),分别于末次施药后11、22、33 d,在每个小区内随机选10点取植株(地上部分全株)若干(保证晒干后能获得稻谷2 kg以上),随机选10点取0~15 cm的表层土约1 kg左右,样品于-20 ℃保存。
1.3 毒死蜱的提取、测定方法
1.3.1 毒死蜱样品的提取和净化
1.3.1.1 水 准确量取过滤后的水样40 mL于250 mL分液漏斗中,加入5 mL饱和氯化钠水溶液,依次用30、30、20 mL二氯甲烷萃取,合并二氯甲烷经无水硫酸钠干燥后,用旋转蒸发仪于45 ℃下减压浓缩至近干,用甲醇定容至2 mL,然后采用气相色谱-氮磷检测器(GC-NPD)法测定。
1.3.1.2 土壤 称取土壤样品10.0 g于150 mL锥形瓶中,加入50 mL丙酮于25 ℃下恒温振荡提取1 h,在铺有Celite545的砂芯漏斗中抽滤,用15 mL丙酮分3次洗瓶,合并滤液待净化。
在250 mL分液漏斗中加入30 mL饱和氯化钠水溶液,将上述滤液转移至分液漏斗中,先后用50、30、20 mL二氯甲烷萃取,合并二氯甲烷经无水硫酸钠干燥后,用旋转蒸发仪于45 ℃下减压浓缩至近干,用甲醇定容至2 mL,然后采用GC-NPD法测定。
1.3.1.3 糙米、谷壳 分别称取糙米10.0 g、谷壳5.0 g置于150 mL锥形瓶中,加入50 mL乙酸乙酯,于25 ℃下恒温振荡提取1 h,在铺有Celite545的砂芯漏斗中抽滤,用20 mL乙酸乙酯洗涤残渣,合并滤液至100 mL梨形瓶中,用旋转蒸发仪于45 ℃下减压浓缩至近干,待净化。
在250 mL分液漏斗中加入50 mL二次纯水和3 g氯化钠,摇匀。然后二氯甲烷涡旋洗涤上述梨形瓶,先后用50、30、20 mL的二氯甲烷萃取,合并二氯甲烷经无水硫酸钠干燥后,用旋转蒸发仪于45 ℃下减压浓缩至近干,氮气吹干,用甲醇定容至2 mL,然后采用GC-NPD法测定。
1.3.1.4 植株 称取植株样品10.0 g于250 mL锥形瓶中,加入100 mL丙酮-水(体积比70∶30)的混合提取剂,于25 ℃下恒温振荡提取1 h,在铺有Celite545的砂芯漏斗中抽滤,用30 mL提取剂洗涤残渣,合并滤液至150 mL梨形瓶中,用旋转蒸发仪于45 ℃下减压浓缩,去除丙酮,转入250 mL分液漏斗中。加入20 mL饱和氯化钠水溶液,先后用50、30、20 mL二氯甲烷萃取,合并二氯甲烷经无水硫酸钠干燥后,用旋转蒸发仪于45 ℃下减压浓缩至近干,氮气吹干,用甲醇定容至2 mL,然后采用GC-NPD法测定。
1.3.2 毒死蜱气相色谱检测条件 色谱柱:19091J-413 HP-5(30.0 m×320 μm×0.25 μm);进样口温度:280 ℃;检测器温度:300 ℃;升温程序:120 ℃保持2 min,以15 ℃/min升至280 ℃,保持4 min;载气:氮气;空气流速:60 mL/min,氢气流速:2.0 mL/min;进样量2.0 μL;不分流进样。在上述色谱条件下,毒死蜱的相对保留时间为8.87 min;采用外标法定量。
1.3.3 毒死蜱标准曲线的绘制 称取一定量的毒死蜱标准品,用甲醇溶解定容并逐级稀释成所需质量浓度的标准溶液(0.01、0.05、0.1、0.5、1.0、2.0 mg/L),按照1.3.2仪器条件进行测定,以峰面积(y)为纵坐标、质量浓度(x)为横坐标绘制标准曲线。
1.3.4 毒死蜱添加回收率试验 用未施用过毒死蜱的稻田水、土壤、糙米、谷壳、植株空白样品进行3个水平(分别为0.025、0.050、0.100 mg/kg,0.01、0.10、0.40 mg/kg,0.01、0.10、0.20 mg/kg,0.01、0.10、0.40 mg/kg,0.01、0.10、0.20 mg/kg)的添加回收试验,每一添加水平做5个平行,按照1.3.1毒死蜱样品的提取、净化方法进行处理,另设空白对照,按照1.3.2毒死蜱气相色谱检测条件测定毒死蜱在稻田水、土壤、糙米、谷壳和植株中的添加回收率。
2 结果与分析
2.1 毒死蜱标准曲线的绘制
由图1可知,以峰面积(y)为纵坐标、质量浓度(x)为横坐标绘制的标准曲线回归方程为y=1 793x+7.156 4,R2=0.999 9,呈良好的线性关系,能够满足外标法定量检测毒死蜱残留量的要求。
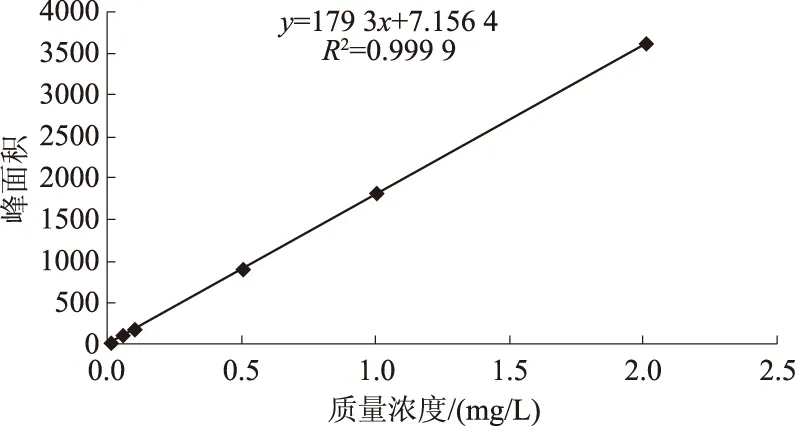
图1 毒死蜱标准曲线
2.2 GC-NPD法测定毒死蜱的灵敏度、准确度及精密度
采用GC-NPD法对毒死蜱的最小检出量为3.6×10-11g;在稻田水、土壤、糙米、谷壳和植株中毒死蜱的最低检测限分别为0.025、0.01、0.01、0.01、0.01 mg/kg。
稻田水、土壤、糙米、谷壳和植株中毒死蜱的添加回收率结果见表1。由表1可知,当毒死蜱的添加水平分别为0.025、0.050、0.100 mg/kg时,稻田水空白添加平均回收率为96.7%~99.9%,RSD为1.8%~4.0%。当毒死蜱的添加水平为0.01、0.10、0.40 mg/kg时,土壤空白添加平均回收率为97.6%~99.6%,RSD为2.4%~4.2%;谷壳空白添加平均回收率为95.8%~100.7%,RSD为1.8%~3.5%。当毒死蜱的添加水平分别为0.01、0.10、0.20 mg/kg时,糙米空白添加平均回收率为94.3%~94.9%,RSD为2.8%~4.0%;植株空白添加平均回收率为96.5%~99.8%,RSD为3.4%~4.8%。该方法的灵敏度、 准确度和精密度均符合国家农业行业标准《农药残留试验准则》(NY/T 788—2004)[13]的要求,能够用于实际样本的残留量检测分析。
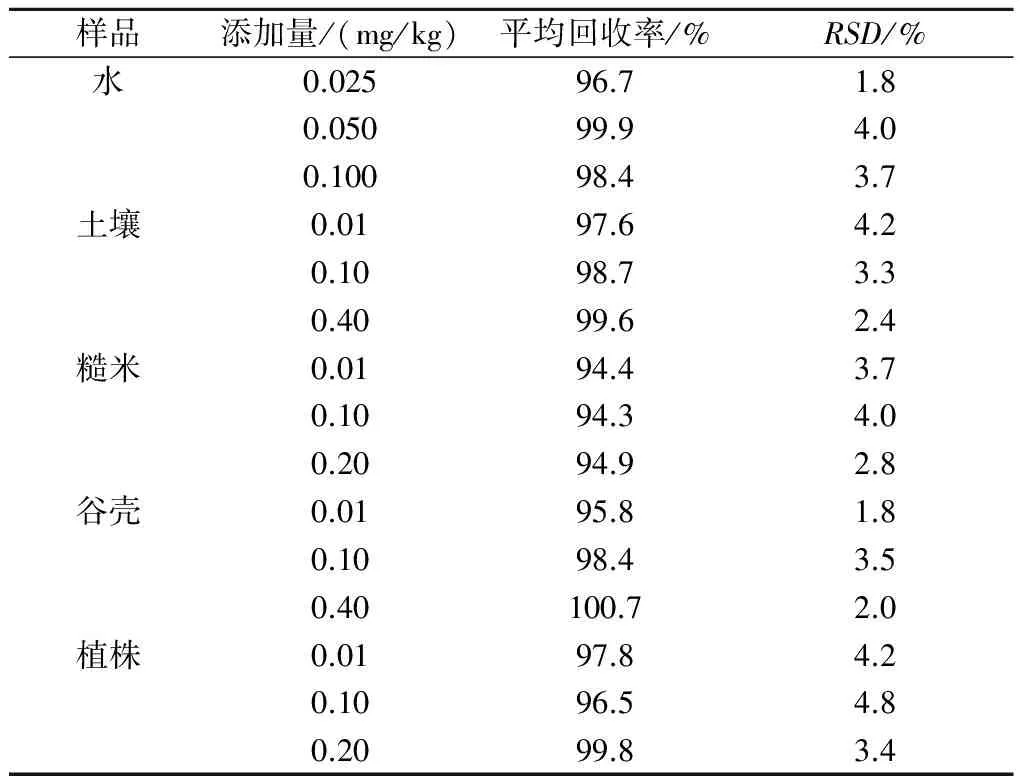
表1 稻田水、土壤、糙米、谷壳及植株中毒死蜱的添加回收率
2.3 毒死蜱在稻田水、土壤和植株中的残留消解动态
从表2可以看出,2013年,在贵阳、长沙、天津三地,施药1 h后稻田水中毒死蜱的残留量分别为0.168 6、0.187 6、0.498 6 mg/kg,施药28 d后三地稻田水中均未检测出毒死蜱,其消解动力学方程分别为C=0.182 8e-0.199 2t、C=0.187 9e-0.205 6t、C=0.323 4e-0.368 6t,R2分别为0.969 3、0.941 9、0.969 4,消解半衰期分别为3.48、3.37、1.88 d;施药1 h后稻田土壤中毒死蜱的残留量分别为0.683 2、0.133 1、0.021 4 mg/kg,施药28 d后三地稻田土壤中均未检测出毒死蜱,其消解动力学方程分别为C=0.257 4e-0.170 2t、C=0.219 2e-0.108 7t、C=0.134 7e-0.172 3t,R2分别为0.836 3、0.829 6、0.903 8,消解半衰期分别为4.07、6.36、4.02 d;施药1 h后水稻植株中毒死蜱的残留量分别为3.259 8、2.973 2、3.192 4 mg/kg,施药28 d后三地水稻植株中均未检测出毒死蜱,其消解动力学方程分别为C=3.933 7e-0.299 7t、C=2.215e-0.275 2t、C=1.322 9e-0.236 8t,R2分别为0.972 8、0.950 2、0.859 0,消解半衰期分别为2.31、2.52、2.93 d。
2014年,在贵阳、长沙、天津三地,施药1 h后稻田水中毒死蜱的残留量分别为0.068 6、0.089 7、0.326 2 mg/kg,施药14 d后三地稻田水中均未检测出毒死蜱,其消解动力学方程分别为C=0.138 1e-0.376 3t、C=0.183 4e-0.409 4t、C=0.254 8e-0.478 3t,R2分别为0.897 9、0.924 9、0.961 6,消解半衰期分别为1.84、1.69、1.45 d;施药1 h后稻田土壤中毒死蜱的残留量分别为0.593 2、0.879 3、0.504 4 mg/kg,施药45 d后三地稻田土壤中均未检测出毒死蜱,其消解动力学方程分别为C=0.780 4e-0.219 3t、C=0.697 4e-0.127 5t、C=0.223 9e-0.146 5t,R2分别为0.878 4、0.877 4、0.796 7,消解半衰期分别为3.16、5.44、4.73 d;施药1 h后水稻植株中毒死蜱的残留量分别为3.167 7、5.720 8、1.789 6 mg/kg,施药28 d后三地水稻植株中均未检测出毒死蜱,其消解动力学方程分别为C=2.083 6e-0.232 6t、C=4.968 3e-0.235 3t、C=2.140 4e-0.338 7t,R2分别为0.937 2、0.969 4、0.969 4,消解半衰期分别为2.98、2.95、2.05 d。
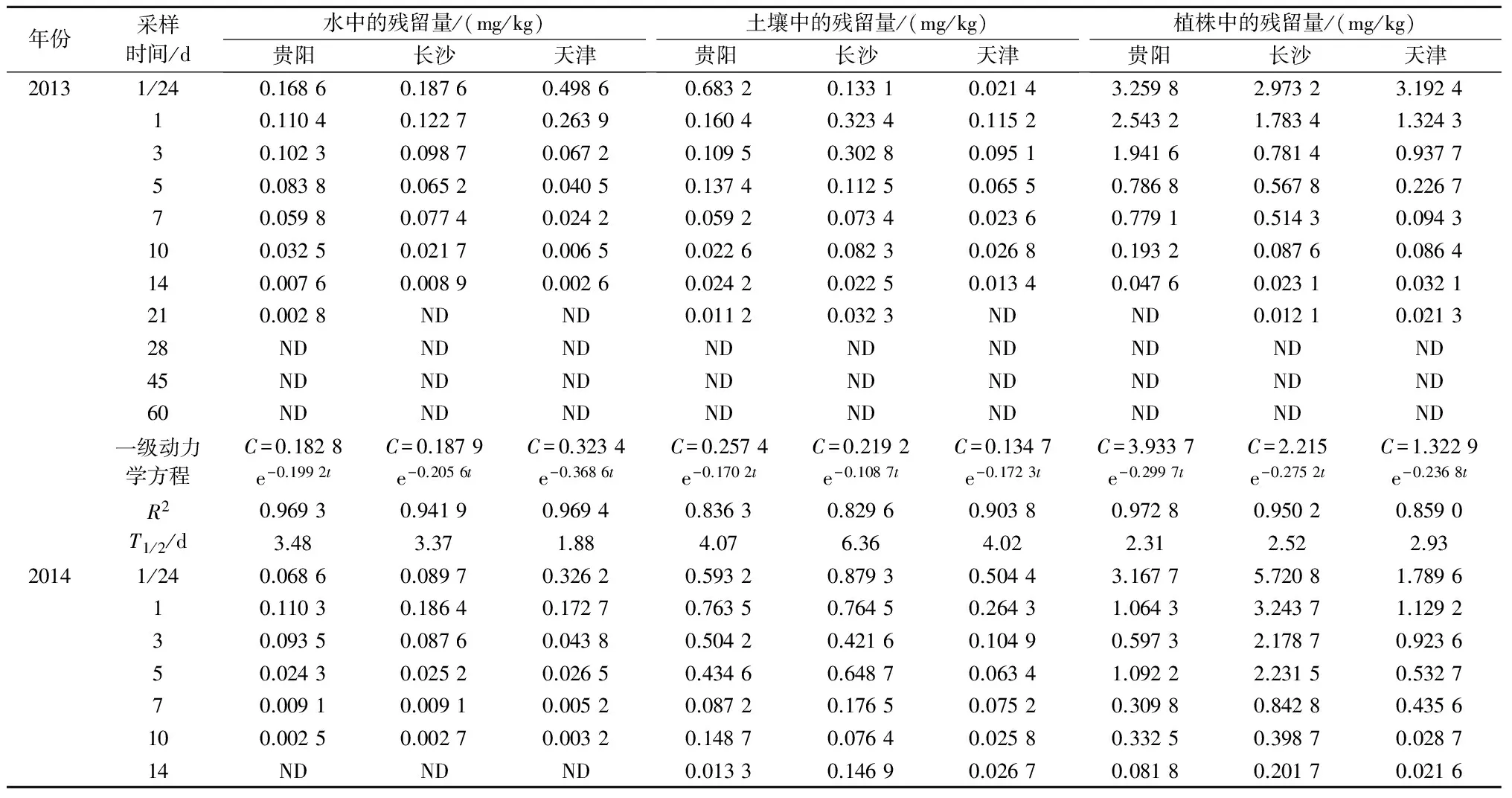
表2 毒死蜱在各地稻田水、土壤和植株中的残留消解动态

续表2 毒死蜱在各地稻田水、土壤和植株中的残留消解动态
注:C是残留量,t是采样时间,T1/2是消解半衰期;ND表示未检出(即样品中毒死蜱残留量低于方法最低检出浓度),下同。
2.4 毒死蜱在稻田土壤、糙米、谷壳和植株中的最终残留量
由表3可知,2013—2014年,在贵阳、长沙和天津三地,稻田土壤、糙米、谷壳和植株中毒死蜱的最终残留量随施药剂量、次数的增加而增加,随采样时间延长而降低。按推荐剂量1 800 g/hm2和1.5倍推荐剂量2 700 g/hm2将25%异丙威·毒死蜱乳油对水喷雾施药3~4次,末次施药后11 d采收的稻田土壤、糙米、谷壳、植株中毒死蜱的最高残留量分别为0.410 2、0.123 2、0.191 4、0.427 2 mg/kg;末次施药后22 d采收的稻田土壤、糙米、谷壳、植株中毒死蜱的最高残留量分别为0.185 9、0.076 5、0.148 3、0.133 1 mg/kg;末次施药后33 d采收的稻田土壤、 糙米、谷壳、植株中毒死蜱的最高残留量分别为0.081 2、0.032 6、0.093 6、0.063 2 mg/kg。其中,按推荐剂量1 800 g/hm2对水喷雾施药3、4次,末次施药后22 d和33 d采收的糙米中毒死蜱的最高残留量分别为0.040 1、0.045 4 mg/kg;按1.5倍推荐剂量2 700 g/hm2对水喷雾施药3、4次,末次施药后22 d和33 d采收的糙米中毒死蜱的最高残留量分别为0.056 4、0.076 5 mg/kg,均低于我国规定的毒死蜱在稻谷中的最大残留限量(0.5 mg/kg)[14]。

表3 毒死蜱在各地稻田土壤、糙米、谷壳和植株中的最终残留量
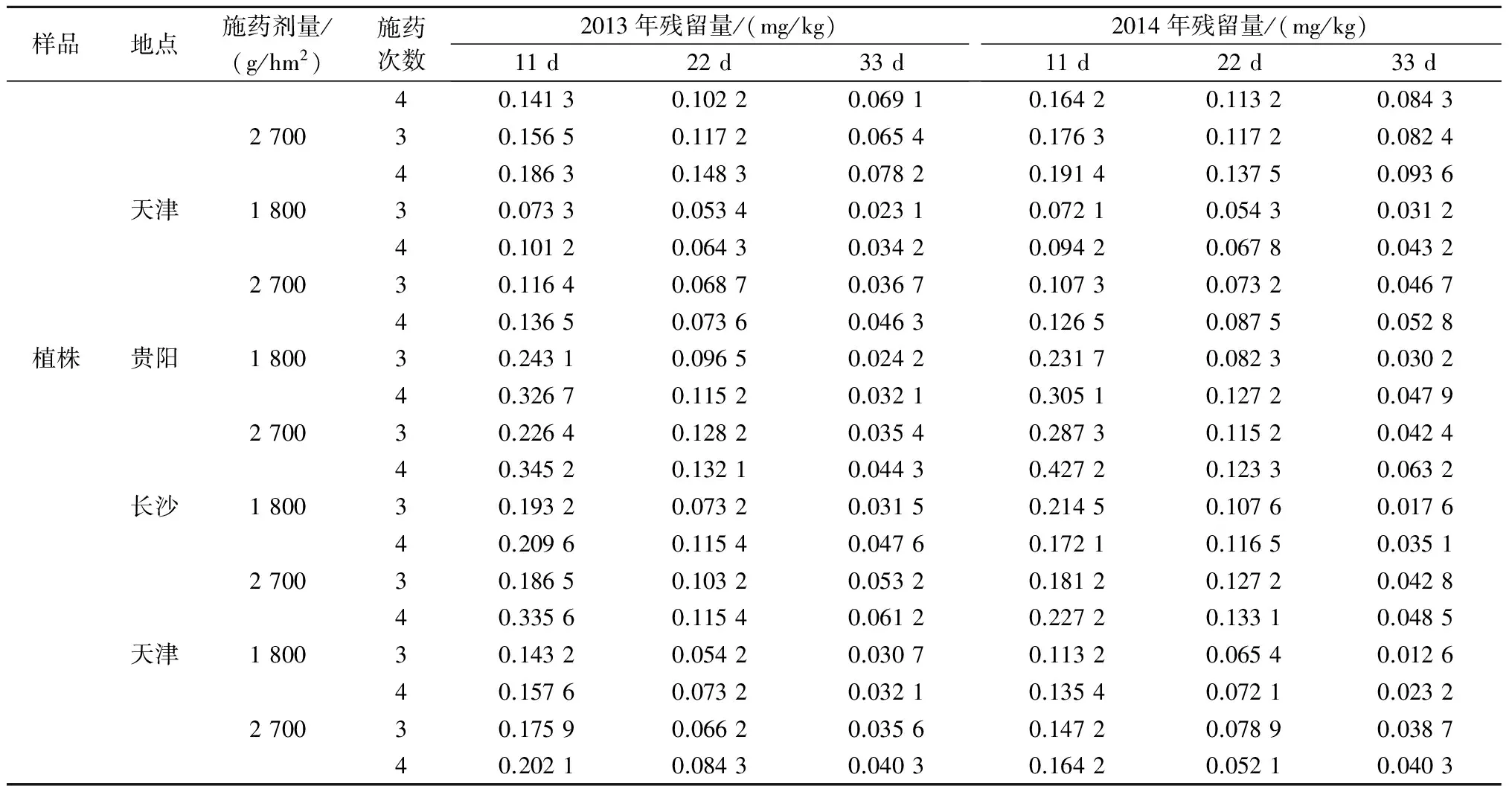
续表3 毒死蜱在各地稻田土壤、糙米、谷壳和植株中的最终残留量
3 结论与讨论
本研究结果表明,GC-NPD对毒死蜱的最小检出量为3.6×10-11g,在稻田水、土壤、糙米、谷壳、植株中毒死蜱的最低检测限分别为0.025、0.01、0.01、0.01、0.01 mg/kg,在稻田水、土壤、糙米、谷壳及水稻植株中毒死蜱的空白添加回收率为94.3%~100.7%,RSD为1.8%~4.8%。由此可见,本研究采用的毒死蜱的提取、测定方法能满足毒死蜱在土壤和稻米上的残留分析要求。
2013—2014年,贵阳、长沙、天津三地稻田水、土壤和植株中毒死蜱的消解半衰期分别为1.45~3.48 d、3.16~6.36 d和2.05~2.98 d,说明混剂中的毒死蜱在稻田水、土壤和植株中均消解较快,属于易降解农药(T1/2<30 d),这与柳王荣等[12]、李界秋等[15]研究结果一致。
我国规定毒死蜱在糙米中的最大残留限量为0.5 mg/kg[14]。本研究结果显示,按推荐剂量1 800 g/hm2将25%异丙威·毒死蜱乳油对水喷雾施药3~4次,末次施药后22 d和33 d采收的糙米中毒死蜱的最高残留量分别为0.040 1、0.045 4 mg/kg;按1.5倍推荐剂量2 700 g/hm2对水喷雾施药3~4次,末次施药后22 d和33 d采收的糙米中毒死蜱的最高残留量分别为0.056 4、0.076 5 mg/kg,均低于我国规定的毒死蜱在糙米中最大残留限量值。因此,采用25%毒死蜱·异丙威防治水稻二化螟时,建议用药量1 800~2 700 g/hm2,施药3~4次,安全间隔期为11 d,此时糙米中毒死蜱的残留量符合国家限量标准的要求,其在水稻上使用安全。
本研究系统地解释了混剂中毒死蜱在稻田环境中的残留动态,但是未涉及到农药剂型、施药环境等对毒死蜱残留行为的影响。因此,今后的研究工作中应将不同配比、不同剂型的药剂在不同环境中的残留行为进行对比研究,以便更为准确地掌握复配后毒死蜱在环境中的残留行为。
[1] 刘腾飞,邓金花,周峰杰,等.毒死蜱在土壤中的降解及分析研究进展[J].中国农学通报,2014,30(9):26-34.
[2] Alavanja M C R,Dosemeci M,Samanic C,etal.Pesticides and lung cancer risk in the agricultural health study cohort[J].American Journal of Epidemiology,2004,160(9):876-885.
[3] Dutta M,Sardar D,Pal R,etal.Effect of chlorpyrifos on microbial biomass and activities in tropical clay loam soil[J].Environ Monit Assess,2010,160(1):385-391.
[4] 孙宝利,曾希柏.毒死蜱有毒代谢物3,5,6-TCP在土壤中的吸附-解吸研究[J].农业环境科学学报,2011,30(6):1114-1120.
[5] 蔡恩兴.毒死蜱在香蕉、土壤中的残留动态及安全性评价[J].安全与环境学报,2015,15(4):349-352.
[6] 万宗君,陈振德,栾霞,等.韭菜和土壤中毒死蜱的残留与降解动态[J].应用生态学报,2012,23(2):525-530.
[7] 郑骏遥,沈兰兰,王蒙岑,等.毒死蜱在桑叶和土壤中的消解动态及养蚕安全间隔期[J].农药,2016,55(1):48-50.
[8] 崔旭,赵静,吴加伦,等.48%毒死蜱乳油在杭白菊和土壤中的消解动态[J].农药学学报,2014,16(2):159-164.
[9] 张超,杨红.水、土壤和蔬菜中毒死蜱、甲基毒死蜱残留检测前处理方法[J].农药,2010,49(5):367-370.
[10] 袁玉伟,司朝光,林恒,等.毒死蜱、氰戊菊酯和高效氯氰菊酯在甘蓝中的残留动态研究[J].农业环境科学学报,2008,27(3):1199-1202.
[11] 赵文婷,杨中华,魏朝俊,等.分散液相微萃取测定苹果中灭线磷、马拉硫磷和毒死蜱残留[J].农业环境科学学报,2010,29(9):1840-1844.
[12] 柳王荣,杨仁斌,傅强,等.甲维·毒死蜱40%水乳剂在水稻和稻田中的残留动态研究[J].中国农学通报,2011,27(30):214-221.
[13] 中华人民共和国农业部.农药残留试验准则:NY/T 788—2004[S].北京:中国农业出版社,2004.
[14] 中华人民共和国国家卫生和计划生育委员会,中华人民共和国农业部.食品安全国家标准 食品中农药最大残留限量:GB 2763—2014[S].北京:中国标准出版社,2014.
[15] 李界秋,黎晓峰,沈方科,等.毒死蜱在土壤中的环境行为研究[J].中国农学通报,2007,23(1):168-171.
Residue and Degradation Dynamics of Chlorpyrifos in Mixed Agent in Rice and Paddy Field
WANG Hongjun,CHEN Yan
(Shangqiu Polytechnic,Shangqiu 476000,China)
In order to discuss the residue and degradation dynamics of 25% isoprocarb and chlorpyrifos EC in rice and paddy filed,this study had used the measurement technique of GC-NPD to determine the residues of chlorpyrifos in rice and paddy field,so as to provide scientific basis for the reasonable usage of this agent in rice and paddy.The results showed that the curve of residue dynamics of chlorpyrifos in water,soil and plants accorded with the first-order kinetics equation,and the half-lives of chlorpyrifos were 1.45—3.48 d in water,3.16—6.36 d in soil,2.05—2.98 d in plants,respectively.The final residues of chlorpyrifos in soil,brown rice,husk and plants,increased correspondingly with the increase of spraying dosage and times,and decreased accordingly with the prolonging of sampling time.When 25% isoprocard and chlorpyrifos EC was applied 3 or 4 times at recommended dosage and 1.5 times recommended dosage in rice field,over 33 days after the last application,the final residues maximum of chlorpyrifos were 0.044 7 mg/kg and 0.081 2 mg/kg in soil,0.045 4 mg/kg and 0.076 5 mg/kg in brown rice,0.084 3 mg/kg and 0.093 6 mg/kg in husk,0.047 9 mg/kg and 0.063 2 mg/kg in plants,respectively,which all were below the maximum residue limit(MRL) 0.5 mg/kg of rice in China,and the rice harvested at this time was safe for human consumption.
chlorpyrifos; rice; paddy field; residue and degradation dynamics
2016-10-15
农业部农药检定所资助项目 (2012P303)
王红军(1965-),男,河南商丘人,副教授,本科,主要从事作物病虫害防治的教学和技术推广工作。 E-mail:whj3261@163.com
S481.8
A
1004-3268(2017)03-0100-07
