过表达Tg737基因对肝癌细胞周期和凋亡的影响
2017-04-04谭烨尤楠郑璐黄小兵王梁吴柯邓昌林李靖
谭烨,尤楠,郑璐,黄小兵,王梁,吴柯,邓昌林,李靖
(第三军医大学新桥医院 肝胆外科,重庆400037)
肝细胞癌(肝癌)在全球范围内发病率位居癌症第5位,病死率位居第3位。大量证据表明,肝癌的病理发生是肝细胞内致癌、抑癌、细胞周期调控等基因不断活化、失活后出现的结果[1-2],所以这些基因理论上都能成为肝癌治疗的靶点[3-5]。抑癌基因在维持基因完整性,调节增殖、分化、凋亡、细胞周期等方面起到了重要作用[6-7],其丧失功能的突变可直接导致肿瘤发生[8]。Tg737是一个可能在人的肝脏肿瘤细胞系中有功能的抑癌基因[9],有研究[10]表明,在59%的肝癌组织中发现了Tg737基因的明显表达下调,并且它还能影响细胞周期进程,在凋亡和增殖过程中发挥关键作用[11]。基于上述研究结果,笔者认为Tg737在肝癌发生中具有重要地位,它能通过介导肿瘤细胞发生周期阻滞及凋亡从而抑制其增殖,十分有望成为肝癌治疗的新靶点。
本研究检测了Tg737过表达对细胞周期、凋亡的影响,以及Tg737的抑制增殖作用与cyclin A、Bax、Bcl-2表达的关系。
1 材料与方法
1.1 细胞与试剂
人的肝癌细胞株HepG2和MHCC97-H购于中国科学院细胞库,达氏修正依氏培养基(DMEM)、胰蛋白酶购自美国Gibco公司,胎牛血清、lipofectamine 2000 reagent购自美国Invitrogen公司,Annexin V/PI细胞凋亡检测试剂盒购自法国Immunotech公司,Hoechst 33342购自美国Sigma公司,氨苄青霉素、链霉素购自华北制药有限公司,Western blot实验所用检测抗体:Tg737多克隆抗体、GAPDH多克隆抗体,cyclin A多克隆抗体、Bax多克隆抗体、Bcl-2多克隆抗体以及二抗均购自美国Cell Signaling Technology试剂公司、美国Abnova试剂公司和美国 Santa Cruz试剂公司。
1.2 方法
1.2.1 构建pcDNA3.1-Tg737质粒 pcDNA3.1-Tg737质粒的构建按课题组成员先前报道[12]完成。
1.2.2 细胞培养与转染 细胞培养于含有10%胎牛血清、100 IU/mL青霉素、100 μg/mL链霉素的DMEM高糖培养基中,接种于75 cm2培养皿上,在37 ℃、5% CO2、95%湿度的培养箱中孵育,每2天更换1次培养基。待细胞长至80%左右时进行转染。用脂质体介导转染法,将重组质粒 pcDNA3.1-Tg737、 空载体 pcDNA3.1(-)分别转染HepG2、MHCC97-H细胞。细胞分为4组:pcDNA3.1-Tg737转染组(Tg737过表达组),pcDNA3.1(-) 转染组(空载体组)、LipofectamineTM2000孵育组(脂质体组)和空白对照组。
1.2.3 Tg737基因过表达分析 转染48 h后,根据文献[13]中所述方法提取蛋白质进行Western blot检测Tg737蛋白表达,一抗为anti-Tg737(稀释比例1:600) 及anti-GAPDH(稀释比例1:400)。
1.2.4 Tg737在细胞周期与细胞凋亡中的作用⑴ 流式细胞仪细胞周期检测:转染后48 h,加入70%冷乙醇4 ℃固定细胞48 h,PBS洗涤1次,200 g离心10 min,1 mg/mL的RNase A 37 ℃处理30 min,加入40 μL浓度为0.1 mg/L的PI染色,流式细胞仪检测处于G0/G1,S和G2/M期的细胞比例。⑵ Annexin V/PI双染法测定细胞凋亡:按照凋亡检测试剂盒说明书进行Annexin V法检测:转染后48 h收集细胞,预冷PBS洗涤,加入标记有FITC的Annexin V,PI,混匀后室温避光孵育15 min,上流式细胞仪检测。⑶ Hoechst 33342染料法检测细胞核形态:转染后48 h,PBS洗涤细胞,70%乙醇4 ℃固定2 h,加入5 μg/mL的Hoechst 33342对细胞核进行染色,37 ℃染色30 min,PBS洗涤1遍,使用荧光显微镜观察细胞核形态。⑷ 光学显微镜法观察凋亡形态:转染后48 h,光学显微镜下观察细胞形态。
1.2.5 Western blot检测cyclin A、Bax、Bcl-2表达 转染后48 h,收集细胞,提取蛋白,采用先前描述的实验方法进行Western blot分析cyclin A、Bax、Bcl-2蛋白表达,一抗使用1:500稀释的cyclin A抗体、1:300稀释的Bax抗体、1:300稀释的Bcl-2抗体。
1.3 统计学处理
数据以均数±标准差(±s)形式表示,用SPSS 14.0统计软件分析处理。数据分析方法为单因素方差分析及t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 pcDNA3.1-Tg737瞬时转染可提高肝癌细胞中Tg737的表达
pcDNA3.1-Tg737转染HepG2和MHCC97-H细胞后,Western blot确认Tg737表达增加(均P<0.05)。为排除脂质体/载体的影响,对分别用LipofectamineTM2000和质粒载体孵育的HepG2和MHCC97-H细胞检测Tg737的表达量,结果表明,与未转染细胞相比,两种方法处理后的细胞内Tg737蛋白水平无明显变化(均P>0.05)(图1),显示脂质体/载体并不会对HepG2和MHCC97-H细胞内Tg737水平造成影响。
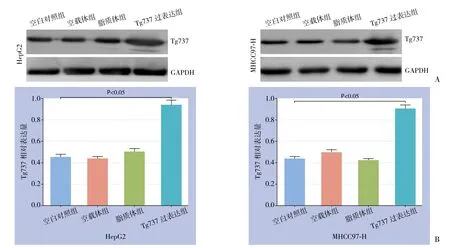
图1 Western blot检测Tg737蛋白表达 A:各组细胞Tg737蛋白情况;B:各组细胞Tg737蛋白相对表达量比较Figure 1 Western blot analysis for Tg737 protein expression A:Tg737 protein expression in each group of cells; B:Comparison of relative levels of Tg737 protein among groups of cells
2.2 Tg737对细胞周期和细胞凋亡的影响
2.2.1 Tg737过表达可诱导周期阻滞 使用流式细胞仪分析转染后各细胞周期中细胞数量比例。同未转染细胞相比,转染后处于S期的细胞明显增多,G0/G1期细胞数量减少,提示发生了S期阻滞;同时处于G2/M期的细胞比例也明显下降(均P<0.05)。同样采用前文所述的方法排除了脂质体/载体对实验的影响(图2)(表1)。
2.2.2 Tg737过表达可诱导细胞凋亡 Annexin V/PI双染法结果显示,未转染时可见正常细胞及较少的凋亡、坏死细胞,转染后48 h,正常细胞比例下降,凋亡细胞比例增加(均P<0.05)。但在比较坏死时发现,转染组与对照组坏死细胞比例无明显改变(均P>0.05)。脂质体/载体对实验的影响可排除(图3)(表2)。
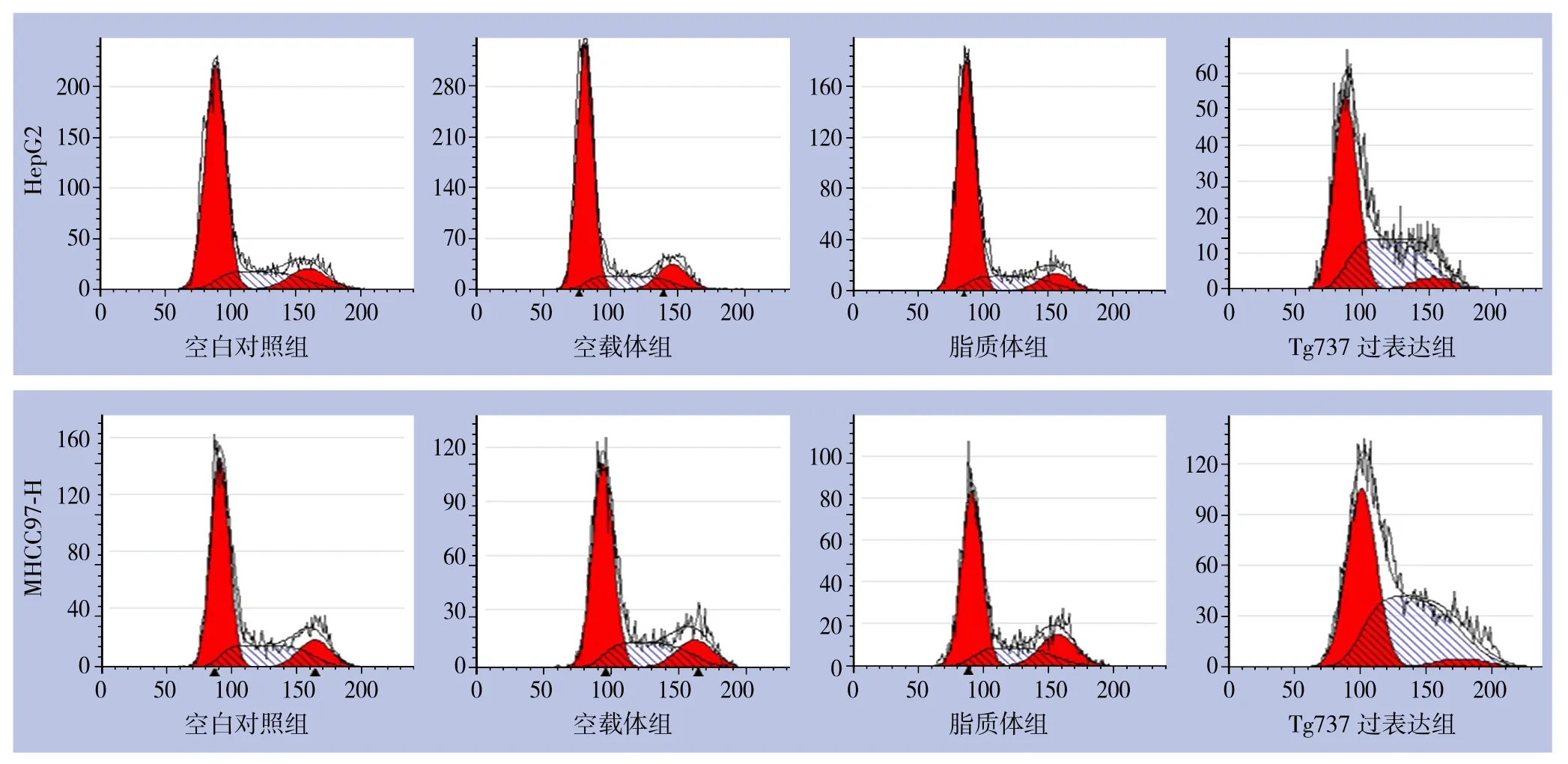
图2 流式细胞仪检测细胞周期Figure 2 Cell cycle analysis by flow cytometry
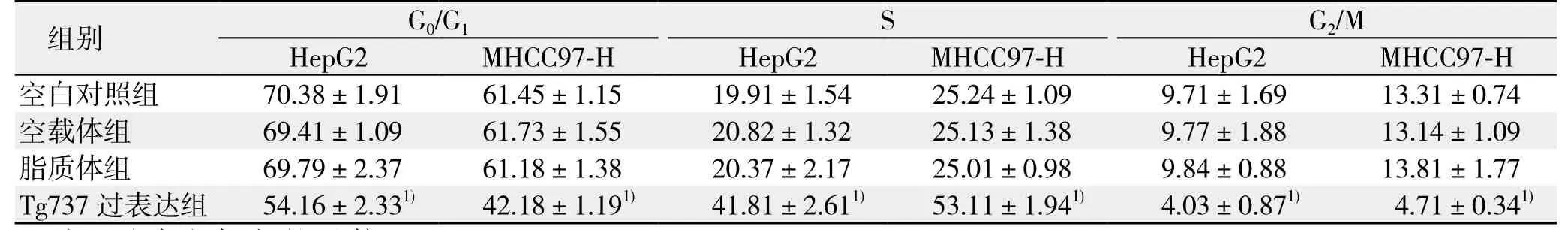
表1 各组细胞周期分布情况(%)Table 1 Cell cycle distributions in each group of cells (%)

图3 Annexin V/PI双染法分析细胞凋亡Figure 3 Annexin V/PI double staining assay for apoptosis

表2 各组细胞凋亡情况(%)Table 2 Comparison of apoptosis among groups of cells (%)
2.2.3 Tg737过表达可导致细胞形态学改变HepG2和MHCC97-H细胞转染质粒后48 h,可观察到细胞形态发生变化。光镜下观察显示,转染后HepG2和MHCC97-H细胞皱缩、变圆,并且从培养瓶壁脱离(图4A)。通过Hoechst33342染料法,发现转染后细胞荧光强度增大,细胞核呈现致密浓染,或碎块状致密浓染和半月形凝聚等特征性的凋亡形态学改变(图4B)。已排除脂质体/载体对实验的影响。
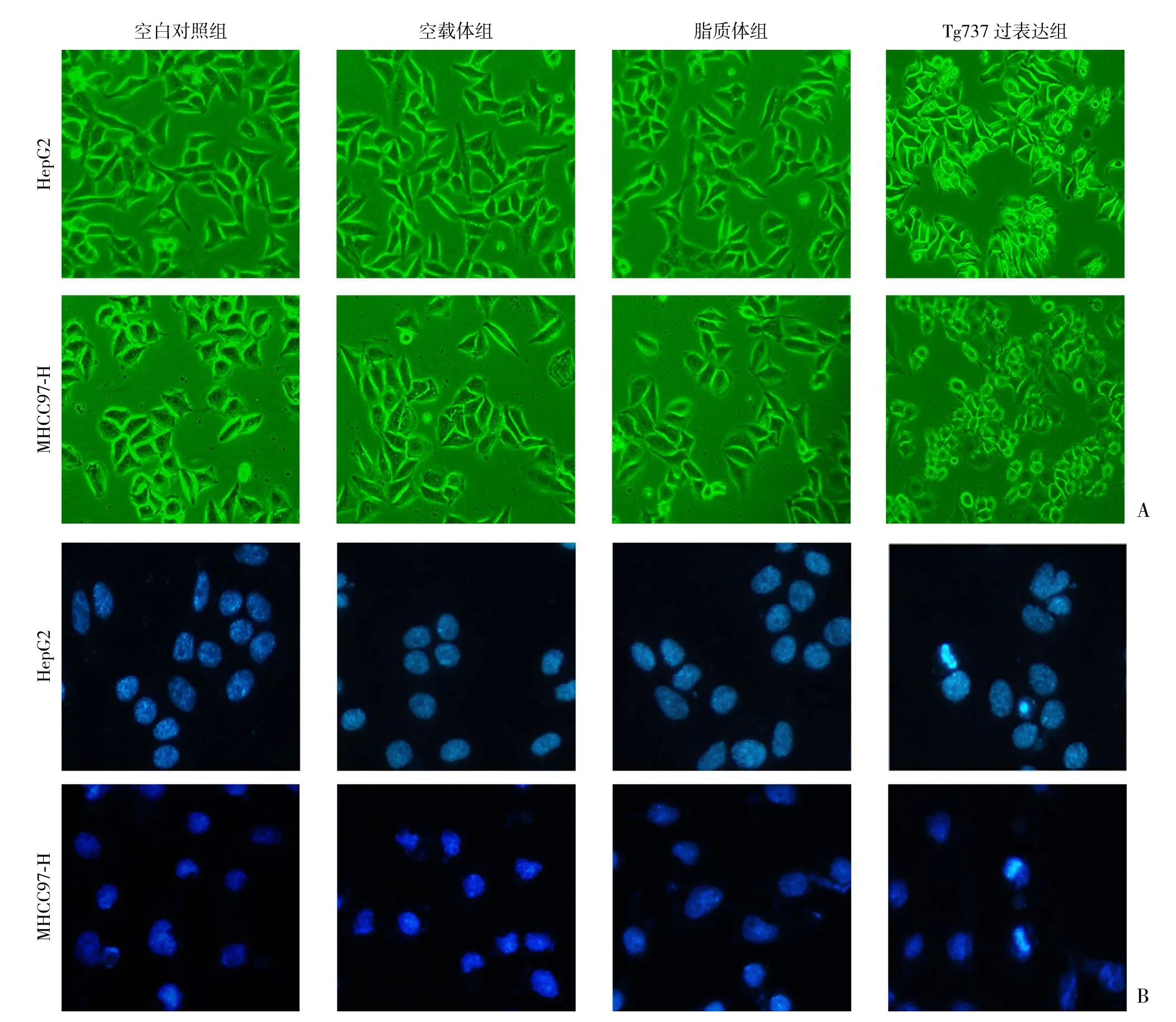
图4 细胞形态学观察 A:光镜观察(×100);B:Hoechst33342核染色(×200)Figure 4 Morphological observations of the cells A:light microscopic examination (×100); B:Hoechst33342 nuclei staining (×200)
2.3 Tg737过表达对cyclin A、Bax、Bcl-2表达水平的影响
Western blot结果显示,cyclin A的水平随Tg737的过表达而明显增高,同S期阻滞结论一致;而Bcl-2表达减少的同时Bax表达增加(均P<0.0 5)。脂质体/载体对实验的影响可排除(图5)。
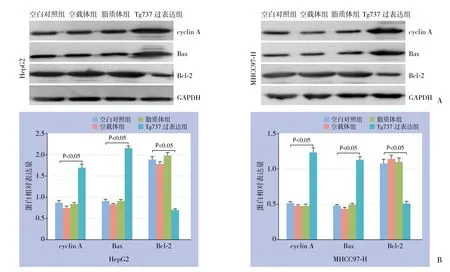
图5 Western blot检测凋亡相关蛋白表达 A:相关蛋白在各组细胞中的表达情况;B:相关蛋白在各组细胞中相对表达量比较Figure 5 Western blot analysis for apoptosis-associated proteins A:Expressions of the apoptosis-associated proteins in each group of cells; B:Comparison of the relative expression levels of the apoptosis-associated proteins among groups of cells
3 讨 论
肝癌是世界范围内最为致命的肿瘤之一。现有治疗方法对肝癌疗效甚微,晚期患者预后较差,临床上已开始积极探寻新的治疗手段[14]。近年来的研究正逐渐加强人们对分子生物学在肝脏肿瘤形成和发展中的认识。目前有证据表明,成熟肝细胞内长期、重复发生的损伤、修复过程,会导致致癌基因的累积和抑癌基因的突变,从而诱发肝癌的发生。对基因层面改变的认识将为肝癌治疗带来可观前景,如果将治疗重心转移到基因,很有可能推迟、逆转甚至预防肿瘤发生[15-17]。
肝癌的新型分子治疗需要筛选出合适的靶点基因。目前已有的证据表明在一些肿瘤中恢复抑癌基因的表达水平能在治疗中发挥一定作用,而抑癌基因能够直接介导肿瘤细胞周期阻滞及凋亡的发生,是基因靶点治疗的理想方案。多项研究表明抑癌基因疗法不仅对正常细胞没有毒性,还能增加常规治疗的疗效[18]。潜在的能作为临床上控制癌细胞增殖、促进癌细胞凋亡的抑癌基因正不断被发掘出,例如:p53[19],Rb[20],p21[21],p16[22],p27[23],BRCA1[24]以及APC[25]等,其中一些已经进入临床试验阶段。尽管已有显著进展,但总体来说抑癌基因靶向治疗的作用仍然局限,若要提高该疗法对肝癌治疗的可行性,则有赖于新分子标志或治疗靶点的发现及对其作用机制的清晰认识。
Tg737在肝脏肿瘤形成过程中可能起到了重要的作用[9],有报道[11]称Tg737参与了细胞周期、凋亡的调节过程,并且能介导细胞周期与凋亡的改变以抑制肿瘤细胞的增殖,从而实现对肿瘤的治疗。综合以上因素,Tg737有望成为肝癌治疗的新位点。
细胞的增殖由细胞周期把控,而许多致癌、抑癌基因都直接参与了细胞周期的调节过程[26]。本研究发现Tg737的过表达可以阻碍HepG2和MHCC97-H的细胞进程。使用流式细胞仪检测发现,停留在S期的细胞明显增多,而G0/G1、G2/M期细胞减少。S期细胞增加即说明细胞周期进程的减缓,进而导致增殖受到抑制。然而本研究的数据与Robert等[11]所观察到的结果并不一致,其研究结果显示Tg737的过表达使细胞周期于G1到S期过程被阻断从而诱导凋亡,数据上的差异说明Tg737在不同细胞中可能存在不同的周期阻滞机制。
凋亡与细胞增殖的关系同样密切。坏死与凋亡是细胞主要的死亡方式,坏死时细胞膨胀,细胞器丧失功能,线粒体崩解,最终细胞破裂。坏死发生后细胞内容物大量排放至内环境,产生严重的宿主炎症反应,相比而言,凋亡时产生的炎症反应则轻很多。凋亡对于生物体存在有利的作用,而坏死通常是无益的,严重时甚至致命。所以,最理想的肝癌治疗情形是增加凋亡水平而不激发坏死的发生[27]。另外,有越来越多的证据表明肿瘤的发生可能与凋亡机制不能正常运作有关,而肿瘤细胞逃避凋亡的能力也是它得以对抗传统疗法的重要手段。因此,将治疗方法转向特异性诱导凋亡的分子可能会有较好疗效[28]。在本研究中,Annexin V法显示Tg737过表达能明显增加凋亡、抑制非必要的坏死;形态学分析同样表明了HepG2和MHCC97-H在过表达Tg737后,细胞内发生了典型的凋亡改变。因为Tg737本身并不会诱导坏死的发生,所以在临床治疗上比其他疗法更显安全。
在诸多肿瘤中,细胞周期调节因子及相关蛋白的表达是不断变化的,据文献[29-30]报道,针对这些因子进行治疗已取得一定疗效。本研究分析了由Tg737过表达引起的S期阻滞和凋亡与其相应调节蛋白的关系。cyclin A在细胞S期的作用已被广泛认可[31],一些化疗药物通过降低cyclin A的表达从而使细胞发生S期阻滞[32],同时还有其他研究提示如果发生S期阻滞,cyclin A的表达量升高[33]。在本研究中,细胞周期分析表明细胞转染后出现明显的S期阻滞以及cyclin A表达的上调。细胞周期不仅受到cyclin、周期蛋白依赖性激酶(CDK)及CDK抑制因子共同构成的复合调控系统的影响,反馈机制也在周期调节中起作用[34],笔者认为,cyclin A表达的增加可能就是一种基于Tg737过表达引起S期阻滞的负反馈调节。cyclin A在Tg737介导的S期阻滞过程中究竟起到何种作用,还有待进一步研究。除了S期阻滞,细胞还能进入凋亡进程,数据显示转染后的肝癌细胞中Bax表达升高、Bcl-2表达下降,Bax/Bcl-2比例增大,因此,在Tg737介导的细胞凋亡过程中,Bcl-2家族也发挥了一定作用。
综上所述,在人肝癌细胞系中过表达Tg737基因能通过介导S期阻滞和诱导凋亡作用进而抑制肿瘤细胞生长,cyclin A、Bax、Bcl-2信号通路可能参与了该过程。然而,诸如Tg737如何与另外的细胞周期、凋亡基因相互影响等详细机制需要进行更加深入的研究。进一步对Tg737作为潜在治疗靶点的鉴别研究,会逐渐将它在细胞周期及凋亡方面所起到的作用解释清楚。如果能将Tg737抑制细胞增殖、介导周期停滞、发生凋亡等机制阐明,该基因在肿瘤治疗中的地位必将显著提高。对Tg737进一步的研究将会让人们对肝脏肿瘤发生的机理及治疗策略产生更为深刻的理解与认识。
参考文献
[1]Zucman-Rossi J,Villanueva A,Nault JC,et al.Genetic Landscape and Biomarkers of Hepatocellular Carcinoma[J].Gastroenterology,2015,149(5):1226–1239.doi:10.1053/j.gastro.2015.05.061.
[2]Kanda M,Sugimoto H,Kodera Y.Genetic and epigenetic aspects of initiation and progression of hepatocellular carcinoma [J].World J Gastroenterol,2015,21(37):10584–10597.doi:10.3748/wjg.v21.i37.10584.
[3]Wong CH,Wong CS,Chan SL.Targeting angiogenic genes as a therapeutic approach for hepatocellular carcinoma[J].Curr Gene Ther,2015,15(2):97–108.
[4]Ma X,Yan J,Chen W,et al.Knockdown of Myosin VI Inhibits Proliferation of Hepatocellular Carcinoma Cells In Vitro[J].Chem Biol Drug Des,2015,86(4):723–730.doi:10.1111/cbdd.12544..
[5]Lin JC,Wu YC,Wu CC,et al.DNA methylation markers and serum alpha-fetoprotein level are prognostic factors in hepatocellular carcinoma[J].Ann Hepatol,2015,14(4):494–504.
[6]Teng YC,Shen ZQ,Kao CH,et al.Hepatocellular carcinoma mouse models:Hepatitis B virus-associated hepatocarcinogenesis and haploinsuf ficient tumor suppressor genes[J].World J Gastroenterol,2016,22(1):300–325.doi:10.3748/wjg.v22.i1.300.
[7]Xu JH,Hu SL,Shen GD,et al.Tumor suppressor genes and their underlying interactions in paclitaxel resistance in cancer therapy[J].Cancer Cell Int,2016,16:13.doi:10.1186/s12935–016–0290–9.
[8]Morris LG,Chan TA.Therapeutic targeting of tumor suppressor genes[J].Cancer,2015,121(9):1357–1368.doi:10.1002/cncr.29140.
[9]Song Z,Li R,You N,et al.Loss of heterozygosity of the tumor suppressor gene Tg737 in the side population cells of hepatocellular carcinomas is associated with poor prognosis[J].Mol Biol Rep,2010,37(8):4091–4101.doi:10.1007/s11033–010–0069–3.
[10]Chen CF,Yeh SH,Chen DS,et al.Molecular genetic evidence supporting a novel human hepatocellular carcinoma tumor suppressor locus at 13q12.11[J].Genes Chromosomes Cancer,2005,44(3):320–328.
[11]Robert A,Margall-Ducos G,Guidotti JE,et al.The intraflagellar transport component IFT88/polaris is a centrosomal protein regulating G1-S transition in non-ciliated cells[J].J Cell Sci,2007,120(Pt 4):628–37.
[12]You N,Liu W,Tang L,et al.Tg737 signaling is required for hypoxia-enhanced invasion and migration of hepatoma cells[J].J Exp Clin Cancer Res,2012,31:75.doi:10.1186/1756–9966–31–75.
[13]Hnasko TS,Hnasko RM.The Western Blot[J].Methods Mol Biol,2015,1318:87–96.doi:10.1007/978–1–4939–2742–5_9.
[14]Jayachandran A,Dhungel B,Steel JC.Epithelial-to-mesenchymal plasticity of cancer stem cells:therapeutic targets in hepatocellular carcinoma[J].J Hematol Oncol,2016,9(1):74.doi:10.1186/s13045–016–0307–9.
[15]Jiang C,Gong F.DNA Methyltransferase 1:A Potential Gene Therapy Target for Hepatocellular Carcinoma?[J].Oncol Res Treat,2016,39(7/8):448–452.doi:10.1159/000447414.
[16]He Q,Yao CL,Li L,et al.Targeted gene therapy and in vivo bioluminescent imaging for monitoring postsurgical recurrence and metastasis in mouse models of liver cancer [J].Genet Mol Res,2016,15(3).doi:10.4238/gmr.15037878.
[17]Lai YH,Lin CC,CHEN SH,et al.Tumor-specific suicide gene therapy for hepatocellular carcinoma by transcriptionally targeted retroviral replicating vectors[J].Gene therapy,2015,22(2):155–162.doi:10.1038/gt.2014.98.
[18]Suzuki K,Matsubara H.Recent advances in p53 research and cancer treatment[J].J Biomed Biotechnol,2011,2011:978312.doi:10.1155/2011/978312.
[19]Meng X,Franklin DA,Dong J,et al.MDM2-p53 pathway in hepatocellular carcinoma[J].Cancer Res,2014,74(24):7161–7167.doi:10.1158/0008–5472.CAN–14–1446.
[20]Hutcheson J,Witkiewicz AK,Knudsen ES.The RB tumor suppressor at the intersection of proliferation and immunity:relevance to disease immune evasion and immunotherapy[J].Cell Cycle,2015,14(24):3812–3819.doi:10.1080/15384101.2015.1010922.
[21]Ohkoshi S,Yano M,Matsuda Y.Oncogenic role of p21 in hepatocarcinogenesis suggests a new treatment strategy[J].World J Gastroenterol,2015,21(42):12150–12156.doi:10.3748/wjg.v21.i42.12150.
[22]LaPak KM,Burd CE.The molecular balancing act of p16(INK4a)in cancer and aging[J].Mol Cancer Res,2014,12(2):167–183.doi:10.1158/1541–7786.MCR–13–0350.
[23]Esmaeili M,Jennek S,Ludwig S,et al.The tumor suppressor ING1b is a novel corepressor for the androgen receptor and induces cellular senescence in prostate cancer cells[J].J Mol Cell Biol,2016,8(3):207–220.doi:10.1093/jmcb/mjw007.
[24]Kononenko AV,Bansal R,Lee NC,et al.A portable BRCA1-HAC(human artificial chromosome) module for analysis of BRCA1 tumor suppressor function[J].Nucleic Acids Res,2014,42(21).doi:10.1093/nar/gku870.
[25]Li N,Liu B,Sui C,et al.Analysis of APC mutation in human ameloblastoma and clinical significance[J].Springerplus,2016,5:314.doi:10.1186/s40064–016–1904–3.
[26]Scott RE,Ghule PN,Stein JL,et al.Cell cycle gene expression networks discovered using systems biology:Significance in carcinogenesis[J].J Cell Physiol,2015,230(10):2533–2542.doi:10.1002/jcp.24990.
[27]Wang F,Wang H,Sun X,et al.Apoptosis-induction is a novel therapeutic strategy for gastrointestinal and liver cancers[J].Curr Gene Ther,2015,15(2):193–200.
[28]Hassan M,Watari H,Abualmaaty A,et al.Apoptosis and molecular targeting therapy in cancer [J].Biomed Res Int,2014,2014:150845.doi:10.1155/2014/150845.
[29]Yang HD,Kim PJ,Eun JW,et al.Oncogenic potential of histonevariant H2A.Z.1 and its regulatory role in cell cycle and epithelialmesenchymal transition in liver cancer[J].Oncotarget,2016,7(10):11412–11423.doi:10.18632/oncotarget.7194.
[30]Bisteau X,Caldez M J,Kaldis P.The Complex Relationship between Liver Cancer and the Cell Cycle:A Story of Multiple Regulations[J].Cancers (Basel),2014,6(1):79–111.doi:10.3390/cancers6010079.
[31]Dachineni R,Ai G,Kumar DR,et al.Cyclin A2 and CDK2 as Novel Targets of Aspirin and Salicylic Acid:A Potential Role in Cancer Prevention[J].M Mol Cancer Res,2016,14(3):241–252.doi:10.1158/1541–7786.MCR–15–0360.
[32]Chien CM,Chang SY,Lin K L,et al.Taiwan cobra cardiotoxin III inhibits Src kinase leading to apoptosis and cell cycle arrest of oral squamous cell carcinoma Ca9–22 cells[J].Toxicon,2010,56(4):508–520.doi:10.1016/j.toxicon.2010.05.007..
[33]Yang TY,Chang GC,Chen KC,et al.Sustained activation of ERK and Cdk2/cyclin-A signaling pathway by pemetrexed leading to S-phase arrest and apoptosis in human non-small cell lung cancer A549 cells [J].Eur J Pharmacol,2011,663(1/3):17–26.doi:10.1016/j.ejphar.2011.04.057.
[34]Ding H,Han C,Guo D,et al.OSU03012 activates Erk1/2 and Cdks leading to the accumulation of cells in the S-phase and apoptosis[J].Int J Cancer,2008,123(12):2923–2930.doi:10.1002/ijc.23896.
