基于医学影像学的3D打印技术在心血管疾病诊疗中的应用现状及研究进展
2017-03-31宋宏宁郭瑞强
宋宏宁,郭瑞强
(武汉大学人民医院超声影像科,湖北 武汉 430060)
基于医学影像学的3D打印技术在心血管疾病诊疗中的应用现状及研究进展
宋宏宁,郭瑞强*
(武汉大学人民医院超声影像科,湖北 武汉 430060)
3D打印技术作为一种快速成型技术,近年来在心血管领域应用广泛。3D打印模型的制作有多种方式,不同的成型方式有各自的优缺点。在先天性心脏病、心脏瓣膜病、大血管病变、心律失常的诊疗过程中3D打印发挥着重要的作用。本文基于医学影像学的3D打印技术在心血管疾病诊疗中的应用现状和研究进展进行综述。
3D打印;心血管疾病;医学影像学
3D打印技术是近年来兴起的一项快速成型技术,其优势为快速、可定制化、可重复性。在心血管疾病的个体化诊疗过程中,3D打印技术正在发挥日益重要的作用。本文对3D打印技术在心血管疾病中的应用现状和研究进展进行综述。
1 3D打印技术简介及实现过程
3D打印技术是一种快速成型技术,也被称为叠加制造(additive manufacturing, AM),其定义为将未成型的材料叠加至已成型的固态材料表面从而制造出一个立体的空间模型。3D打印技术应用于医疗领域可以追溯到20世纪90年代初[1]。最近几年,随着材料学和工程学的进步,才获得较快的发展。
医学3D打印模型的获取基于符合医学数字成像和通信(digital imaging and communications in medicine, DICOM)的图像,实现心血管3D打印主要有以下步骤(图1):①医学影像图像数据的获取;②图像处理,提取ROI,分离出需要重建和打印的部分,该过程被称为分割;③将容积数据转化为3D打印识别的三角网格模型;④将数字模型输入3D打印机进行打印。
1.1 心血管3D打印的影像数据源 准确可靠的影像学数据是获得精确3D打印模型的基础。目前临床常用的心脏影像学检查包括CT、心脏磁共振(cardiac magnetic resonance, CMR)和超声心动图检查。
CT作为常用的心血管检查方式,具有较高的空间分辨率和密度分辨率,在多数临床研究中为心脏模型获得的数据源。由于心脏由肌肉及结缔组织构成,其内部密度差异在CT平扫的条件下很难清晰显示,采用CT血管造影可以增强心内结构的显示。在造影模式下,CT图像高密度显示的内容为心脏腔室及血管,因而CT是心腔与血管结构3D打印的首选数据来源,但并非所有心脏结构或所有患者均适合使用心脏CT作为源数据,在心脏软组织或心脏瓣膜的显示中,CMR较心脏CT有一定的优势[2]。同时,随着超声心动图技术的发展,经胸及经食管三维超声心动图的空间分辨率和时间分辨率显著提高,三维超声心动图也被证实可以作为3D打印的可靠来源[3]。
由于心脏是一个结构相对复杂的器官,使用单一数据源可能并不能获取心脏复杂的解剖信息全貌。最新的研究[4-5]中,使用多种数据源进行融合成像并进行3D打印,显著提高了心脏内复杂解剖细节的显示效果,为结构性心脏病介入及手术治疗术前准备提供了更全面的信息。
1.2 医学3D图像的分割与处理 分割是将用于3D打印的ROI从图像中分离出来的图像后处理过程,精确地分割是获得准确模型的基础。通过特定的软件可对医学DICOM图像进行分割,常用的数据处理软件包括Mimics、OsriX、MeshLab等[6-8]。
阈值分割是3D图像分割最重要的方法,通过设定特定的密度阈值,保留图像中特定密度阈值范围的信息,同时去除密度范围以外的图像内容[7]。在心脏CT血管造影图像中,设定分割阈值为对比剂密度可以快速地分离心脏、大血管及冠状动脉。阈值分割决定ROI的范围,因而阈值的确定是决定分割精确度的重要因素。由于不同患者不同时相心脏密度值均有差别,因而需针对每一患者进行个体化阈值分割。在阈值分割不能完全分离的区域,同时需要辅助交互式分割等方法进行心血管图像的进一步处理。分割后的图像需进一步经过网格生成获得容积图像表面模型,进而获得可以被打印机识别的数据格式。目前最常用的3D打印数据格式为标准镶嵌语言(standard tessellation language, STL)数据格式[9]。
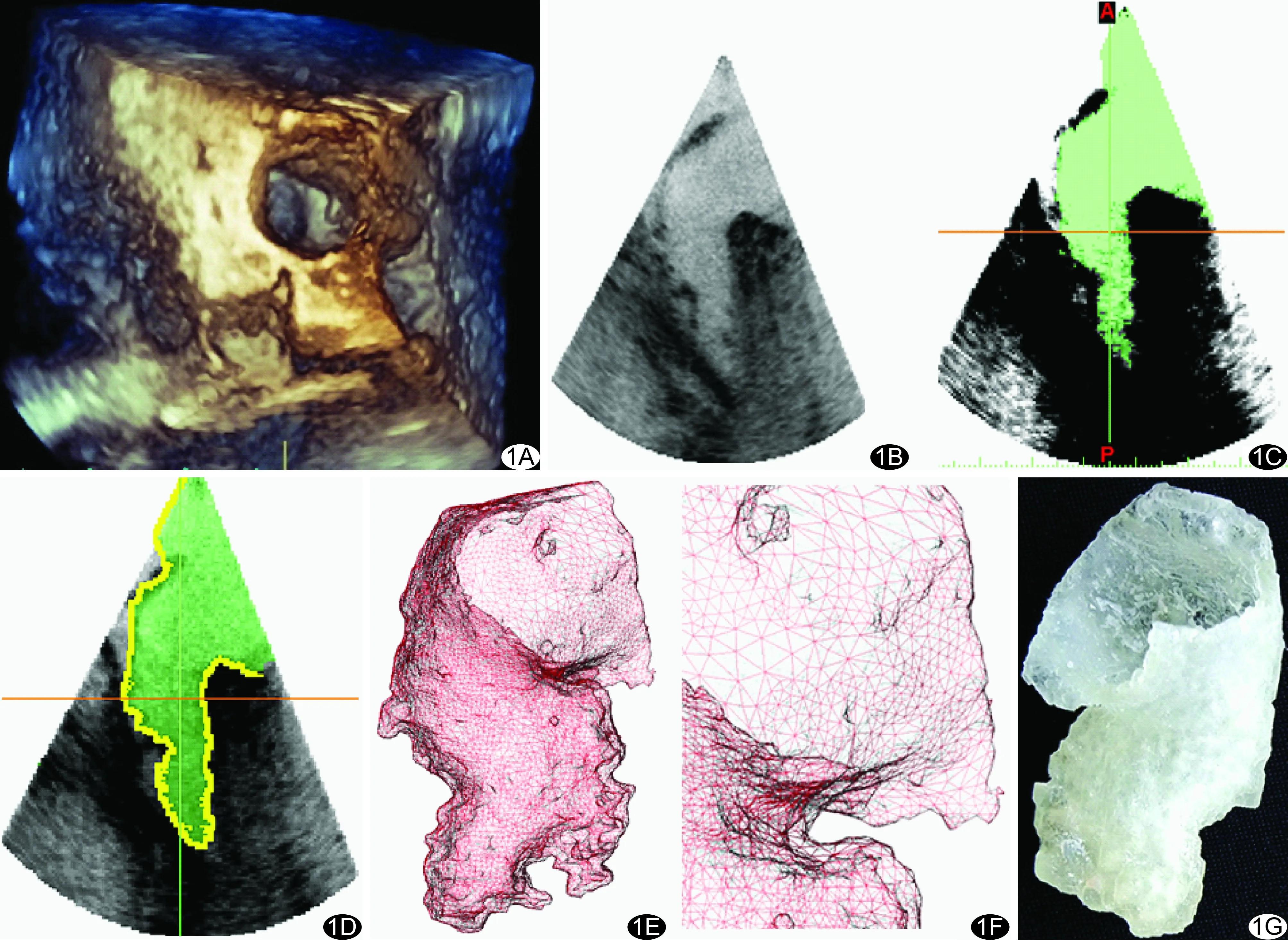
图1 基于超声心动图的3D打印模型获取步骤 A.获取超声DICOM图像; B、C.阈值分割; D.图像后处理; E、F.网格生成; G.生成3D打印模型
1.3 3D打印模型的制作及打印方式 3D打印模型的制作一般经过3个步骤:模型获取、3D打印及打印后处理。打印机将获取的3D数字模型分割为多层2D图像,类似计算机断层扫描的显示方式,然后使用3D打印机逐层成型,进而获得空间立体的3D打印模型。3D打印模型的材质及成型方法有多种,现阶段常用于医学领域的打印方式主要有以下几种。
(1)熔融沉积成型(fused deposition modeling, FDM):将热熔材质加热到液态,通过计算机控制的挤压喷头喷涂建造每层模型,通过每层材质的堆积建立空间立体模型。目前,FDM是最广泛应用的3D打印方式,通过调整加热温度和喷头的参数,可以使用多种材质进行打印。但FDM存在打印精度较低,材质耐热性差,对于软性材质打印效果不佳的缺点。
(2)选择性激光烧结(selective laser sintering, SLS):是使用红外激光器作能源,将粉末状材料有选择地进行烧结,逐层进行,最终获取立体打印模型的一种AM方法。SLS工艺简单,材料选择范围广,成本较低,且可用柔性材质打印,但其精度一般,设备昂贵,且打印过程中有环境污染的危害[10]。
(3)光固化快速成型(stereolithography, SLA):使用液态光敏树脂进行快速成型,这种材料在激光照射下可快速凝为固体。使用计算机控制激光对液态光敏树脂表面进行照射,同时液体容器逐渐下降,在已经成型的固体表面继续凝结,进而获得空间立体模型[11]。SLA可以快速精确地获取3D打印模型,但光敏树脂种类较少,成本很高,强度一般,无法完成较大体积模型的快速成型。
(4)聚合物喷射成型(PolyJet):是目前软性材料快速成型的主要方法之一,与SLA相似,同样使用光敏树脂进行成型,但PolyJet使用喷头将光敏树脂和支撑聚合物同时喷射到工作台,再使用紫外线照射,完全凝固后再喷涂下一层。由于支撑材料的存在,光敏树脂可以在完全不受力的状态下凝固成型,对于软性材料的支持较其他打印方式具有很大优势。
(5)生物材料打印:使用细胞或其他生物活性的材质进行打印,并使用特殊的黏合剂进行粘连,最终实现具有生物活性的组织、器官的快速成型。这种打印方式尚处于实验室研究阶段,与临床应用尚有一段距离[12-15]。
由于以上打印方式各具特点,针对特定的临床需求可使用不同的打印技术进行快速成型。
2 3D打印在心血管诊疗中的应用现状
3D打印最初应用于临床是对复杂心血管病变进行体外再现,使外科或介入医师更直观地了解心脏及大血管结构的病变,从而进行更充分的术前准备。随着技术的发展,3D打印在心血管诊疗中正在发挥更多的作用,包括临床训练、医学教育、个性化诊疗方案的制定甚至直接参与疾病的治疗过程。
2.1 先天性心脏病 复杂先天性心脏病的术前准备需要对心脏解剖结构的准确评估。以往心外科医师主要通过超声和其他影像学文字描述了解心脏病变情况,即使通过CT容积再现或3D超声图像也很难将解剖信息完全传达给心外科医师。同时,一些解剖畸形本身就难以描述[16],需更为准确形象的表达方式。3D打印模型可使外科医师接触到完整的影像学数据,且并不需要额外的学习时间,可极大地提高外科医师术前对心脏解剖结构的认知。
CT、超声和MR均可获取心脏解剖结构,根据不同需求和研究对象可使用不同的影像学方法。2006年,Noecker等[17]应用CT数据采集11例婴幼儿的心脏3D数据,并进行3D打印,成功获取了所有患儿的心脏腔室模型,证实了心脏数据3D打印的可行性。2008年Kim等[18]对4例结构性心脏病患者进行3D打印,通过CT数据获得心脏模型,成功实现了房间隔缺损、室间隔缺损、人工瓣周边漏及主动脉假性动脉瘤的体外重建模型。在模型中进行模拟操作,实现了个性化治疗方案的制定。
Greil等[2]采用多排心脏CT和CMR对5例先天性心脏病患者进行心脏扫描并使用SLA方法获得高分辨率3D打印模型,证实CMR可以与CT一样获得满意的3D模型。同时,SLA 3D打印的精度(约0.15 mm)高于MDCT及MR的扫描精度,其打印过程不会降低影像学成像的精度,获得打印成品的测量误差为(0.27±0.76)mm,可以实现对影像学数据的空间再现。
超声心动图是诊断先天性心脏病最常用的工具,对心内结构的显示有较大优势。随着三维超声心动图(three dimensional echocardiography, 3DE)的发展,超声图像分辨率提高,经胸及经食管3DE开始成为心脏3D打印的数据来源。Olivieri等[3]对9例先天性心脏病患者进行3DE扫描重建,获得3D打印模型,证实基于超声的3D打印模型的误差小于1 mm。
由于心脏是一个组织结构复杂的器官,不同影像学对不同组织结构的显示各有优势。Gosnell等[4]使用心脏CT和3DE对心腔血池和瓣膜分别成像,并通过软件后处理进行拼接处理,获得了心脏融合成像的模型,CT具有较高的密度分辨率和空间分辨率,而3DE对心内软组织及瓣膜的显示更有优势。在先天性心脏病诊疗中使用多种影像技术进行拼接成像进行3D打印,将对完整心脏结构的显示提供更有指导意义的临床资料。
2.2 心脏瓣膜病 随着心脏瓣膜修复手术技术和瓣膜介入治疗的发展,术前准确评估心脏瓣膜的病变部位和程度对选择合理的治疗方式日益重要。3D打印在心脏瓣膜疾病的评估和治疗中也发挥着重要作用。
房室瓣的3D模型重建多采用3DE作为数据源,Mahmood等[19]使用经后处理的二尖瓣图像成功重建了正常二尖瓣、二尖瓣狭窄及二尖瓣脱垂时的二尖瓣空间模型,对二尖瓣修复提供了重要的依据。Witschey等[20]使用经食管3DE对4例不同二尖瓣病变的患者进行三维重建,获得了满意的二尖瓣空间形态模型。二尖瓣装置包括瓣膜、瓣环、腱索等,对二尖瓣瓣环的准确评估是二尖瓣外科手术的重要依据。Owais等[21]使用三维超声心动图及3D打印技术获得了二尖瓣瓣环的立体模型,达到了快速、准确、形象地评估二尖瓣瓣环的目的。
经导管主动脉瓣置入术(transcatheter aortic valve implantation, TAVI)是治疗主动脉瓣病变尤其是高龄患者主动脉瓣关闭不全的重要方法。TAVI创伤小、恢复快,但易出现瓣周漏等并发症,需进行充分的术前准备和术中监测[22]。由于TAVI需评估主动脉瓣、主动脉窦及升主动脉情况,心脏CT血管造影是最适合的3D打印数据源。Ripley等[23]使用基于心脏CT的主动脉根部数据获得3D打印模型,在模型中植入主动脉瓣并进行周边漏评估,证实在术前可使用3D打印技术对TAVI术后并发症进行一定程度的预测,进而可优化手术进程、减少并发症的发生。Fujita等[24]对1例病情复杂的TAVI患者术前进行主动脉根部3D打印重建,在模型中进行模拟导管操作及影像学显像,证实对该患者可以进行TAVI手术,从而规避了可能存在的风险。
基于3D打印的成型方式,细胞、组织均可以作为打印材料进行快速成型。生物学材料的优势在于可以最大程度地再现正常生理状态下心脏瓣膜的结构和功能,因此快速成型的人工生物瓣膜是3D打印研究的热点。使用3D打印获得支架并在表面进行细胞培养或直接使用细胞进行AM成型均可获得具有一定形态功能的心脏瓣膜结构。Yamanami等[25-26]使用快速成型技术基于硅胶材料制作的主动脉瓣阀门样装置已经成功植入家兔体内,并具有类似生物主动脉瓣的功能,Kishimoto等[27]使用结缔组织制作的无支架心脏瓣膜结构植入山羊体内也被证实存在理论上的可行性。但所有生物打印的研究均处于实验室阶段,距临床应用仍有较长一段距离。
2.3 大血管疾病 3D打印技术对于复杂主动脉疾病也具有重要的指导意义。Schmauss等[28]报道1例罕见的主动脉瘤手术,主动脉扩张由升主动脉延伸至降主动脉,采用3D打印技术获得了主动脉全程的三维模型,最终决定使用主动脉弓部血管置换及降主动脉支架的手术方式,并最终取得成功。Sodian等[29]应用3D打印模型定制了一种线圈栓塞装置,成功地通过介入治疗封堵1例主动脉弓置换患者的手术缝合部位的残余漏。在主动脉夹层、腹主动脉瘤等各种大血管疾病的个性化治疗中,3D打印也起到了重要的作用。由于CT血管造影在空间分辨率和密度分辨率的优势,在大血管疾病3D打印中,CT是最主要的数据源[30-31]。
2.4 心律失常 心律失常患者虽然一般不涉及心脏结构异常,但3D打印仍有一定的作用,Bauch等[32]基于CT成像获得了心脏希氏束的空间形态,从而达到优化起搏器电极位点的作用。在心房颤动患者中,3D打印发挥着更为重要的作用。由于心房颤动,左心耳内易形成血栓导致脑卒中及其他部位栓塞[33-34]。因而经导管左心耳封堵是防止心房颤动并发症的重要方法。左心耳形态结构复杂多变,对左心耳形态进行准确评估是手术顺利进行的保障。基于心脏CT或3D TEE可获得左心耳的3D打印模型,对模型进行空间形态评估和封堵器模拟释放有助于确定术中使用封堵器大小、型号以及封堵方案的制定[35-36]。
3 3D打印的局限性
虽然3D打印在心血管疾病诊疗中的作用日益凸显,但关于3D打印的作用,仍存有争论。Mathur等[37]指出,3D打印模型基于影像学数据获得,然而打印模型的获取过程需要经过多个后处理步骤,每一步后处理环节均可能导致最终成型的模型与原始数据差别增大。而使用未经处理的图像数据则很难获得满意的模型。同时3D打印自身仍存在一些的缺陷,如3D打印材料的物理性状无法完全模拟心肌硬度等。由于心脏是一个不断运动的器官,如何使用静态的模型准确模拟动态的心脏仍是3D打印在心血管应用的局限。
在工艺时间和打印成本方面,2013年Tam等[38]报道打印一个腹主动脉瘤的经济成本为200~500美元,加上前期检查耗时约10 h。随着技术的发展和普及,3D打印的物料成本已有极大的减低,但建造一个精度较高的模型仍需花费较多的人力、物力。而打印出的模型除用于“观看”和术前演练外还有何种潜在临床价值,需进一步探讨。
4 3D打印的发展趋势与展望
3D打印技术由于其快速直观的特点,可以在心血管疾病的术前准备中起重要的作用。随着技术的发展,这一作用将会进一步加强。随着影像学技术和材料科学技术的发展,心血管3D打印的精度和仿真程度将会不断提高。因此,3D打印在术前模拟仿真程度会有巨大的进步,同时随着虚拟现实和增强现实技术的日益完善,有望与3D打印技术相结合,在心脏手术模拟及教学过程中将会发挥更重要的作用。生物3D打印是目前研究的热点,且已经实现了部分瓣膜、血管及心肌组织的生物打印[39-40],虽然与临床应用仍有一段距离,但随着生物工程技术的发展,材料学、生物学、计算机科学等多学科的交叉合作,生物3D打印获得的组织器官必将应用于心血管疾病的治疗过程。
[1] Sachs E, Cima M, Cornie J, et al. Three-dimensional printing: The physics and implications of additive manufacturing. CIRP Ann-Manuf Technol, 1993,42:257-260.
[2] Greil GF, Wolf I, Kuettner A, et al. Stereolithographic reproduction of complex cardiac morphology based on high spatial resolution imaging. Clin Res Cardiol, 2007,96(3):176-185.
[3] Olivieri LJ, Krieger A, Loke YH, et al. Three-dimensional printing of intracardiac defects from three-dimensional echocardiographic images: Feasibility and relative accuracy. J Am Soc Echocardiogr, 2015,28(4):392-397.
[4] Gosnell J, Pietila T, Samuel BP et al. Integration of computed tomography and three-dimensional echocardiography for hybrid three-dimensional printing in congenital heart disease. J Digit Imaging, 2016,29(6):665-669.
[5] Kurup HK, Samuel BP, Vettukattil JJ. Hybrid 3D printing: A game-changer in personalized cardiac medicine? Expert Rev Cardiovasc Ther, 2015,13(12):1281-1284.
[6] Olszewski R. Three-dimensional rapid prototyping models in cranio-maxillofacial surgery: Systematic review and new clinical applications. Proc Belg R AcadMed, 2013:43-77.
[7] Rosset A, Spadola L, Ratib O. OsiriX: An open-source software for navigating in multidimensional DICOM images. J Digit Imaging, 2004,17(3):205-216.
[8] Cignoni P, Cignoni P, Callieri M, et al. MeshLab: An open-source mesh processing tool. Salerno: Eurographics Italian Chapter Conference, 2008:129-136.
[10] Liu YF, Xu LW, Zhu HY, et al. Technical procedures for template-guided surgery for mandibular reconstruction based on digital design and manufacturing. Biomed Eng Online, 2014, 13:63.
[11] Niikura T, Sugimoto M, Lee SY, et al. Tactile surgical navigation system for complex acetabular fracture surgery. Orthopedics, 2014,37(4):237-242.
[12] Mironov V, Boland T, Trusk T, et al. Organ printing: Computer-aided jet-based 3D tissue engineering. Trends Biotechnol, 2003,21(4):157-161.
[13] Fedorovich NE, Alblas J, Hennink WE, et al. Organ printing: the future of bone regeneration? Trends Biotechnol, 2011,29(12):601-606.
[14] Mironov V, Kasyanov V, Markwald RR. Organ printing: From bioprinter to organ biofabrication line. Curr Opin Biotechnol, 2011,22(5):667-673.
[15] Orlando G, Wood KJ, De Coppi P, et al. Regenerative medicine as applied to general surgery. Ann Surg, 2012,255(5):867-880.
[16] Van Praagh R, Van Praagh S. Morphologic anatomy//Fyler DC. Nadas' pediatric cardiology. Philadelphia: Hanley & Belfus, 1992:17-26.
[17] Noecker AM, Chen JF, Zhou Q, et al. Development of patient-specific three-dimensional pediatric cardiac models. ASAIO J, 2006,52(3):349-353.
[18] Kim MS, Hansgen AR, Wink O, et al. Rapid prototyping: A new tool in understanding and treating structural heart disease. Circulation, 2008,117(18):2388-2394.
[19] Mahmood F, Owais K, Taylor C, et al. Three-dimensional printing of mitral valve using echocardiographic data. JACC Cardiovasc Imaging, 2015,8(2):227-229.
[20] Witschey WR, Pouch AM, McGarvey JR, et al. Three-dimensional ultrasound-derived physical mitral valve modeling. Ann Thorac Surg, 2014,98(2):691-694.
[21] Owais K, Pal A, Matyal R, et al. Three-dimensional printing of the mitral annulus using echocardiographic data: Science fiction or in the operating room next door? J Cardiothorac Vasc Anesth, 2014,28(5):1393-1396.
[22] Kapadia SR, Leon MB, Makkar PR, et al. 5-year outcomes of transcatheter aortic valve replacement compared with standard treatment for patients with inoperable aortic stenosis (PARTNER 1): A randomised controlled trial. Lancet, 2015,385(9986):2485-2491.
[23] Ripley B, Kelil T, Cheezum MK, et al. 3D printing based on cardiac CT assists anatomic visualization prior to transcatheter aortic valve replacement. J Cardiovasc Comput Tomogr, 2016,10(1):28-36.
[24] Fujita T, Saito N, Minakata K, et al. Transfemoral transcatheter aortic valve implantation in the presence of a mechanical mitral valve prosthesis using a dedicated TAVI guidewire: Utility of a patient-specific three-dimensional heart model. Cardiovasc Interv Ther, 2016 Aug 27. [Epub ahead of print]
[25] Yamanami M, Yahata Y, Tajikawa T, et al. Preparation of in-vivo tissue-engineered valved conduit with the sinus of Valsalva (type Ⅳ biovalve). J Artif Organs, 2010,13(2):106-112.
[26] Yamanami M, Yahata Y, Uechi M, et al. Development of a completely autologous valved conduit with the sinus of Valsalva using in-body tissue architecture technology: A pilot study in pulmonary valve replacement in a beagle model. Circulation, 2010,122(11 Suppl):S100-S106.
[27] Kishimoto S, Takewa Y, Nakayama Y, et al. Sutureless aortic valve replacement using a novel autologous tissue heart valve with stent (stent biovalve): Proof of concept. J Artif Organs, 2015,18(2):185-190
[28] Schmauss D, Juchem G, Weber S, et al. Three-dimensional printing for perioperative planning of complex aortic arch surgery. Ann Thorac Surg, 2014,97(6):2160-2163.
[29] Sodian R, Schmauss D, Schmitz C, et al. 3-dimensional printing of models to create custom-made devices for coil embolization of an anastomotic leak after aortic arch replacement. Ann Thorac Surg, 2009, 88(3):974-978.
[30] Dickinson KJ, Matsumoto J, Cassivi SD, et al. Individualizing management of complex esophageal pathology using three-dimensional printed models. Ann Thorac Surg, 2015,100(2):692-697.
[31] Tam MD, Laycock SD, Brown JR, et al. 3D printing of an aortic aneurysm to facilitate decision making and device selection for endovascular aneurysm repair in complex neck anatomy. J Endovasc Ther, 2013,20(6):863-867.
[32] Bauch T, Vijayaraman P, Dandamudi G, et al. Three-dimensional printing for in vivo visualization of his bundle pacing leads. Am J Cardiol, 2015,116(3):485-486.
[33] Landmesser U, Holmes DR Jr. Left atrial appendage closure: A percutaneous transcatheter approach for stroke prevention in atrial fibrillation. Eur Heart J, 2012,33(6):698-704
[34] Faletra FF, Pedrazzini G, Pasotti E, et al. 3D TEE during catheter-based interventions. JACC Cardiovasc Imaging, 2014,7(3):292-308.
[35] Otton JM, Spina R, Sulas R, et al. Left atrial appendage closure guided by personalized 3D-printed cardiac reconstruction. JACC Cardiovasc Interv, 2015,8(7):1004-1006
[36] 宋宏宁,周青,邓倾,等.基于三维经食管超声的3D打印模型指导左心耳封堵的可行性研究.中华超声影像学杂志,2016,25(4):294-299
[37] Mathur M, Patil P, Bove A. The role of 3D printing in structural heart disease: All that glitters is not gold. JACC Cardiovasc Imaging, 2015,8(8):987-988.
[38] Tam MD, Laycock SD, Brown JR, et al. 3D printing of an aortic aneurysm to facilitate decision making and device selection for endovascular aneurysm repair in complex neck anatomy. Endovasc Ther, 2013,20(6):863-867.
[39] Gao Q, He Y, Fu JZ, et al. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials, 2015,61:203-215.
[40] Gaetani R, Doevendans PA, Metz CH, et al. Cardiac tissue engineering using tissue printing technology and human cardiac progenitor cells. Biomaterials, 2012,33(6):1782-1790.
R445
A
1003-3289(2017)03-0375-06
