黄连解毒汤提取物对原代神经元氧糖剥夺再灌注损伤后5-脂氧酶活性的影响*
2017-03-29黄竹燕叶夷露刘丹丹潘蓓蓓俞月萍
徐 静 黄竹燕 叶夷露 刘丹丹 潘蓓蓓 俞月萍 张 琦#
1 温州医科大学 浙江 温州 325035
2 杭州医学院 浙江 杭州 310053
3 浙江大学医学院附属第二医院 浙江 杭州 310009
黄连解毒汤提取物对原代神经元氧糖剥夺再灌注损伤后5-脂氧酶活性的影响*
徐 静1,2黄竹燕3叶夷露2刘丹丹2潘蓓蓓3俞月萍2张 琦1,2#
1 温州医科大学 浙江 温州 325035
2 杭州医学院 浙江 杭州 310053
3 浙江大学医学院附属第二医院 浙江 杭州 310009
黄连解毒汤 原代神经元氧糖剥夺 再灌注损伤 5-脂氧酶 半胱氨酰白三烯 大鼠
脑缺血是严重危害人类健康的神经系统疾病。5-脂氧酶(5-LOX)是催化花生四烯酸生成白三烯(LTs)的关键酶。大量研究证实,5-LOX及其代谢产物半胱氨酰白三烯(CysLTs)介导脑缺血后炎症反应,5-LOX抑制剂和CysLTs受体拮抗剂对脑缺血损伤具有保护作用[1-2],表明5-LOX/CysLTs通路参与脑缺血再灌注损伤的病理生理过程。
黄连解毒汤(HJD)是清热解毒的经典方剂。国内外研究表明HJD传统水煎剂对体内、外脑缺血损伤均具有保护作用[3]。本研究采用大孔树脂吸附法分离制备获得50%乙醇提取物HJDEE50,观察HJDEE50对大鼠原代皮质神经元糖氧剥夺(OGD)再灌注损伤的保护作用及对5-LOX活性的影响。
1 材料与方法
1.1 实验动物:SPF级新生SD大鼠(24h内)由上海斯莱克实验动物有限公司提供[实验动物合格证号:SCXK(沪)2012-0002]。
1.2 主要试剂与仪器:栀子苷、黄芩苷、盐酸小檗碱和盐酸巴马汀对照品购自中国药品生物制品检定所;汉黄芩素、汉黄芩苷和黄芩素对照品购自上海泽衡生物技术有限公司。连二亚硫酸钠(Na2S2O4)和四甲基偶氮唑盐(MTT)购自Sigma公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京凯基生物科技发展有限公司;兔抗多克隆5-LOX抗体购自Santa cruz公司;CysLTs酶联免疫吸附试剂盒购自美国Cayman公司。高效液相色谱仪(Lumtech K501双泵,德国),紫外可变波长检测器(Lumtech K2501,德国),CO2培养箱(HF151,香港力康),酶标仪(Mul tiskan MK3,美国),流式细胞检测仪(Beckman,美国)。
1.3 药物制备和含量测定:黄连、黄芩、黄柏、栀子由华东医药股份有限公司提供并经鉴定,按3∶3∶2∶3的比例组方,蒸馏水浸泡2h,分别用水、50%乙醇、80%乙醇煎制,过滤后合并滤液,减压浓缩至生药含量为1.0g/ml的HJD浸膏。浸膏稀释1倍后上D101型大孔树脂柱,50%乙醇洗脱,洗脱液减压浓缩干燥得到HJDEE50。采用本实验室建立的RP-HPLC法,测定HJDEE50中7个指标性成分的含量[4]。
1.4 原代皮质神经元培养:新生24h内SD大鼠,分离剪碎大脑皮质,0.027%胰蛋白酶液37℃消化20min,含血清培养液终止消化,吹打后过200目筛网。离心后用种植液(DMEM-HG+10%FBS+10%HS)重悬,以1×106个/ml接种于96孔板内。24h后换维持培养液(NB+2%B-27+1% L-Glutamine),第3d加入5µg/ml阿糖胞苷。每隔2~3d换液,培养至7~9d后随机分组实验。
1.5 原代皮质神经元OGD模型制备和实验分组:正常对照组用DMEM-HG孵育。OGD模型组神经元用无糖DMEMHG+10mmol/L Na2S2O4孵育20min后,换正常培养液再灌注 1h。齐留通组(10μmol/L)、HJD组(10mg/L)和HJDEE50组(1、10和100mg/L)分别于神经元OGD损伤前30min开始孵育,并维持至实验结束。
1.6 细胞存活率检测:弃去孔板中培养液,加入终浓度为0.5mg/ml的MTT溶液,于37℃、5%CO2培养箱培养4h后弃上液,每孔加入150μl DMSO振荡10min。在490nm处测定吸光度(OD值),细胞存活率(%)=(实验组OD值-空白组OD值)/(正常对照组OD值-空白组OD值)× 100%。筛选出HJDEE50作用的最佳剂量。
1.7 流式细胞检测技术:细胞消化5min后,吹打细胞,收集细胞悬液,离心10min(1000rpm),弃上清,加0.5ml结合缓冲液重悬后,加入10μl PI与5μl Annexin VFITC,室温下避光孵育5~10min,之后用流式细胞仪进行检测。
1.8 免疫细胞化学法:准备好细胞爬片。采用兔抗5-LOX多克隆抗体(1∶50)和兔IgG-两步法免疫组化试剂盒(即用型),按照说明书进行免疫细胞化学染色,DAB显色,乙醇梯度脱水,中性树脂和二甲苯(1∶1)封片。
1.9 酶联免疫吸附法:各组参照1.5中的方法进行OGD建模。结束后,培养基中取细胞样本200μl,离心后取上清备用。根据酶联免疫反应试剂盒说明书步骤,测定CysLTs的含量。
1.10 统计学方法:数据用均数±标准差(-x±s)表示。采用SPSS 19.0统计软件包进行分析,以单因素方差分析进行多组间差异的比较,以P<0.05认为差异有统计学意义。
2 结果
2.1 HJDEE50中指标性成分的含量:RP-HPLC结果显示,在本色谱条件下7种标准品能达到较好分离。HJD主要含有7种指标性成分,含量分别为:栀子苷(1.46±0.02)%、黄芩苷(5.57±0.05)%、巴马汀(0.80±0.01)%、小檗碱(5.18± 0.04)%、汉黄芩苷(0.98±0.01)%、黄芩素(1.36±0.02)%、汉黄芩素(0.45±0.02)%,总含量为15.8%。HJDEE50主要含有4种指标性成分,其含量分别为:黄芩苷(23.99± 0.38)%、小檗碱(22.13±0.37)%、汉黄芩苷(5.19± 0.03)%、巴马汀(3.93±0.00)%,总含量为55.24%。
2.2 HJDEE50对原代神经元OGD再灌注损伤后存活率的影响:MTT法结果表明,OGD再灌注损伤使神经元存活率显著降低。与模型组比较,HJDEE50(1、10、100mg/L)均可提高神经元存活率(P<0.05或P<0.01),有效剂量范围较广,最佳有效剂量为1mg/L,后续实验将采用该剂量。与HJD(10mg/L)相比,HJDEE50(1mg/L)显著提高神经元存活率(P<0.01)。详见表1。
表1 HJDEE50对神经元存活率的影响(±s)
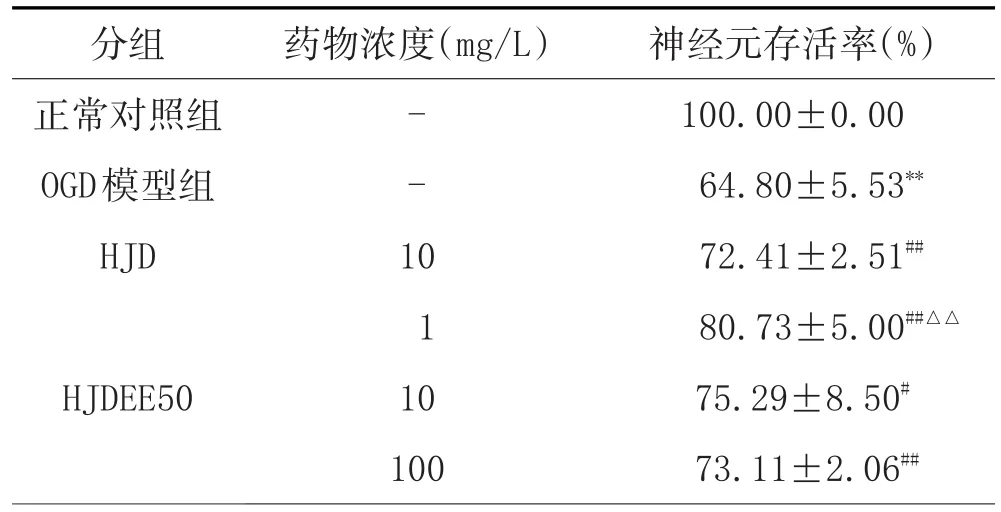
表1 HJDEE50对神经元存活率的影响(±s)
注:与正常对照组比较,**P<0.01;与OGD模型组比较,#P<0.05,##P<0.01;与HJD组比较,△△P<0.01。
分组正常对照组OGD模型组HJD HJDEE50药物浓度(mg/L)--1 011 0 100神经元存活率(%)100.00±0.00 64.80±5.53**72.41±2.51##80.73±5.00##△△75.29±8.50#73.11±2.06##
2.3 HJDEE50对神经元凋亡情况的影响:正常对照组活细胞数量约为95%;OGD模型组早期与中晚期凋亡细胞数量均显著增加,活细胞数量显著减少(P<0.01)。与模型组比较,HJDEE50(1mg/L)组早期和中晚期凋亡细胞均显著减少(P<0.01)。与HJD相比,HJDEE50对细胞凋亡的抑制作用稍弱(P<0.01)。详见图1。

图1 HJDEE50对神经元凋亡的影响
2.4 HJDEE50对原代神经元OGD再灌注损伤后5-LOX分布的影响:正常对照组原代皮质神经元处于静息状态时,5-LOX均匀分布于细胞核、细胞质与突起上。OGD模型组约30%神经元中的5-LOX转移到细胞核膜上,核染色加深,胞浆中有颗粒聚集。与模型组比较,HJDEE50组显著抑制了5-LOX核膜转移,使核膜转移细胞数目下降约17%,胞浆中颗粒减少(P<0.01)。但与HJD组相比,无显著性差异(P>0.05)。详见图2。

图2 HJDEE50对5-LOX核膜转移的影响
2.5 HJDEE50对原代神经元OGD再灌注损伤后CysLTs含量的影响:正常对照组CysLTs含量为423.1± 9.15pg/ml,OGD模型组CysLTs含量显著增加,达531.7±21.71pg/ml(P<0.01)。与模型组比较,齐留通组、HJD组和HJDEE50组均显著减少,CysLTs含量分别降至455.7±22.31pg/ml、444.0±17.47pg/ml和464.2± 44.67pg/ml(P<0.05或P<0.01)。与HJD组比较,HJDEE50组CysLTs含量无显著差异。详见图3。
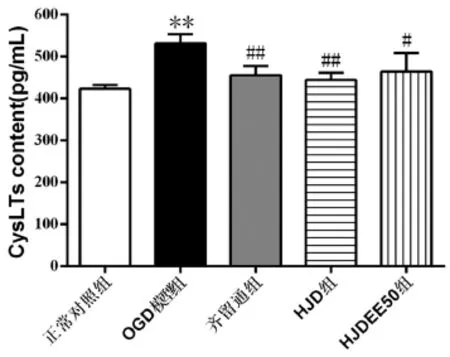
图3 HJDEE50对CysLTs含量的影响
3 讨论
本研究发现,HJDEE50中指标性成分含量显著高于HJD,可显著提高OGD再灌注损伤后神经元存活率、抑制神经元凋亡。其作用机制可能与抑制神经元5-LOX核膜转移、减少花生四烯酸代谢产物CysLTs含量,从而减轻炎症反应相关。
5-LOX/CysLTs通路介导脑缺血损伤。Ciceri等[5]发现大鼠脑缺血后,大鼠脑内CysLTs显著增加。通过检查脑缺血死亡病人的脑组织,发现脑内5-LOX表达增加,并被激活[6]。静息状态时,5-LOX主要分布在细胞核、细胞质中,当被激活时5-LOX向核膜移位,代谢产物白三烯释放增加。因此,5-LOX发生核膜转移是其被激活的表现方式,并常作为药物抗炎作用的靶点[7]。本研究结果发现,原代皮质神经元OGD再灌注损伤后,约30%神经元的5-LOX发生了核膜移位,CysLTs释放增加,同时神经元活性下降,凋亡细胞增多。HJD和HJDEE50显著抑制神经元5-LOX核膜移位和CysLTs释放,增加神经元活性,减少神经元凋亡。上述结果提示,HJD和HJDEE50可能通过抑制5-LOX激活发挥抗神经元OGD损伤作用。
RP-HPLC结果显示,HJD含有7种指标性成分,HJDEE50仅含有4种,缺少栀子苷、黄芩素和汉黄芩素,这可能与各成分在不同溶剂中的溶解度不同有关。但就指标性成分的含量而言,HJDEE50中4种成分总含量达到55.24%,显著高于HJD中的7种成分的总含量,表明HJDEE50具有开发新药的潜力。因此,研究HJDEE50对大鼠皮质神经元OGD再灌注损伤的作用,对于HJD经典方的二次开发工作具有重要意义。
研究发现,黄连解毒汤全方对缺血性脑损伤作用的强弱与方中主要指标性成分小檗碱、黄芩苷、栀子苷的含量相关[8]。HJD和HJDEE50抑制神经元OGD损伤后5-LOX激活可能与指标性成分的作用有关。已有研究表明,黄芩苷可抑制5-LOX核膜移位、减少炎症产物CysLTs生成,发挥抗脑缺血作用[9-10]。然而,HJDEE50抑制5-LOX核膜移位的具体成分和作用机制尚不清楚,需要后续研究进一步证实。
总之,本研究结果表明HJDEE50对大鼠原代皮质神经元OGD再灌注损伤具有较好的保护作用,其机制可能与5-LOX/CysLTs通路有关。
[1]Si lva BC,de Miranda AS,Rodrigues FG,et al.The 5-l ipoxygenase(5-LOX)inhibitor zi leuton reduces inf lammation and infarct size with improvement in neurological outcome fol lowing cerebral ischemia[J]. Curr Neurovasc Res,2015,12(4):398-403.
[2]Shi QJ,Wang H,Liu ZX,et al.HAMI 3379,a CysLT2R antagonist,dose and time dependent ly at tenuates brain injury and inhibits microgl ial inf lammation af ter focal cerebral ischemia in rats[J].Neuroscience,2015,291:53-69.
[3]张鹏晖,张建亭.黄连解毒汤药理作用研究进展[J].浙江中医杂志,2012,47(6):458-460.
[4]黄春燕,姜莉莉,王玮,等.RP-HPLC同时测定黄连解毒汤7种活性成分[J].浙江预防医学,2011,23(11):15-19.
[5]Ciceri P,Rabuf fetti M,Monopol i A,et al.Production of leukot rienes in a model of focal cerebral ischaemia in the rat[J].Br J Pharmacol,2001,133(8): 1323-1329.
[6]Tomimoto H,Shibata M,Ihara M,et al.A comparative study on the expression of cyclooxygenase and 5-l ipoxygenase during cerebral ischemia in humans[J]. Acta Neuropathol,2002,104(6):601-607.
[7]Radmark O,and Samuelsson B.5-l ipoxygenase:regulation and possible involvement in atherosclerosis [J].Prostaglandins Other Lipid Mediat,2007,83(3): 162-174.
[8]钱智磊,李欢,朱华旭,等.黄连解毒汤中指标性成分药动学与药效学相关性的初步研究[J].中国实验方剂学杂志,2011,17(11):122-128.
[9]涂献坤,杨卫忠,石松生,等.黄芩苷通过抑制5-脂氧合酶活性减轻大鼠脑缺血炎症反应和脂质过氧化反应[J].解剖学杂志,2014,37(1):51-53.
[10]Li CT,Zhang WP,Fang SH,et al.Baical in at tenuates oxygen glucose deprivation induced injury by inhibiting oxidative st ress-mediated 5-lipoxygenase activation in PC12 cel ls[J].Acta Pharmacol Sin,2010,31(2):137-144.
2016-11-18
浙江省中医药科技计划项目黄连解毒汤活性部位对体内外神经细胞损伤的保护作用,编号:2012ZA025
# 通讯作者:张 琦,E-mail:zhangqiwzh@163.com
