肝脏恶性肿瘤射频消融术后即刻超声造影的临床价值
2017-03-29谢璐璐廖锦堂李悦怡黄云周乐杜李文政龙学颖
谢璐璐,廖锦堂,李悦怡,黄云,周乐杜,李文政,龙学颖
(中南大学湘雅医院 1.超声影像科 2.普通外科 3.放射科,湖南 长沙 410008)
射频消融(Radiofrequency Ablation,RFA)是肝脏恶性肿瘤非手术治疗的主要方法之一,与手术相比,RFA具有创伤小,并发症少,对复发、转移病灶能多次治疗的优点。近期文献[1]报道,原发性肝细胞肝癌患者在RFA治疗后5年生存率达40%~70%。但是由于肿瘤形状的不规则及热凝区域的不规则,在三维上容易出现热凝的漏空,导致肿瘤残存,是影响治疗效果的重要因素。目前,RFA治疗后疗效评价的主要方法包括增强CT/MRI以及超声造影(contrast-enhanced ultrasonography,CEUS)。本研究在肝脏恶性肿瘤RFA术后即刻应用CEUS检查对消融区进行评估,对于发现残存的病灶,在术中进行补充治疗,以探讨即刻CEUS的应用在提高肝脏恶性肿瘤RFA治疗疗效的价值。
1 资料与方法
1.1 研究对象
以中南大学湘雅医院2014年10月—2015年12月收治的60例肝脏恶性肿瘤患者为研究对象(共76个病灶)完全随机分为两组,试验组和对照组,每组各30例。所有患者均符合肝脏恶性肿瘤RFA治疗纳入标准:⑴ 不愿意手术治疗或不符合手术治疗适应症的患者;⑵ 单个病灶且病灶最大直径≤5cm,或多个病灶者病灶数目≤3个且病灶最大直径≤3cm;⑶ 肝功能分级:Child-Pugh A级或B级,或经内科治疗后达到该标准;⑷ 门静脉主干及分支内无癌栓,未侵犯邻近器官且肝外无转移灶。
1.2 仪器
超声仪器选用Siemens ACUSON S2000彩色多普勒超声诊断仪,具有实时谐波超声造影功能,采用4C1探头(频率为2.0~4.5 MHz),机械指数(mechanical index,MI)0.05~0.06。造影剂为意大利Bracco公司生产的SonoVue(注射用六氟化硫微泡),使用时加入5mL注射用生理盐水振摇后形成微泡混悬液,5mL注射器抽取上述混悬液2.4mL,经肘部浅静脉团注,随后用5mL注射用生理盐水冲管。观察动脉期(10~20 s开始,25~35 s结束),门脉期(30~45 s开始,120 s结束)及延迟期(120 s开始,240~360 s结束)肿瘤增强情况,并以超声仪器内置工作站记录造影全过程。
射频治疗仪为迈德医疗科技(上海)有限公司生产的S-1500射频仪,可手动调节功率与治疗时间。电极针为3.5cm、15 G伞状多极治疗针,长20cm,前端伞状针尖可收缩回纳至针内。
1.3 研究方法
两组患者术前1个月内均行CEUS或增强CT/MRI检查,记录患者病灶位置、大小、数目、形态、边界、供血情况及造影增强模式。
两组均采用超声实时引导下经皮RFA治疗:患者取平卧位或左侧卧位,背部贴电极片。二维超声定位病灶后,常规消毒、铺巾,利多卡因局部浸润麻醉,监测患者血压、心率等生命体征。在超声引导下,根据术前拟定的布针方案,将射频电极置入病灶内,打开伞状针尖。自小功率20 W开始,每分钟增加功率10 W,至射频针尖局部温度达50 ℃时维持功率不变3 min后,再次定时上调功率至阻抗上升至无穷大时结束。病灶消融结束后进行针道消融。对<3cm的病灶实行单点消融,3~5cm的病灶实行多点消融,最大限度使消融范围完全覆盖病灶并保证病灶周围0.5~1.0cm的安全边界。
消融治疗结束后,试验组于5~10 min内行CEUS检查,观察射频病灶内及周边的造影剂灌注情况,若发现异常增强区,则提示肿瘤残存,调整射频针的位置,将其置于异常增强区内,补充消融治疗,至造影检查无肿瘤残存方可结束。
评价肿瘤残存的标准:⑴ 造影条件下,动脉期消融灶内或周边见不规则高增强区,并于门脉期或延迟期呈低增强为病灶残存;⑵ 动脉期未见明显不规则高增强区,但门脉期或延迟期见不规则低增强区为可疑残存;⑶ 消融后即刻超声造影或第一个月影像检查坏死灶范围较原病灶范围小,为残存。
1.4 疗效评价及随访
所有患者对超声造影剂及CT/MRI造影剂均无过敏反应,且在RFA治疗过程中及治疗后未发生严重并发症。
试验组患者术后36~48 h行CEUS检查,所有患者术后及1个月复查CEUS、增强CT(或增强MRI)、肝功能及肿瘤标志物。病灶完全灭活、残存或复发的最终诊断依靠至少两种增强影像学检查(CEUS、增强CT、增强MRI)或病理活检进行综合判断。所有CEUS诊断均由2名高年资超声医师共同完成,超声造影医师及增强CT/MRI医师各自独立完成对RFA疗效的评估。
1.5 统计学处理
采用SPSS 18.0统计学软件,计量资料以均数±标准差表示,计量资料的比较用t检验,计数资料的比较用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料特征
试验组30例(共41个病灶);男27例,女3例;平均年龄(55.47±10.04)岁;病灶平均大小(20.23±10.15)mm;原发性肝脏恶性肿瘤(包括肝细胞性肝脏恶性肿瘤和胆管细胞性肝脏恶性肿瘤)31灶,转移性肝脏恶性肿瘤10灶。对照组30例(共35个病灶);男25例,女5例;平均年龄(53.23±11.33)岁;病灶平均(21.93±10.29)cm;原发性肝癌27灶,转移性肝癌8灶。经比较,两组患者性别比例、平均年龄、原发性肝癌与转移性肝癌比例、肝功能、甲胎蛋白等一般资料均无统计学差异(均P>0.05)(表1)。

表1 60例肝脏恶性肿瘤患者术前一般资料Table 1 Preoperative data of the 60 patients with malignant hepatic lesions
2.2 两组完全消融率的比较
试验组患者30例41个病灶,在RFA术后行即刻CEUS检查,发现5例患者的5处病灶出现病灶内或周边不规则动脉期高增强,即残存。再次进针对残存区进行消融。此5处病灶再次消融后,CEUS检查均达到完全消融。对照组30例患者共35个病灶,RFA术后未行即刻CEUS检查。
两组患者1个月后均行CEUS、增强CT/MRI检查,CEUS诊断结果与增强CT/MRI一致:试验组1例患者发现1处病灶残存(1/41)(图1),对照组发现7处病灶残存(7/35)(图2)。两组患者病灶完全消融率的比较,差异有统计学意义(χ2=4.459,P=0.035)(表2)。

图1 试验组41岁中年男性HCC患者 A:RFA后即刻CEUS,发现治疗灶近膈肌处残存(红色箭头);B:RFA术后1个月复查CEUS,治疗灶无残存Figure 1 A 41-year old male patients in study group A: Presence of tumor residue tumor residue in the ablation region near the diaphragm(red arrow) showed by CEUS immediately after RFA; B: Absence of tumor residue in the ablation region showed by second CEUS one month after RFA

图2 对照组55岁女性HCC患者 A:RFA术前病灶CEUS动脉期高增强;B:RFA术后1个月复查CEUS,治疗灶残存Figure 2 A 55-year old female patients in control group A: CEUS enhancement pattern of lesion in arterial phase before RFA;B: Presence of tumor residue in the ablation region showed by second CEUS one month after RFA
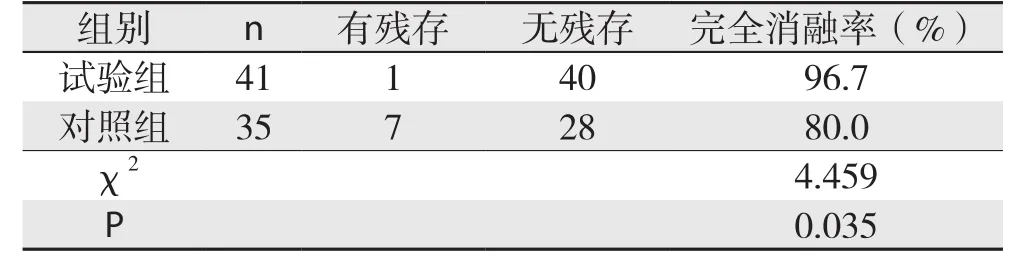
表2 试验组与非对照组1个月完全消融率的比较Table 2 Comparison of the complete ablation rates betweenstudy group and control group one month later
2.3 试验组患者即刻CEUS与36~48 hCEUS充血水肿带的比较
试验组患者RFA治疗后分别于即刻及36~48 h行CEUS检查,均于动脉期测量射频灶周围充血水肿带的宽度,测得宽度分别为(6.89±2.73)mm、(4.68±2.05)mm。术后即刻与术后36~48 h充血水肿带宽度的比较,差异有统计学意义(t=8.21,P=0.00)。
3 讨 论
RFA治疗肝脏恶性肿瘤的疗效主要决定于病灶是否完全消融,初次消融肿瘤即获整体灭活是降低复发转移的关键[2]。消融范围不足是导致肿瘤局部复发的重要因素[3-4]。Lencioni等[5]的研究表明,对于原发性肝癌病灶,为了保证安全的“无瘤边缘”,消融范围应该超过肿瘤边界的0.5~1.0cm。根据Wang等[6]的研究,在结直肠癌肝转移的患者对转移病灶的进行射频消融治疗时,为了保证可靠的治疗效果,消融范围应该超过肿瘤边界至少5 mm。超过1.0cm的安全边界有降低转移性肝癌局部肿瘤进展的可能性。但是由于肿瘤形状的不规则及热凝区域的不规则,在三维上容易出现热凝的漏空,导致肿瘤残存。RFA治疗后病灶的残存和局部复发是影响疗效的重要因素,与未经射频治疗的肿瘤病灶相比,RFA后局部复发肿瘤的侵袭性生长及血管侵犯特征更加明显,分化程度更低[7]。根据Zhang等[7]的研究,RFA不完全消融增加了残存肿瘤细胞的侵袭性和转移性。因此,要想获得理想的治疗效果,关键在于一次治疗使病灶整体灭活,降低术后肿瘤残存率。
3.1 RFA术后即刻CEUS的价值
在肝脏恶性肿瘤的RFA治疗中,要达到理想的消融效果,需要及时对病灶的灭活情况进行评估。目前常用的疗效评价方法主要有增强CT和增强MRI,以及CEUS。但是受到仪器设备的限制,增强CT/CEMRI无法在消融过程中实时监测。近年来CEUS发展迅速,不仅可以实时动态地进行术中监测,也能较准确地对疗效予以评价[8-12]。根据文献[13]报道,射频消融术后24 h超声造影对疗效的评估与24 h CECT/CEMRI准确性相当。
根据本研究结果,术后1个月复查,试验组病灶的完全消融率为97.6%(40/41),对照组完全消融率为80%(28/35),两组术后1个月完全消融率的比较具有统计学差异。即刻CEUS时上述残存灶表现为坏死灶周边动脉期结节样不规则高增强,门脉期呈等增强或低增强,延迟期均呈低增强,基本与病灶治疗前CEUS表现一致。在RFA术后即刻行CEUS检查,能够有效地发现残存病灶,并且能够帮助定位进行残存灶的再次消融,降低术后残存率,有效避免二次手术,减轻患者的痛苦。
在RFA术后首次CEUS检查(即试验组术后第1次即刻CEUS,对照组1个月后CEUS),发现试验组5例患者5处病灶残存,对照组7名患者7处病灶残存。在所有出现残存的12个病灶中:⑴ 6处病灶(试验组3处,对照组3处)位置较深,射频治疗时超声引导切面测量病灶距体表距离≥7cm,其中4处病灶距体表约9cm(图3)。⑵ 2处病灶(均为对照组)较大,最大直径分别为42、43 mm。⑶ 1处病灶(试验组)内有较粗的血管穿行(图4)。而现有的研究[14-16]表明RFA治疗能否完全灭活病灶与病灶的大小密切相关,肿瘤的位置也会影响RFA的疗效,靠近血管、膈肌、胆囊及胃肠道的肿瘤,其治疗效果相对较差。对直径≤3cm的HCC病灶,RFA可以作为安全有效的一线治疗方法。组织学研究[17]发现,直径>3cm或者位于血管旁(与血管距离<5 mm)的肿瘤,射频消融治疗后,肿瘤完全灭活率明显降低;位于血管旁的病灶容易受到血流“热沉降效应”的影响,血液流动会带走部分热量使组织温度下降,导致可达到的最高温度降低[18],不足以使肿瘤细胞灭活,而导致残存。在CEUS模式下,当深度≥8cm时,衰减明显增加,图像显示清晰度明显降低,降低术前病灶范围评估的准确性,同时,病灶位置较深增加了射频针穿刺定位的难度。此外,试验组1个月后CEUS时,发现1处病灶残存,此病灶在即刻CEUS时未发现残存,分析其可能原因为该病灶位置较深,距体表约9.2cm,声衰减使图像清晰度减低且受到RFA过程中产生的气体的影响,难以分辨残存肿瘤。

图3 对照组63岁男性HCC患者 病灶直径>3cm(34 mm×32 mm),超声造影切面病灶距体表>8cm,1个月复查病灶近膈肌处残存Figure 3 A 63-year old male patients with HCC Diameter of the lesion larger than 3cm (34 mm×32 mm),distance of the lesion from body surface larger than 8cm in the ultrasound sectional image,and presence of tumor residue in the ablation region near the diaphragm one month later

图4 对照组60岁男性HCC患者 病灶内有1条较粗动脉血管穿行,1个月复查病灶与血管邻近处残存Figure 4 A 60-year old male patients with HCC A relatively large artery passing through inside the lesion,and presence of tumor residue adjacent to the artery one month later
本研究中,试验组的30例患者共41个病灶在射频术后5~10 min内超声造影检查,发现5处病灶残存,残存率为12.2%(5/41)。明显低于大多数文献[13,19]中报道的残存率,可能的原因是本研究纳入的病灶平均直径较小,试验组41个病灶中仅5个病灶直径>3cm,需要多点消融的病灶较少,大部分病灶将射频电极的伞状多极针全部打开足以覆盖整个病灶的范围。
3.2 RFA术后即刻CEUS与36~48 h CEUS充血水肿带的比较
在RFA术后早期几乎所有的影像检查方法都会面临充血水肿带的困扰。充血水肿带是肝脏组织热损伤后出现的炎症反应,在消融术后即刻出现,并于1~2个月内逐渐消退。在CEUS模式下,该充血水肿带动脉期表现为形态规则,厚度较均匀的高增强,呈环形围绕在坏死区的周围,门脉期及延迟期造影剂不消退,随着周围正常肝组织内造影剂灌注增加,表现为等增强[20]。而残存肿瘤表现为局灶性或结节样不规则增强。尽管如此,部分直径较小的残存肿瘤可能覆盖于充血水肿带内难以辨别。而进入门脉期以后,随着周围正常肝组织内造影剂灌注的不断增加,不论是充血水肿带还是残存病灶都有被掩盖的可能,这些情况都可能导致假阴性结果的出现。此外,如果消融坏死区的形态不规则,其周围的充血水肿带也会呈现为不规则形状,最后导致假阳性结果的出现。根据本研究结果,RFA术后即刻充血水肿带宽度为(6.89±2.73)mm,术后36~48 h充血水肿带宽度为(4.68±2.05)mm,两组充血水肿带宽度差异具有统计学意义,术后36~48 h CEUS充血水肿较术后即刻有所减轻。
在本研究中,即刻CEUS与36~48 h后CEUS对充血水肿带的测量结果虽然存在差异,两次检查对治疗后病灶有无残存的诊断结果是一致的。由于1个月后复查,试验组仅1例患者出现残存,上述结果的出现可能是阳性例数太少而存在偏倚所致。因此,术后即刻与术后36~48 h充血水肿带宽度变化对CEUS诊断准确性的影响,尚需要更大样本的研究进一步探讨。
肝脏恶性肿瘤RFA治疗后即刻CEUS能及时发现残存肿瘤并指导补充治疗,提高了治疗完全消融率,减轻了患者的治疗痛苦和经济负担。
[1]Facciorusso A,Serviddio G,Muscatiello N.Local ablative treatments for hepatocellular carcinoma: An updated review[J].World J Gastrointest Pharmacol Ther,2016,7(4):477–489.
[2]Tateishi R,Shiina S,Teratani T,et al.Percutaneous radiofrequency ablation for hepatocellular carcinoma.An analysis of 1000 cases[J].Cancer,2005.103(6):1201–1209.
[3]Koda M,Tokunaga S,Okamoto T,et al.Clinical usefulness of the ablative margin assessed by magnetic resonance imaging with Gd-EOB-DTPA for radiofrequency ablation of hepatocellular carcinoma[J].J Hepatol,2015,63(6):1360–1367.doi: 10.1016/j.jhep.2015.07.023.
[4]Kim YS,Lee WJ,Rhim H,et al.The minimal ablative margin of radiofrequency ablation of hepatocellular carcinoma (> 2 and < 5cm) needed to prevent local tumor progression: 3D quantitative assessment using CT image fusion[J].AJR Am J Roentgenol,2010,195(3):758–765.doi: 10.2214/AJR.09.2954.
[5]Lencioni R,de Baere T,Martin RC,et al.Image-Guided Ablation of Malignant Liver Tumors: Recommendations for Clinical Validation of Novel Thermal and Non-Thermal Technologies - A Western Perspective[J].Liver Cancer,2015,4(4):208–214.doi:10.1159/000367747.
[6]Wang X,Sofocleous CT,Erinjeri JP,et al.Margin size is an independent predictor of local tumor progression after ablation of colon cancer liver metastases[J].Cardiovasc Intervent Radiol,2013,36(1):166–175.doi: 10.1007/s00270–012–0377–1.
[7]Zhang N,Wang L,Chai ZT,et al.Incomplete radiofrequency ablation enhances invasiveness and metastasis of residual cancer of hepatocellular carcinoma cell HCCLM3 via activating beta-catenin signaling[J].PLoS One,2014.9(12):e115949.doi: 10.1371/journal.pone.0115949.
[8]Lee J,Lee JM,Yoon JH,et al.Percutaneous radiofrequency ablation with multiple electrodes for medium-sized hepatocellular carcinomas[J].Korean J Radiol,2012,13(1):34–43.doi: 10.3348/kjr.2012.13.1.34.
[9]Wu JY,Chen MH,Yang W,et al.Role of contrast enhanced ultrasound in radiofrequency ablation of metastatic liver carcinoma[J].Chin J Cancer Res,2012.24(1):44–51.doi: 10.1007/s11670–012–0044–8.
[10]Zheng SG,Xu HX,Lu MD,et al.Role of contrast-enhanced ultrasound in follow-up assessment after ablation for hepatocellular carcinoma[J].World J Gastroenterol,2013,19(6):855–865.doi:10.3748/wjg.v19.i6.855.
[11]Minami Y,Kudo M.Therapeutic response assessment of transcatheter arterial chemoembolization for hepatocellular carcinoma: ultrasonography,CT and MR imaging[J].Oncology,2013,84(Suppl 1):58–63.doi: 10.1159/000345891.
[12]Alzaraa A,Gravante G,Chung WY,et al.Contrast-enhanced ultrasound in the preoperative,intraoperative and postoperative assessment of liver lesions[J].Hepatol Res,2013,43(8):809–819.doi: 10.1111/hepr.12044.
[13]Meloni MF,Andreano A,Franza E,et al.Contrast enhanced ultrasound: Should it play a role in immediate evaluation of liver tumors following thermal ablation?[J].Eur J Radiol,2012,81(8):e897–902.doi: 10.1016/j.ejrad.2012.05.002.
[14]Kariyama K,Nouso K,Wakuta A,et al.Percutaneous radiofrequency ablation for treatment of hepatocellular carcinoma in the caudate lobe[J].AJR Am J Roentgenol,2011,197(4):W571–575.doi: 10.2214/AJR.11.6893.
[15]Tang Z,Fang H,Kang M,et al.Percutaneous radiofrequency ablation for liver tumors: Is it safer and more effective in low-risk areas than in high-risk areas?[J].Hepatol Res,2011,41(7):635–640.doi: 10.1111/j.1872–034X.2011.00817.x.
[16]Morimoto M,Numata K,Kondo M,et al.Radiofrequency ablation combined with transarterial chemoembolization for subcapsular hepatocellular carcinoma: a prospective cohort study[J].Eur J Radiol,2013,82(3):497–503.doi: 10.1016/j.ejrad.2012.09.014.
[17]Lencioni R,Crocetti L,De Simone P,et al.Loco-regional interventional treatment of hepatocellular carcinoma: techniques,outcomes,and future prospects[J].Transpl Int,2010,23(7):698–703.doi: 10.1111/j.1432–2277.2010.01109.x.
[18]Lencioni R,Crocetti L.Radiofrequency ablation of liver cancer[J].Tech Vasc Interv Radiol,2007,10(1):38–46.
[19]Park MH,Rhim H,Kim YS,et al.Spectrum of CT fi ndings after radiofrequency ablation of hepatic tumors[J].Radiographics,2008,28(2):379–390.doi: 10.1148/rg.282075038.
[20]Kim SK,Lim HK,Kim YH,et al.Hepatocellular carcinoma treated with radio-frequency ablation: spectrum of imaging findings[J].Radiographics,2003,23(1):107–121.
