膜联蛋白A2、上皮细胞钙黏蛋白及波形蛋白在肝内胆管结石相关肝内胆管癌中的表达及意义
2017-03-29柳志陈勇治舒健符洋王俊吕品张红辉周正
柳志,陈勇治,舒健,符洋,王俊,吕品,张红辉,周正
(湖南师范大学第一附属医院/湖南省人民医院 肝胆外科,湖南 长沙 410005)
肝内胆管癌是高度侵袭性胆管癌家族中一种亚型,来源于胆管上皮细胞,占所有胆管癌的20%~25%[1],具有高度恶性、高度侵袭性,其3、5年生存率分别为30%、18%[2]。肝内胆管结石是肝内胆管癌已明确的危险因素[3],肝内胆管结石相关肝内胆管癌患者由于发现时往往处于肿瘤晚期,伴有血管神经侵犯或转移,预后很差[4],因此寻找新的肿瘤生物标志物至关重要,以便早期发现、早治疗、早预防以及预测疾病的进展。膜联蛋白A2(annexin A2)是一类钙依赖磷脂蛋白,与肿瘤细胞的粘连、增殖、凋亡、侵犯、转移、肿瘤的新生血管生成有密切相关[5],研究[6]表明上皮-间质转化(epithelial-mesenchymaltransition,EMT)是肿瘤细胞具有迁移性和侵袭性的一个主要原因,本研究旨在探讨annexin A2与EMT重要生物标志物上皮细胞钙黏蛋白(E-cadherin)及波形蛋白(vimentin)[7]在肝内胆管结石合并肝内胆管癌组织中的表达情况、三者的相关性及临床意义。
1 材料与方法
1.1 病例资料
收集湖南省人民医院病理科2009年1月—2015年8月手术切除的肝内胆管组织的蜡块标本共131例。其中肝内胆管结石合并肝内胆管癌组织46例(肿瘤组),同期单纯肝内胆管结石患者胆管炎症组织标本50例,来自肝血管瘤旁、肝外伤行肝切除术的正常肝内胆管组织35例(正常组)。肿瘤组中男24例,女22例;根据WHO肿瘤分化诊断标准:低分化26例,中分化17例,高分化3例;根据第7版AJCC/UICC分期方法对ICC进行TNM分期[8]:I~II期15例,III~IV期31例;伴有淋巴结转移者20例,转移阴性者26例。所有的病例均得到术后病理证实,排除肿瘤组患者在术前接受过任何放、化疗者。
1.2 免疫组化检测annexin A2、E-cadherin及vimentin的表达
1.2.1主要试剂兔抗annexin A2单克隆抗体(ab41803)、兔抗E-cadherin单克隆抗体(ab15148)、兔抗vimentin单克隆抗体(ab16700)均购自Abcam公司。
1.2.2方法切取石蜡切片,每张切片厚约4 μm,按照免疫组化SP法进行实验操作,检测3种因子表达(annexin A2一抗工作浓度为1:500;E-cadherin一抗工作浓度为1:500;vimentin一抗工作浓度为1:500)。以PBS代替一抗作为阴性对照,试剂公司提供的阳性着色图片为阳性对照。
1.2.3结果判定参考Simons等[9]的评定标准,于光学显微镜下观察染色结果,具体评定标准根据着色强度和阳性细胞百分比采用半定量法,细胞着色强弱度评分:无着色者0分,浅黄色者1分,棕黄色者2分,棕褐色者3分。阳性细胞数所占的百分比评分:无阳性细胞者0分,≤10%者1分,11%~50%者2分,51%~75%者3分,≥75%者4分。再根据上述两者所得评分相乘结果划分等级:0~2分为“-”,≥3分即为阳性,其中3~5分为“+”,5~8分为“++”,9~12分则为“+++”。
1.3 统计学处理
采用SPSS 13.0软件进行统计分析,不同组别间差异分析采用χ2检验或Fisher精确概率检验,3种因子表达的相关性采用Spearman等级相关分析法,利用Kaplan-Meier法检测累积生存率并用Graphpad Prism 5绘制生存率曲线,Log-rank比较生存率差异。P<0.05表示差异有统计学意义。
2 结 果
2.1 免疫组化检测结果分析
光学显微镜下可见胆管细胞annexin A2阳性者染色主要位于细胞膜、细胞质,呈黄色、棕黄色或褐色(图1)。各组间annexin A2表达率差异统计学意义(P<0.05)[肿瘤组与炎症组比较(χ2=10.816,P=0.001)、肿瘤组与正常组比较(χ2=27.208,P<0.001)、炎症组与正常对照组比较(χ2=6.480,P=0.011)],annexin A2的表达强弱关系为:肿瘤组>炎症组>正常组(表1)。光学显微镜下可见胆管细胞E-cadherin阳性者染色主要位于细胞膜,呈黄色、棕黄色或褐色(图2)。各组间E-cadherin表达率差异有统计学意义(P<0.05)[肿瘤组与炎症组比较(χ2=7.223,P=0.007)、肿瘤组与正常组比较(χ2=19.999,P<0.001)、炎症组与正常对照组比较(χ2=4.6 2 9,P=0.031)],E-cadherin的表达强弱关系为:正常组>炎症组>肿瘤组(表1)。光学显微镜下可见胆管细胞vimentin阳性者染色主要位于细胞膜、细胞质(图3),呈黄色、棕黄色或褐色。各组间vimentin表达率差异有统计学意义(P<0.05)[肿瘤组与炎症组比较(χ2=6.895,P=0.009)、肿瘤组与正常组比较(χ2=18.415,P<0.001)、炎症组与正常对照组比较(χ2=4.857,P=0.028)];vimentin的表达强弱关系为:肿瘤组>炎症组>正常组(表1)。
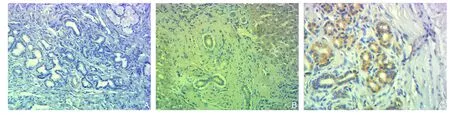
图1 免疫组化检测annexin A2的表达(×400) A:正常组;B:炎症组;C:肿瘤组Figure 1 Immunohistochemical staining for annexin A2 expressions (×400) A: Normal group; B: In fl ammation group; C: Tumor group
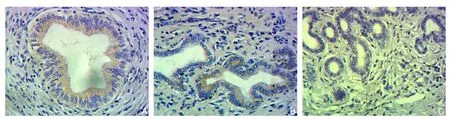
图2 免疫组化检测E-cadherin的表达(×400) A:正常组;B:炎症组;C:肿瘤组Figure 2 Immunohistochemical staining for E-cadherin expressions (×400) A: Normal group; B: In fl ammation group; C: Tumor group
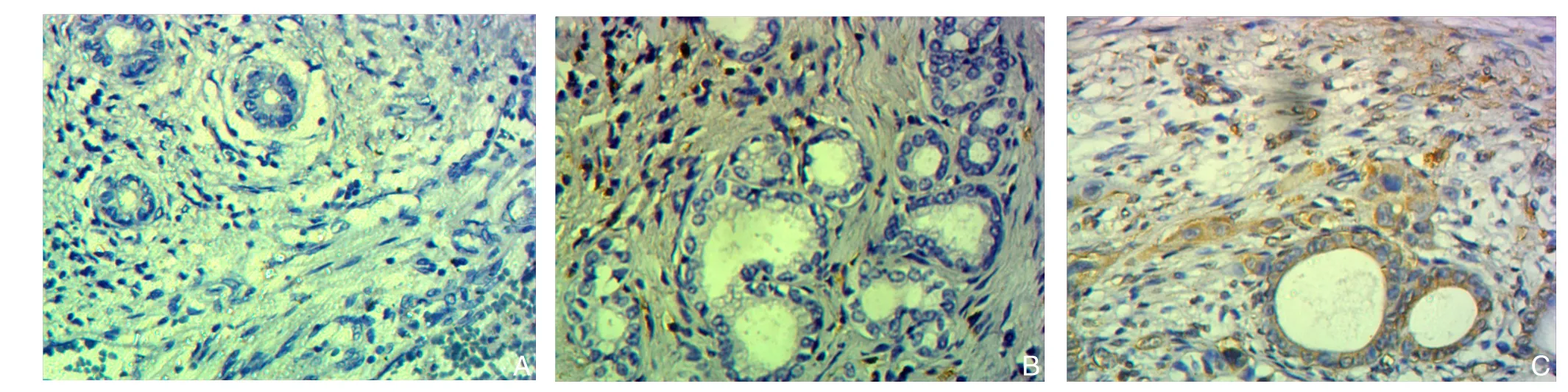
图3 免疫组化检测vimentin的表达(×400) A:正常组;B:炎症组;C:肿瘤组Figure 3 Immunohistochemical staining for vimentin expressions (×400) A: Normal group; B: In fl ammation group; C: Tumor group
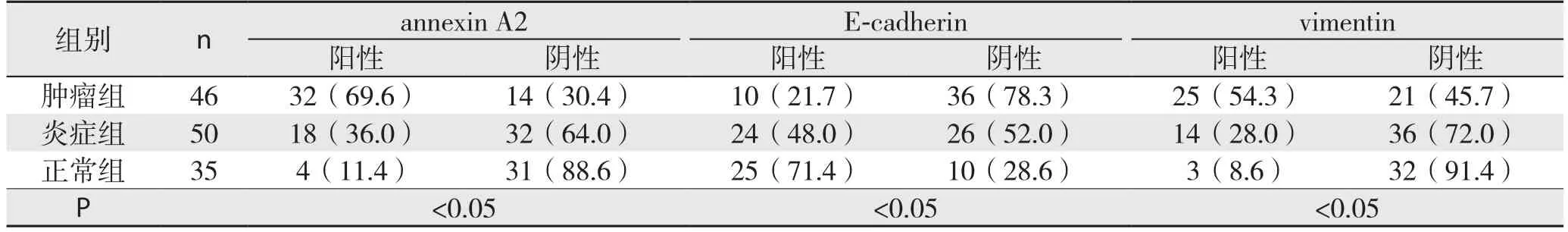
表1 各组3种蛋白表达率的比较[n(%)]Table 1 Comparison of the expressions of the three proteins among the three groups [n (%)]
2.2 胆管癌组织中annexin A2、E-cadherin、vimentin表达的相关性分析
在肝内胆管结石相关肝内胆管癌组织中,相关分析显示:annexin A2与vimentin的表达呈正相关(r=0.627,P<0.001);annexin A2与E-c a d h e r i n的表达呈负相关(r=-0.6 8 2,P<0.001);E-cadherin与vimentin的表达呈负相关(r=-0.575,P<0.001)(表2)。

表2 胆管癌组织中3种蛋白表达的相关性分析(n)Table 2 Correlations among the expressions of the three proteins in cholangiocarcinoma tissues (n)
2.3 annexin A2、E-cadherin、vimentin的表达与胆管癌临床病理特征的关系
annexin A2、E-cadherin、vimentin的表达均与患者的年龄、性别无关(均P>0.05)。胆管癌分化程度越低,细胞膜、细胞质annexin A2和vimentin表达程度越高,分化越高,其表达程度越低,annexin A2和vimentin的表达与胆管癌的分化程度、淋巴转移及肿瘤TNM分期有关(均P<0.05);对于E-cadherin,肿瘤分化程度越高,细胞膜、细胞质内E-cadherin表达程度越高,E-cadherin的表达与胆管癌的分化程度、淋巴转移有关(均P<0.05),但与肿瘤TNM分期无关(P>0.05)(表3)。

表3 annexin A2、E-cadherin、vimentin表达与胆管癌患者临床病理因素的关系[n(%)]Table 3 Relations of the expressions of annexin A2,E-cadherin and vimentin with the clinicopathologic factors of cholangiocarcinoma patients [n (%)]
2.4 肝内胆管结石相关肝内胆管癌患者生存分析
采用电话和患者门诊复查的病例资料随访肿瘤组患者的生存状况,随访时间终止于2016年9月。术后有5例肿瘤患者未定期到我院复查,电话失去联系(病例失访率10.87%)。肝内胆管结石合并胆管癌患者的平均生存时间为25个月,中位生存时间为17个月。患者术后的1、3、5年生存率分别为67.4%、17.4%、4.3%。生存分析显示,annexin A2表达阳性者的生存率低于其表达阴性者(32 vs.14,χ2=7.845,P=0.0051),vimentin表达阳性者的生存率低于其表达阴性者(25 vs.21,χ2=8.541,P=0.0035),E-cadherin表达阴性者的生存率低于其表达阳性者(36 vs.10,χ2=7.653,P=0.0057)。
根据本免疫组化实验结果实际情况,将患者按三种因子的表达情况分为4组:E-cadherin阳性并其余两种因子均阴性组、E-cadherin阴性并其余两种因子均阳性组、三种因子均阴性组、annexin A2阳性并其余两种因子均阴性组(9 vs.24 vs.4 vs.6,其余情况因做生存分析病例数不足未分组),生存分析显示:E-cadherin阴性并其余两种因子均阳性组患者的生存率明显低于E-cadherin阳性并其余两种因子均阴性组(χ2=9.7 6 9,P=0.0018),与3种因子均阴性组(χ2=0.8741,P=0.3498)、annexin A2阳性并其余两种因子均阴性组(χ2=2.717,P=0.0993)比较,无统计学差异;E-cadherin阳性并其余两种因子均阴性组患者的生存率明显高于3种因子均阴性组(χ2=6.286,P=0.0122),与annexin A2阳性并其余两种因子均阴性组无统计学差异(χ2=2.412,P=0.1204);3种因子均阴性组患者的生存率与annexin A2阳性并其余两种因子阴性组比较,无统计学差异(χ2=0.04393,P=0.8340)(图4)。
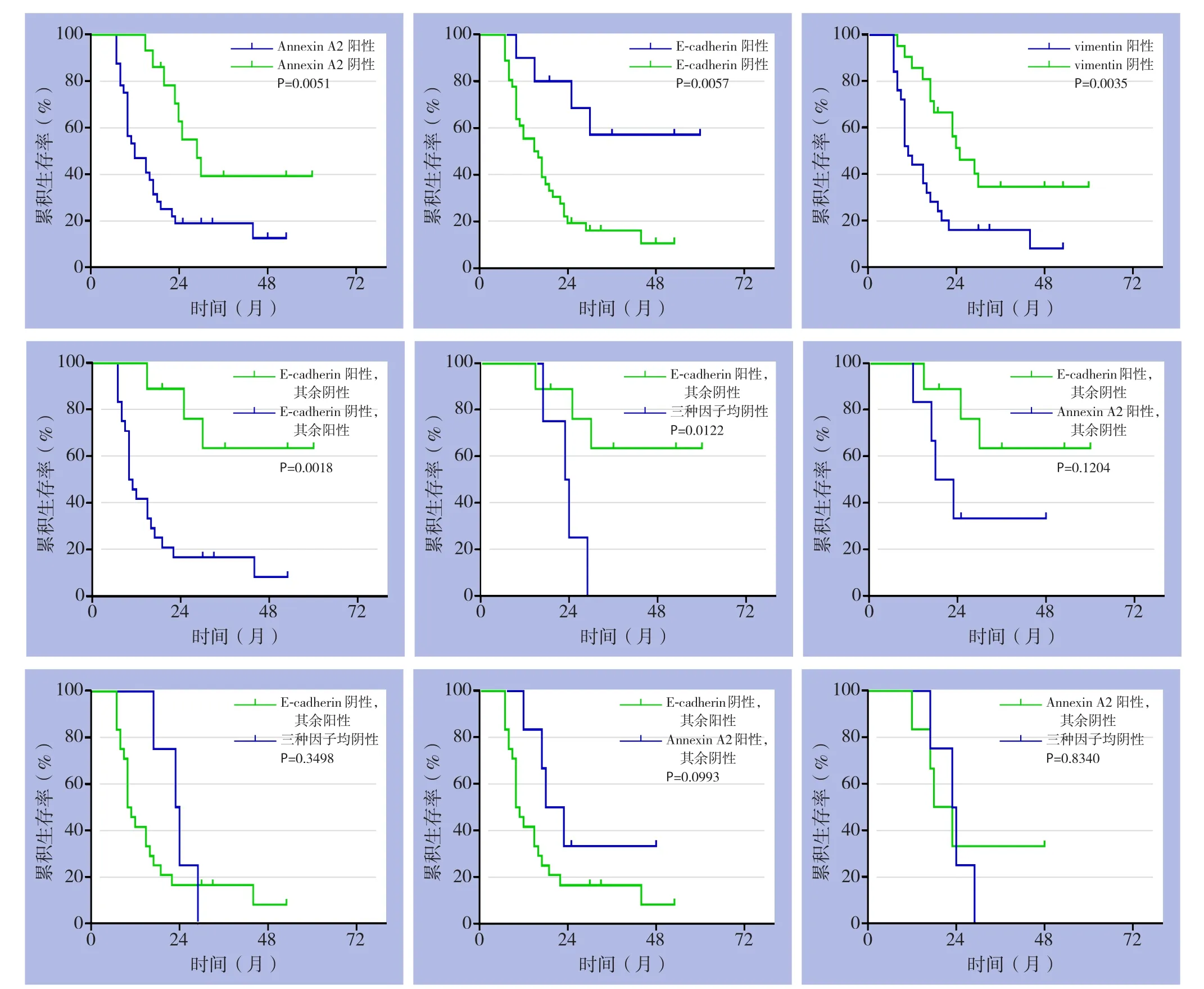
图4 不同annexin A2、E-cadherin及vimentin的表达状态患者生存率的比较Figure 4 Comparison of survival rates among patients with different sexpressions of annexin A2,E-cadherin and vimentin
3 讨 论
胆管癌是高度恶性和高度侵袭性的恶性肿瘤,肝内胆管结石相关肝内胆管癌并不罕见[3],而我国又是肝胆管结石高发地[10],肝内胆管结石相关肝内胆管癌的发生率为5%~13%[11-12],所以弄清肝内胆管结石相关胆管癌的发病机制十分重要。尽管肝内胆管结石相关肝内胆管癌的发病机制不是十分明确,但慢性增生性胆管炎在癌变过程中至关重要[13]。肝胆管结石患者常伴有胆管炎反复发展、胆管狭窄、胆汁淤积、慢性细菌感染,这些导致胆管上皮的炎症迁延不愈及胆管上皮非典型增生,最终可能导致胆管癌的发生[14]。肿瘤的侵犯和转移是肿瘤患者死亡的主要原因,Liotta等[15]提出了肿瘤侵袭和转移的三步曲:粘连、降解及迁移,这有助于理解胆管癌的高度侵袭性及转移特点。
annexin A2是一种分子量为36 kDa大小的钙离子依赖的磷脂结合蛋白[16],其结构高度保守,主要分布在真核细胞的细胞膜、细胞质上,一小部分分布在细胞核[17-18],它参与肌动蛋白细胞骨架动力学调节、胞吞作用、胞吐作用、细胞间的粘连、细胞极性及内涵体的形成[5]。已有研究[19-20]证明annexin A2参与肿瘤细胞的黏附,通过促进肿瘤细胞DNA的合成、促进原癌基因蛋白的合成、抑制抑癌基因p53介导的细胞凋亡等多种途径促进肿瘤细胞的增殖[21-22],促进肿瘤新生血管的形成[23],能激活纤溶酶原活化系统,通过金属蛋白酶的活化、降解细胞外基质及生长因子的转换一系列过程从而促进肿瘤细胞迁移、侵犯及转移[24],此外annexin A2能通过促进EMT从而促进肿瘤的侵犯和转移[25]。Yonglitthipagon等[26]发现annexin A2的高表达与肝吸虫相关胆管癌高的TNM分期、淋巴结侵犯、转移及预后不良密切相关,通过Cox多元回归分析证实annexin A2的表达是肝吸虫相关胆管癌预后的一个独立危险因素。本研究发现,annexin A2在肝内胆管结石相关肝内胆管癌中高表达,在正常组、肝内胆管结石炎症组、肿瘤组,其表达程度依次增高,其阳性表达与肝内胆管结石相关肝内胆管癌的低分化、淋巴结转移、高的TNM分期密切相关,而且annexin A2表达阳性者较其表达阴性者预后差,提示annexin A2在肝内胆管结石相关肝内胆管癌的发生发展过程、侵犯及转移可能起重要作用,同时提示annexin A2可做为肝内胆管结石相关肝内胆管癌的一个潜在的肿瘤生物标志物及预后标志物。
EMT使肿瘤上皮细胞极性丧失,上皮细胞黏附表型转化到间叶表型,细胞侵袭和迁移能力得到增强,细胞骨架重塑和抑制细胞凋亡,其中应力纤维重排、黏附分子的改变及细胞外基质蛋白是肿瘤细胞发生EMT的关键[27]。研究[28-29]表明EMT与胆管癌的侵袭和转移密切相关。E-cadherin和v i m e n t i n是E M T的两个标志蛋白[7,30]。E-cadherin是钙依赖性细胞黏附分子,它是上皮细胞紧密连接系统的主要成分,除了支持细胞间的黏附,E-cadherin能够影响广泛的细胞功能,包括细胞信号通路的激活,细胞骨架的调节和细胞极性的控制[30]。E-cadherin是EMT的关键蛋白[30],E-cadherin表达缺失是EMT发生并导致肿瘤侵袭和转移的标志性变化[31],E-cadherin表达下调导致原发性肿瘤中的肿瘤细胞之间的细胞黏附减弱,因此肿瘤细胞更容易发生侵润和转移[31]。vimentin表达与肿瘤的侵袭和转移能力成正相关,是间叶细胞表型的常用标志之一[32]。Wei等[32]发现vimentin可能是通过C-src调节E-cadherin/β-catenin复合物来促进肿瘤细胞的侵袭和转移。Mao等[33]发现vimentin的阳性表达与胆管癌的分化程度、静脉侵犯和肝炎病毒感染相关,通过Cox多元回归分析证实vimentin的表达是胆管癌预后的一个独立危险因素。Korita等[34]也发现vimentin的阳性表达与肝内胆管癌的低分化和预后不良相关。Huang等[29]的研究表明E-cadherin的低表达和vimentin的高表达与肝内胆管癌的淋巴结转移和预后差密切相关。本研究再次验证了以上结论,E-cadherin在肝内胆管结石相关肝内胆管癌中低表达,在正常组、肝内胆管结石炎症组、肿瘤组,E-cadherin表达程度依次降低,与肝内胆管癌的分化程度、淋巴结转移密切相关,尽管本研究结果发现E-cadherin表达与肝内胆管癌的临床分期无关(P=0.057),可能与本研究样本量小有关,但已有许多研究发现E-cadherin表达与胆管癌的临床分期相关,而且其表达阴性者较其表达阳性者预后差;而vimentin在肝内胆管结石相关肝内胆管癌中高表达,在正常组、肝内胆管结石炎症组、肿瘤组,vimentin表达程度依次增高,与肝内胆管结石相关肝内胆管癌的分化程度、淋巴结转移、临床分期密切相关,而且vimentin表达阳性者较其表达阴性者预后差,这些都提示E-cadherin、vimentin 在肝内胆管结石相关肝内胆管癌的发生发展过程、侵犯及转移过程可能起重要作用,本研究还发现:在肝内胆管结石相关肝内胆管癌中,annexin A2与vimentin的表达呈正相关,E-cadherin与annexin A2、vimentin的表达呈负相关,而E-cadherin和vimentin是EMT的两个标志蛋白,同时生存分析显示,E-cadherin阴性与annexin A2、vimentin均阳性组患者的生存率明显低于E-cadherin阳性与annexin A2、vimentin均阴性组(χ2=9.769,P=0.0018),因此推测,annexin A2与EMT之间可能存在某种联系通路,这种联系通路导致肝内胆管结石相关肝内胆管癌的侵袭和转移能力得到明显增强,从而导致胆管癌患者预后不良。
本研究部分患者未定期复查,对患者术后肿瘤的复发和转移情况未掌握准确信息,所有的肝内胆管癌患者均行手术治疗,肝内胆管结石的分布、残肝有无结石残留、肝脏切除范围、淋巴结清扫范围、患者的体力状态等均是影响患者预后的因素,此外,因为样本量小,未对可能影响预后的因子进行Cox多元回归分析,故本临床研究存在一定的局限性。
综上所述,annexin A2/EMT通路可能参与肝内胆管结石相关胆管癌发生发展,若能明确通路的具体环节及机制,通过阻断通路的关键环节从而减弱胆管癌细胞的黏附及迁移能力,为肝内胆管结石相关胆管癌的诊断、预防及预后提供重要临床指导意义。
[1]Brown KM,Parmar AD,Geller DA.Intrahepatic cholangiocarcinoma[J].Surg Oncol Clin N Am,2014,23(2):231–246.doi: 10.1016/j.soc.2013.10.004.
[2]Nathan H,Aloia TA,Vauthey JN,et al.A proposed staging system for intrahepatic cholangiocarcinoma[J].Ann Surg Oncol,2009,16(1):14–22.doi: 10.1245/s10434–008–0180–z.
[3]Kim HJ,Kim JS,Joo MK,et al.Hepatolithiasis and intrahepatic cholangiocarcinoma: A review[J].World J Gastroenterol,2015,21(48):13418–13431.doi: 10.3748/wjg.v21.i48.13418.
[4]Olnes MJ,Erlich R.A review and update on cholangiocarcinoma [J].Oncology,2004,66(3):167–179.
[5]Xu XH,Pan W,Kang LH,et al.Association of Annexin A2 with cancer development (review)[J].Oncol Rep,2015,33(5):2121–2128.doi: 10.3892/or.2015.3837
[6]Gao D,Vahdat LT,Wong S,et al.Microenvironmental regulation of epithelial-mesenchymal transitionsin cancer[J].Cancer Res,2012,72(19):4883–4889.doi: 10.1158/0008–5472.CAN–12–1223.
[7]Thiery JP,Acloque H,Huang RY,et al.Epithelial-mesenchymal transitions in development and disease[J].Cell,2009,139(5):871–890.doi: 10.1016/j.cell.2009.11.007.
[8]Egner JR.AJCC Cancer Staging Manual[J].JAMA,2010,304(15):1726–1727.doi:10.1001/jama.2010.1525.
[9]Simons MP,Moore JM,Kemp TJ,et al.Identification of the mycobacterial subcomponents involved in the release of tumor necrosis factor-related apoptosis-inducing ligand from human neutrophils[J].Infect Immun,2007,75(3):1265–1271.
[10]Tazuma S.Gallstone disease: Epidemiology,pathogenesis,and classification of biliary stones (common bile duct and intrahepatic)[J].Best Pract Res Clin Gastroenterol,2006,20(6):1075–1083.
[11]Lin CC,Lin PY,Chen YL.Comparison of concomitant and subsequent cholangiocarcinomas associated with hepatolithiasis:Clinical implications[J].World J Gastroenterol,2013,19(3):375–380.doi: 10.3748/wjg.v19.i3.375.
[12]Kim HJ,Kim JS,Suh SJ,et al.Cholangiocarcinoma Risk as Longterm Outcome After Hepatic Resection in the Hepatolithiasis Patients[J].World J Surg,2015,39(6):1537–1542.doi: 10.1007/s00268–015–2965–0.
[13]Nakanuma Y,Terada T,Tanaka Y,et al.Are hepatolithiasis and cholangiocarcinoma aetiologically related?[J].Virchows Arch A Pathol Anat Histopathol,1985,406(1):45–58.
[14]Aishima S,Kubo Y,Tanaka Y,et al.Histological features of precancerous and early cancerous lesions of biliary tract carcinoma[J].J Hepatobiliary Pancreat Sci,2014,21(7):448–452.doi: 10.1002/jhbp.71.
[15]Liotta LA,Mandler R,Murano G,et al.Tumor cell autocrine motility factor[J].Proc Natl Acad Sci U S A,1986,83(10):3302–3306.
[16]赵玲,崔全才.Annexin A2在肿瘤发生中的作用研究进展[J].中华病理学杂志,2007,36(2):129–132.doi:10.3760/j.issn:0529-5807.2007.02.015.Zhao L,Cui QC.Annexin A2 and pathogenesis cancer:an update[J].Chinese Journal of Pathology,2007,36(2):129–132.doi:10.3760/j.issn:0529–5807.2007.02.015.
[17]Courtneidge S,Ralston R,Alitalo K,et al.Subcellular location of an abundant substrate (p36) for tyrosine-specific protein kinases[J].Mol Cell Biol,1983,3(3):340–350.
[18]Eberhard DA,Karns LR,Vandenberg SR,et al.Control of the nuclear-cytoplasmic partitioning of annexin II by a nuclear export signal and by p11 binding[J].J Cell Sci,2001,114(Pt 17):3155–3166.
[19]Lokman NA,Elder A,Ween MP,et al.Annexin A2 is regulated by ovarian cancer-peritoneal cell interactions and promotes metastasis[J].Oncotarget,2013,4(8):1199–1211.
[20]Shiozawa Y,Havens A M,Jung Y,et al.Annexin II/annexin II receptor axis regulates adhesion,migration,homing,and growth of prostate cancer[J].J Cell Biochem,2008,105(2):370–380.doi:10.1002/jcb.21835.
[21]Pelengaris S,Khan M.The c-MYC oncoprotein as a treatment target in cancer and other disorders of cell growth[J].Expert Opin Ther Targets,2003,7(5):623–642.
[22]Huang Y,Jin Y,Yan CH,et al.Involvement of Annexin A2 in p53 induced apoptosis in lung cancer[J].Mol Cell Biochem,2008,309(1/2):117–123.
[23]Limae Silva R,Shen J,Gong YY,et al.Agents that bind annexin A2 suppress ocular neovascularization[J].J Cell Physiol,2010,225(3):855–864.doi: 10.1002/jcp.22296.
[24]Lokman NA,Ween MP,Oehler MK,et al.The role of annexin A2 in tumorigenesis and cancer progression[J]Cancer Microenviron,2011,4(2):199–208.doi: 10.1007/s12307–011–0064–9.
[25]Thiery JP.Epithelial-mesenchymal transitions in tumour progression[J].Nat Rev Cancer,2002,2(6):442–454.
[26]Yonglitthipagon P,Pairojkul C,Chamgramol Y,et al.Upregulation of annexin A2 in cholangiocarcinoma caused by Opisthorchis viverrini and its implication as a prognostic marker[J].Int J Parasitol,2010,40(10):1203–1212.doi: 10.1016/j.ijpara.2010.05.002.
[27]强勇,陈钟.EMT相关分子标志物在胆管癌侵袭转移中的研究进展[J].世界华人消化杂志,2015,23(25):4051–4059.doi:10.11569/wcjd.v23.i25.4051.Qiang Y,Chen Z.Epithelial mesenchymal transition related molecular markers and invasion and metastasis of cholangiocarcinoma[J].World Chinese Journal of Digestology,2015,23(25):4051–4059.doi:10.11569/wcjd.v23.i25.4051.
[28]Nitta T,Mitsuhashi T,Hatanaka Y,et al.Prognostic significance of epithelial-mesenchymal transition-related markers in extrahepatic cholangiocarcinoma: comprehensive immunohistochemical study using a tissue microarray[J].Br J Cancer,2014,111(7):1363–1372.doi: 10.1038/bjc.2014.415.
[29]Huang XY,Zhang C,Cai JB,et al.Comprehensive multiple molecular profile of epithelial mesenchymal transition in intrahepatic cholangiocarcinoma patients[J].PLoS One,2014 ,9(5):e96860.doi: 10.1371/journal.pone.0096860.
[30]Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymal transitions[J].J Clin Invest,2009,119(6):1429–1437.doi: 10.1172/JCI36183.
[31]Techasen A,Loilome W,Namwat N,et al.Loss of E-cadherin promotes migration and invasion of cholangiocarcinoma cells and serves as a potential marker of metastasis[J].Tumour Biol,2014,35(9):8645–8652.doi: 10.1007/s13277–014–2087–6.
[32]Wei J,Xu G,Wu M,et al.Overexpression of vimentin contributes to prostate cancer invasion and metastasis via src regulation[J].Anticancer Res,2008,28(1A):327–334.
[33]Mao X,Chen D,Wu J,et al.Differential expression of fascin,E-cadherin and vimentin: Proteins associated with survival of cholangiocarcinoma patients[J].Am J Med Sci,2013,346(4):261–268.doi: 10.1097/MAJ.0b013e3182707108.
[34]Korita PV,Wakai T,Ajioka Y,et al.Aberrant expression of vimentin correlates with dedifferentiation and poor prognosis in patients with intrahepatic cholangiocarcinoma[J].Anticancer Res,2010,30(6):2279–2285.
