传染性造血器官坏死病病毒G基因全长cDNA克隆及重组表达研究
2017-03-28焦雪卢玉婷安俊花张翔宇张培军李月红
焦雪,卢玉婷,安俊花,张翔宇,张培军,李月红
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.内蒙古乌兰察布市农牧业综合行政执法支队,内蒙古乌兰察布012000; 3.内蒙古乌兰察布市水产站,内蒙古乌兰察布012000;4.吉林省卫生检测检验中心,吉林长春130118)
传染性造血器官坏死病病毒G基因全长cDNA克隆及重组表达研究
焦雪1,卢玉婷1,安俊花2,张翔宇3,张培军4,李月红1
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.内蒙古乌兰察布市农牧业综合行政执法支队,内蒙古乌兰察布012000; 3.内蒙古乌兰察布市水产站,内蒙古乌兰察布012000;4.吉林省卫生检测检验中心,吉林长春130118)
本研究旨在克隆G基因全长并与其他传染性造血器官坏死病病毒(IHNV)株进行分析,为IHNV的预防检测提供依据。通过提取IHNV-G蛋白RNA并进行扩增,将其克隆到pMD-18T并与pChlamy-4载体相连,重组到莱茵衣藻中并提取总蛋白,结果可得:扩增片段长度为1 500 bp,经SDS-PAGE电泳得到一条大约为58 kDa的蛋白条带,Westen Blot分析结果显示,重组莱茵衣藻所表达的蛋白可以与6×HIS标签抗体特异性结合;并且以重组表达的G蛋白为抗原,鼠抗IHNV血清为一抗,辣根过氧化物酶标记的驴抗鼠IgG为二抗,再次进行Westen Blot检验,其结果显示,经诱导后的G蛋白能与鼠抗IHNV血清反应,并在58 kDa处出现了一条明显的特异性条带,具有良好的反应原性。表明重组莱茵衣藻表达系统构建成功。
传染性造血器官坏死病病毒(IHNV);糖蛋白;Western Blot
传染性造血器官坏死病病毒(Infectious Hematopoietic Necrosis Virus,IHNV)属弹状病毒科,诺拉弹状病毒属,主要感染鲑、鳟鱼。以肾脏和脾脏等造血组织坏死为主要特征[1]。该病毒主要通过水平传播感染宿主,幼鱼时期患病未死亡的带病鱼是IHNV的主要传播源[2]。其中,IHNV糖蛋白是病毒的主要抗原[3],与病毒的毒力直接相关[4],并且在细胞受体与病毒结合过程中起着十分重要的作用[5]。目前,对IHNV有效的防控措施是通过隔离病毒或是注射疫苗,但3月龄内的鱼苗其免疫器官未发育成熟,所以注射疫苗往往达不到理想的效果,本研究主要以研制出安全、可靠的新型载体口服疫苗为目的,从根本上断绝病毒的传播,为我国的冷水渔业健康发展提供一定的技术支持。
1 材料与方法
1.1 试验材料FHM细胞系分离培养的IHNV株细胞毒由吉林农业大学动科109实验室保存,重组莱茵衣藻由实验室构建并保存。
1.2 IHNV-G基因总RNA的提取取300 μL细胞毒加1 mL TRIZol室温孵育5 min,12 000 r/min (4℃)离心15 min后吸取上清,加入200 μL的氯仿震荡15 s,室温孵育5 min;12 000 r/min(4℃)离心15 min;吸取上层转置到一个新的EP管中,加入500 μL的异丙醇沉淀RNA,室温孵育10 min; 12 000 r/min(4℃)离心15 min;倒掉上清,加入1 mL 75%的乙醇洗涤2次,7 500 r/min(4℃)离心5 min;室温干燥5 min,加25 μL的无RNA酶处理水溶解并保存在-80℃。
1.3 IHNV-G基因cDNA的克隆以1 μL细胞毒为模板,按照宝生物工程(大连)有限公司提供的反转录试剂盒合成cDNA第一条链,引物根据NCBI数据库中已公开IHNV的HLJ-09株(登录号: JX649101)的G基因序列设计上下游引物,去掉终止密码子后在上游引物中引入EcoR I酶切位点和下游引物中引入Kpn I酶切位点如图2~4。IHNVG(F:5'-TAGATATCATGGACGCCATGATCAC-3';R: 5'-ATGGTACCTATTAGGACCTGTTTGCC-3')由上海生工生物工程技术服务有限公司合成;PCR反应条件为:94℃预变性5 min;94℃变性5 min;退火温度61Tm;72℃延伸1 min,35个循环;最后72℃延伸8 min,4℃保存。将PCR产物进行胶回收,按宝生物工程(大连)有限公司提供的胶回收试剂盒进行纯化,连接至DH5α中,挑取白色菌落扩大培养,按照质粒DNA小量提取试剂盒提取,用EcoR I酶、Kpn I酶进行双酶切,将阳性质粒送上海生工生物工程技术服务有限公司进行测序。
1.4 序列分析及构建发育树将获得的DNA序列使用DNAStar软件进行同源性比对,使用MEGE5.2分析遗传进化关系构建系统进化树。
1.5 IHNV-G蛋白血清的制备抗IHNV全血清病毒的制备,取本实验室保存的IHNV细胞毒15 mL,按照2.5 μL/mL加入40%甲醛至终浓度0.1%,37℃温育48 h。加入等体积的弗氏佐剂混匀,采用腹腔注射,每只小鼠注射0.25 mL。每隔7 d免疫1次,第4次免疫后3 d眼球取血,每只小鼠眼球取血约0.7 mL,37℃水浴1 h,3 000 r/min(4℃),离心10 min,最后血清量约350 μL左右置于-20℃保存。
1.6 Westen Blot将重组的莱茵衣藻表达蛋白进行SDS-PAGE电泳,电泳结束后用蒸馏水冲洗3次,置于转膜缓冲液中平衡5 min准备转膜;转膜结束后,取出PVDF膜,做好标记,用PBS冲洗3次,置于5%脱脂奶中,4℃封闭过夜;次日,取出PVDF膜,用TBST漂洗3次,每次5 min,在加入1∶3 000稀释浓度的鼠源HIS标签抗体作为一抗,室温孵育5 h;TBST漂洗3次,每次5 min;加入1∶2 000稀释浓度的辣根过氧化物酶标记的驴抗鼠IgG作为二抗,37℃孵育1.5 h;TBST漂洗3次,每次5 min。按照DAB显示试剂盒进行显色,显色前将10 mL反应液,200 μL溶液A,100 μL溶液B,20 μL溶液C在棕色瓶中充分混匀,再将PVDF膜浸泡在其中,37℃条件下震荡反应5 min,弃去显色液后用蒸馏水冲洗3次,自然干燥后观察记录。
1.7 重组G蛋白的反应原性以重组表达的G蛋白为抗原,鼠抗IHNV血清为一抗,辣根过氧化物酶标记的驴抗鼠IgG为二抗,再次以Westen Blot试验测定G蛋白抗血清与病毒反应性。
2 结果与分析
2.1 IHNV-G基因总RNA提取结果待80%细胞出现明显病变,按照TRIZol试剂说明书操作提取细胞毒中FHM细胞和IHNV病毒的总RNA如图1。

图1 FHM细胞和IHNV病毒的总RNA
2.2 IHNV-G基因RT-PCR扩增以FHM细胞和IHNV病毒的总RNA为模板,反转录合成cDNA第一条链。再以cDNA作为PCR反应的模板,经特异性引物PCR反应后,PCR产物经1%琼脂糖凝胶电泳鉴定结果如图2,得到一条1 500 bp左右大小的特异性条带。

图2 PCR扩增结果
2.3 IHNV-G基因系统发育树构建及分析将IHNV-G基因与多株IHNV参考株进行核苷酸同源性比较可得,IHNV-G基因与韩国株ChYa 07和PcKw11同源性较高,分别为97.8%和97.5%,其推导的氨基酸序列同源性为97.5%和98.2%。与其他参考株核苷酸同源性为94.8%~96.7%,推导出的氨基酸同源性为94.5%~95.8%。从G基因的进化树上看(图3),CJ-13株G基因与韩国分离的2株相对较近,表明亚洲分离株与美国分离株、欧洲分离株进化关系较远,明显不在同一个进化分支上。
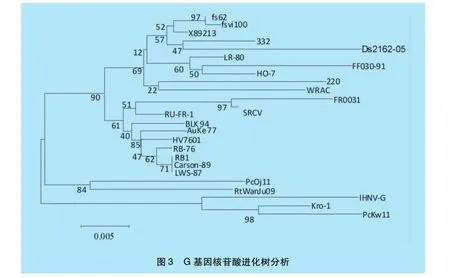
图3 G基因核苷酸进化树分析
2.4 IHNV-G基因重组用EcoR I和Kpn I消化pMD-18T-IHNV-G重组质粒和pChlamy-4载体,回收IHNV-G基因片段和pChlamy-4线性化载体片段,T4连接酶连接构建出表达载体。将表达载体化学转化到大肠杆菌TOP10感受态细胞中进行扩增后提取质粒,进行双酶切,酶切产物用1%的琼脂糖凝胶电泳进行验证结果如图4,得到一条1 500 bp左右大小的特异性条带,说明线性化载体与目的片段连接成功,将质粒送至测序公司进行测序,测序结果同样证明载体与目的片段连接成功,插入片段进行同源性比对结果同源性为99%。
2.5 SDS-PAGE电泳分析结果转基因莱茵衣藻经两次抗性筛选后,离心收集转基因莱茵衣藻,超声波破碎莱茵衣藻提取粗蛋白,进行SDS-PAGE电泳,结果显示,有一条大约为58 kDa的蛋白条带(如图5),与理论结果相符合。
2.6 Western blot检测结果以重组表达的目的蛋白为抗原,鼠源HIS标签抗体为一抗,辣根过氧化物酶标记的驴抗鼠IgG为二抗,Western Blot结果显示,目的蛋白能与鼠源HIS标签抗体反应,在58 kDa处出现了一条明显的特异性条带,与SDS-PAGE出现的目的蛋白一致,如图6。

图4 PCR结果M1:λ-EcoT 14 I Marker;M2:250 bp DNA Marker 1:转基因莱茵衣藻基因组DNA;2:PCR结果

图5 pCh-IHNV-G在莱茵衣藻中表达产物的SDS-PAGE分析
以重组表达的产物为抗原,鼠抗IHNV血清为一抗,辣根过氧化物酶标记的驴抗鼠IgG为二抗,再次进行Western Blot检测,并在58 kDa处出现了一条明显的特异性条带(见图7箭头),说明经诱导后的G蛋白能与鼠抗IHNV血清反应。

图6 Western Blot分析
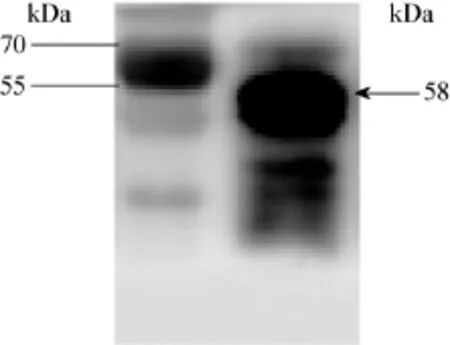
图7 Western Blot分析
3 讨论
本试验以IHNV-G基因、莱茵衣藻为原料进行基因重组,免疫小鼠获得了鼠抗血清,并通过Western Blot进行免疫原性分析,结果表明,糖蛋白在莱茵衣藻中得到了表达,具有反应原性,但是表达量很低。其原因可能是由于莱茵衣藻的核基因组含有较高的GC碱基对,并具有较明显的密码子偏好性,密码子的第一位和第3位多数为G或C[6-7],而本试验没有对糖蛋白基因进行密码子优化,可能是造成蛋白表达量低;其次基因在莱茵衣藻表达高低与启动子的选择和mRNA的稳定性有一定的关系[8]。Lumbreras等[9]的研究显示,RBCS2内含子的插入可提高ble基因的表达效率,由于RBCS2中含有转录增强元件;Schroda等的研究发现,HSP70A融合到RBCS2和NIT的上游时,可提高外源基因的表达,并减少“基因沉默”。本研究选用HSP70ARbc S2融合启动子和3'-UTR确保正常终止转录,保障外源基因的表达[10]。三是外界的原因,转基因莱茵衣藻的培养条件也会影响外源基因的表达,如抗生素的浓度,培养温度,光照强度等。本试验对转基因莱茵衣藻的培养沿用转基因前的条件,并未对其进行摸索,可能也是其表达量低的原因。
[1]St-Hilaire S,Ribble C S,Stephen C,et al.Epidemiological investigation of infectious hematopoietic necrosis virus in salt water netpen reared Atlantic salmon in British Columbia Canada[J].Aquaculture,2002,212(1):49-67.
[2]Ammayappan,S E La Patra,V N Vakharia.Mo Lecu Lar characterization of the viru Lent infectious hematopoietic necrosis virus(IHNV)strain 220-90[J].Viro Logy Journa L,2010,7:10.
[3]世界动物卫生组织(OIE).水生动物疫病诊断手册[M].3版.北京:中国农业出版社,2000:45.
[4]H Schutze,P J Enzmann,E Mundt,et al.Identification of the nonvirion(NV)protein of fish rhabdoviruses vira L haemorrhagic septicaemia virus and infections haematopoietic necrosis virus[J].Gen Viro L,1996,77:1259-1263.
[5]J H Cox,B Dietzscho Ld,L G Schneider,et al.Rabies virus g Lycoprotein.II.Bio Logica L andsero Logica L characterization[J].Infect Immuno Logy,1977,16(3):75-759.
[6]Kurath G,Garver K A,Corbeil S,et al.Protective immunity and lack of histopathological damage two years after DNA vaccination against infectious hematopoietic necrosis virus in trout[J].Vaccine,2006,24(3):345-354.
[7]卢玉婷,王建超.传染性造血器官坏死病病毒(IHNV)糖蛋白基因莱茵衣藻表达载体的构建[J].中国兽医学报,2016,36 (11):5-9.
[8]杨星宇.含GFP基因的莱茵衣藻高效表达载体的构建及其在衣藻叶绿体中的表达[D].青岛:青岛科技大学,2012.
[9]Jakubiec H.Studies on the Polish Chlamydomonadaceae[J].Nova Hedwigia,1984,39:269-292.
[10]吉尚雷,卢玉婷.传染性造血器官坏死病病毒CJ-13株糖蛋白的原核表达及免疫原性[J].西北农林科技大学学报(自然科学版),2015(7):1-7.
Cloning and recombinant expression of cDNA gene of infectious hematopoietic necrosis virus G gene
JIAO Xue1,LU Yu-ting1,AN Jun-hua2,ZHANG Xiang-yu3,ZHANG Pei-jun4,LI Yue-hong1
(1.Jilin Agriculture University,College of animal science and technology,Changchun 130118,China;2.Agriculture and animal husbandry,Wulanchabu City,Inner Mongolia comprehensive administrative law enforcement detachment,Wulanchabu 012000,China;3.Fisheries Station of Wulanchabu City,Wulanchabu 012000,China;4.Jilin provincial health inspection and Testing Center,Changchun 130118,China)
This study aimed to clone the full-length G gene and compred with other IHNV strains to provide the basis for preventive detection of IHNV.IHNV-G gene was amplified and cloned into pMD-18T pChlamy-4 and was then connected to the carrier recombination into C.reinhardtii.The amplified fragment length was 1 500bp,and SDS-PAGE electrophoresis showed that the expressed protein was about 58KDa,Westen blot analysis showed that the recombinant protein expressed by C.reinhardtii specifically bound with a 6×HIS tag antibody;westen blot analysis also shaved that the recombinant G could reacted with mouse anti-serum IHNV.Our results indicate that the recombinant expression system reinhardtii is successfully constructed.
Infectious Hematopoietic Necrosis Virus;IHNV;Glycoprotein;Western blot
LI Yue-hong
S941
A
0529-6005(2017)01-0003-04
2016-04-13
国家自然科学基金(30972191);吉林省留学人员创新创业项目(201523);长春市农业先进实用技术的示范推广项目(20130215);农业部948项目(2014Z34)
焦雪(1992-),女,硕士生,主要从事动物疾病及免疫研究,E-mail:455261939@qq.com
李月红,E-mail:liyhong@sina.com
