棉花木葡聚糖转移/水解酶基因克隆和分析
2017-03-28李先良李居宁李傲夏涛
李先良 李居宁 李傲 夏涛


摘要:为研究XTH基因与棉花(Gossypium spp.)纤维伸长的关系,克隆了两个XTH基因,分别命名为GhXTH1(GenBank:AY189971)和GhXTH2(GenBank:JN968478)。GhXTH1编码区全长870 bp,编码289个氨基酸,GhXTH1全长885 bp,编码294个氨基酸。序列分析表明,GhXTH1和GhXTH2均存在XTH家族保守序列DEIDFEFLG。生物信息学分析表明,GhXTH1和GhXTH2均含有信号肽。跨膜结构预测表明,GhXTH1和GhXTH2均在N端存在跨膜螺旋。系统发生学分析表明,GhXTH1与拟南芥XTH6、XTH7亲缘关系较近,GhXTH2与拟南芥XTH9亲缘关系较近。半定量分析表明,GhXTH1和GhXTH2均随着棉花纤维发育表达量降低,GhXTH2比GhXTH1表达量高。
关键词:棉花(Gossypium spp.)纤维;木葡聚糖转移/水解酶;克隆;表达分析;伸长
中图分类号:S562;Q78 文献标识码:A 文章编号:0439-8114(2017)04-0756-06
棉花(Gossypium spp.)纤维是由胚珠表皮细胞发育而来,成熟纤维细胞长度可为其直径的1 000~3 000倍,有的可达35~40 mm[1]。海岛棉(Gossypium barbadense,Gb)成熟棉纤比陆地棉(Gossypium hirsutum,Gh)长,但在开花后24 d,陆地棉纤维长度比海岛棉纤维长[2]。棉纤维细胞的伸长开始于开花当天[3-5],纤维细胞伸长速率最大的阶段发生在开花后6~12 d和15~20 d,两个阶段伸长量可达最终长度的80%[6]。
棉纤细胞伸长由细胞内膨压驱动,并伴以细胞壁松弛过程。细胞内渗透溶质增加,促进细胞内渗透压增加,使细胞吸收大量水分,从而使细胞膨压增加,使细胞渗透压增加的溶质主要是可溶性糖、苹果酸盐及鉀离子(K+)[7]。磷酸丙酮酸羧化酶(PEPC)[8]、胞间连丝[9,10]、蔗糖酶(Vacuelar invertase)[11]、水通道蛋白[12]与棉纤细胞膨压产生或增加有关。
棉纤细胞壁是由纤维素、半纤维素和结构蛋白组成的动态网络。半纤维素木葡聚糖是植物细胞初生壁的结构多糖,木葡聚糖链通过共价氢键绑附到纤维素链上,将临近纤维素微纤丝交联起来[13]。微纤丝之间木葡聚糖交联结构是细胞伸长的主要限制因素之一。该交联结构可以被木葡聚糖转移/水解酶(Xyloglucan endotransglucosylase/Hydrolase,XTH)解开并重新连接,从而降低细胞伸长的阻力,因此XTH能通过松弛细胞壁进而促进细胞伸长。重组拟南芥(Arabidopsis thaliana,At)XTH14和XTH26加到根系上,展现出对根系细胞伸长明显的促进作用[14]。在拟南芥中,超表达AtXTH18、AtXTH19、AtXTH20能刺激下胚轴伸长[15];在棉花中,超表达GhXTH1能增强XTH活性,使棉花纤维长度增加15%~20%[16]。XTH基因在棉花纤维中表达存在时间特异性和品种特异性[17],在海岛棉和陆地棉花棉花纤维中表达存在差异[18]。XTH基因表达模式与棉花纤维长度存在关联。
本研究从陆地棉中克隆分离两个XTH基因,对其进行序列分析、系统发生学分析和表达分析,以期为了解XTH基因及其家族与棉花纤维伸长之间的关系奠定基础,从而为棉花纤维品质改良特别长度品质改良提供候选基因。
1 材料与方法
1.1 试验材料
所用的棉花材料为陆地棉珂字201、华棉99,海岛棉为军海1号。分别取开花后4、9、14、19、24 d棉瓣放入液氮,然后存入-80 ℃冰箱备用。大肠杆菌(Escherichia coli)菌株DH5α为实验室保存,中间载体pMD18-T购于宝生物工程(大连)有限公司。
1.2 总RNA的提取与cDNA的合成
棉花纤维总RNA用热硼酸法提取[19],并按DNase I试剂盒所示方法处理总RNA,以去除其中DNA,然后用15 μL DEPC ddH2O溶解,分光光度计测定RNA浓度。最后按照Promega反转录酶体系进行操作,合成第1链cDNA,反转录后的cDNA保存于-20 ℃。
1.3 GhXTH1和GhXTH2克隆
在NCBI中有一个XTH全长编码序列(AY189971),另外还存在一个EST序列(DV848907)。对于AY189971,根据其全长序列,从两端设计引物(GhXET-OE-F:5′-AAAGTCGACATTCTCTTTCTGTTTCTCTGGTTTA-3′;GhXET-OE-R:5′-AAAGGTACCTCAGATGATGGACATGCACTC-3′),以14 d棉花纤维cDNA为模板,PCR扩增后测序。对于DV848907,将其与AtXTH序列比对,发现该段EST序列与AtXTH基因5′端同源程度较高,而且同源区包含起始密码子。根据此段EST序列设计引物进行3′RACE(Rapid-amplification of cDNA ends),测序得到一段DNA序列,以该序列与EST序列拼接翻译,发现以EST序列的第三个碱基开始翻译能翻译出一个完整蛋白序列。在该序列内存在两个起始密码子,以第一个起始密码子翻译到蛋白序列长度相对符合XTH蛋白序列长度。RACE方法见参考文献[20]。
1.4 GhXTH生物信息学分析
利用ClustalW软件进行多序列对齐和排序, 使用GenDOC和MEGA5.0软件输出同源比对和进化树构建结果[21];用SingaIP进行信号肽预测[22];用ProtParam计算蛋白质的相对分子质量和理论等电点[23];利用TMHMM预测蛋白质的跨膜结构域。
1.5 GhXTH1和GhXTH2表达分析
UBQ7为RT-PCR分析内参基因,设计引物序列为:GhUBI-RT-F:GAAGGCATTCCACCTGACCAAC;GhUBI-RT-F:CTTGACCTTCTTCTTCTTGTGCTTG。GhXTH引物序列为:GhXTH1-RT-F:TCCGTGACAGC
AGATGAGATC;GhXTH1-RT-R:TGGTGCAAACTTA
ACTCCGAC。GhXTH2引物序列为:GhXTH2-RT-F:GGTTTCCGTGACAGCAGATG;GhXTH2-RT-F:GTGCAAACTTAACTCCGACATT。PCR产物在1.0%的琼脂糖凝胶上进行电泳。
2 结果与分析
2.1 GhXTH1和GhXTH2全长序列克隆和分析
GhXTH1在NCBI中存在一个全长序列(AY189971),根据该序列设计引物进行PCR扩增,扩增产物进行琼脂糖凝胶电泳(图1A),片段大小在750~1 000 bp间。测序结果表明,该序列与AY189971存在一个碱基差别,但蛋白序列完全相符。将该基因命名为GhXTH1。
在NCBI存在GhXTH的一个EST序列DV848907,将该序列与拟南芥中XTH序列比对,发现该序列覆盖该基因的5′端,因此,仅需要进行3′-RACE可得到该基因全长序列,根据试剂盒(SMARTTM RACE cDNA Amplification Kit)说明书,进行3′-RACE,扩增片段进行琼脂糖凝胶电泳(图1B)。将该片段测序,测序后所得序列与EST拼接,将所得序列在Premier软件进行翻译,发现从第3个碱基开始能翻译出一个蛋白序列。以第一个起始密码子为起始,能翻译出289个氨基酸(aa)。以编码该序列的DNA序列为模板设计引物,用该引物进行PCR扩增(图1C),对该片段进行测序,所得序列与前面的拼接序列完全吻合。將该序列提交NCBI库(JN968478)。
2.2 GhXTH1和GhXTH2蛋白特征分析
GhXTH1全长序列包含289个氨基酸,GhXTH2包含294个氨基酸。将拟南芥和其他几种植物中XTH与克隆得到XTH多序列比对。结果表明,棉花XTH序列与其他XTH序列有比较高的保守性,所有序列都存在维持XTH活性的保守序列DEIDFEFLG[24,25],但有些序列与之相差1~2个氨基酸(图2)。GhXTH1保守序列与此相差1个氨基酸,第3个氨基酸由异亮氨酸(I)变成了亮氨酸(L);GhXTH2保守序列与此相差2个氨基酸,第1个氨基酸从天冬氨酸(D)变成天冬酰胺(N),第3个氨基酸从异亮氨酸变成苯丙氨酸(F)。拟南芥XTH家族中多个XTH保守序列存在1~2个氨基酸变化。
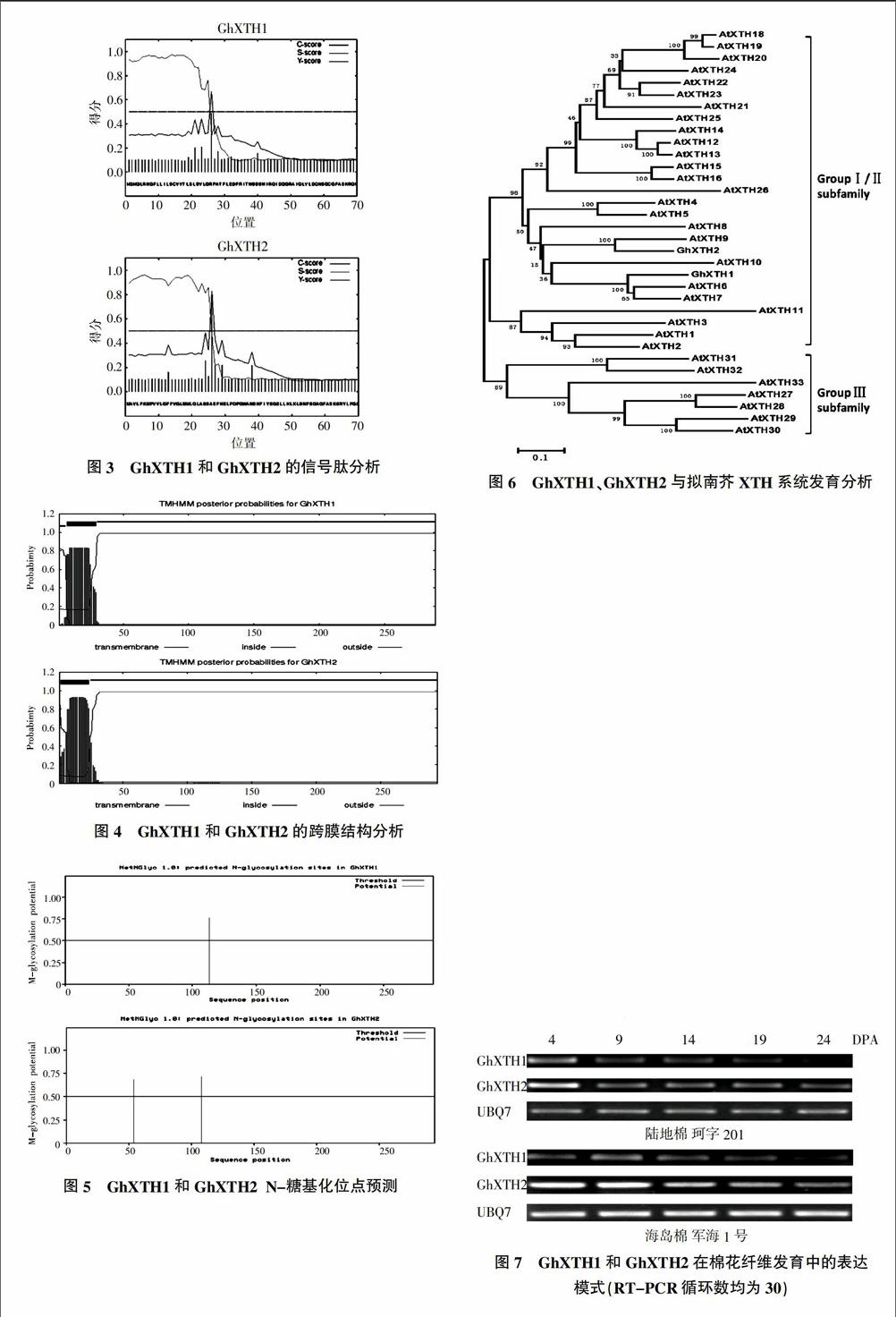
XTH是一种细胞壁蛋白,因此,对所获得的两个棉花XTH进行信号肽预测、亚细胞定位预测及等电点等蛋白特征分析。有助于了解其生物学功能。经Protparam程序预测,GhXTH1理论分子质量33.07 ku,理论等电点(pI)为6.38,GhXTH2理论分子质量33.61 ku,理论pI为5.40。通过SignalP 4.1 Server预测,显示GhXTH1和GhXTH2在N端均存在一段信号肽(图3),位置位于第1~25 aa。该信号肽的作用是将该蛋白定位至细胞壁。TMHMM预测GhXTH1和GhXTH2均存在1个跨膜结构(图4),该跨膜结构位于N端,在蛋白序列中信号肽的后面。N-糖基化对维持XTH活性具有重要作用[26]。用NetNGlyc 1.0 Server分析GhXTH1和GhXTH2中 N(天冬酰胺)-糖基化位点。结果表明,GhXTH1存在1个糖基化位点,GhXTH2有两个糖基化位点,GhXTH1和GhXTH2保守序列DEIDFEFLG后面均存在1个糖基化位点。
2.3 GhXTH1和GhXTH2系统发育分析
为了解GhXTH1、GhXTH2与拟南芥XTH之间进化关系,进行系统发育分析(图6)。AtXTHs可以分3类,大部分Ⅰ类XTH成员包含4个外显子,Ⅱ类XTH成员具有2或3个外显子,Ⅲ类XTH成员具有4或5个外显子,且3类XTH C端存在特征序列[25]。但随着AtXTHs与水稻XTHs(OsXTHs)叠加系统发生分析发现,Ⅰ类和Ⅱ类XTH成员分歧已不明显[27];Ⅲ类显示具有木葡聚糖水解酶活性而不是转糖基酶活性[28]。但酶活性分析表明Ⅲ类酶并不都具有水解酶活性,番茄中的一个Ⅲ类XTH(SIXTH5)表现出转糖基酶活性[29]。因此,XTH系统发生学分类与其活性之间并无关系。GhXTH1与AtXTH6、AtXTH亲缘关系较近,GhXTH2与AtXTH9亲缘关系较近,均属于Ⅰ/Ⅱ类XTH。
2.4 GhXTH1和GhXTH2在棉花纤维发育中的表达分析
为获得两个XTH在不同棉花纤维中随发育时期的表达模式,用克隆到两个XTH序列设计引物,进行半定量分析,以了解两个XTH在陆地棉和海岛棉棉花纤维发育中的表达模式(图7)。结果表明,GhXTH1和GhXTH2在陆地棉和海岛棉表达量均随着棉花纤维发育而下降。在棉花纤维发育的初生壁时期,细胞伸长较快,XTH大量表达能松弛初生细胞壁进而释放因细胞伸长而产生的阻力。在陆地棉和海岛棉中,GhXTH2表达量比对应发育时期GhXTH1表达量高。
3 讨论
利用传统PCR技术和RACE技术,从棉花纤维中分离到两个XTH基因,分别命名为GhXTH1和GhXTH2。序列比对发现它们均存在XTH家族保守基序DEIDFEFLG,该基序不仅在XTH家族中保守,在XTH所隶属的GH16家族中也相对保守[30,31]。从拟南芥和水稻XTH家族保守序列看,该基序在某些位点有些变化。因此,GhXTH1和GhXTH2在该基序上有1~2氨基酸残基变化不影响其成为XTH家族成员。
拟南芥XTH家族包含33个成员,从系统发生学角度可分为3类[32],GhXTH1和GhXTH2均属于其中Ⅰ类(Group Ⅰ/Ⅱ)。Ⅰ类XTH具有一个共同特征,XTH基因由4个外显子组成,其保守基序位于3个外显子上。但系统发育分类与XTH活性无关[29],在水稻中,Ⅲ类中两个XTH(OsXTH19,OsXTH20)仅表现出水解酶活性,而Ⅰ类中的OsXTH1具有内转移酶活性和水解酶活性[33]。系统发生分析显示,GhXTH1与AtXTH6、AtXTH7亲缘关系密切,而GhXTH2与AtXTH9亲缘关系较近。将GhXTH1和具有水解酶活性XTH(TmNGX1)进行三维结构比较可知,其在负责水解活性的保守环状结构上存在差异,因此,GhXTH1主要是转糖基酶活性[17]。AtXTH9活性还无报道,但从系统发生分析看,AtXTH9、GhXTH2与GhXTH1关系较近,它们在酶活性上应该是类似的,AtXTH9表达受远红光的正调控[34]。因此,GhXTH2的表达有可能受到红外光的正调控。
XTH具有多种生理功能,包括有细胞生长[15,16,35]、水果软化[29,36]、器官脱落[37,38]、维管形成[39-42]等。水稻3个XTH酶活性类型不同,将它们在水稻中超表达或抑制表达,均不能明显改变水稻表型,说明这3个XTH存在功能冗余[33]。GhXTH1和GhXTH2在棉纤中有较高的表达,说明其与棉花纤维发育有关。GhXTH1在具有更长棉花纤维的棉花品种或者海岛棉中上调表达[17],说明GhXTH1与棉纤伸长有关,GhXTH1在棉花中超表达后,棉纤转糖基酶活性增加,成熟纤维长度也有增加。GhXTH2在棉花纤维中表达高于GhXTH1,因此,GhXTH2在棉花纤维伸长方面的作用可能比GhXTH1强,但也不能排除GhXTH1和GhXTH2在棉花纤维伸长方面存在功能冗余。
4 结论
获得了两个全长木葡聚糖转移/水解酶基因GhXTH1和GhXTH2全长cDNA序列,GhXTH1和GhXTH2均含有信号肽和跨膜结构,这表明其是定位于质膜上的分泌性蛋白。GhXTH1和GhXTH2均含有XTH家族的保守基序DEIDFEFLG,且在基序后存在糖基化位点,该基序和糖基化是XTH产生活性必需的,这说明所获得两个序列具有该家族的一般特性。系统发生学分析表明,GhXTH1与拟南芥XTH6、XTH7亲缘关系较近,GhXTH2与拟南芥XTH9亲缘关系较近。GhXTH1和GhXTH2均随着棉花纤维发育表达量降低,GhXTH2比GhXTH1表达量高。
参考文献:
[1] MAUNEY J R. Cotton Physiology (The Cotton Foundation Reference Book Series No 1)[M].Memphis:Cotton Foundation,1987.
[2] 徐 雯.棉花紫色酸性磷酸酶基因的克隆及功能分析[D].武汉:华中農业大学,2012.
[3] BEASLEY C A.Developmental morphology of cotton flower sand seed as seen with the scanning electron microscope[J].Amer J Bot,1975,62(6):584-592.
[4] STEWART J M.Fiber Initiation on the Cotton Ovule(Gossypium hirsutum)[J].Amer J Bot,1975,62(7):723-730.
[5] JOSHI P A.,STEWART J M,GRAHAM E T.Localization of β-glycerophosphatase activity in cotton fiber during differentiation[J].Proto Plasma,1985,125(1):75-85.
[6] MEINERT M C,DELMER D P.Changes in bioehemical composition of the cell wall in cotton fiber during development[J].Plant Physiol,1977,59(6):1088-1097.
[7] RUAN Y L,CHOUREY P S,DELMER P D,et al. The differential expression of sucrose synthase in relation to diverse patterns of carbon partitioning in developing cotton seed[J].Plant Physiol,1997,115(2):375-385.
[8] LI X R,WANG L,RUAN Y L.Developmental and molecular physiological evidence for the role of phosphoenolpyruvate carboxylase in rapid cotton fibre elongation[J].J Exp Bot,2010, 61(1):287-295.
[9] RUAN Y L,LLEWELLYN D J,FURBANK R T. The Control of single-celled cotton fiber elongation by developmentally reversible gating of plasmodesmata and coordinated expression of sucrose and K+ transporters and expansin[J].Plant Cell,2001, 13(1):47-60.
[10] RUAN Y L,XU S M,WHITE R,et al. Genotypic and developmental evidence for the role of plasmodesmatal regulation in cotton fiber elongation mediated by callose turnover[J].Plant Physiol,2004,136(4):4104-4113.
[11] WANG L,LI X R,LIAN H,et al. Evidence that high activity of vacuolar invertase is required for cotton fiber and Arabidopsis root elongation through osmotic dependent and independent pathways, respectively[J].Plant Physiol,2010,154(2):744-756.
[12] MAUREL C,SANTONI V,LUU D T,et al. The cellular dynamics of plant aquaporin expression and functions[J].Curr Opin Plant Biol,2009,12(6):690-698.
[13] VISSENBERG K,FRY S C,PAULY M,et al. XTH acts at the microfibril-matrix interface during cell elongation[J].J Exp Bot,2005,56:673-683.
[14] MARIS A,SUSLOV D,FRY S C,et al. Enzymic characterization of two recombinant xyloglucan endotransglycosylase/hydrolase(XTH) proteins of Arabidopsis and their effect on root growth and cell wall extension[J].J Exp Bot,2009,60(13):3959-3972.
[15] MIEDES E,SUSLOV D,VANDENBUSSCHE F,et al.Xyloglucan endotransglucosylase/hydrolase(XTH)overexpression affects growth and cell wall mechanics in etiolated Arabidopsis hypocotyls[J].J Exp Bot,2013,64(8):2481-2497.
[16] LEE J,BURNS T H,LIGHT G,et al. Xyloglucan endotransglycosylase/hydrolase genes in cotton and their role in fiber elongation[J].Planta,2010,232:1191-1205.
[17] MICHAILIDIS G,ARGIRIOUS A,DARZENTAS N,et al.Analysis of xyloglucan endotransglycosl-ase/hydrolase(XTH) genes from allotetraploid(Gossypium hirsutum) cotton and its diploid progenitors expressed during fiber elongation[J].J Plant Physiol,2009,166:403-416.
[18] GHAZI Y,BOUROT S,ARIOLI T,et al. Transcript profiling during fiber development identifies pathways in secondary metabolism and cell wall structure that may contribute to cotton fiber quality[J].Plant Cell Physiol,2009,50(7):1364-1381.
[19] 武耀廷,劉进元.一种高效提取棉花不同组织总RNA的热硼酸改良法[J].棉花学报,2004,16(2):67-71.
[20] LI X L,XIA T,HUANG J,et al. Distinct biochemical activities and heat shock responses of twoUDP-glucose sterol glucosyltransferases in cotton[J].Plant Sci,2014,219-220(1):1-8.
[21] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[22] BENDTSEN J D,NIELSEN H,VON HEIJNE G,et al. Improved prediction of signal peptides:SignalP 3.0[J].J Mol Biol,2004, 340(4):783-795.
[23] GASTEIGER E,GATTIKER A,HOOGLAND C,et al.Ex-PASy:The proteomics server for in depth protein knowledge and analysis[J].Nucl Acid Res,2003,31:3784-3788.
[24] YOKAYAMA R,NISHITANI K. A comprehensive expression analysis of all members of a gene family encoding cell-wall enzymes allowed us to predict cis-regulatory regions involved in cell-wall construction in specific organs of Arabidopsis[J].Plant Cell Physiol,2001,42:1025-1033.
[25] ROSE J K C,BRAAM J,FRY S C,et al. The XTH family of enzymes involved in xylo-glucan endotransglucosylation and endohydrolysis:Current perspectives and a new unifying nomenclature[J].Plant Cell Physiol,2002,43:1421-1435.
[26] HENRIKSSON H,DENMAN S E,CAMPUZANA I D G,et al.N-linked glycosylation of native and recombinant cauliflower xyloglucan endotransglycosylase 16A[J].Biochem J,2003,375: 61-73.
[27] YOKOYAMA R,ROSE J K C,NISHITANI K. A surprising diversity and abundence of xyloglucan endotransglucosylase/hydrolases in rice. Cassification and expression analysis[J].Plant physiol,2004,134(3):1088-1099.
[28] TABUCHI A,MORI H,KAMISAKA S,et al. A new type of endoxyloglucan transferase devoted to xyloglucan hydrolysis in the cell wall of azuki bean epicotyls[J].Plant Cell Physiol,2001, 42:154-161.
[29] SALADI?魪 M,ROSE J K C,COSGROVE D J,et al. Characterization of a new xyloglucan endotransglucosylase/hydrolase(XTH) from ripening tomato fruit and implications for the diverse models of enzymic action[J].Plant J,2006,47:282-295.
[30] HENRISSAT B,COUTINHO P M,DAVIES G J. A census for carbohydrate-active enzymes in the genome of Arabidopsis thaliana[J].Plant Mol Biol,2001,47:55-72.
[31] CANTAREL B L,COUTINHO P M,RANCUREL C,et al. The carbohydrate-active enzymes database(CAZy):An expert resource for glycogenomics[J].Nucleic Acids Res,2009,37:233-238.
[32] BAUMANN M J,EKLOF J M,MICHEL G,et al.Structural evidence for the evolution of xyloglucanase activity from xyloglucan endo-transglycosylases:Biological implications for cell wall metabolism[J].Plant Cell,2007,19(6):1947-1963.
[33] HARA Y,YOKOYAMA R,OSAKABE K,et al. Function of xyloglucan endotrans-glucosylase/hydrolases in rice[J].Ann Bot,2014,114:1309-1318.
[34] SASIDHARAN R,CHINNAPPA C C,STAAL M,et al. Light quality-mediated petoile elongation in Arabidopsis during shade avoidance involves cell wall modification by xyloglucan endotransglucosylase/hydrolases[J].Plant Physiol,2010,154:978-990.
[35] HARADA T,TORII Y,MORITA S,et al. Cloning, characterization,and expression of xyloglucan endotransglucosylase/hydrolase and expansin genes associated with petal growth and development during carnation flower opening[J].J Exp Bot,2011,62(2):815-823.
[36] HAN Y,ZHU Q G,ZHANG Z K,et al. Analysis of xyloglucan endotransglycosylase/hydrolase(XTH) genes and diverse roles of isoenzymes during persimmon fruit development and postharvest softening[J].PLoS One,2014,10(4):e0123668.
[37] SINGH A P,TRIPATHI S K,NATH P,et al. Petal abscission in rose is associated with the differential expression of two ethylene responsive xyloglucan endotransglucosylase/hydrolase genes RbXTH1,and RbXTH2[J].J Exp Bot,2011,62:5091-5103.
[38] TSUCHIYA M,SATOH S,IWAI H. Distribution of XTH,expansin,and secondary-wall-related CesA in floral and fruit abscission zones during fruit development in tomato (Solanum lycopersicum)[J].Front Plant Sci,2015,6:1-9.
[39] MATSUI A,YOKOYAMA R,SEKI M,et al.AtXTH27 plays an essential role in cell wall modification during the development of tracheary elements[J].Plant J,2005,42:525-534.
[40] BOURQUIN V,NISHIKUBO N,ABE H,et al. Xyloglucan endotransglycosylases have a function during the formation of secondary cell walls of vascular tissues[J].Plant Cell,2002, 14:3073-3088.
[41] NISHIKUBO N,TAKAHASHI J,ROOS A A,et al. Xyloglucan endotransglycosylase-mediated xyloglucan rearrangements in developing wood of hybrid aspen[J].Plant Physiol,2011,155: 399-413.
[42] WANG B,ZHANG D. Association of allelic variation in PtoXET16A with growth and wood properties in Populus tomentosa[J].Int J Mol Sci,2014,15(9):16949-16974.
