造船废油对海水中微生物数量和酶活性的影响
2017-03-28袁翼李土建顾得月熊妍妍刘雪珠李
袁翼 李土建 顾得月 熊妍妍 刘雪珠 李鹏

摘要:实验室条件下,在28 d周期内研究了不同浓度(0、0.05、0.15、0.45、1.35 mg/L)的含油废水对海水中微生物数量和酶活性的影响。结果表明,海水中的微生物数量随着含油废水污染时间和浓度的不同,表现出不同的变化特征。在培养过程中,细菌数目在7 d时达到最大值,之后开始呈缓慢下降的趋势,其中7 d时含油浓度为0.15 mg/L的处理数量增长最为明显;在培养过程中放线菌一直保持增长的趋势,浓度为0.45 mg/L的处理在28 d时放线菌数量明显超过其他浓度处理;在整个培养过程中霉菌与酵母菌数量极少。含油废水对海水中微生物脱氢酶和超氧化物歧化酶(SOD)的诱导作用不同。微生物的脱氢酶活性在0~14 d内缓慢上升,至14 d时达到最大,其后随着时间推移脱氢酶活性逐渐减弱。而SOD酶活性在28 d的培养期内呈先下降后回升并缓慢升高的趋势,且不同浓度的含油废水油污染对海水中微生物SOD酶活性的影响差异不显著(P>0.05)。
关键词:含油废水;微生物数量;酶活性
中图分类号:X55;Q938.8 文献标识码:B 文章编号:0439-8114(2017)04-0645-05
目前国内开展的關于溢油污染对海洋生态系统影响的研究主要集中在贝类、无脊椎动物、鱼类以及海鸟和哺乳动物等方面[1,2]。也有大量研究集中在海洋细菌对海洋溢油污染物的生物降解上,如石油降解菌的分离、纯化和筛选、石油降解菌的降解效率以及海洋石油污染的生物修复等方面[3-5],很少涉及石油污染对海洋微生物消长规律及微生物酶活性的影响[6]。
造船产业是国民经济中的重要组成部分。船厂在对船舶进行机械加工、部件预舾装、码头舾装、试验和试航时产生的废水中含有较高浓度的油,含油废水被排到海水中后,油层覆盖了水面,阻止空气中的氧向水中扩散。由于水体中溶解氧减少,藻类的光合作用受到了限制。同时,废水中的油除了刺激烃降解微生物的生长外,还会引起油污染海域微生物数量、群落结构组成和微生物酶活性等方面的变化,并最终影响海洋生态系统的次级生产过程[7,8]。
本研究以舟山某造船厂废油为试验用油,远离造船厂近海表层水为试验用水。于实验室条件下,研究含油海水与海水中微生物数量对应关系及其对酶活性的影响,为初步建立含油废水污染对海洋次级生产过程影响的评估体系奠定基础,并为油污染海域自身修复能力和含油废水污染治理提供科学依据和决策参考。
1 材料与方法
1.1 材料
试验海水采自远离造船厂近海表层海水,样品采集参照《海洋生物生态调查技术规程》方法[9]。
试验用油为舟山某造船厂废油。由于油难溶于水,为使油均匀分散到海水中,首先制备饱和含油海水(母液),用于研究重油在水相中稳定存在的小油珠和溶解成分对异养细菌的影响。母液制备方法:在无菌海水(0.22 μm滤膜过滤)中滴加过量试验用油,将混合液置于磁力搅拌机上,连续搅拌24 h后静置约6 h,用分液漏斗分离出下层水相即为饱和的含油海水(母液)。
1.2 方法
1.2.1 母液浓度测定 采用紫外分光光度法测定[10]:①油标准贮备液(1 000 mg/L),准备称取100 mg标准油于烧杯中,加入少量石油醚,溶解。全量转移到100 mL容量瓶中,并稀释至标线,混匀。②油标准使用液(50 mg/L),移取5 mL油标准贮备液于100 mL容量瓶中,用石油醚稀释至标线,混匀。
分别配制10、20、30、40、50 mg/L的系列标准样品,用1 cm光程石英比色皿以石油醚为空白参比,在256 nm波长处依次测定上述样品的吸光度值,绘制标准曲线y=0.001 0x-0.000 2,R2=0.998 7。根据标准曲线计算出母液浓度为22.5 mg/L;根据母液测定结果及海水水质标准,设置处理浓度为0、0.05、0.15、0.45、1.35 mg/L,并按20 mg/L和10 mg/L加入NH4NO3和KH2PO4作为无机营养盐[11],每个浓度分装100 mL水样于250 mL锥形瓶中。将设置好的5个浓度组置于28 ℃、120 r/min的恒温振荡培养箱中培养。分别于0、7、14、21、28 d进行取样测定。
1.2.2 海水初始状态下微生物数量检测 采用荧光显微镜计数法检测海水初始状态下的微生物总数[12-14]:①取一张0.2 μm微孔滤膜,使膜光滑面朝上平贴于滤器底部;②摇匀样品,吸取0.25 mL菌液注入滤器内,同时加入0.375 mL无菌冲洗水,加2~3滴丫啶橙染液染色3 min,手动抽滤染色液,使微生物留于滤膜上,用无菌水冲洗数次,再将滤液抽干;③取下滤器,用镊子将滤膜移到载玻片上,滴一小滴香波油,在荧光显微镜下观察计数;④观察并计数3个装片共30个视野下微生物数目,并按下列公式计算初始状态下海水中微生物总数:E=X■·V,式中,E表示样品中微生物数量(ind/mL);X表示各视野中细菌总数的平均值(个);S1表示滤膜面积(mm2);S2表示显微镜视野面积(mm2);V表示过滤菌液体积(mL)。
1.2.3 可培养异养微生物计数 可培养异养细菌数测定方法用Zobell 2216E培养基稀释平板法培养并计数[15],可培养异养放线菌数测定方法用高氏一号培养基稀释平板法培养并计数,可培养异养霉菌及酵母菌数测定方法用PDA培养基稀释平板法培养并计数。
1.2.4 脱氢酶及SOD酶活性测定 脱氢酶活性测定采用氯化三苯基四氮唑(TTC)法[16,17],其原理是无色的TTC在细胞呼吸过程中替代O2-作为人为受氢体,接受H+后被还原成红色的三苯基甲臜(TF),通过测定TF吸光值大小反映细胞活力大小,样品前处理采用文献[18]方法。超氧化物歧化酶(SOD)活性测定采用改良的邻苯三酚自氧化法(325 nm法),细胞破壁采用助溶剂破壁法[19,20]。
1.3 数据处理及分析
数据分析在SPSS 17.0中进行,采用方差分析和LSD比较不同废油浓度、不同培养时间微生物数量及生物酶活性的差异性。相关图表制作通过Excel 2010完成。
2 结果与分析
2.1 海水初始状态下微生物数量的检测
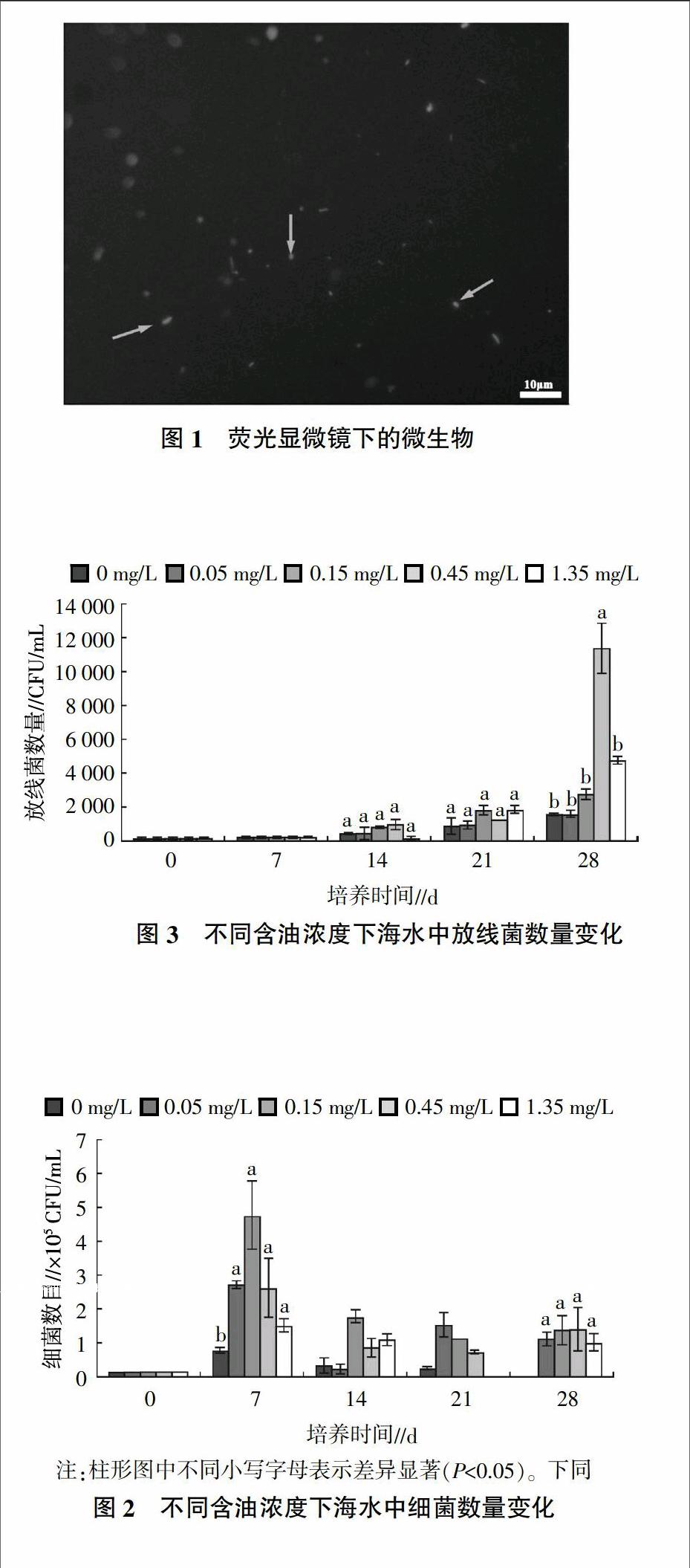
为检测海水初始状态下微生物总数,通过观察荧光显微镜下30个不同视野,得X=16个,S1=491 mm2,S2=7.2×10-3 mm2,V=0.25 mL,数据代入公式,可得E=4.36×106 ind/mL[21],观察结果如图1所示。由于经荧光染色后在观察时肉眼无法分辨死细胞及无生命颗粒,故正常情况下计算所得数值往往较实际可培养异养微生物总数高几个数量级。
2.2 不同浓度含油废水对海水中细菌数量的影响
不同含油浓度条件下海水中细菌的数量随时间的变化见图2。从图2可以看出,在培养过程中不同的培养时间所有处理细菌数目均呈现先上升后下降的趋势。在最初培养的7 d内各组均大幅度增长,而以含油浓度为0.15 mg/L的处理数量增长速度最快。各组均于7 d时细菌数量达到最大值,且可测得的各处理细菌数量显著高于对照组(P<0.05)。其原因可能是石油进入海水一段时间后,刺激能够利用石油烃作为C源并参与石油烃降解细菌的生长,导致其大量增殖,而石油污染对细菌生存的影响存在一个最适浓度。
而在7~14 d的培养时间内,各组细菌数量均呈明显下降趋势,表明长时间的含油环境对细菌生长有抑制作用。之后各组均缓慢上升,至28 d时,数值达到相对稳定,各组之间没有显著性差异(P>0.05),且各处理数值均高于对照。其中,最高浓度(1.35 mg/L)海水中的细菌数在14~21 d时曾下降至无,可能是由于高浓度的溢油污染对细菌的生长产生了抑制作用,之后又逐渐上升,至28 d试验结束时,其数值较对照组明显上升,但低于其他浓度组,推测是由于某些细菌对石油烃的降解作用所致。
已有研究表明,环境中可培养石油降解菌数与石油浓度呈密切正相关[22,23]。李博等[22]的研究表明,在石油污染的海水中,可培养异养细菌的数量先是呈增长趋势,在第7天时达到最大值,然后逐渐减少。这与本试验结果一致,石油污染后,可培养异养菌数短期内先增长后降低,较长时间后,逐渐恢复。另有研究表明,细菌中的多个属的菌类对石油烃具有不同程度的降解能力[24-26]。
2.3 不同浓度含油废水对海水中放线菌数量的影响
在培养过程中放线菌的数量随培养时间的变化如图3所示,放线菌数量一直保持增长的趋势,且在21 d及21 d之前处理与对照放线菌数量无显著性差异(P>0.05),含油浓度为0.45 mg/L的处理在28 d时放线菌数量显著高于其他处理(P<0.05),故推测放线菌比细菌耐受性更好,可适应更高浓度的石油污染。而经用PDA培养基分离培养表明所取海水中霉菌与酵母菌数量极少。
对于放线菌类而言,在长期培养过程中处理放线菌数总体呈上升趋势,而且随着时间推移,含油浓度越高(在低于1.35 mg/L时),这种趋势越明显。这也证明了放线菌对石油烃类具有强大的降解作用[27-32],但到目前为止,针对放线菌与石油污染及其对石油降解的应用研究还很少,值得进一步探索。
2.4 不同浓度含油废水对海水微生物脱氢酶活性的影响
在海水中加入不同浓度的含油废水后,海水中微生物脱氢酶活性随时间变化特征如图4所示。在0~7 d内各处理微生物脱氢酶活性缓慢上升,脱氢酶活性显著高于对照(P<0.05)。推测石油污染物诱导了细菌脱氢酶的产生。7~14 d内,除含油浓度为0.05 mg/L的处理大幅度升高,显著高于其他处理(P<0.05),脱氢酶活性达到最大值外,其余0.15、0.45、1.35 mg/L浓度处理组,均呈小幅度下降趋势,其后随着时间推移,14~28 d试验过程中脱氢酶活性逐渐减小,除28 d时浓度为0.05 mg/L的处理脱氢酶活性高于对照外,其余处理均小于对照。推测不同浓度的含油废水对脱氢酶诱导的作用程度不同,高浓度的含油废水反而较快抑制了脱氢酶的活性。
脱氢酶是微生物体内参与石油烃类氧化分解的重要酶类,脱氢是石油降解或转化的首要步骤。已有研究表明脱氢酶与石油烃降解有良好的相关性[33,34],通常能反映微生物对石油污染的适应情况。本试验结果显示,各处理脱氢酶活性均呈先上升后下降趋势,且7 d后含油浓度为0.05 mg/L的处理脱氢酶活性明显高于其他处理。推测石油污染发生后,有关石油降解菌增殖,从而导致与石油降解有关的菌株脱氢酶活性增强,且较低浓度的含油废水能更好地诱导油降解菌产生大量脱氢酶,使得脱氢酶活性显著升高。之后,随着石油被逐步降解,脱氢酶活性也缓慢降低到稳定水平。
2.5 不同浓度含油废水对海水微生物SOD酶活性的影响
在海水中加入不同浓度的含油废水后,海水中微生物SOD酶活性随时间变化特征如图5所示。在28 d的培养期内各处理SOD酶活性呈先下降后回升并持续缓慢升高的趋势,0~7 d内不同浓度的含油废水对海水中微生物SOD酶活性的影响差异不显著(P>0.05),只有浓度为0.05 mg/L的处理SOD酶活性出现下降趋势;而在7~14 d内,各个处理SOD酶活性下降程度不大;随后SOD酶活性至21 d時稍有上升,至试验结束各处理SOD酶活性已保持相对稳定。
不考虑偶然因素,可以推测微生物对海水中施加的重油污染成分需要较长时间的适应期,并在适应期过后,重油可以刺激并诱导微生物SOD酶的生物合成。但从培养后期SOD酶活性升高的趋势来看,这种诱导作用是十分微弱的。目前为止,国内外有诸多关于石油污染物对海洋生物抗氧化酶系统毒性效应的研究[33-36],但较少见石油污染对海洋微生物SOD酶活性的研究。SOD酶是生物抗氧化系统的重要酶类,其活性对维持细胞正常生命活动具有重要意义。与脱氢酶相比,重油污染对SOD酶的促进作用要小很多,在所设计浓度范围内,仅在14 d时有小幅回落而后缓慢上升。Christian等[37]在原油污染对大鼠抗氧化酶的作用中发现,当给原油超过6 mL/kg时其SOD酶活性明显上升,而在给原油3 mL/kg时其SOD酶活性变化不明显。
3 小结
1)被含油废水污染后,海水中可培养异养微生物数目(细菌及放线菌)随时间推移和含油浓度的不同而变化。从28 d周期来看,可培养异养细菌数目总体呈先升高后下降的变化趋势,7 d时各处理细菌数量大幅度上升,其中以0.15 mg/L浓度处理增长最为迅速,7 d后细菌数量明显下降,至试验结束各处理数量保持相对稳定。本试验中0.15 mg/L浓度的含油废水对细菌生长有较明显的促进作用,而超过或低于该浓度其促进作用减弱。总体显示含油废水污染发生后,细菌对其的自净能力是有限的。
长期培养放线菌的过程中,放线菌数量一直保持上升趋势。7 d之前放线菌基数极小,至7 d时各处理放线菌数量开始逐步上升。此外,放线菌数量14 d后出现快速增长,其在含油废水污染环境中的耐受力比细菌更好,但其对废油的适应能力及降解修复能力值得进一步研究。
2)较低浓度(本试验中0.15 mg/L)的含油废水可促进海水中可培养异养微生物脱氢酶的大量合成,且含油浓度为0.15 mg/L时,这种促进作用最为明显。但从21 d开始至试验结束,各组脱氢酶活性均维持在较低水平,且对照与各处理间无显著性差异(P>0.05)。显然,在0.05~1.35 mg/L浓度范围内和0~14 d时间内,含油废水对脱氢酶具有诱导作用,但一旦浓度过高或作用时间过长,则其诱导作用就不明显并开始减弱。相较于SOD酶,脱氢酶对含有废水的刺激更为敏感,是否可将脱氢酶活性作为检测海洋受废油早期污染的一个生理检测指标值得研究。
相比脱氢酶,各组浓度的含油废水对海水中微生物SOD酶活性的影响差异性不显著(P>0.05)。在所有设计浓度范围内各组SOD酶活在14 d时有小幅下降现象,21 d至试验结束,对照与各处理SOD酶活性亦无显著性差异(P>0.05),说明含油废水污染对海水微生物SOD酶活性的影响较小。SOD酶对海洋废油的这种迟钝反应是否可以作为检测海洋受重度废油污染的一个生理检测指标有待于进一步研究。
参考文献:
[1] 王志霞,刘敏燕.溢油对海洋生态系统的损害研究进展[J].水道港口,2008,29(5):367-371.
[2] SMOLDERS R,BERVOETS L,COEN W D,et al. Cellular energy allocation in zebra mussels exposed along a pollution gradient:Linking cellular effects to higher levels of biological organization[J].Environmental Pollution,2004,129(1):99-112.
[3] HYUN M J,KIM J M,LEE H J,et al. Alteromonas as a key agent of polycyclic aromatic hydrocarbon biodegradation in crude oil-contaminated coastal sediment[J].Environmental Science & Technology,2012,46(14):7731-7740.
[4] WANG W P,ZHONG R Q,SHAN D P,et al. Indigenous oil-degrading bacteria in crude oil-contaminated seawater of the Yellow sea, China[J].Applied Microbiology and Biotechnology,2014,98(16):7253-7269.
[5] YAKIMOV M M,TIMMIS K N,GOLYSHIN P N. Obligate oil-degrading marine bacteria[J].Current Opinion in Biotechnology,2007,18(3):257-266.
[6] 游 偲,曲 良,马 帅,等.石油污染对海水中细菌数量和酶活性的影响[J].海洋环境科学,2014,33(3):366-371.
[7] 李 玫,陈桂珠.含油废水对秋茄幼苗的几个生理生态指标的影响[J].生态学报,2000,20(3):528-532.
[8] 游 偲.海洋异养细菌对溢油污染响应特征的初步研究[D].山东青岛:中国海洋大学,2012.
[9] 梁玉波.我国近海海洋综合调查与评价专项─海洋生物生态调查技术规程[M].北京:海洋出版社,2006.13-23.
[10] 庞艳华,丁永生,公维民.紫外分光光度法测定水中油含量[J].大连海事大学学报,2002,28(4):68-71.
[11] MCKEW B A,COULON F,OSBORN A M,et al. Determining the identity and roles of oil metabolizing marine bacteria from the Thames estuary,UK[J].Environmental Microbiology,2007, 9(1):165-176.
[12] 晏榮军,尹平河,林小涛.荧光显微镜细菌计数方法研究[J].海洋技术,2005,24(1):64-66.
[13] 赵海萍,李清雪,陶建华.海洋细菌荧光显微计数法及其应用[J].河北工程大学学报(自然科学版),2007,24(1):57-60.
[14] 张武昌,肖 天,王 荣.海洋微型浮游动物的丰度和生物量[J].生态学报,2001,21(11):1893-1908.
[15] 徐怀恕,杨学宋,李 筠.对虾苗期细菌病害的诊断与控制[M].北京:海洋出版社,1999.55-101.
[16] 趙连梅,池勇志,张春青.TTC-脱氢酶活性测定中标准曲线的影响因素研究[J].实验室科学,2009(4):72-74.
[17] 陈 莉,梁文艳,李 炯,等.细菌脱氢酶活性生物测试法用于水质毒性检测的改进[J].中国环境监测,2010,26(3):17-21.
[18] PAISS E S,COULON F,GONI-URRIZA M,et al. Structure of bacterial communities along a hydrocarbon contamination gradient in a coastal sediment[J].FEMS Microbiol Ecol,2008, 66(4):295-305.
[19] 李 兰,张明霞,袁金辉.不同破壁方法对细菌产SOD活性的影响[J].食品工业科技,2008,29(10):108-111.
[20] 张 宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报(自然科学版),2002, 33(6):677-681.
[21] 沈 萍,陈向东.微生物学实验[M].第四版.北京:高等教育出版社,1999.
[22] 李 博,沈 璐,张德民.石油污染海水中细菌群落的动态变化[J].宁波大学学报(理工版),2009,22(4):477-483.
[23] 田胜艳,刘宪斌,高秀花.石油污染海洋环境中的细菌群落[J].环境与可持续发展,2006(4):32-35.
[24] TAZAKI K,CHAERUN S K. Life in oil:Hydrocarbon degrading bacterial mineralization in oil spill-polluted marine environment[J].Front Mater Sci China,2008,2(2):120-133.
[25] KODAMA Y,STIKNOWATI L I,UEKI A,et al.Thalassospira tepidiphila sp. nov,a polycyclic aromatic hydrocarbon-degrading bacterium isolated from seawater[J].International Journal of Systematic and Evolutionary Microbiology,2008,58(3):711-715.
[26] KASAI Y,KISHIRA H,SASAKI T,et al. Predominant growth of Alcanivorax strains in oil-contaminated and nutrient-supplemented sea water[J].Environmental Microbiology,2002,4(3):141-147.
[27] CHANG J H,RHEE S K,CHANG Y K,et al. Desulfurization of diesel oils by a newly isolated dibenzothiophene-degrading Nocardia sp. strain CYKS2[J].Biotechnology Progress,1998, 14(6):851-855.
[28] ZEINALI M,VOSSOUGHI M,ARDESTANI S K,et al. Hydrocarbon degradation by thermophilic Nocardia otitidiscaviarum strain TSH1: Physiological aspects[J].Journal of Basic Microbiology,2007,47(6):534-539.
[29] ZEINALI M,VOSSOUGHI M,ARDESTANI S K. Degradation of phenanthrene and anthracene by Nocardia otitidiscaviarum strain TSH1,a moderately thermophilic bacterium[J].Journal of Applied Microbiology,2008,105(2):398-406.
[30] MOODY J D,FREEMAN J P,DOERGE D R,et al. Degradation of phenanthrene and anthracene by cell suspensions of Mycobacterium sp. strain PYR-1[J].Applied and Environmental Microbiology,2001,67(4):1476-1483.
[31] KIM Y H,FREEMAN J P,MOODY J D,et al. Effects of pH on the degradation of phenanthrene and pyrene by Mycobacterium vanbaalenii PYR-1[J].Applied Microbiology Biotechnology,2005,67(2):275-285.
[32] ALONSO-GUTI?魪RREZ J,TERAMOTO M,YAMAZOE A,et al. Alkane-degrading properties of Dietzia sp. H0B, a key player in the Prestige oil spill biodegradation (NW Spain)[J].Journal of Applied Microbiology,2011,111(4):800-810.
[33] 李广贺,张 旭,卢晓霞.土壤残油生物降解性与微生物活性[J].中国地质大学学报,2002,27(2):181-185.
[34] MARIN J A,HERN?魣ND T,GARCIA C. Bioremediation of oil refinery sludge by land farming in semiarid conditions influence on soil microbial activity[J].Environmental Research,2005,98(2):185-195.
[35] 孙福红,周启星,张倩如.石油烃、Cu2+对沙蚕的毒性效应及对其抗氧化酶系统的影响[J].环境科学,2006,27(7):1415-1419.
[36] 陈 荣,郑微云,余 群,等.石油污染对僧帽牡蛎(Ostrea cucullata)抗氧化酶的影响[J].环境科学学报,2002,22(3):385-388.
[37] CHRISTIAN E O,OKWESILI F C N,PARKER J,et al. Effects of bonny light crude oil on anti-oxidative enzymes and total proteins in wistar rats[J].African Journal of Biotechnology,2012,11(6):16455-16460.
