非整倍体与肿瘤细胞致瘤性关系的初步研究
2017-03-27康燕燕
康燕燕,徐 阳
上海市医药学校,上海 200135
非整倍体与肿瘤细胞致瘤性关系的初步研究
康燕燕,徐 阳
上海市医药学校,上海 200135
背景与目的:非整倍体与肿瘤形成有关,本研究旨在探讨非整倍体与肿瘤细胞致瘤性的关系。方法:C3和C5细胞系是来自于同一淋巴瘤细胞系的两个亚克隆,采用CCK-8检测2个淋巴瘤细胞系C3和C5的增殖能力;应用常规染色体分析法检测这些细胞系的核型;采用软琼脂克隆形成实验检测这些细胞系的体外致瘤能力;采用Transwell小室检测这些细胞系的侵袭转移能力;通过小鼠体内成瘤实验检测这些细胞系的体内致瘤能力。结果:两个细胞系中C3增殖能力强于C5,差异有统计学意义。核型分析结果表明,这两个细胞系都是非整倍体核型,细胞系C3的众数范围是38~78,C5的众数范围是28~50,C3细胞系中亚二倍体、二倍体和超二倍体所占比例分别为20.33%、8.47%和71.2%,C5细胞系中亚二倍体、二倍体和超二倍体所占比例分别为11.11%、86.42%和2.47%。C3和C5细胞系的非整倍体细胞比例分别为95.73%和13.58%。C3细胞系可以在软琼脂中形成克隆,而C5细胞系未能形成克隆。在体外,C3细胞系的侵袭转移能力强于C5细胞系。体内致瘤实验结果表明,C3细胞系恶性程度较高,体内致瘤能力明显强于C5细胞系,C3细胞系在体内的转移灶较多,在肝脏和肾脏均有转移灶点,而C5细胞系只在肾脏出现转移灶点。结论:非整倍体与肿瘤细胞致瘤性之间存在相关性,非整倍体对细胞的恶性转化及肿瘤发生具有重要贡献。
非整倍体;致瘤致瘤性;核型;增殖能力;侵袭转移能力
染色体不稳定(chromosome instability,CIN)是指由于有丝分裂时发生错误,使得染色体错误分离的几率增加[1-2]。CIN是基因组不稳定性(genomic instability,GIN)的一种形式,包括导致变化染色体拷贝数(非整倍体)频繁的细胞遗传学改变,即CIN的主要产品之一就是非整倍体。同时兼具CIN和非整倍体是癌细胞的共同特征,其在肿瘤发生、发展中的作用尚不清楚。与GIN相比,CIN提供表型变异,增加肿瘤的异质性,因此促进癌细胞的恶性演变、抗化疗或复发[3]。在大部分肿瘤中,CIN发生在早期阶段,它与不良预后密切相关,会增加多种类型的人类癌症的侵袭性演变[4]。此外,在撤掉小鼠KRAS-诱导的肺癌模型中致癌刺激物后发现,CIN可以驱动肿瘤转移[5],表明CIN能够引起基因改变,向致癌基因转化。此外,染色体不稳定的肿瘤细胞与染色体稳定的肿瘤细胞相比,多药耐药性显著增强[6-8]。Birkbak等[9]在卵巢癌、胃癌和非小细胞肺癌中也发现CIN的高低与预后密切相关。以上研究表明,CIN可以驱动癌症发展。CIN、非整倍体和癌症之间的关系比以前预期的更为复杂。最近有研究提出,非整倍体本身也可能导致CIN,积极的反馈回路的存在导致非整倍性水平的增加[10]。越来越多的临床证据支持非整倍体对于肿瘤形成有积极的贡献。最近Davoli等[11]提出了一种关于癌症形成的新理论,非整倍体驱动了癌症,而不仅仅是它的结果,基因突变、重排和表达改变等其他一些事件也很重要。
尽管非整倍体与癌症之间的关系早已被知晓,但是非整倍体是癌症发生的贡献性因素还只是恶性转化的结果目前尚无定论。制约人们找寻这一答案的一个重要原因就是肿瘤细胞的基因组成的复杂性。但是无论如何,上述事实及争论均说明非整倍体对恶性转化及肿瘤发生具有重要贡献。非整倍体、CIN与肿瘤发生、发展的关系亟待进一步阐明。因此,本研究采用染色体分析技术、克隆形成实验和致瘤性检测等方法分析非整倍体与肿瘤发生、发展之间的关系,为最终明确肿瘤发生、发展机制提供实验依据。
1 材料和方法
1.1 材料
1.1.1 试剂
细胞培养板购自美国Costar公司,RPMI-1640培养液购自美国Life公司,胎牛血清和胰酶购自美国Gibco公司,吉姆萨染料和秋水仙素购自美国Sigma公司。
1.1.2 实验动物和细胞系
C57BL/6雌鼠购自上海斯莱克实验动物有限公司。由本实验室制备保存的2株小鼠淋巴瘤细胞系:C3和C5。C3和C5是来自同一株小鼠淋巴瘤细胞系的两个亚克隆。本项目以这两个亚克隆细胞系为细胞模型展开研究。
1.2 实验方法
1.2.1 细胞培养
癌细胞在37 ℃、CO2体积分数为5%的温箱中培养,培养液为含10%灭活胎牛血清的RPMI-1640,含1%的双抗(青霉素和链霉素)。每3~4 d传代1次,并取对数生长期的细胞用于实验。
1.2.2 CCK-8法检测细胞增殖能力
将处于对数生长期的细胞用0.25%的胰酶消化,倒置显微镜下观察,细胞变圆,连接消失后用完全培养基终止消化。台盼蓝染色后用血球计数板计数。将计数好的细胞悬液移至离心管,稀释成2×104/mL。将稀释好的细胞悬液滴加入96孔板里,分别设250/孔、500/孔、1 000/孔、2 000/孔和4 000/孔5个浓度组,每组设4个复孔。同时设不加细胞的空白对照,用含血清1640培养液培养。分别于24、48和72 h对细胞进行处理并测量吸光度(D)值。处理过程如下:测量孔每孔分别滴加10 μL的CCK-8工作液后,放入37 ℃温箱继续培养4 h。取出振荡溶解15 min。酶标仪在490 nm下测各孔D值,计算24、48和72 h的D值平均数和标准差。
1.2.3 细胞核型分析
癌细胞培养至对数生长期,分别加入1 μg/mL的秋水仙素,4 h后,用PBS洗涤,经胰酶消化制成单细胞悬液,225×g离心10 min,吸去上清液,加入37 ℃预温的0.075 mol/L的氯化钾至10 mL,充分混匀后,置37 ℃水浴箱中低渗处理20 min左右,加入1 mL甲醇-冰醋酸(3∶1)固定液,混匀,157×g离心10 min;吸去上清液;沿离心管壁慢慢加入7 mL固定液,轻轻混匀,固定至少30 min,吸去上清液;再加入7 mL固定液,继续固定30 min,吸去上清液;根据细胞多少加入适量的固定液,充分混匀制备细胞悬液,取预先经过冰水浸泡过的洁净载玻片,在30 cm高位置上向载玻片上滴2~3滴细胞悬液使细胞较好地分散,晾干,吉姆萨染液染色30 min,清水冲洗干净,晾干,在光学显微镜下分析细胞核型。众数范围的细胞比例=染色体数目处于众数范围的细胞数目/核型分析细胞总数。
1.2.4 软琼脂克隆形成试验
对指数生长期细胞采用常规消化传代方法制成细胞悬液。细胞悬液反复吹打,使细胞充分分散,单个细胞百分率应在95%以上。细胞记数,并用培养基调节细胞浓度,待用。根据细胞增殖能力,将细胞悬液倍比稀释。一般按照每皿含50、100和200个细胞的浓度分别接种5 mL细胞悬液到培养皿(直径60 mm)中,以十字方向轻轻晃动培养皿,使细胞分散均匀。调整细胞悬液密度为1×103个/mL细胞。制备底层琼脂,完全溶化的5%琼脂和37 ℃左右预温的新鲜完全培养液以1∶9比例在40 ℃下均匀混合,加入培养皿(直径60 mm)中,每皿含0.5%琼脂培养基2 mL,室温下琼脂完全凝固。制备上层琼脂,取37 ℃不同密度梯度(按照每皿含50、100和200个)的细胞悬液1.5 mL移入小烧杯中,加入40 ℃、5%琼脂等体积混匀,即成0.25%半固体琼脂培养基。配好的半固体琼脂培养基立即加入铺有底层琼脂的培养皿中,室温下琼脂凝固。于37 ℃、CO2体积分数为5%的环境中静置培养2~3w。中间根据培养液pH变化适时更换新鲜培养液。当培养皿中出现肉眼可见克隆时,终止培养,弃去培养液,PBS小心浸洗2次,空气干燥。甲醇固定15 min,弃甲醇后空气干燥。用Giemsa染液染色10 min,流水缓慢洗去染液,空气干燥。镜检,拍照。
1.2.5 Transwell迁移实验
Transwell在24孔板中浸泡1 h;消化细胞,无血清培养基洗2次,计数,用无血清培养基配成细胞悬液,每孔加入100 µL;下腔室中加入含血清20%的培养基;37 ℃培养箱中,温育20~24 h;取出Transwell用PBS洗2遍,5%戊二醛固定,4 ℃;PBS洗2遍,加入0.1%的结晶紫染色,室温0.5 h,PBS洗2遍,用棉球擦去上表面细胞,显微镜下观察计数,每个200倍镜视野下细胞的数量,每下室计3个视野后取平均值。运用统计学方法比较3组间穿入下室细胞数量的差异,从而比较侵袭能力的差异。
1.2.6 Transwell侵袭实验
取300 μL无血清培养基,加入30 μL(或50 μg/每室)人工基底膜,混匀(4 ℃操作,最好在冰浴上),加入上室各100 μL(3个室);放入37 ℃培养箱中,温育4~5 h;消化细胞,无血清培养基洗3次,计数,配成细胞悬液;用无血清培养基洗1次;每孔加入100 μL细胞悬液;下腔室中加入含血清20%的培养基;在37 ℃培养箱中温育20~24 h;取出Transwell用PBS洗2遍,5%戊二醛固定,4 ℃;PBS洗2遍,加入结晶紫(0.1%)染色,室温0.5 h,PBS洗2遍,用棉球擦去上表面细胞,在显微镜下观察。计数每个200倍镜视野下细胞的数量,每下室计3个视野后取平均值。运用统计学方法比较3组间穿入下室细胞数量的差异,从而比较侵袭能力的差异。
1.2.7 体内致瘤性检测
取对数生长期的癌细胞,PBS洗涤3次以除去残留的血清,重悬于PBS中并调整浓度为5×106/mL。将20只C57BL/6小鼠分为2组,每组10只,在左侧腹股沟皮下分别注射不同的细胞悬液0.1 mL,每隔2 d测量并记录小鼠肿瘤的生长情况,当测定最大瘤体直径达2.0 cm时两组荷瘤鼠全部处死,处死后,观察记录小鼠皮下肿瘤生成情况、肿瘤数目、大小及是否有腹水形成等。
2 结 果
2.1 细胞形态
C3细胞系细胞大小不均一,形态各异,有梭形贴壁细胞,有圆形悬浮细胞,表明异质性较高。C5细胞系细胞大小一致,形态相同,均为圆形悬浮细胞,异质性较低(图1)。
2.2 细胞增殖能力检测
分别对C3和C5细胞系的细胞增殖能力进行了检测,结果显示,在接种24 h后,C3细胞系的细胞增殖速度稍快于C5细胞系(图2A);但是接种48 h后,C3细胞系的增殖速度明显快于C5细胞系(图2B);在接种72 h后,C3细胞系的增殖速度减慢,但仍然比C5细胞系增殖快(图2C)。综合比较,以培养48 h时差异最显著。
2.3 核型分析
细胞系C3和C5的细胞核型分析结果都是非整倍体核型,在C3细胞系中发现大部分的非整倍体为端着丝粒,以超二倍体居多。但是在C5细胞系中只发现少量非整倍体,均为端着丝粒,以亚2倍体居多(图3A)。其中细胞系C3的众数范围是38~78,C5的众数范围是28~50,C3细胞系中亚二倍体、二倍体和超二倍体所占比例分别为20.33%、8.47%和71.2%,C5细胞系中亚二倍体、二倍体和超二倍体所占比例分别为11.11%、86.42%和2.47%(图3B)。C3和C5细胞系的非整倍体细胞比例分别为95.73%和13.58% (图3C)。
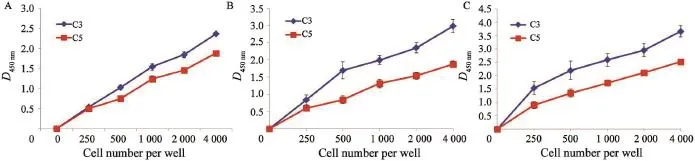
图2 C3和C5细胞系的增殖能力检测Fig. 2 The proliferation of C3 and C5 cell lines

图3 C3和C5细胞系的核型分析Fig. 3 The karyotype analysis of C3 and C5 cell lines
2.4 软琼脂克隆形成能力检测
C3和C5细胞系在软琼脂中培养2周后观察发现,C3细胞系可以成球,C5细胞系不能成球。非整倍体含量和异质性较高的C3细胞系在体外成球能力较强,而非整倍体含量和异质性较低的C5细胞系无法成球(图4),差异显著。
2.5 细胞迁移能力检测
在细胞迁移实验中,在接种细胞4 h后检测,结果发现,C3细胞系的迁移能力较强,随机选择3个视野的细胞数分别为123、106和102;C5细胞系的迁移能力较弱,随机选择3个视野的细胞数分别为25、19和23,差异有统计学意义(P<0.05,图5)。
2.6 细胞侵袭能力检测
在细胞侵袭实验中,在接种细胞7 h后检测,结果发现,C3细胞系的侵袭能力较强,随机选择3个视野的细胞数分别为68、57和61;C5细胞系的侵袭能力较弱,随机选择3个视野的细胞数分别为12、9和10,差异有统计学意义(P<0.05,图6)。
2.7 体内致瘤能力检测

图4 C3和C5细胞系的软琼脂克隆形成能力检测Fig. 4 Soft agar colony formation assay of C3 and C5 cell lines

图5 细胞迁移实验Fig. 5 Cell migration assay

图6 细胞侵袭实验Fig. 6 Cell invasion assay
体内致瘤实验结果表明,两种癌细胞系C3和C5细胞在免疫功能正常的小鼠皮下均可成瘤,其中C3细胞系共接种10只老鼠,其中有9只成瘤,成瘤率为90%(9/10);C5细胞系共接种10只老鼠,其中有6只成瘤,成瘤率为60%(6/10);C3细胞系致瘤能力较强,肿瘤的生长速度快于C5细胞系,差异有统计学意义(P<0.05,图7A、B)。C3细胞系的荷瘤鼠普遍发生了肝肾大面积病灶转移,而C5细胞系的荷瘤鼠只发生了肾转移(图7C)。综合表明,非整倍体含量和异质性较高的C3细胞系在体内致瘤能力较强,细胞恶性程度较高,侵袭转移能力较强,而非整倍体含量和异质性较低的C5细胞系恶性程度较低,侵袭转移能力较弱(图7D)。

图7 C3和C5的体内致瘤实验Fig. 7 Tumorigenicity of C3 and C5 cell lines in vivo
3 讨 论
肿瘤最主要的表型是异常增殖,因此如果非整倍体是癌变的原因,那么非整倍体一定与肿瘤细胞的致瘤性具有很好的相关性。为分析非整倍体与癌变的关系,我们对C3和C5细胞系的细胞表型、核型、克隆形成能力和致瘤性进行初步分析。细胞增殖结果表明,这两种细胞系的细胞增殖能力存在较大差异,C3细胞系的增殖能力明显强于C5细胞系。核型分析结果表明,C3和C5细胞系都是非整倍体核型,都由具有不同染色体数目的细胞构成,C3细胞系的核型以非整倍体居多,而且大部分为超二倍体,异质性较高。C5细胞系的核型以二倍体居多,少量非整倍体几乎均为亚二倍体,异质性较低。该结果表明,这两种细胞系的细胞核型存在很大异质性。致瘤能力检测结果表明,无论是在体内还是体外,C3细胞系的致瘤能力均高于C5细胞系。而且C3细胞系在体内的侵袭转移能力较强。以上研究结果表明,致瘤性高的细胞系核型存在很大异质性,非整倍体与致瘤性之间存在正向相关性。有研究显示,核型的异质性和不稳定性是肿瘤细胞异质性表型的直接原因,因此也是肿瘤发生的根本原因[12-13]。本研究结果与此一致。一个主要问题是CIN是否足以启动肿瘤发生。有学者通过分析人类的马赛克斑综合症患者发现,此类患者的最大特点是CIN增加,非整倍体增加,最终大多会发展为儿童癌症[14-15],这一发现支持了这个想法,CIN可能导致人类癌症。因此可以确定,非整倍体细胞含量越高,细胞恶性越高,致瘤能力越强。即非整倍体驱动了癌症,而不仅仅是它的结果。我们认为单纯以非整倍体不可能合理解释肿瘤细胞的表型异质性,非整倍体也不可能是肿瘤发生的唯一原因。非整倍体和基因突变假说都难以解释肿瘤细胞增殖异质性现象,提示还有其它因素参与癌变过程。因此,研究CIN、非整倍体和GIN的起源,对了解肿瘤发生的原因、肿瘤的预防及治疗有重大意义。
综上所述,CIN和非整倍体可能促进癌症发展。在未来,鉴于其在促进肿瘤发生的潜在作用,最根本的是鉴定在哺乳动物细胞中非整倍体和GIN之间的相互作用的特征。
[1] GEIGL J B, OBENAUF A C, SCHWARZBRAUN T, et al. Defining ‘chromosomal instability’ [J]. Trends Genet, 2008, 24(2): 64-69.
[2] GORDON D J, RESIO B, PELLMAN D. Causes and consequences of aneuploidy in cancer [J]. Nat Rev Genet, 2012, 13(3): 189-203.
[3] ROSCHKE A V, ROZENBLUM E. Multi-layered cancer chromosomal instability phenotype [J]. Front Oncol, 2013, 3: 302.
[4] MCGRANAHAN N, BURRELL R A, ENDESFELDER D, et al. Cancer chromosomal instability: therapeutic and diagnostic challenges [J]. EMBO Rep, 2012, 13(6): 528-538.
[5] SOTILLO R, SCHVARTZMAN J M, SOCCI N D, et al. Mad2-induced chromosome instability leads to lung tumour relapse after oncogene withdrawal [J]. Nature, 2010, 464(7287):436-440.
[6] LEE A J, ENDESFELDER D, ROWAN A J, et al. Chromosomal instability confers intrinsic multidrug resistance[J]. Cancer Res, 2011, 71(5): 1858-1870.
[7] DUESBERG P, STINDL R, HEHLMANN R. Explaining the high mutation rates of cancer cells to drug and multidrug resistance by chromosome reassortments that are catalyzed by aneuploidy [J]. Proc Natl Acad Sci U S A, 2000, 97(26):14295-14300.
[8] SWANTON C, NICKE B, SCHUETT M, et al. Chromosomal instability determines taxane response [J]. Proc Natl Acad Sci U S A, 2009, 106(21): 8671-8676.
[9] BIRKBAK N J, EKLUND A C, LI Q, et al. Paradoxical relationship between chromosomal instability and survival outcome in cancer [J]. Cancer Res, 2011, 71(10): 3447-3452.
[10] GIAM M, RANCATI G. Aneuploidy and chromosomal instability in cancer: a jackpot to chaos [J]. Cell Div, 2015, 10: 3.
[11] DAVOLI T, XU A W, MENGWASSER K E, et al. Cumulative haploinsufficiency and triplosensitivity drive aneuploidy patterns and shape the cancer genome [J]. Cell, 2013, 155(4): 948-962.
[12] DUESBERG P, LI R. Multistep carcinogenesis: a chain reaction of aneuploidizations [J]. Cell Cycle, 2003, 2(3):202-210.
[13] LI R, SONIK A, STINDL R, et al. Aneuploidy vs. gene mutation hypothesis of cancer: recent study claims mutation but is found to support aneuploidy [J]. Proc Natl Acad Sci U S A, 2000, 97(7): 3236-3241.
[14] HANKS S, COLEMAN K, REID S, et al. Constitutional aneuploidy and cancer predisposition caused by biallelic mutations in BUB1B [J]. Nat Genet, 2004, 36(11): 1159-1161.
[15] SNAPE K, HANKS S, RUARK E, et al. Mutations in CEP57 cause mosaic variegated aneuploidy syndrome [J]. Nat Genet, 2011, 43(6): 527-529.
Preliminary study of the relationship between aneuploidy and tumorigenicity of tumor cells
KANG
Yanyan, XU Yang (Shanghai Pharmaceutical School, Shanghai 200135, China)
Background and purpose: Aneuploidy is associated with tumor formation. This study aimed to study the relationship between aneuploidy and tumorigenicity of tumor cells. Methods: The proliferations of C3 and C5 cell lines were tested by CCK-8 assay. Regular chromosome assay was used to analyze the karyotypes of the 2 cell lines. The tumorigenicity of C3 and C5 cell lines was tested by soft agar colony formation assay in vitro. The invasion and metastasis of C3 and C5 cell lines were detected by transwell chamber. The tumorigenicity of C3 and C5 cell lines was tested by xenograft in vivo. Results: The proliferative ability of C3 was stronger than that of C5. The dif f erence was statistically signif i cant. The karyotype assay showed that the karyptypes of the C3 and C5 cell lines were all aneuploid and their model numbers were 38-78 for C3 cell line and 28-50 for C5 cell line respectively. The proportions of C3 hypodiploid, diploid and hyperdiploid were 20.33%, 8.47%, and 71.2%, respectively. The proportions of C5 hypodiploid, diploid and hyperdiploid were 11.11%, 86.42%, and 2.47 %, respectively. The proportions of aneuploid C3 and C5 were 95.73% and 13.58%, respectively. C3 cell line could form colonies in soft agar, while C5 cell line failed to form colonies. The invasion and metastasis of C3 was stronger than that of C5 in vitro. The results showed that the tumorigenicity of C3 cell line was stronger than that of C5 cell line in vivo. Liver and kidney metastases from C3 were observed, while the C5 only spread to the kidneys. Conclusion: Aneuploidy may not be the only reason for the tumorigenicity of cancer cells. There is a correlation between aneuploidy and tumorigenicity of tumor cells. Aneuploidy contributes to malignant transformation and tumorigenesis of tumor cells.
Aneuploidy; Tumorigenicity; Karyotype; Proliferation; Invasion and metastasis
XU Yang E-mail: 13311726825@189.cn
10.19401/j.cnki.1007-3639.2017.02.004
R730.231+.3
A
1007-3639(2017)02-0102-07
2016-07-18
2016-10-12)
徐 阳 E-mail: 13311726825@189.cn
