新辅助放化疗对腹腔镜中低位直肠癌根治术围术期结果的影响*
2017-03-27王德臣
孙 涛 周 鑫 傅 卫* 王德臣 袁 炯
(北京大学第三医院普通外科,北京 100083)
·临床论著·
新辅助放化疗对腹腔镜中低位直肠癌根治术围术期结果的影响*
孙 涛 周 鑫**傅 卫***王德臣 袁 炯
(北京大学第三医院普通外科,北京 100083)
目的 对比新辅助放化疗组与直接手术组腹腔镜中低位直肠癌根治术的围术期结果,探讨新辅助放化疗对腹腔镜中低位直肠癌根治术围术期结果的影响。 方法 回顾性分析2012年1月~2015年3月我科收治的符合纳入标准的182例中低位直肠癌患者的临床资料,其中行低位前切除术104例,腹会阴联合切除术71例,Hartmann手术7例。按美国国立综合癌症网络(NCCN)指南均建议行新辅助放化疗,按患者意愿,57例接受新辅助放化疗(新辅助治疗组),125例直接手术(直接手术组)。对2组围手术期资料进行对比分析。 结果 新辅助放化疗组36例(63.2%)T分期降期,其中13例(22.8%)达到病理完全缓解,清扫淋巴结数目明显少于直接手术组[(8.7±4.6)枚vs. (15.7±4.6)枚,t=-6.872,P=0.000],淋巴结阳性率明显低于直接手术组[15.8%(9/57) vs. 60.0%(75/125),χ2=30.789,P=0.000]。104例低位前切除术中,新辅助治疗组(n=37)行保护性末端回肠造瘘的比例远大于直接手术组(n=67)[83.8%(31/37) vs. 26.9%(18/67),χ2=30.992,P=0.000],新辅助治疗组手术时间更长[(251.7±64.0) min vs. (213.7±69.9)min,t=2.735,P=0.007],2组中转开腹率、吻合口高度、术中出血量、外科并发症发生率、Dindo 3~4级并发症发生率无统计学差异(P>0.05)。71例腹会阴联合切除术中,新辅助治疗组(n=17)和直接手术组(n=54)中转开腹率、手术时间、术中出血量、外科并发症发生率、Dindo 3~4级并发症发生率以及会阴切口并发症发生率均无统计学差异(P>0.05)。 结论 新辅助放化疗没有增加腹腔镜中低位直肠癌根治术的术中出血量、中转开腹率以及围手术期并发症发生率。但对于保肛手术,新辅助放化疗明显增加保护性末端回肠造瘘的比例,并且导致手术时间延长。
新辅助放化疗; 腹腔镜根治术; 直肠癌
直肠癌是我国常见的恶性肿瘤,以手术为主的综合治疗是其主流治疗方式,美国国立综合癌症网络(NCCN)指南推荐对中低位局部进展期直肠癌行新辅助放化疗[1],目前新辅助放化疗联合全直肠系膜切除术(total mesorectal excision,TME)已成为中低位局部进展期直肠癌的标准治疗模式。随着腹腔镜技术的不断进步,腹腔镜在直肠癌根治术中的应用越来越多。一项大规模临床随机对照试验[2]已经确定了腹腔镜技术在直肠癌手术中的安全性以及与开腹手术相当的肿瘤学效果,另一项随机对照试验[3]在新辅助放化疗后的直肠癌患者中也得出了相似的结论。但目前有关新辅助放化疗对腹腔镜直肠癌手术围术期结果的影响的研究尚少。本文通过回顾性分析直接行腹腔镜中低位直肠癌根治术与新辅助放化疗后行腹腔镜手术的病例资料,旨在探讨新辅助放化疗对腹腔镜手术围术期结果的影响。
1 临床资料与方法
1.1 一般资料
病例纳入标准:①中低位直肠癌,肿瘤下缘距肛缘<10 cm,病理证实为直肠腺癌;②增强MRI或直肠腔内超声提示肿瘤浸润深度≥T3期或合并直肠系膜内淋巴结转移,新辅助放化疗组可以纳入T4期,但术后病理不超过T3期;③术前全面检查无远处转移;④术前评估心肺功能可耐受腹腔镜手术,多学科专家组讨论可耐受新辅助放化疗;⑤行腹腔镜直肠癌根治术。
病例排除标准:①直接手术组术前检查提示或术中证实为T4期;②合并其他手术如肝转移灶切除、胆囊切除等。
2012年1月~2015年3月我科共收治符合上述条件的中低位直肠癌182例,按照NCCN指南[1]均建议患者术前行新辅助放化疗,其中只有57例接受新辅助放化疗,125例直接手术。2组年龄、性别、体重指数(body mass index,BMI)、美国麻醉医师协会(ASA)评分、肿瘤下缘距肛缘距离、既往腹部手术史均无统计学差异(表1)。新辅助治疗组5例T4期,术后病理均不超过T3期;直接手术组无T4期病例。

表1 2组一般资料比较
1.2 新辅助治疗方案[1]
放疗采用适形调强放疗,靶区为肿瘤及淋巴引流区域,总剂量45~50 Gy(1.8~2.0 Gy/次,每周5次,共5周),同步口服卡培他滨[1600 mg/(m2·d),第1~14天,第22~35天]化疗。新辅助治疗组均在最后一次放疗结束后8~10周内接受手术,术前1周行直肠MRI评估新辅助治疗的疗效。
1.3 手术方式
手术均按照TME原则进行,常规行淋巴结清扫[4]。术前依据肛门指诊、影像学检查结果确定肿瘤下界,距肛缘5 cm以上者选择保肛手术(低位前切除术),距肛缘5 cm以内者根据术中情况及冰冻结果决定是否保留肛门。行低位前切除术时,术中发现盆腔水肿明显,则行保护性末端回肠造瘘。通过术前、术中评估认为能保留肛门形态者,如果肛门括约肌功能差,则行Hartmann术式。如腹腔镜操作困难不能保证肿瘤学效果,即中转开腹手术。
1.4 观察指标
1.4.1 围手术期情况 比较2组手术方式,不同手术方式的手术时间、术中出血量、中转开腹率、围手术期并发症,以及低位前切除术的2组吻合口高度、保护性末端回肠造瘘等情况。中转开腹定义为进行腹腔镜操作后因操作困难或腹腔镜条件限制无法继续完成腹腔镜操作,不包括腹腔镜探查后即开腹手术的病例。吻合口高度按照术后初次复查肠镜测量决定。外科并发症指与外科手术操作有关的并发症。Dindo 3~4级并发症指需要外科、内镜及放射介入治疗的并发症[5]。会阴切口并发症指与会阴部切口有关的并发症,包括会阴部切口感染、不愈合及切口裂开等。
1.4.2 肿瘤学效果 比较2组环周切缘(circumferential resection margin,CRM)受累、病理分期以及清扫淋巴结数目等情况。在术前MRI图像中,当淋巴结短轴直径≥5 mm,并伴有不均匀的信号强度、边缘模糊时,诊断为治疗前淋巴结阳性[6]。所有腹腔镜手术切除标本均经病理科医师仔细取材,其中环周切缘阳性定义为肿瘤距环周切缘最近距离<1 mm[7]。病理完全缓解(pathological complete response,pCR)定义为新辅助放化疗后的病理标本(包括淋巴结)经仔细取材显微镜下未见肿瘤细胞残留。新辅助放化疗后T分期由肿瘤细胞残留的最深部位决定[8]。
1.5 统计学方法
2 结果
2.1 2组手术方式和术后病理比较
见表2。新辅助治疗组36例(63.2%)T分期降期,其中13例(22.8%)达到pCR,清扫淋巴结数目明显少于直接手术组,淋巴结阳性率明显低于直接手术组。直接手术组有更多病例接受腹会阴联合切除术(abdominoperinealresection,APR)[43.2%(54/125)vs. 29.8%(17/57)],但2组差异无统计学意义(χ2=2.944,P=0.086)。接受保肛手术(低位前切除)的104例均无环周切缘阳性,接受腹会阴联合切除术的71例中,直接手术组4例环周切缘受累。
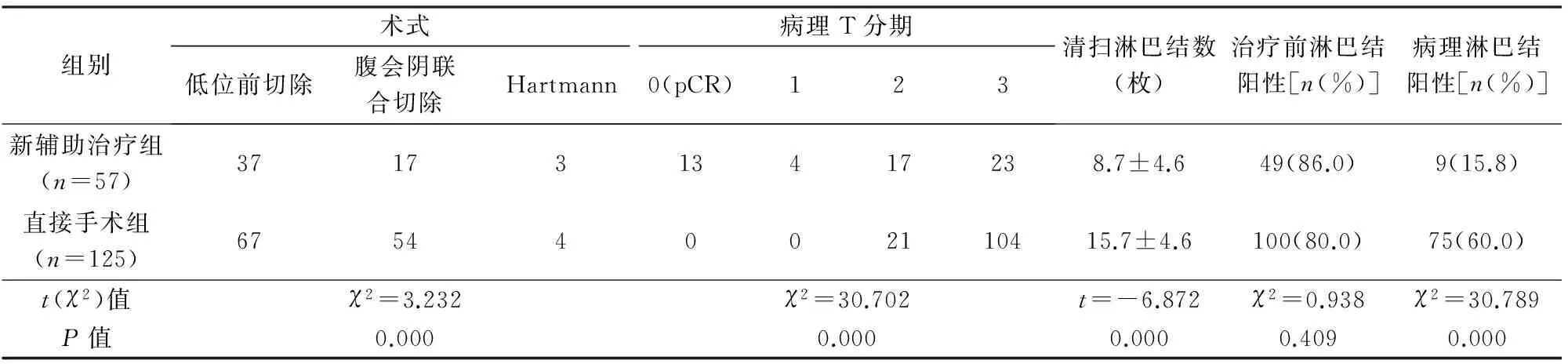
表2 2组手术方式和术后病理比较
pCR:病理完全缓解
2.2 2组围手术期情况比较
保肛手术(低位前切除)中(表3),新辅助治疗组行保护性末端回肠造瘘的比例远大于直接手术组,且手术时间更长,2组吻合口高度、术中出血量、术后并发症发生率、外科并发症发生率、Dindo 3~4级并发症发生率无统计学差异。2组均无环周切缘阳性和吻合口漏。直接手术组1例因术中肿瘤与前列腺关系密切而中转开腹。外科并发症包括新辅助治疗组肠梗阻4例、吻合口出血1例、输尿管损伤1例、腹腔感染2例,直接手术组肠梗阻2例、吻合口出血2例、尿潴留3例、腹腔感染3例。

表3 2组保肛手术(低位前切除)的围手术期情况比较
*Fisher检验
腹会阴联合切除术中(表4),直接手术组1例因肿瘤体积大,2例肿瘤与周围组织关系密切而中转开腹,2组手术时间、术中出血量、外科并发症发生率、Dindo 3~4级并发症发生率无统计学差异。外科并发症包括新辅助治疗组会阴切口感染1例、肠梗阻1例,直接手术组会阴切口感染8例、肠梗阻2例、小肠穿孔1例、腹部切口感染2例。
新辅助治疗组和直接手术组两组患者中均无术后吻合口漏发生。
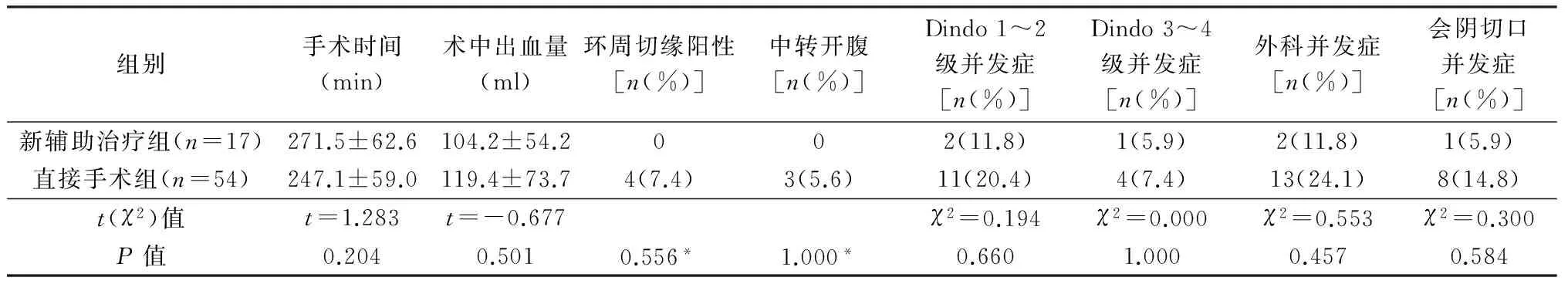
表4 2组腹会阴联合切除手术的围手术期情况比较
*Fisher检验
3 讨论
NCCN指南推荐对中低位直肠癌进行术前新辅助治疗[1],新辅助放化疗联合根治性手术已成为中低位局部进展期直肠癌的标准治疗模式。新辅助放化疗较术后放化疗能有效提高R0切除率,降低局部复发风险,新辅助放化疗后约16%的患者能获得pCR[9,10]。本研究中接受新辅助治疗57例中22.8%(13/57)达到pCR,63.2%(36/57)出现T分期降期,淋巴结阳性率明显低于直接手术组(15.8% vs. 60.0%),新辅助治疗后行腹会阴联合切除术的17例均无环周切缘受累,放化疗联合腹腔镜治疗中低位直肠癌获得了良好的肿瘤学效果。
目前直肠癌的治疗指南仅推荐腹腔镜直肠癌根治术用于临床试验[1]。来自韩国的COREAN研究[3]纳入340例新辅助放化疗后的中低位直肠癌,随机分为腹腔镜组(170例)和开腹组(170例),腹腔镜组的术中出血量、术后恢复优于开腹组,但手术时间比开腹组长,2组环周切缘受累、TME标本的质量、清扫淋巴结数以及围手术期并发症等方面无统计学差异,该研究显示腹腔镜手术在新辅助放化疗患者中的安全性。有关术前放化疗对腹腔镜操作的影响的研究较少。放化疗造成的组织水肿和纤维化导致术中难以判断正确的游离层面,而且电器械以及超声刀在游离过程中作用于水肿组织产生大量的烟雾影响腹腔镜视野,同时产生的渗出增加了游离的困难,可能会增加出血量。但是放化疗后肿瘤T分期降期以及肿瘤体积缩小可以在狭窄的骨盆中创造更大的分离空间,使低位直肠周围的分离操作和闭合器离断直肠更为容易。在Ishihara等[10]的新辅助放化疗后腹腔镜直肠癌根治术手术难度相关因素的研究中,作者认为放化疗后直肠系膜的平均CT值可以提示组织水肿和纤维化的程度,从而预测手术操作的难度。
文献[12~15]报道未行保护性造瘘的直肠前切除术后吻合口漏发生率6.3%~17%,其中肿瘤位置低、新辅助放化疗是吻合口漏的危险因素。一项关于腹腔镜直肠前切除术相关吻合口漏的病例对照研究[16]表明,男性、BMI>25、ASA评分>Ⅱ、肿瘤直径>5 cm、术前放化疗、手术时间长、术中输血、吻合口高度<5 cm以及离断直肠使用钉数>3个是吻合口漏发生的危险因素。本研究中,新辅助放化疗后保肛手术组83.8%(31/37)的患者接受保护性末端回肠造瘘,16.2%(6/37)的患者未行保护性末端回肠造瘘,是否行保护性末端回肠造瘘取决于术者经验以及术中情况。所有患者均未发生术后吻合口漏。吻合口漏发生率低可能与病例数相对较少、尚不足以导致统计学差异有关;另一方面,经验丰富的术者会根据术中吻合状况决定是否行保护性末端回肠造瘘,从而降低吻合口漏的发生率。吻合口漏显著影响直肠癌患者术后的健康相关生活质量,包括推迟保护性造瘘的还纳时间,影响患者的情感和社会功能等[17]。目前,保护性末端回肠造瘘的应用亦存在争议。有的研究[18,19]认为,保护性末端回肠造瘘能有效降低吻合口漏的发生率以及吻合口漏引起的再手术率。但是欧洲的一项研究[20]表明,虽然近年来保护性末端回肠造瘘比率在上升,但吻合口漏发生率并没有相应下降,提示存在过度治疗的趋势。此外,部分保护性末端回肠造瘘因为术后化疗疗程限制、肿瘤局部复发或者远处转移等因素而没有被按时还纳[21]。根据我们的经验,放化疗造成的吻合口狭窄以及放射性肠炎也是造成保护性末端回肠造瘘延迟还纳或者永久存在的重要因素。
本研究中新辅助放化疗组与直接手术组相比术后总并发症发生率和外科并发症发生率差异无统计学意义。一项随机对照研究[22]表明,新辅助放化疗增加开腹手术总体感染并发症(26.2% vs. 15.5%)、切口感染(8.5% vs. 2.7%)以及会阴切口裂开(38.5%vs. 15.9%)的发生率,但并未增加严重感染的发生率。本研究接受腹会阴联合切除术病例中新辅助放化疗组会阴切口并发症发生率较直接手术组低,一方面是因为手术者已知放化疗能增加切口感染风险,围手术期对切口处理较为谨慎,另一方面是因为新辅助放化疗组病例少,尚不足以引起统计学差异,并不能代表总体并发症发生率低。
综上所述,新辅助放化疗没有增加腹腔镜中低位直肠癌根治术的术中出血量、中转开腹率以及围手术期并发症发生率,同时得到了更好的肿瘤学效果。但对于接受保肛手术的患者,新辅助放化疗明显增加了保护性末端回肠造瘘的比例,并且导致手术时间延长。
1 National Comprehensive Cancer Network.NCCN practice guidelines in oncology:Rectal cancer.2015.http://www.nccn.org/professionals/physician_gls/pdf/rectal.pdf (accessed July 9,2015).
2 Bonjer HJ,Deijen CL,Abis GA,et al.A randomized trial of laparoscopic versus open surgery for rectal cancer.N Engl J Med,2015,372(14):1324-1332.
3 Jeong SY,Park JW,Nam BH,et al.Open versus laparoscopic surgery for mid-rectal or low-rectal cancer after neoadjuvant chemoradiotherapy (COREAN trial): survival outcomes of an open-label,non-inferiority,randomised controlled trial.Lancet Oncol,2014,15(7):767-774.
4 中华医学会外科学分会腹腔镜与内镜外科学组,中国抗癌学会大肠癌专业委员会腹腔镜外科学组.腹腔镜结直肠癌根治手术操作指南(2008版).中华胃肠外科杂志,2009,13(3):310-312.
5 Kim JH,Beets GL,Kim MJ,et al.High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to size?Eur J Radiol,2004,52(1):78-83.
6 Xie H,Zhou X,Zhuo Z,et al.Effectiveness of MRI for the assessment of mesorectal fascia involvement in patients with rectal cancer:a systematic review and meta-analysis.Dig Surg,2014,31(2):123-134.
7 Dworak O,Keilholz L,Hoffmann A.Pathological features of rectal cancer after preoperative radiochemotherapy.Int J Colorectal Dis,1997,12(1):19-23.
8 Zorcolo L,Rosman AS,Restivo A,et al.Complete pathologic response after combined modality treatment for rectal cancer and long-term survival:a meta-analysis.Ann Surg Oncol,2012,19(9):2822-2832.
9 Sauer R,Becker H,Hohenberger W,et al.Preoperative versus postoperative chemoradiotherapy for rectal cancer.N Engl J Med,2004,351(17):1731-1740.
10 Ishihara S,Watanabe T,Fukushima Y,et al.Safety and factors contributing to the difficulty of laparoscopic surgery for rectal cancer treated with preoperative chemoradiotherapy.Tech Coloproctol,2014,18(3):247-255.
11 张 键,骆成玉,季晓昕,等.腹腔镜与开腹低位直肠癌全直肠系膜切除术的前瞻性随机对照研究.中国微创外科杂志,2012,12(1):27-29.
12 Koyama M,Murata A,Sakamoto Y,et al.Risk factors for anastomotic leakage after intersphincteric resection without a protective defunctioning stoma for lower rectal cancer.Ann Surg Oncol,2015,23(2s):249-256.
13 Tortorelli AP,Alfieri S,Sanchez AM,et al.Anastomotic leakage after anterior resection for rectal cancer with mesorectal excision:incidence,risk factors,and management.Am Surg,2015,81(1):41-47.
14 于爱军,谢海艇,崔 龙,等.腹腔镜与开腹全直肠系膜切除术后吻合口漏发生率的meta分析.中国微创外科杂志,2013,13(8):724-728.
15 Qu H,Liu Y,Bi DS.Clinical risk factors for anastomotic leakage after laparoscopic anterior resection for rectal cancer:a systematic review and meta-analysis.Surg Endosc,2015,29(12):3608-3617.
16 Marinatou A,Theodoropoulos GE,Karanika S,et al.Do anastomotic leaks impair postoperative health-related quality of life after rectal cancer surgery? A case-matched study.Dis Colon Rectum,2014,57(2):158-166.
17 Espin E,Ciga MA,Pera M,et al.Oncological outcome following anastomotic leak in rectal surgery.Br J Surg,2015,102(4):416-422.
18 Tan WS,Tang CL,Shi L,et al.Meta-analysis of defunctioning stomas in low anterior resection for rectal cancer.Br J Surg,2009,96(5):462-472.
19 Snijders HS,van den Broek CB,Wouters MW,et al.An increasing use of defunctioning stomas after low anterior resection for rectal cancer.Is this the way to go?Eur J Surg Oncol,2013,39(7):715-720.
20 Floodeen H,Lindgren R,Matthiessen P.When are defunctioning stomas in rectal cancer surgery really reversed?Results from a population-based single center experience.Scand J Surg,2013,102(4):246-250.
21 Salmenkyla S,Kouri M,Osterlund P,et al.Does preoperative radiotherapy with postoperative chemotherapy increase acute side-effects and postoperative complications of total mesorectal excision?Report of the randomized Finnish rectal cancer trial.Scand J Surg,2012,101(4):275-282.
22 Marijnen CA,Kapiteijn E,van de Velde CJ,et al.Acute side effects and complications after short-term preoperative radiotherapy combined with total mesorectal excision in primary rectal cancer:report of a multicenter randomized trial.J Clin Oncol,2002,20(3):817-825.
(修回日期:2017-02-21)
(责任编辑:王惠群)
Effects of Neoadjuvant Chemoradiotherapy on Perioperative Outcomes of Laparoscopic Radical Resection for Mid-rectal and Low-rectal Cancers
SunTao,ZhouXin,FuWei,etal.
DepartmentofGeneralSurgery,PekingUniversityThirdHospital,Beijing100083,China
FuWei,E-mail:fuwei0720@sohu.com
Objective To compare the perioperative outcomes of laparoscopic radical resection for mid-rectal and low-rectal cancer with or without neoadjuvant chemoradiotherapy, and to investigate the impact of neoadjuvant chemoradiotherapy on perioperative outcomes of laparoscopic rectal surgery. Methods Clinical data of mid-rectal and low-rectal cancer patients treated in our hospital between January 2012 and March 2015 were retrospectively collected. One hundred and eighty-two patients met the inclusion criteria, which included 104 cases of low anterior resection, 71 cases of abdominoperineal resection and 7 cases of Hartmann resection. All of them were suggested to receive neoadjuvant chemoradiotherapy based on the guideline of National Comprehensive Cancer Network (NCCN). Fifty-seven patients underwent neoadjuvant chemoradiotherapy before surgery (neoadjuvant chemoradiotherapy group), and the other 125 patients underwent surgery directly (control group). Their perioperative data were analyzed. Results Thirty-six (63.2%) patients in the neoadjuvant chemoradiotherapy group achieved T stage downstaging and thirteen (22.8%) patients achieved pathological complete response. Fewer lymph nodes [(8.7±4.6) nodes vs. (15.7±4.6) nodes,t=-6.872,P=0.000] were harvested after neoadjuvant chemoradiotherapy, together with a lower lymph node positive rate [15.8% (9/57) vs. 60.0% (75/125),χ2=30.789,P=0.000]. In 104 patients undergoing low anterior resection, a significantly higher rate of defunctioning ileostomy [83.8% (31/37) vs. 26.9% (18/67),χ2=30.992,P=0.000] and a longer operation time [(251.7±64.0) min vs. (213.7±69.9) min,t=2.735,P=0.007] were observed in the neoadjuvant chemoradiotherapy group, and no significant differences in the conversion rate, height of anastomosis, intraoperative blood loss, surgical morbidity rate and Dindo 3-4 morbidity rate were observed between the two groups(P>0.05). In 71 patients undergoing abdominoperineal resection, no significant differences in the conversion rate, operation time, intraoperative blood loss, surgical morbidity rate, Dindo 3-4 morbidity rate and perineal wound complications were observed between the two groups(P>0.05). Conclusion Neoadjuvant chemoradiotherapy does not increase intraoperative blood loss, conversion rate and perioperative morbidity rate in the laparoscopic radical resection for mid-rectal and low-rectal cancer, but significantly increases the rate of defunctioning ileostomy and length of operation time in the laparoscopic sphincter-sparing procedure (low anterior resection) for mid-rectal and low-rectal cancer.
Neoadjuvant chemoradiotherapy; Laparoscopic radical resection; Rectal cancer
国家临床重点专科建设项目(06-191730)
A
1009-6604(2017)03-0197-05
10.3969/j.issn.1009-6604.2017.03.002
2016-12-17)
**共同第一作者
***通讯作者,E-mail:fuwei0720@sohu.com
