不同土壤类型上低水平镉污染对小麦植物络合素合成的影响
2017-03-23吕家珑
刘 衡,吕家珑,刘 克
(西北农林科技大学 资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西杨陵 712100)
不同土壤类型上低水平镉污染对小麦植物络合素合成的影响
刘 衡,吕家珑,刘 克
(西北农林科技大学 资源环境学院,农业部西北植物营养与农业环境重点实验室,陕西杨陵 712100)
通过在中国18种不同农田土壤背景下设置较低水平的重金属镉(Cd)污染,研究小麦分蘖期叶片中非蛋白巯基(TNP)、谷胱甘肽(GSH)和植物络合素(PCs)的合成情况。结果表明,低水平土壤Cd(0.3~1.2 mg/kg)污染导致小麦TNP、GSH、PCs的合成量显著改变,其中以PCs反应最敏感,两者存在一定的剂量-效应关系。研究还发现,土壤Cd污染下植物PCs合成量与部分土壤理化指标间存在显著的相关性,表明土壤种类间复杂多变的理化性质可能会通过不同途径影响植物PCs的合成。说明在试验设定范围内可通过检测植物PCs含量来预测或评价土壤重金属Cd的污染情况。
农田土壤;镉污染;植物络合素;土壤理化性质
目前,中国受重金属污染的耕地面积占耕地总数的10%以上,接近2 000万hm2。其中,中重度污染面积占比超过12%[1-2],日益严重的农田土壤重金属污染将直接造成巨大经济损失,并危害到人类的健康生存。在污染土壤中,植物抗重金属胁迫机制主要有2大类:一是通过限制对重金属离子的吸收避免细胞受伤害,二是通过生物合成1种或几种配体化合物,在植物体内络合重金属并以复合物的形式进行区域化隔离。而植物络合素(PCs)正是一种有较强对重金属离子螯合能力的配体化合物[3-5]。PCs是植物体内合成的一类富含巯基,并具有很强络合重金属离子能力的小分子多肽。在粟酒裂殖酵母(SchizosaccharomycespombeL.)中首次发现,其结构式为:(γ-Glu-Cys)n-Gly,(n=2~4)[3]。此后,人们发现这类多肽广泛存在于各类真菌、藻类、蕨类直到种子植物的多种生物体内[6]。有研究认为,PCs的合成作为植物在重金属胁迫下的生理生化反应特征,可以作为检测土壤或水体受重金属污染的早期预警指标,并在一定程度内反映其受污染程度[7-8]。也有许多研究着重于通过分子生物学与基因组学相关技术,确定PCs的解毒机制和信号途径,确定植物络合素酶(PCS)的合成途径及其相关基因表达,以期通过转基因技术增强植物对重金属污染土壤的适应能力,或培育对重金属富集能力更强的超富集植物,创造可行、高效的重金属污染植物修复方法[3-4]。近年来,以PCs为介质的重金属解毒机制的研究日渐增多,但大都集中在分子生物学与基因组学的层面上,在细胞层面上对小麦受重金属胁迫后的生理生化反应研究却寥寥无几,且多集中在水培条件下的藻类、水生植物以及部分陆生植物在遭到高剂量、短时间重金属镉的急性胁迫下PCs的合成情况[9-13]。
以往试验中Cd的添加量往往超出中国土壤环境质量标准[14]中关于环境中Cd污染含量标准的数倍甚至数十倍[7],这远远超出植物在自然生长环境可能遭受的污染量,且试验观察时间较短,多集中在5~10 d左右。而在实际的自然环境中,尤其是以小麦(TriticumaestivumL.)等所代表的大田作物,往往受到的是低水平重金属长时间的慢性胁迫。这一类的慢性接触污染往往很难对小麦等作物造成生物量减少等显著的毒害作用[15],但却有可能对人类健康产生巨大潜在威胁,因此开展土壤中低水平重金属污染物在较长时间范围内对小麦等大田作物PCs合成的影响,以期寻找到高效、敏感的环境重金属污染生物指示指标十分重要。鉴于此,本研究采用盆栽培养与室内测定相结合的方法,研究中国18种典型农田土壤低水平重金属Cd污染对小麦分蘖期PCs合成的影响,并进一步分析不同土壤理化性质与低水平土壤Cd污染下小麦PCs合成量间的关系,以期为土壤重金属Cd污染的评价和防治提供重要的理论依据。
1 材料与方法
1.1 试验材料
选择中国18个省区具有代表意义的18种农田土壤为研究对象,基本能反映中国不同气候区典型农田的土壤特点。供试土壤样品均使用多点采样法采集耕层土壤(0~20 cm),自然风干后,剔除残茬、碎石,全部过1 mm尼龙筛,备用。18种供试土壤的采样地点与理化性质等信息见表1。
所选小麦品种为‘小堰22号’,由西北农林科技大学种子公司提供。主要仪器:850型光栅荧光分光光度计,Z281001型原子吸收分光光度计,岛津UV2220型分光光度计,J22HS高速冷冻离心机。

表1 供试土壤理化性质Table 1 Physicochemical properties of tested soils
1.2 试验设计
将备用土样7 kg装入白色塑料盆,并做如下处理:分别对18种土壤样品做Cd低水平、高水平2种处理,各处理重复3次,共计18×2×3=108盆,同时每种土样各设3个空白对照,共计18×3=54盆。于6月处理土壤样品,每盆加入尿素(N)、磷酸二氢钙(P)、硫酸钾(K)3种肥料作为基肥(表2)。

表2 基肥施用品种及施用量Table 2 Basal fertilizer types and weights
同时用喷壶将重金属Cd溶液喷洒入土壤中,搅拌均匀,装盆。Cd外源添加量是根据中国《土壤环境质量标准》(GB15618-1995)中关于镉(Cd)的Ⅱ类土壤(为保障农业生产,维护人体健康的土壤限制值)环境质量标准中Cd的标准值(0.3 mg/kg,pH≤7.5或0.6 mg/kg,pH>7.5)的1倍量与2倍量确定的,试剂选用八水合硫酸镉(3CdSO4·8H2O)。具体喷施量为:
pH≤7.5的土壤样品,Cd低质量比(L)处理加入量为0.3 mg/kg,Cd高质量比(H)处理加入量为0.6 mg/kg。
pH>7.5的土壤样品,Cd低质量比(L)处理加入量为0.6 mg/kg,Cd高质量比(H)处理加入量为1.2 mg/kg。
基肥与Cd同时充分混匀,放置平衡3个月,期间每天及时补充因蒸发而损失的水分。3个月后在盆内播种小麦(10月上旬),每盆播种15粒。两周后出苗,每盆匀苗至8株,期间取样一株。11月,进入小麦分蘖期,采集小麦样品。样品用去离子水冲洗干净后,准确称量一定的新鲜小麦叶片,然后迅速用液氮固定,存放入-80 ℃冰柜中保存,用以PCs等巯基化合物的测定。
1.3 测定方法
参照孙琴等[11]方法,并略加改进。取小麦叶片组织1 g放于研钵中,加入预冷的5 g/L 磺基水杨酸(SSA)(含6.3 mmol/L DTPA,pH<1)5 mL和少量的石英砂,冰浴上研磨充分,4 ℃低温离心(15 000 g)15 min。上清液冷藏用于TNP和GSH的测定。
TNP测定:取上清液0.3 mL,加入1.5 mL 0.2 mol/L的Tris-HCl(pH 8.2)缓冲液和0.2 mL DTNB,室温下放置20 min,然后在412 nm波长下比色,根据标准曲线计算。
GSH的测定:取上清液0.2 mL,加入1.5 mL PBS(磷酸缓冲液 pH 8.0,含 5 mmol/L 的EDTA),用NaOH调混合物pH至8.0,再加入0.3 mL 1 g/L的OPT(邻苯二甲醛),培养20 min,用荧光分光光度计检测,激发波长为350 nm,发射波长为420 nm。根据GSH标准曲线计算。
采用差减法测定PCs,计算公式为:PCs=TNP-GSH。
1.4 数据统计分析
使用SPSS 18.0进行数据统计分析,相关性分析采用Pearson法。采用Excel 2003制图。
2 结果与分析
2.1 Cd污染水平对小麦分蘖期叶片中非蛋白巯基类化合物合成的影响
从图1可以看出,在试验设定的较低Cd污染水平范围内(0.3~1.2 mg/kg),小麦分蘖期内叶片中合成TNP的量随Cd污染水平的增加有着较为明显的增加。18种土壤的空白对照中,小麦叶片中TNP质量摩尔浓度的算术平均数为(4.29±0.24) μmol/g;而在低Cd处理中,小麦叶片中TNP质量摩尔浓度的算术平均数为(5.98±0.28) μmol/g;在高Cd处理中,小麦叶片中TNP质量摩尔浓度的算术平均数为(6.27±0.14) μmol/g。其中低Cd处理下TNP质量摩尔浓度与空白对照组差异显著(P<0.05),而高Cd处理与低Cd处理差异不显著。18种供试土壤中:A 黑土与褐土的3种不同Cd水平处理间均差异显著(P<0.05);棕壤、E 潮土、F 潮土、K 潮土、灌淤土、灰漠土、栗钙土和赤红壤随着低水平外源Cd的添加,TNP的质量摩尔浓度显著增加(P<0.05),而低Cd处理与高Cd处理差异不显著(P>0.05);B 黑土、D 潮土、I 红壤、J 红壤、塿土中低Cd处理与空白处理差异不显著(P>0.05),但高Cd处理与空白处理差异显著(P<0.05),且Cd处理下的TNP质量摩尔浓度均高于空白处理;G 黄棕壤、H 黄棕壤和紫色土的小麦叶片中TNP质量摩尔浓度随着Cd的施入均有所增加,但3个处理间差异不显著(P>0.05)。
从图1可以看出,在试验设定的较低Cd污染水平范围内(0.3~1.2 mg/kg),小麦分蘖期内叶片中合成GSH的量随重金属Cd的施入也有着较为明显的减少。18种土壤的空白对照中,小麦叶片中GSH质量摩尔浓度的算术平均数为(2.11±0.28) μmol/g;而在低Cd与高Cd处理中,小麦叶片中GSH质量摩尔浓度的算术平均数分别为(1.10±0.13) μmol/g和(1.01±0.13) μmol/g,相差无几。仅低Cd处理下的GSH质量摩尔浓度与空白对照组差异显著(P<0.05)。18种供试土壤中:D 潮土3种不同Cd水平处理间均差异显著(P<0.05),小麦叶片中GSH的质量摩尔浓度随着Cd施入量的增加而显著减少;E 潮土、F 潮土、G 黄棕壤、J 红壤、K 潮土、塿土、灌淤土、灰漠土、栗钙土和紫色土随着低水平外源Cd的添加,GSH显著减少(P<0.05),而低Cd处理与高Cd处理差异不显著(P>0.05);褐土中高Cd处理与低Cd和空白处理差异显著(P<0.05),且Cd处理下的GSH质量摩尔浓度低于空白处理;A 黑土和棕壤低Cd处理与空白处理以及和高Cd处理差异显著(P<0.05),高Cd处理与空白处理间差异不显著(P>0.05);B 黑土、H 黄棕壤、I 红壤和赤红壤的小麦叶片中GSH质量摩尔浓度随着Cd的施入均有所减少,但3种处理间差异不显著(P>0.05)。
小麦分蘖期内叶片中合成PCs的量随重金属Cd的施入有着较为明显的增加。18种土壤的空白对照中,小麦叶片中PCs质量摩尔浓度的算术平均数为(2.17±0.19) μmol/g;而在低和高Cd处理中,小麦叶片中PCs质量摩尔浓度的算术平均数分别为(4.88±0.23) μmol/g和(5.26±0.28) μmol/g。其中低Cd处理下的PCs质量摩尔浓度与空白对照组差异显著(P<0.05),而高Cd处理与低Cd处理差异不显著。具体来看,18种供试土壤中:A 黑土、棕壤、D 潮土、E 潮土、F 潮土、J 红壤、K 潮土、褐土、塿土、灌淤土、灰漠土、栗钙土和赤红壤随着低水平外源Cd的添加,PCs的质量摩尔浓度显著增加(P<0.05),而低Cd处理与高Cd处理差异不显著(P>0.05);G 黄棕壤、I 红壤中低Cd处理与空白处理差异不显著(P>0.05),但高Cd处理与空白处理差异显著(P<0.05),且Cd处理下的PCs质量摩尔浓度均高于空白处理;其余供试土壤的小麦叶片中PCs质量摩尔浓度随着Cd的施入均有所增加,但3种处理间差异不显著(P>0.05)。另外,从图1中还可以看出,在同一Cd处理水平下,不同土壤种类间小麦分蘖期叶片中PCs的质量摩尔浓度有所差别,而不同取样地的同一土壤种类间PCs质量摩尔浓度相近。
2.2 重金属Cd作用下小麦分蘖期叶片中PCs占TNP的比例
植物体内GSH与PCs几乎占到TNP的全部[16-17],在重金属暴露的情况下,吸收进植物体内的游离重金属离子激活PCS,PCS以GSH为底物大量合成PCs[3-4],这一过程将导致一定时间内PCs在TNP中的所占比例发生变化。这一变化的规律将有助于进一步了解土壤重金属Cd污染条件下,小麦PCs的合成情况。从图2可以看出,在试验设定的较低Cd污染水平范围内(0.3~1.2 mg/kg),小麦分蘖期内叶片中PCs/TNP随重金属Cd的施入有着显著的增加(P<0.05)。18种土壤的空白对照中,小麦叶片中PCs在TNP中占比约47.30%;在低Cd处理中,PCs在TNP中占比约80.14%;在高Cd处理中,PCs在TNP中占比约为82.67%。随着土壤Cd污染水平的增加, PCs占到TNP中的大部分比例,占比接近90%,这与孙琴等[16]的研究结果相近。18种供试土壤中,A 黑土低Cd处理与空白处理和高处理小麦叶片中PCs/TNP的比值差异显著(P<0.05),而高Cd处理与空白处理小麦叶片中PCs/TNP的比值间差异不显著(P>0.05),出现这样的结果可能与该条件下空白处理的试验精度有关;I 红壤中低Cd处理与空白处理小麦叶片中PCs/TNP的比值差异不显著(P>0.05),高Cd处理与低Cd和空白处理差异显著(P<0.05)。其余供试土壤均随着低水平外源Cd的添加,PCs/TNP的比值显著增加(P<0.05),而低Cd处理与高Cd处理小麦叶片中PCs/TNP的比值差异不显著(P>0.05)。
2.3 土壤理化性质与土壤Cd污染下小麦分蘖期叶片PCs合成量的关系
通过SPSS软件使用pearson法分析供试土壤理化性质(表1)与小麦PCs质量摩尔浓度的相关性可得。9种Cd处理水平在0~0.6mg/kg的土壤(pH≤7.5),即:A 黑土、B 黑土、棕壤、G 黄棕壤、H 黄棕壤、I 红壤、J 红壤、紫色土、赤红壤的理化性质与低Cd和高Cd 2个处理下小麦分蘖期叶片中PCs之间的相关性均表现出相同的显著规律。低Cd处理下小麦PCs与土壤速效磷(AV.P)呈极显著的负相关(P<0.01),相关系数为-0.800;与土壤CEC呈显著的负相关性(P<0.05),相关系数为-0.766;与土壤游离氧化铁(Free ir.oxide)呈极显著的正相关(P<0.01),相关系数为0.894。在高Cd处理下,小麦PCs与土壤速效磷(AV.P)呈显著的负相关(P<0.05),相关系数为-0.741;与土壤CEC呈显著的负相关(P<0.05),相关系数为-0.762;与土壤游离氧化铁(Free ir.oxide)呈显著的正相关(P<0.05),相关系数为0.761。
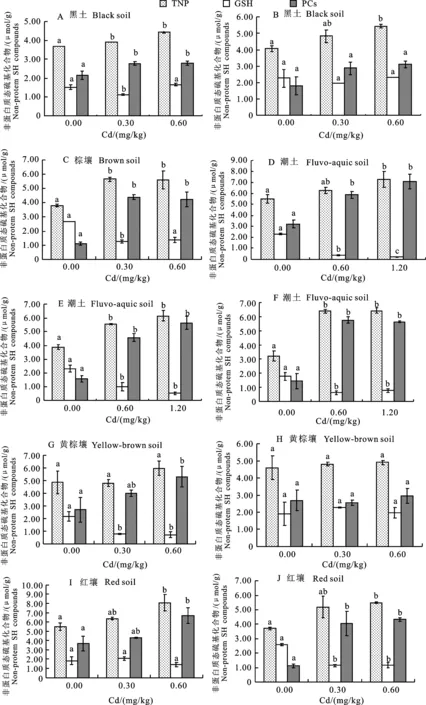
(图续转下页 Be continued in next page)
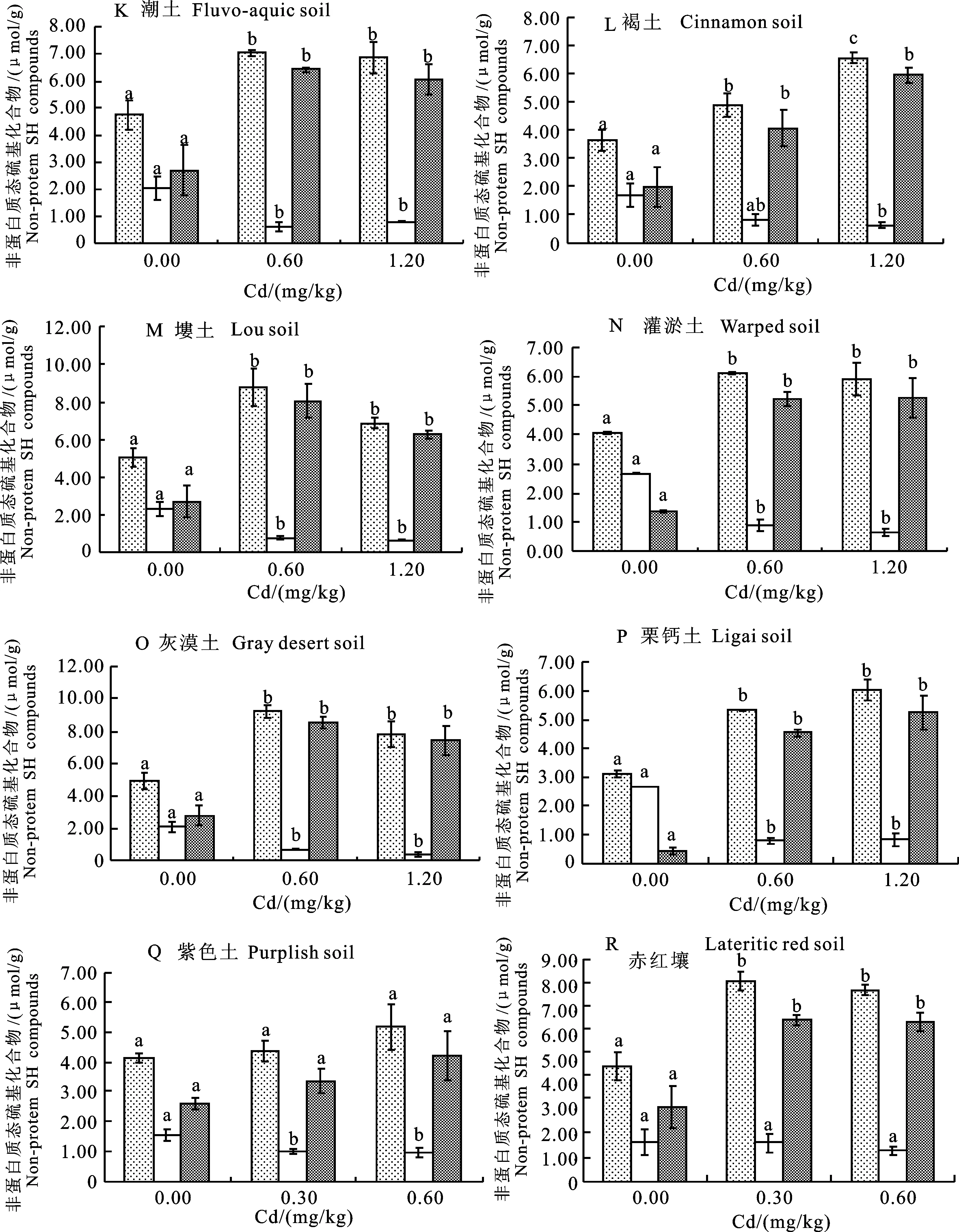
同一类化合物不同处理间标有不同小写字母表示差异显著(P<0.05)。下同。
Different lower letters in the same compound between different disposes indicate significant different atP<0.05.The same as below.
图1 小麦分蘖期TNP、GSH、PCs对重金属镉的响应
Fig.1 Response of wheat’s TNP, GSH, and PCs to Cd at the tillering stage
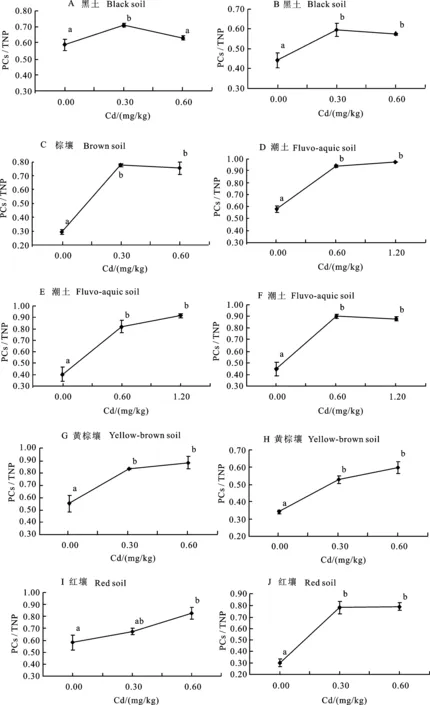
(图续转下页 Be continued in next page)
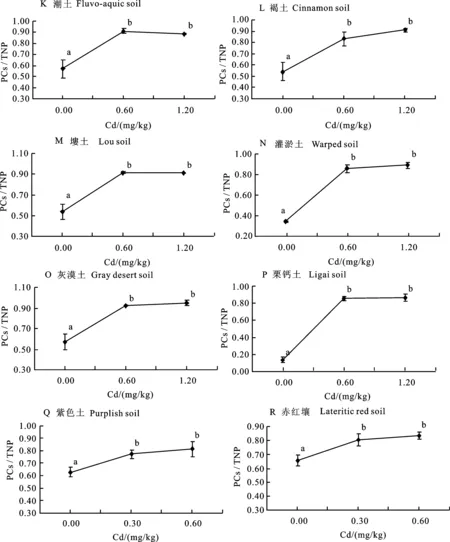
图2 小麦分蘖期PCs/TNP对重金属镉的响应Fig.2 Response of wheat’s PCs/TNP to Cd at the tillering stage
3 讨 论
3.1 小麦分蘖期叶片中TNP、GSH、PCs对重金属镉的响应
随着土壤中Cd污染水平的增加,小麦分蘖期叶片中TNP的质量摩尔浓度显著增加,这与国内外众多研究结果相同[15-17]。18种土壤具体分析可见,在试验处理设置的较低水平范围内(0.3~1.2 mg/kg),外源添加重金属镉Cd导致小麦叶片中TNP的增加,但低水平与高水平处理无明显差异,可能与添加Cd质量比差异梯度设置相近导致重金属Cd的毒害作用差距不大,因而并未引发TNP合成量的显著差异。另外,研究还发现同一Cd处理水平下,不同土壤种类间小麦分蘖期叶片中TNP的合成量差异显著,且相似土壤种类TNP合成量相近。
随着土壤中Cd污染水平的增加,小麦分蘖期叶片中GSH的质量摩尔浓度显著减少,这与孙琴等[15-16]、覃光球[17]的研究结果不相同。分析认为小麦叶片中GSH的减少可能与其作为PCs的合成底物有关[3-5],植物细胞内游离重金属离子激活PCS后, PCS将以GSH为底物大量合成PCs而螯合细胞内游离的重金属离子,这一快速发生的过程可能会导致植物细胞内GSH的短时间减少。因此,可以认为GSH并不是一种理想的土壤重金属Cd污染的生化指标。
随着土壤中Cd污染水平的增加,小麦分蘖期叶片中PCs的质量摩尔浓度显著增加,同时含量占到非蛋白质类巯基化合物中的80%左右,这与国内外相关研究结果一致[16-17]。Cd胁迫的情况下, PCs占到非蛋白质类巯基化合物的绝大部分,与TNP十分相似,外源添加重金属Cd导致小麦叶片中PCs的增加,但低水平与高水平处理差异不明显。在同一Cd处理水平下,不同土壤种类间小麦分蘖期叶片中PCs的合成量差异巨大,却存在着相似土壤种类PCs合成量相近的情况,这为开展不同土壤理化性质对PCs合成量影响的研究提供相应启示。在数理统计结果中,TNP与PCs在外源添加重金属Cd的情况下变化规律相似,但具体分析18种不同地带性土壤的变化规律可以发现,小麦分蘖期叶片中PCs的合成量在面对土壤重金属Cd增长时变化规律更加一致且显著,这表明证明PCs相较TNP更适合作为土壤重金属Cd污染的小麦生化指标。
小麦分蘖期中叶片内TNP在向PCs转化,并且随着重金属污染水平的增加这一转化更加明显,这与覃光球[17]的研究结果一致。这可能是因为在重金属暴露下,非蛋白质类巯基化合物中的GSH在PCS的催化下大量合成PCs有关[3-4]。这一分布比例的变化进一步证明PCs与土壤重金属Cd质量分数的相关性,植物在重金属暴露环境中细胞内会大量合成PCs以对抗重金属Cd的胁迫[3-4],这也证明PCs作为重金属Cd污染的生物指示标识的可能性。
3.2 土壤理化性质与小麦叶片中植物络合素合成量关系
孙琴等[16]发现,pH可能是通过影响重金属镉的生物可利用性进而影响植物体内PCs的合成量。本研究发现,18种土壤中小麦PCs的合成量与土壤pH显著相关(相关系数在-0.729~-0.853),说明土壤pH对小麦PCs合成量的影响能力。但在同时进行的18种土壤的相关性分析中,小麦PCs合成量与除去pH性质外的其他理化指标之间的相关性表现并不明显。根据pH指标区分的9种Cd处理水平,在0~0.6 mg/kg的土壤其小麦PCs的合成量与相应理化指标呈现显著相关,且在2种不同Cd处理水平下,相关规律一致。关于上述试验结果,分析认为:随着土壤中有效态磷的增加,小麦PCs的合成量显著降低,这可能与磷素可以减缓重金属镉的生物毒性有关,增磷可以减缓镉胁迫的毒性,进而降低小麦体内的诱导合成量,这与孙琴等[16]的研究结果一致。随着土壤中阳离子交换量的升高,小麦PCs的合成量显著降低,这可能与阳离子交换量对于土壤吸附重金属Cd有正向作用有关[18],阳离子交换量的升高,增强土壤对于重金属镉的吸附性,降低小麦对重金属镉的可吸收量,进一步降低重金属镉的生物有效性,从而降低小麦体内植物络合素的诱导合成量。随着土壤中游离氧化铁质量分数的升高,小麦PCs的合成量显著增加。这一研究结论并未找到相应或相似的文献报道,作者分析认为这可能与PCs能够维持植物细胞内金属离子的动力平衡有关。作为植物络合素的生理功能之一,PCs可以络合过量的金属离子,从而保护相应的敏感酶类[3-4],同时作为细胞内金属离子的一种储存形式,可以在需要时释放相应金属离子以供应植物生理需要[3-6]。土壤游离氧化铁与小麦植物络合素呈现正相关关系正是有可能被小麦大量吸收进入体内的金属铁离子需要一定量的植物络合素与其络合以达到小麦细胞内铁离子的动态平衡,从而土壤游离氧化铁与小麦体内植物络合素呈现出一定的正相关关系。
4 结 论
随着土壤中重金属Cd污染水平的增加,小麦分蘖期叶片中PCs的含量显著增加,且在不同地带性土壤中增加规律表现稳定,随Cd质量比变化规律优于TNP与GSH。这表明即使重金属Cd未对小麦植物生物量造成毒害时,小麦叶片中的PCs对土壤中重金属Cd的含量反应依旧敏感,两者含量间表现出良好的剂量-效应关系,在细胞层面上证明可通过检测小麦叶片中的PCs含量来评价或预测农田土壤中重金属Cd的污染情况。面对土壤中重金属Cd含量增加时, PCs在TNP中占比增大,这进一步证明植物PCs含量与土壤中Cd含量的剂量-效应关系,进一步表明PCs是一种高效且敏感的土壤重金属Cd污染的生物指示剂。土壤种类间复杂多变的理化性质有可能会通过影响土壤重金属Cd的有效性进而影响PCs的合成,且相关性显著,这一结果为将来开展相关研究提供一定的试验支持。本研究结果说明在试验设定范围内可通过检测植物PCs含量来预测或评价土壤重金属Cd的污染情况。
Reference:
[1] 黄益宗,郝晓伟,雷 鸣,等.重金属污染土壤修复技术及其修复实践[J].农业环境科学学报,2013,32(3):409-417.
HUANG Y Z,HAO X W,LEI M,etal.The remediation technology and remediation practice of heavy metals-contaminated soil[J].JournalofAgro-EnvironmentScience,2013,32(3):409-417(in Chinese with English abstract).
[2] 宋 伟,陈百明,刘 琳.中国耕地土壤重金属污染概况[J].水土保持研究,2013,20(2):293-298.
SONG W,CHEN B M,LIU L.Soil heavy metal pollution of cultivated land in China[J].ResearchofSoilandWaterConservation,2013,20(2):293-298(in Chinese with English abstract).
[3] 高 华,张玉秀,柴团耀.植物络合素和植物络合素合酶的研究[J].西北植物学报,2001,21(4):779-790.
GAO H,ZHANG Y X,CHAI T Y.Research advances in phytochelations and phytochelatin synthase[J].ActaBotanicaBoreali-occidentaliaSinica,2001,21(4):779-790(in Chinese with English abstract).
[4] 冯保民,麻 密.植物络合素及其合酶在重金属抗性中的功能研究进展[J].应用与环境生物学报,2003,9(6):657-661.
FENG B M,MA M.Research advance of phytochelations and phytochelatin synthase on heavy metal tolerance[J].ChineseJournalofAppliedandEnvironmentalBiology,2003,9(6):657-661(in Chinese with English abstract).
[5] 赵 迪,夏立江,朱永官.植物络合素的测定方法[J].生态学杂志,2005,24(3):330-334.
ZHAO D,XIA L J,ZHU Y G.Analysis methods of phytochelations[J].ChineseJournalofEcology,2005,24(3):330-334(in Chinese with English abstract).
[6] 严竞竞,刘 伟,麻 远,等.植物络合素分析方法进展[J].分析化学,2005,33(9):1339-1344.
YAN J J,LIU W,MA Y,etal.Developments of analytical technologies of phytochelations[J].ChineseJournalofAnalyticalChemistry,2005,33(9):1339-1344(in Chinese with English abstract).
[7] 王 超,王丽娅,孙 琴.低浓度Cd暴露对金鱼藻营养元素吸收与植物络合素(PCs)合成的影响[J].环境科学,2009,30(4):1179-1184.
WANG CH,WANG L Y,SUN Q.Effects of lower concentrations of Cd on micronutrients uptake and production of phytochelations (PCs) in ceratophyllum demersum[J].EnvironmentalScience,2009,30(4):1179-1184(in Chinese with English abstract).
[8] 孙 琴,王 超.土壤外源Cd和Pb复合污染对小麦(TriticumaestivumL.)根系植物络合素和谷胱甘肽合成的影响[J].生态环境,2008,17(5):1833-1838.
SUN Q,WANG CH.Phytochelatins and glutathione synthesis in roots of wheat (TriticumaestivumL.) under combined pollution of Cd and Pb: a pot study[J].EcologyandEnvironment,2008,17(5):1833-1838(in Chinese with English abstract).
[9] 李红梅,王宏镔,王海娟,等.不同形态砷对黑藻植物络合素合成的影响[J].生态学杂志,2012,31(5):1233-1240.
LI H M,WANG H B,WANG H J,etal.Effects of arsenic speciation on the phytochelations(PCs) synthesis byHydrillaverticillata[J].ChineseJournalofEcology,2012,31(5):1233-1240(in Chinese with English abstract).
[10] 齐 君,吕金印,李鹰翔,等.Cr3+胁迫对青菜中植物络合素含量及AsA-GSH代谢关键酶活性的影响[J].农业环境科学学报,2012,31(7):1303-1309.
QI J,LÜ J Y,LI Y X,etal.Effects of chromium stress on the content of phytochelatins and the activities of key enzymes of ascorbate-glutathione cycle inBrassicachinensis[J].JournalofAgro-EnvironmentScience,2012,31(7):1303-1309(in Chinese with English abstract).
[11] 孙 琴,王晓蓉,袁信芳,等.有机酸存在下小麦体内Cd的生物毒性和植物络合素(PCs)合成的关系[J].生态学报,2004,24(12): 2804-2809.
SUN Q,WANG X R,YUAN X F,etal.Correlations between Cd toxicity and production of phytochelatins(PCs) in wheat(TriticumaestivumL.) exposed to Cd added with various organic acids[J].ActaEcologicaSinica,2004,24(12):2804-2809(in Chinese with English abstract).
[12] 王 超,王丽娅,孙 琴,等.低浓度镉胁迫下2种水生植物体内植物络合素的响应[J].四川大学学报(工程科学版),2008,40(6): 86-91.
WANG CH,WANG L Y,SUN Q,etal.Response of phytochelatins in two macrophytes exposed to environmentally relevant lower concentrations of cadmium[J].JournalofSichuanUniversity(EngineeringScienceeEdition),2008,40(6):86-91(in Chinese with English abstract).
[13] 邸丽俊,吕金印,宋相帝,等.镉硫交互对菜豆植物络合素及DNA增色效应的影响[J].北方园艺,2011(10):14-18.
DI L J,LÜ J Y,SONG X D,etal.Influence of interaction between cadmium and sulfur on phytochelatin and hyperchromic ofPhaseolusvulgaris[J].NorthernHorticulture,2011 (10):14-18(in Chinese with English abstract).
[14] 国家环境保护局,国家技术监督局.中华人民共和国国家标准—土壤环境质量标准GB15618-1995 [B].国家环境保护局,北京:1995-07-13.
National Environmental Protection Agency,State Bureau of Technical Supervision.China National Standard—Environmental quality standards for soil GB15618-1995[B].National Environmental Protection Agency,Beijing:1995-07-13(in Chinese).
[15] 孙 琴,王 超.土壤Cd Zn复合污染对小麦根系植物络合素和谷胱甘肽合成的影响[J].农业环境科学学报,2008,27(5):1913-1918.
SUN Q,WANG CH.Phytochelatin and glutathione synthesis in roots of wheat (TriticumaestivumL.) under combined pollution of Cd and Zn in a pot trial[J].JournalofAgro-EnvironmentScience,2008,27(5):1913-1918(in Chinese with English abstract).
[16] 孙 琴,袁信芳,王晓蓉.环境因子对小麦体内镉的生物毒性和植物络合素合成的影响[J].应用生态学报,2005,16(7):1360-1365.
SUN Q,YUAN X F,WANG X R.Effects of environmental factors on Cd biotoxicity and phytochelatins production inTriticumaestivum[J].ChineseJournalofAppliedEcology,2005,16(7):1360-1365(in Chinese with English abstract).
[17] 覃光球.桐花树幼苗植物络合素和植物多酚对重金属的响应[D].福建厦门:厦门大学,2007.
QIN G Q.Response of phytochelatins and phenolics to heavy metals ofAegicerascorniculatumseedlings[D].Xiamen Fujian: Xiamen University,2007(in Chinese with English abstract).
[18] 王金贵.我国典型农田土壤中重金属镉的吸附-解吸特征研究[D].陕西杨凌:西北农林科技大学,2012.
WANG J G.Adsorption-desorption characteristics of cadmium in typical agricultural soils in china[D].Yangling Shaanxi: Northwest A&F University,2012(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Effect of Lower Level of Cadmium Pollution on Wheat Phytochelatin Synthesis in the Different Soil Types
LIU Heng, LÜ Jialong and LIU Ke
(College of Natural Resource and Environment, Northwest A&F University, Yangling Shaanxi 712100, China)
In this study, heavy metal cadmium (Cd) pollution were set through 18 different farmland soil in China, the synthesis of nonprotein thiols (TNP), glutathione (GSH) and the plant phytochelations (PCs) content were determined at wheat tillering stage.Results show that the lower level Cd of soil pollution (Cd mass ratio of 0.3-1.2 mg/kg) led to the significant changes in the amount of wheat’s TNP,GSH and PCs.In particularly, PCs was more sensitive to even lower level of Cd pollution in soil, a significant dose-effect relationship was detected between PCs and Cd.This result demonstrated that there was a significant correlation between PCs synthesis and some soil physical and chemical properties under the soil cadmium pollution, which indicated that the synthesis of PCs in plant may be effected by the complicated unstable physical and chemical properties between soil types.This work further confirmed that heavy metal Cd pollution of soil can be predicted or graded by detecting plant PCs at the range of the experimental setting.
Agricultural soil; Cadmium pollution; Plant phytochelations (PCs); Soil physical and chemical properties
LIU Heng, male, master student.Research area: the evaluation of soil quality.E-mail:294626343@qq.com
LÜ Jialong,male,professor,doctoral supervisor.Research area: soil chemistry and environmental chemistry.E-mail: ljll@nwsuaf.edu.cn
2016-05-07
2016-05-11
农业部公益性行业(农业)科研专项(200903015);国家“十二五”科技支撑计划项目子课题(2012BAD15B04)。
刘 衡,男,硕士研究生,主要从事土壤质量评价研究。 E-mail:294626343@qq.com
吕家珑,男,教授,博士生导师,主要从事土壤化学与环境化学教学和研究。E-mail: ljlll@nwsuaf.edu.cn
日期:2016-12-20
X171.5
A
1004-1389(2017)01-0121-11
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161220.1645.030.html
Received 2016-05-07 Returned 2016-05-11
Foundation item The Ministry of Agriculture of the People’s Republic of China (No.200903015); the Sci-Tech Project of the “12th 5-Year-Plan” of China (No.2012BAD15B04).
